Method Article
In Vivo Duo-colore metodo di Imaging vascolare dinamica dopo la lesione del midollo spinale contusivi
In questo articolo
Riepilogo
Introduciamo un in vivo imaging metodo utilizzando due tinture fluorescenti differenti per rilevare cambiamenti vascolari spinali dinamici che segue una ferita del midollo spinale contusivi in ratti Sprague-Dawley adulti.
Abstract
Ferita del midollo spinale (SCI) causa significativa rottura vascolare presso il sito della ferita. Patologia vascolare si verifica immediatamente dopo SCI e continua durante la fase acuta. Infatti, le cellule endoteliali sembrano essere il primo a morire dopo un contusivi SCI. I primi eventi vascolari, tra cui aumento della permeabilità della barriera sangue-spinali (BSTT), inducono l'edema vasogenic e contribuiscono agli eventi pregiudizievoli lesione secondaria causati da meccanismi di ferita complessa. Targeting per la rottura vascolare, di conseguenza, potrebbe essere una strategia chiave per ridurre cascades di lesioni secondarie che contribuiscono ai danni istologici e funzionali dopo SCI. Gli studi precedenti sono stati per lo più effettuati su campioni post mortem ed erano in grado di catturare i cambiamenti dinamici della rete vascolare. In questo studio, abbiamo sviluppato un in vivo duo-colore del due-fotone metodo di imaging per monitorare i cambiamenti dinamici vascolari acuti seguito contusivi SCI. Questo approccio consente di rilevare il flusso sanguigno, diametro del vaso e altre patologie vascolari in vari siti del ratto stesso pre- e post-infortunio. Nel complesso, questo metodo fornisce un luogo eccellente per indagare la dinamica vascolare.
Introduzione
Ferita traumatica del midollo spinale (SCI) è un pregiudizio comune che conduce a danno della funzione motore, sensoriale e autonoma. Secondo il National del midollo spinale lesioni statistico Center (NSCISC) nel 2016, circa 282.000 persone sono state colpite mentre il 69% di loro sono stati principalmente a causa di incidenti stradali o cade1. Questi pazienti spesso richiedono cure intensive; Tuttavia, nessun trattamento efficace è attualmente disponibile. Pertanto, nuove strategie efficaci verso SCI sono urgentemente necessari.
SCI si divide principalmente in due fasi: ferita primaria e secondaria ferita. La ferita primaria comprende l'insulto fisico causando necrosi emorragica al luogo dell'impatto2, seguito da una serie di eventi di lesione secondaria, quali infiammazione, apoptosi delle cellule e la demielinizzazione degli assoni rimanenti, che progressivamente portano l'espansione del deficit morfologici e funzionali3,4,5,6. L'emorragia è il primo segno visibile della lesione, che indica un'immediata rottura vascolare nella fase acuta di SCI7,8. Una strategia di neuroprotective mirata a ridurre il danno vascolare precoce potrebbe migliorare il recupero dei pazienti, ma questo richiede una migliore comprensione del meccanismo fisiopatologico di eventi vascolari precoci post-infortunio.
Nonostante studi precedenti usando vari metodi per studiare il sistema vascolare del midollo spinale, limitazioni significative rimangono. Lo svantaggio più comune sta studiando solo post mortem campioni, per esempio, idrogeno liquidazione9, autoradiografia10, microangiogram8, corrosione vascolare calchi11e immunohistochemistry12 ,13. Sebbene la flussometria del Laser Doppler consente il monitoraggio in tempo reale non invadente di midollo spinale sangue flusso14, è impossibile distinguere tra sistemi vascolari e rilevare i cambiamenti morfologici vascolari. MRI contrapporre-aumentato dinamico (DCE-MRI) è anche non invadente, ma genera immagini a bassa risoluzione e richiede un' infrastruttura costosa15.
Anche se in vivo imaging mediante 2 fotoni laser microscopia (2P-LSM) è stato sviluppato per studiare vasodynamics nella corteccia16,17,18, hanno un numero limitato di studi ha dimostrato i cambiamenti vascolari seguendo un SCI. Tang et al hanno mostrato cambiamenti nel flusso sanguigno al bordo del luogo della lesione in un'emisezione modello19, ma la formazione immagine dopo un infortunio contusivo è più impegnativo per due motivi. In primo luogo, una finestra ottica tradizionale vetro sopra il sito di lesione non sostenere l'impatto meccanico e rimangono funzionale per l'imaging. In secondo luogo, la perdita dell'elemento tracciante nel parenchima causa di emorragia crea difficoltà con formazione immagine post-infortunio.
Qui presentiamo un metodo di imaging romanzo duo-colore, che permette gli stessi vasi singoli intervalli di tempo pre- e post-infortunio di imaging. Inoltre, fornisce un profilo temporale-spaziale dei cambiamenti dinamici vascolari seguendo un contusivi SCI. Ha anche il potenziale per l'imaging a più punti di tempo post-infortunio. Questo protocollo può essere direttamente applicato agli animali transgenici per studiare l'interazione neurovascolare.
Protocollo
Tutte le procedure di gestione degli animali e chirurgica sono state effettuate come approvato sotto la guida per la cura e uso di animali da laboratorio (Consiglio nazionale delle ricerche) e gli orientamenti della Indiana University School di medicina istituzionali cura degli animali e dell'uso Comitato.
1. preparazione chirurgica
- Sterilizzare tutti gli strumenti chirurgici, tra cui lo stabilizzatore della colonna vertebrale. Pulire il tavolo operatorio e tutta la zona circostante con etanolo al 70%. Per la preparazione della procedura chirurgica non-sopravvivenza, posizionare un tampone pulito chirurgico sulla cima di un 37 ° C, rilievo di riscaldamento.
- Utilizzare sei settimane vecchio ratto Sprague Dawley (deviazione standard) per questo studio. Pesare e anestetizzare il topo con un'iniezione intraperitoneale di ketamina (87,7 mg/kg) e miscela di xilazina (12,3 mg/kg). Confermare la corretta fase di anestesia quando l'animale cessa di rispondere ad uno stimolo di pizzico di punta. Iniettare per via sottocutanea 0,01-0,05 mg/kg buprenorfina e 5mg/kg Carprofen prima della chirurgia.
- Radere il ratto in 2 aree: la regione cervicale della spina dorsale sul retro e la regione del collo sul lato del seno. Tamponare le zone della pelle con scrub chirurgico betadine e salviettine imbevute di alcool di 70%. Applicare unguento oculare per evitare secchezza oculare durante l'intervento chirurgico. Metti l'animale in una posizione supina la pulizia chirurgica.
2. cateterizzazione della vena giugulare esterno
- Individuare la vena giugulare esterna trovando il punto di impulso vicino alla clavicola e tagliare con un paio di forbici piccolo primavera per fare un'incisione verticale sul posto, che è il punto croce di 3 punti anatomici: ramus caudale della mandibola di destra, Tubercolo maggiore del Omero e manubrio (Figura 1A). Isolare il vaso usando forbici di primavera e una pinzetta. Legare l'estremità distale con 1 sutura chirurgica sterile linea (Figura 1)20.
- Preparare una siringa 1 mL riempita con soluzione fisiologica e collegata con un catetere specializzato effettuato in un ago da 21 gauge (Figura 1B). Praticare una piccola incisione utilizzando un paio di forbici micro sulla nave e far scorrere il catetere nel vaso.
- Fissare l'ago legando entrambe le estremità prossimale e distale (Figura 1). Il catetere specializzato è composto da un ago da 21 gauge. Macinare la punta piatta e saldare con un pezzo di 2 mm di punta tagliata da un altro ago da 21 gauge. Questo può impedire il catetere di scivolare fuori.
Nota: Una piccola quantità di sangue che scorre nell'ago indica che l'ago è entrato con successo in un vaso sanguigno.
- Fissare l'ago legando entrambe le estremità prossimale e distale (Figura 1). Il catetere specializzato è composto da un ago da 21 gauge. Macinare la punta piatta e saldare con un pezzo di 2 mm di punta tagliata da un altro ago da 21 gauge. Questo può impedire il catetere di scivolare fuori.
3. colonna vertebrale stabilizzazione e Laminectomy C5-C7
- Metti l'animale in posizione prona. Tagliare la pelle lungo la linea mediana con un bisturi n. 15 a livello spinale desiderata. Sezionare gli strati di muscolo da 5th a7 vertebre cervicali (C5-C7) bilateralmente per esporre le sfaccettature laterali (Figura 2A)21 .
Nota: Individuare la seconda vertebra toracica (T2) trovando il picco tra le scapole. Contare verso l'alto dalla vertebra T2 per trovare la vertebra C721,22,23,24. - Stabilizzare la colonna vertebrale del ratto usando un apparato stabilizzante modificato. Fare una fessura su entrambi i lati dell'osso vertebrale laterale. Far scorrere i bracci in acciaio inox sotto le sfaccettature di processo trasversale esposti e stringere le viti per assicurare la stabilità (Figura 2B).
- Rimuovere con cautela le lamine di C5-C7 (laminectomia, Figura 2).
- Inserire un piccolo pezzo di gelfoam imbevuta di soluzione fisiologica in cima il mater di dura esposto per mantenerla idratata (Figura 2D).
4. installazione della finestra di Imaging di due fotoni (2P)
- Piccoli pezzi di roba di gelfoam nella fessura tra muscoli e ossa vertebrali, anche roba una sottile linea di gelfoam tra ossa vertebrali e del midollo spinale, quindi utilizzare colla adesiva tessuto per sigillare l'area muscolo-osso circostante. Aspettare 5 minuti per la completa secchezza (Figura 2E).
Nota: Questo passaggio impedisce efficacemente futuro sanguinamento nella finestra e permeabilità delle soluzioni di immersione. - Preparare 4% agar con ddH2O in un forno a microonde. Dopo l'agar è dissolto completamente, attendere finché ritorna ad una temperatura al tatto. Riempire una siringa sterile 1 mL di soluzione di agar e reindirizzarlo sul bordo della finestra per costruire un muro (Figura 2E). La soluzione si solidifica rapidamente e rimane flessibile per consentire l'obiettivo o l'obiettivo di muoversi liberamente.
- Quando si è pronti per l'imaging, è possibile rimuovere il liquido di immersione gelfoam e posto all'interno della finestra per 2P imaging (Figura 2F). Trasferire l'animale stabilizzato all'interno della camera oscura di microscopio 2 fotoni e posizionare la finestra di imaging 2P direttamente sotto la lente. Abbassare la lente attentamente nella finestra di imaging.
5. iniezione di primo colorante fluorescente e Baseline Imaging
- Preparare 0,5 mL di Rodamina B isotiocianato-destrano (peso molecolare medio di 4 mg/mL ~ 70kDa) in soluzione salina. Riempire una siringa sterile da 1 mL con la soluzione e collegare la siringa al catetere precedentemente installato.
Nota: Preparazione della soluzione di colorante fluorescente prima si consiglia. - Iniettare la tintura prima premendo molto lentamente la siringa (Figura 3B). In primo luogo, utilizzare l'oculare per identificare l'area di interesse. Utilizzare una macchina fotografica di charge coupled device (CCD) per acquisire un'immagine del campo luminoso dei modelli di superficie del vaso sanguigno a basso ingrandimento come un'immagine caposaldo. Passare alla modalità di scansione laser e quindi aprire 2P software per la raccolta di entrambe le immagini di imaging e scansione lineare dei dati.
- Selezionare la corretta lunghezza d'onda di eccitazione del laser di 2P, potenza e fluorescente canale (rosso per primo colorante) da abbinare con fluorofori utilizzati nel tessuto imaged e quindi eseguire in vivo imaging (Figura 3E). Tenere l'animale su un rilievo di riscaldamento durante l'intero processo.
6. C7 contusivi ferita usando il dispositivo di LISA
- Eseguire una ferita di contusione del midline C7 utilizzando un dispositivo di Louisville lesioni sistema apparato (LISA) secondo un protocollo precedentemente stabilita25,26.
- In breve, metti l'animale sul palco LISA dopo la calibrazione.
7. iniezione di secondo colorante fluorescente e Imaging post-infortunio
- Preparare 0,5 mL di fluoresceina isotiocianato-destrano (4 mg/mL, peso molecolare medio ~ 70 kDa) in soluzione salina stessa come in 5.1. Riempire la soluzione in una siringa sterile da 1 mL e connetterti con il catetere precedentemente installato.
- Trasferire sul retro animale stabilizzato all'interno della camera oscura di microscopio 2P e ricreare l'immagine stessa area con il canale rosso per il primo colorante e il canale del verde per il secondo colorante (figure 3D & G).
- Alla fine dell'imaging, rilasciare il ratto dal dispositivo di stabilizzazione spinale e pulire la bacheca di agar.
8. animale sacrificio
- Dopo formazione immagine, sacrificio di ratto dopo perfusione perfusione protocollo27. Raccogliere i campioni di midollo spinale e fissarli in 4% PFA.
9. analisi dati offline: Quantificazione dei diametri vaso
- Trasferire i file di immagine a una workstation per l'analisi off-line.
- Aprire ImageJ e selezionare "file" e poi scegli precedentemente salvato i dati grezzi e aprire il file di immagine singola associata (Figura 4B).
- Calibrare l'immagine selezionando "Analizza" seguita da "Imposta scala" (Figura 4). Il valore inserito nella "Distanza in pixel" è calcolato utilizzando l'equazione visualizzata in Figura 4A. La taratura della lente ottica 2-fotone determina il valore di predefinito nell'equazione. Il valore di "opticalZoom" viene trovato in Excel Extensible Markup Languagefile (file XML) associato al file di immagine singola (Figura 4B).
- Disegnare una linea perpendicolare all'asse longitudinale della nave (Figura 41 & E1) e selezionare "Analizza" seguita da "Misura". La misura del diametro del vaso viene visualizzata nella finestra del risultato (Figura 42 & E2). Ripetere 3 volte in tutta la nave per acquisire il valore medio.
10. non in linea dati analisi: Quantificazione di sangue rosso delle cellule (RBC) velocità
- Trasferire i file di scansione lineare per la workstation per l'analisi.
- Avviare il software ImageJ e selezionare "file" e poi scegli precedentemente salvato i dati grezzi e aprire tutti i file di scansione lineare associato con il nome di estensione ".ome".
- Aprire "Immagine" e selezionare "Stacks" seguita da "immagini di stack". Convertire tutti i file di OME in un file TIFF di singola immagine dello stack.
- Avviare il software Matlab e fare clic su "Apri", seleziona il file di codice "LSPIV_parallel.m". Nota: Il codice Matlab per LS-PIV può essere scaricato presso https://sourceforge.net/projects/lspivsupplement/files/18
- Selezionare i seguenti ordini: "Run" > "Cambia cartella" > "arteria". Scegliere il file TIFF di immagine dello stack generato in 10.3.
- Digitare "Y" e premere INVIO.
- Posizionare il cursore a sinistra e a destra dell'immagine, rispettivamente, e il programma inizia a elaborare i dati.
- Alla fine del programma, inserire 2 valori per calcolare la lettura finale: "valore di conversione di pixel_meter del e"valore di tempo di scansione conversione". Entrambi possono essere trovati nel file XML associato a dati linea-scan. Il valore finale è espresso come la media e la deviazione standard della velocità nelle unità di millimetro al secondo (mm/s).
Risultati
Il metodo è in grado di monitorare in vivo dinamici cambiamenti vascolari spinali in singoli vasi pre- e post-traumatiche SCI. In primo luogo, un catetere viene installato attraverso la vena giugulare esterna per fornire l'accesso per le iniezioni successive colorante fluorescente (fig. 1A-C, Figura 3). Nella seconda fase, un apparato specializzato viene utilizzato per stabilizzare l'esposto C5-C7 (Figura 1-F, Figura 2A-B). Questo passaggio di stabilizzazione può eliminare artefatti di respirazione e fornire formazione immagine costante. A seguito di laminectomia (Figura 2), il prossimo passo è l'installazione di 2P finestra di imaging sopra C5-C7 (Figura 2D-F). Ridurre al minimo tessuto periferico sanguinamento intorno alla finestra di imaging spinale è critico per l'imaging vascolare successo. Il passo seguente è di iniettare tintura fluorescente rodamina-destrano (rosso) tramite il catetere sopra alla pietra miliare e mappa la rete vascolare come la linea di base (Figura 3A-B, E). Dopo l'infortunio contusivo del midline di C7 con severità moderata, FITC-Destrano (verde) è stato introdotto in punti di tempo post-lesione desiderato (Figura 3A & D). La bellezza del metodo duo-colore è che uno è in grado di rilevare la struttura vascolare usando la tintura seconda quando il primo colorante è già trapelato in parenchima a causa di infortunio (Figura 3).
Durante la sessione di imaging, è consigliabile tenere l'animale su un rilievo di riscaldamento per mantenere la temperatura corporea dopo induzione di anestesia.
Utilizzando il nostro metodo duo-colore, la velocità di diametro e globuli rossi (RBC velocità) di singole navi può essere misurata e calcolata. Per diametro, ImageJ potrà essere utilizzata per misurare la nave al relativo più grande diametro per 3 ripetizioni dopo la calibrazione (Figura 4). Per velocità, linea-scan immagini sono misurati utilizzando il programma Matlab (MATLAB R2013a) per calcolare la velocità (Figura 5) RBC18. Basata sulla morfologia, velocità del flusso sanguigno e diametro del vaso, i vasi possono essere classificati in 2 categorie: arteria e vena (Vedi tabella 1).
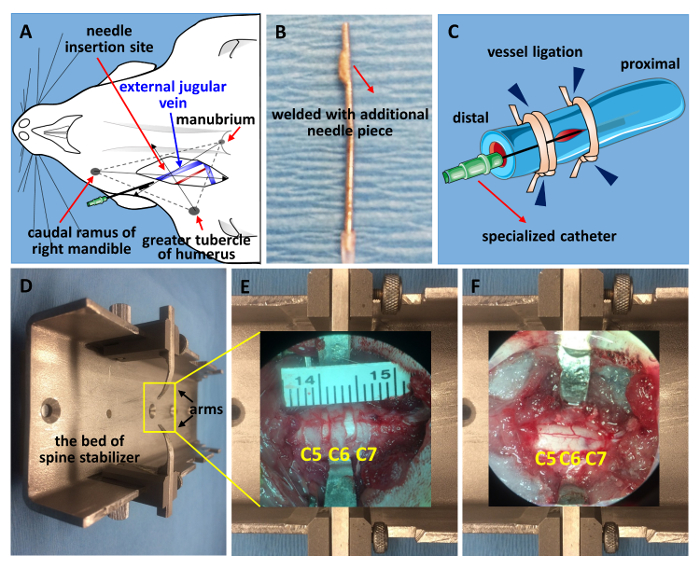
Figura 1 . Stabilizzazione di cateterizzazione e la spina dorsale della vena giugulare.
(A) un disegno schematico per localizzare la vena giugulare esterna. (B) il catetere specializzato effettuato in un ago da 21 gauge. Il suggerimento era terra piatta e saldato con un pezzo di punta di 2 millimetri tagliato fuori da un altro ago da 21 gauge. (C) un diagramma schematico di cateterizzazione. L'estremità distale è legata in primo luogo, seguita da stabilizzazione prossimale del catetere, che termina con l'ago di fissaggio insieme con la nave (legatura del vaso, punte di freccia blu). (D) un'immagine dello stabilizzatore modificate della colonna vertebrale. Viene visualizzata una finestra di C5-C7 prima laminectomia (E) e dopo laminectomy e contusivi SCI (F) . Clicca qui per visualizzare una versione più grande di questa figura.
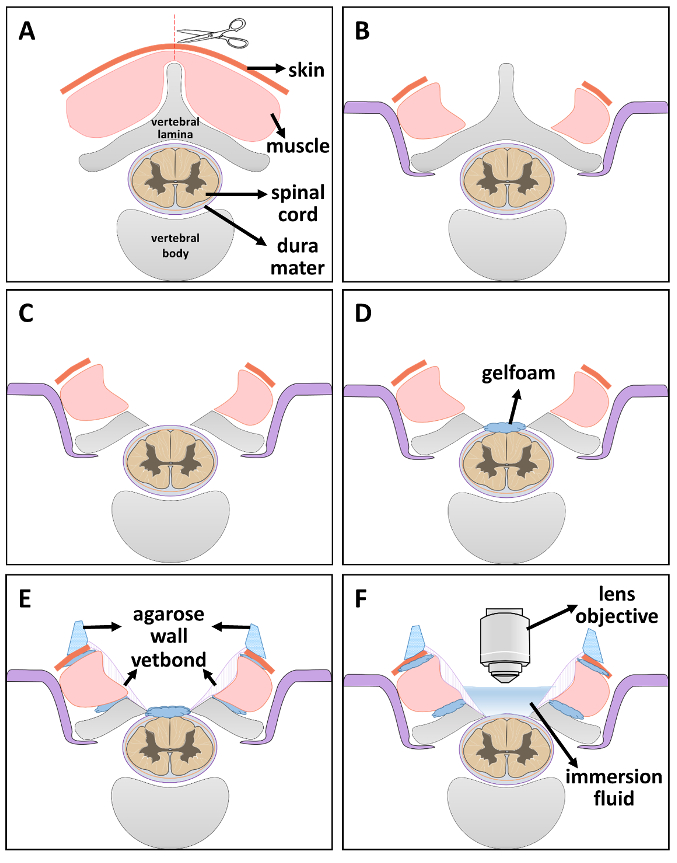
Figura 2 . Diagramma schematico di finestra ottica di installazione passo-passo.
(A) fase 1: esporre la vertebra da taglio pelle e muscolo lungo la linea mediana. (B) passo 2: stabilizzazione della colonna vertebrale. (C) passo 3: laminectomia. (D) passaggio 4: mantenere l'umidità del midollo spinale mettendo un pezzo di gelfoam imbevuta di soluzione fisiologica. (E) passo 5: sigillare le lacune con gelfoam sterile e vetbond. Dopo l'essiccazione, uno strato di parete agar è costruito sul bordo della finestra. (F) passo 6: quando si è pronti per l'imaging, rimuovere il liquido di immersione gelfoam e posto all'interno di 2P finestra di imaging. Clicca qui per visualizzare una versione più grande di questa figura.
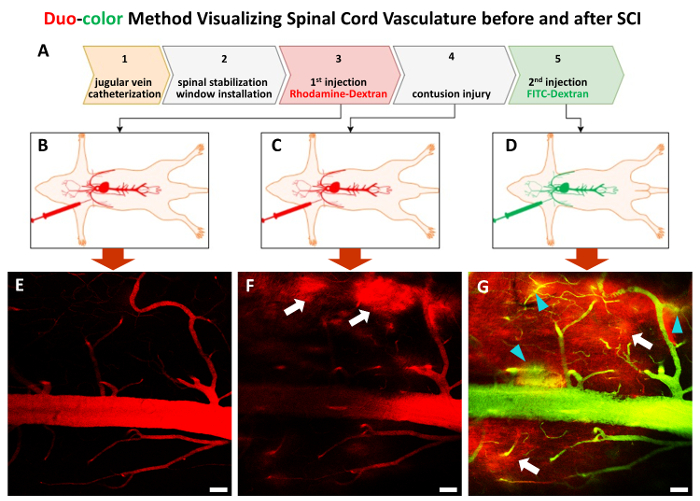
Figura 3 . La in vivo procedura di metodo duo-colore dettagliata.
L'intera procedura è costituito da 5 passi (A). Dopo la fase 1 e fase 2, un paio di elementi traccianti del dextrano con una dimensione di circa 70 KDa sono iniettato in sequenza per etichettare il sistema vascolare del midollo spinale prima (inB e C) e dopo contusivi SCI (D). (E)-(G) immagini rappresentative di 2P visualizzare il sistema vascolare del midollo spinale al passaggio 3 a passaggio 5. Frecce bianche puntano alla prima ondata colorante rosso colatura aree (F e G), punte di freccia turchese visualizzare perdita della tintura di verde di seconda ondata (G). Barra della scala = 50 µm. Clicca qui per visualizzare una versione più grande di questa figura.
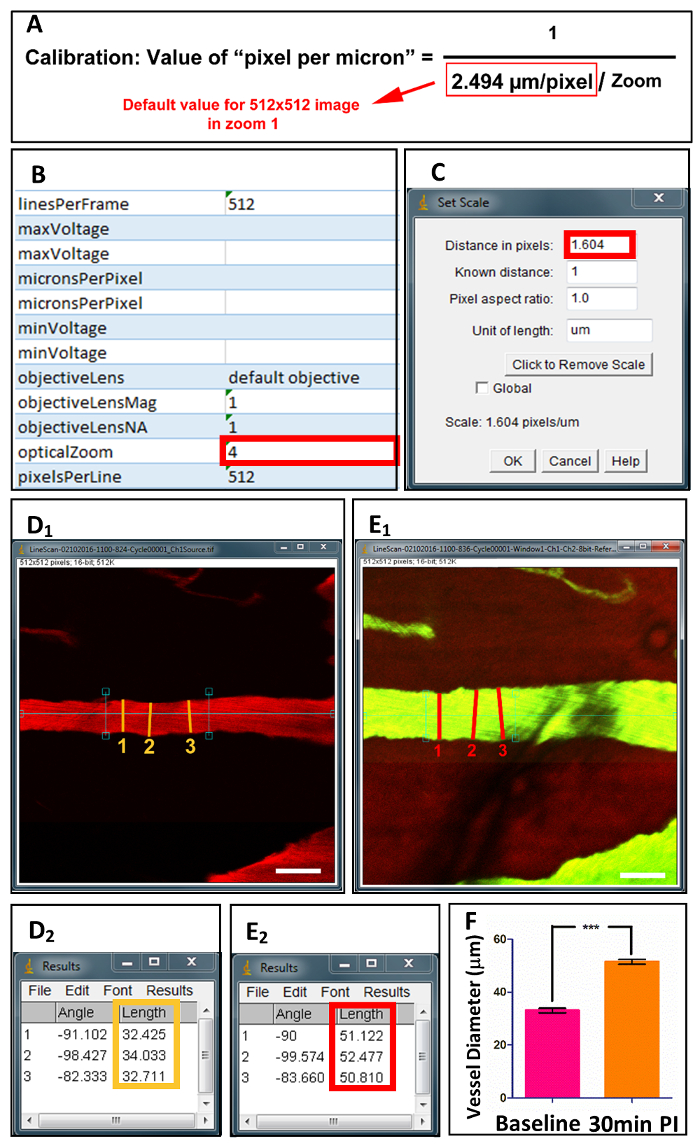
Figura 4 . Acquisizione e quantificazione dei diametri vaso spinale.
Dopo la preparazione, singoli file di immagine vengono acquisiti nell'ambito di microscopia P 2, insieme ai file XML dei valori calibrati (B). (A) l'equazione consente di visualizzare il calcolo di "pixel per micron", basato su valori di zoom ottico. Dopo la calibrazione in ImageJ (C), diametri vaso sono misurati a 3 punti lungo l'asse longitudinale prima (D1) e dopo (E1) lesioni. (D2) e (E2) visualizzare i valori misurati. (F) quantificazione dei diametri vaso basale e di alberino-ferita di 30 min. Scala bar = 50 µm. dati sono mostrati come media ± DS, * * * p < 0,0001, prova accoppiata a due code di t.Clicca qui per visualizzare una versione più grande di questa figura.
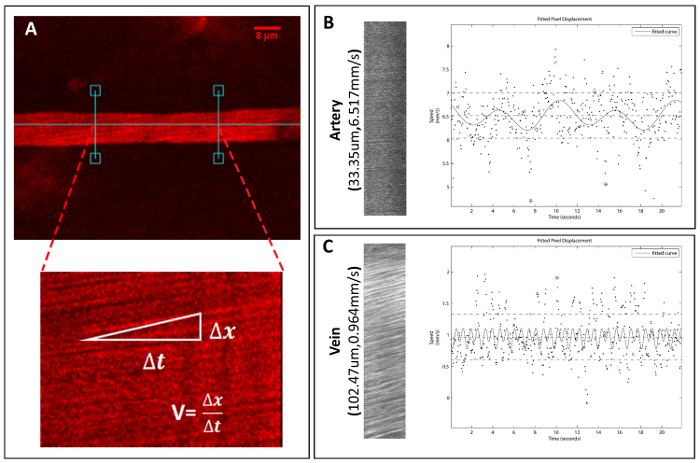
Figura 5 . Acquisizione e quantificazione della velocità nave spinale.
I file di immagine di scansione lineare vengono acquisiti microscopio P 2 per calcolare le velocità singolo vaso. (A) un esempio di un metodo per valutare la velocità del vaso sanguigno RBC e vaso selezionato. (B) un esempio arterioso di riga-scansione immagine e file di stampa corrispondente per il calcolo della velocità, nonché un esempio di una vena (C). Clicca qui per visualizzare una versione più grande di questa figura.
| Dell'arteria | Vena | |
| Morfologia | Parete del vaso dritto, liscio, spessore | Rami, bordi grezzi |
| Velocità del flusso sanguigno | Veloce | Lento, ma varia |
| Diametro | 30-80 µm | 100-250 µm |
Tabella 1: Criteri per l'identificazione dei tipi di navi
Discussione
Una sfida per studi vascolari dopo SCI è la limitazione tecnica perché le tecniche tradizionali sono in gran parte limitate ai cambiamenti di struttura vascolare in campioni post mortem. Questo romanzo in vivo imaging metodo sopra descritto consente la misurazione dinamica del flusso sanguigno e dei relativi parametri (velocità e vaso diametro) usando 2 P-LSM in ratti dal vivo. Permette anche l'esame ripetuto nelle stesse serie di vasi in diversi momenti dopo sci contusivi. Tecniche di imaging microscopia 2-fotone precedente erano in grado di catturare le strutture vascolari post trauma dovuto la perdita di un singolo elemento tracciante. Il nostro design duo-colore consente dinamica imaging vascolare per modelli traumatiche. Inoltre, la flessibilità di questo metodo fornisce un'opportunità per generare un profilo temporale-spaziale di cambiamenti vascolari acuti dopo SCI.
Ci sono diversi passaggi critici nella nostra in vivo duo-colore metodo di imaging. In primo luogo, è fondamentale per garantirne la stabilità fisica del midollo spinale prima del time-lapse imaging, in particolare riducendo artefatto movimento di respirazione. Abbiamo progettato la forma della spinale morsetti per sollevare leggermente l'altezza della vertebra spinale durante la stabilizzazione. Così il movimento di correlazione del midollo spinale all'animale di respirazione può essere notevolmente ridotto (Figura 1-F, 2B). Si raccomanda di verificare la stabilità del midollo spinale prima dell'inizio di ogni sessione di imaging. Se il midollo spinale non riesce a raggiungere la stabilità, l'adeguamento per l'allineamento e il serraggio dei morsetti del midollo spinale. Secondo, periferico del tessuto (pelle, strato del muscolo e osso) sanguinamento nella finestra di imaging potrebbe rischiare la contaminazione della vista. Per una regolare sessione di imaging, gelfoam e tessuto colla adesiva deve essere applicata al tessuto circostante per una prevenzione efficace. In terzo luogo, le tinture fluorescenti che scegliamo hanno dimensioni simili come albumina (66 kDa), che è la proteina del plasma sanguigno principale ad alto peso molecolare. Condizioni omeostatiche, i coloranti sono stati mantenuti in gran parte all'interno del recipiente simile come albumina28. Dopo la ferita, i coloranti passato attraverso la struttura endoteliale perturbata e perdeva nel parenchima, causando un significativo aumento dell'intensità fluorescente nella zona periferica del sistema vascolare (Figura 3F-G). Inoltre, ci sono due motivi perché abbiamo scelto la cateterizzazione della vena giugulare esterna. In primo luogo, può fornire un percorso costantemente accessibile di consegna in qualsiasi momento dell'esperimento. In secondo luogo, può essere utilizzato come un itinerario iniettabile trattamento futuro.
Anche se il nostro metodo di duo-colore in vivo è in grado di fornire un luogo novello per studi di imaging vascolari traumatici, devono essere affrontati alcuni avvertimenti per quanto riguarda questa tecnica. Attualmente, questa tecnica è stata progettata per valutare i cambiamenti vascolari a 2 punti di tempo (linea di base e 1 punto di tempo post-infortunio), ma è possibile passare a più punti di tempo, se sono disponibili canali e ulteriori tinture fluorescenti. Anche se ci sono parecchi studi utilizzando la finestra di vetro impiantato per l'imaging di videomicroscopia cronica, nessuno di loro può fornire informazioni di base sulla stessa imbarcazione dopo lesione traumatica19,29,30, 31,32. A differenza di questi studi, la nostra finestra è una finestra di vetro no. Questo è utile per l'imaging pre- e post-infortunio, ma può essere impegnativo per ristabilire la finestra per l'osservazione a lungo termine. Nostra ricerca futura sta lavorando sul miglioramento tecnico per l'imaging cronica. Il sistema vascolare è composto da diversi tipi di navi (arteria, vena e capillare) e ognuno è diverso in aspetti della morfologia e funzione. Differenziazione tra i tipi di navi durante l'imaging potrebbe contribuire a prendere in giro un chiaro modello di cambiamenti vascolari. Il protocollo di cui sopra dipende l'osservatore l'indicazione delle navi basate sulla morfologia e velocità; Tuttavia, un colorante specifico dell'arteria possa essere facilmente aggiunti per dare una classificazione più definitiva tra nave tipi33.
Questa tecnica non è solo limitata a valutazioni su contusivi e altri modelli traumatiche, come lesione da schiacciamento e ferita di radiazione, ma anche su studi concentrandosi sulla rottura del BSTT, permeabilità vascolare come pure di come cambia. Oltre a SCI, potrebbe essere usato per studiare i cambiamenti vascolari seguendo altre patologie neurodegenerative come la sclerosi laterale amiotrofica (ALS) e la sclerosi multipla (SM). Inoltre, potrebbe essere trasferibile ad un modello di animali transgenico per studiare l'interazione dinamica neurovascolare. Come uno strumento di screening potente, gli studi futuri potrebbero utilizzare la tecnica di imaging descritta qui per valutare l'efficacia del trattamento per lesioni del midollo spinale.
In conclusione, metodo in vivo duo-colore è uno strumento di approccio affidabili, in tempo reale, in vivo per valutare i cambiamenti vascolari dinamici, che è l'ideale per la caratterizzazione del profilo vascolare temporali-spaziali e di screening per i trattamenti a ridurre i danni secondari dopo SCI.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto in parte da NIH NS059622, NS073636, DOD CDMRP W81XWH-12-1-0562 merito recensione premio I01 BX002356 dal US Department of Veterans Affairs, Craig H Neilsen Foundation 296749, Indiana del midollo spinale e cervello lesioni Research Foundation ( ISCBIRF) di Indiana State Department of Health (019919) e fondi di dotazione di Mari Hulman George.
Materiali
| Name | Company | Catalog Number | Comments |
| Purdue Products Betadine Surgical Scrub | Fisher Scientific | 19-027132 | Skin sterilization |
| Ketamine (87.7 mg/kg)/Xylazine (12.3 mg/kg) | Patterson Veterinary | 07-881-9413, 07-890-5745 | Anesthetic agent |
| Buprenorphine(0.03 mg/mL) | Patterson Veterinary | 07-891-9756 | Pain relief agent |
| Carprofen | Patterson Veterinary | 07-844-7425 | Non-steroidal anti-inflammatory drug |
| Dukal Gauze Sponges | Fisher Scientific | 22-415-490 | Skin sterilization |
| Decon Ethanol 200 Proof | Fisher Scientific | 04-355-450 | Skin sterilization |
| Artificial Tears Eye Ointment | Webster Veterinary | 07-870-5261 | Prevent drying eyes |
| Cotton Tipped Applicators | Fisher Scientific | 1006015 | |
| Rhodamine B isothiocyanate–Dextran | Sigma-Aldrich | R9379 | Average mol wt 70kDa |
| Fluorescein isothiocyanate–dextran | Sigma-Aldrich | 46945 | Average mol wt 70kDa |
| Instrument Sterilizer | Fine Science Tools | 18000-50 | for sterilizing surgery tool |
| Spine stabilizer set | Custom Manufactured from Norton Neuroscience Institute | Contact Y. Ping Zhang for details. (yipingzhang50@gmail.com) | |
| Vetbond | 3M Animal Care Products | 1469SB | Tissue adhesive Glue |
| Gelfoam | Henry Schein | 9083300 | Stop bleeding |
| Noyes Spring Scissors | F.S.T | 15013-12 | |
| Fine Forceps- Dumont #5 | F.S.T | 11254-20 | |
| Rongeur | Fine Science Tools | 16021-14 | laminectomy |
| Surgical Retractor | Fine Science Tools | 17005-04 | |
| Scalpel | Fine Science Tools | 10003-12 | skin cut |
| Scalpel Blade #15 | Royal-Tek | BS2982 | skin cut |
| micro angled scissors | World Precision Instruments | 500260 | Can be from any vendor |
| 3-0 vicryl sutures | Ethicon | J393H | Can be from any vendor |
| Silk Black Braided Non-Absorbable Suture, 3-0, C-7, Reverse Cutting, 18" | LOOK | 786 | Can be from any vendor |
| 1 ml syringe | Henke Sass Wolf | 4010.200.V0 | Can be from any vendor |
| 21 gauge needle | BD | 305165 | Can be from any vendor |
| Agar | Sigma-Aldrich | A1296 | Can be from any vendor |
| Two-photon Laser Scanning Microscope | Bruker Fluorescence Microscopy | ||
| LISA device | Custom Manufactured from Norton Neuroscience Institute | Contact Y. Ping Zhang for details. (yipingzhang50@gmail.com) | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| HCImage Live | Hamamatsu Corporation | Imaging software | |
| PrairieView | Prairie Technologies/Bruker | Two-photon imaging software | |
| ImageJ | Image analysis software | ||
| Matlab statistics toolbox | The MathWorks, Inc. | https://www.mathworks.com/products/statistics.html?s_tid=srchtitle | Image analysis software |
Riferimenti
- National Spinal Cord Injury Statistical Center. Spinal Cord Injury Facts and Figures at a Glance. SCI Data Sheet 2016. , (2016).
- Dumont, R. J., et al. Acute spinal cord injury, part I: pathophysiologic mechanisms. Clin Neuropharmacol. 24 (5), 254-264 (2001).
- Beattie, M. S., Farooqui, A. A., Bresnahan, J. C. Review of current evidence for apoptosis after spinal cord injury. J Neurotrauma. 17 (10), 915-925 (2000).
- Liu, N. K., et al. A novel role of phospholipase A2 in mediating spinal cord secondary injury. Ann Neurol. 59 (4), 606-619 (2006).
- Wu, X., Xu, X. M. RhoA/Rho kinase in spinal cord injury. Neural Regen Res. 11 (1), 23-27 (2016).
- Li, X. G., et al. Combination of methylprednisolone and rosiglitazone promotes recovery of neurological function after spinal cord injury. Neural Regen Res. 11 (10), 1678-1684 (2016).
- Kulkarni, M. V., et al. Acute spinal cord injury: MR imaging at 1.5. T. Radiology. 164 (3), 837-843 (1987).
- Tator, C. H., Koyanagi, I. Vascular mechanisms in the pathophysiology of human spinal cord injury. J Neurosurg. 86 (3), 483-492 (1997).
- Kobrine, A. I., Doyle, T. F., Martins, A. N. Spinal cord blood flow in the rhesus monkey by the hydrogen clearance method. Surg Neurol. 2 (3), 197-200 (1974).
- Rivlin, A. S., Tator, C. H. Regional spinal cord blood flow in rats after severe cord trauma. J Neurosurg. 49 (6), 844-853 (1978).
- Koyanagi, I., Tator, C. H., Theriault, E. Silicone rubber microangiography of acute spinal cord injury in the rat. Neurosurgery. 32 (2), 260-268 (1993).
- Noble, L. J., Wrathall, J. R. Correlative analyses of lesion development and functional status after graded spinal cord contusive injuries in the rat. Exp Neurol. 103 (1), 34-40 (1989).
- Maikos, J. T., Shreiber, D. I. Immediate damage to the blood-spinal cord barrier due to mechanical trauma. J Neurotrauma. 24 (3), 492-507 (2007).
- Tei, R., Kaido, T., Nakase, H., Sakaki, T. Secondary spinal cord hypoperfusion of circumscribed areas after injury in rats. Neurol Res. 27 (4), 403-408 (2005).
- Cohen, D. M., et al. Blood-spinal cord barrier permeability in experimental spinal cord injury: dynamic contrast-enhanced MRI. NMR Biomed. 22 (3), 332-341 (2009).
- Drew, P. J., Shih, A. Y., Kleinfeld, D. Fluctuating and sensory-induced vasodynamics in rodent cortex extend arteriole capacity. Proc Natl Acad Sci U S A. 108 (20), 8473-8478 (2011).
- Schaffer, C. B., et al. Two-photon imaging of cortical surface microvessels reveals a robust redistribution in blood flow after vascular occlusion. PLoS Biol. 4 (2), e22 (2006).
- Kim, T. N., et al. Line-scanning particle image velocimetry: an optical approach for quantifying a wide range of blood flow speeds in live animals. PLoS One. 7 (6), e38590 (2012).
- Tang, P., et al. In vivo two-photon imaging of axonal dieback, blood flow, and calcium influx with methylprednisolone therapy after spinal cord injury. Sci Rep. 5, 9691 (2015).
- Thrivikraman, K. V., Huot, R. L., Plotsky, P. M. Jugular vein catheterization for repeated blood sampling in the unrestrained conscious rat. Brain Res Brain Res Protoc. 10 (2), 84-94 (2002).
- Walker, M. J., et al. A novel vertebral stabilization method for producing contusive spinal cord injury. J Vis Exp. (95), e50149 (2015).
- Anderson, K. D., Sharp, K. G., Steward, O. Bilateral cervical contusion spinal cord injury in rats. Exp Neurol. 220 (1), 9-22 (2009).
- Krishna, V., et al. A contusion model of severe spinal cord injury in rats. J Vis Exp. (78), (2013).
- Lepore, A. C. Intraspinal cell transplantation for targeting cervical ventral horn in amyotrophic lateral sclerosis and traumatic spinal cord injury. J Vis Exp. (55), (2011).
- Zhang, Y. P., et al. Spinal cord contusion based on precise vertebral stabilization and tissue displacement measured by combined assessment to discriminate small functional differences. J Neurotrauma. 25 (10), 1227-1240 (2008).
- Wu, X., et al. A Tissue Displacement-based Contusive Spinal Cord Injury Model in Mice. J Vis Exp. (124), (2017).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), (2012).
- Egawa, G., et al. Intravital analysis of vascular permeability in mice using two-photon microscopy. Sci Rep. 3, 1932 (2013).
- Farrar, M. J., et al. Chronic in vivo imaging in the mouse spinal cord using an implanted chamber. Nat Methods. 9 (3), 297-302 (2012).
- Evans, T. A., Barkauskas, D. S., Myers, J. T., Huang, A. Y. Intravital imaging of axonal interactions with microglia and macrophages in a mouse dorsal column crush injury. J Vis Exp. (93), e52228 (2014).
- Davalos, D., Akassoglou, K. In vivo imaging of the mouse spinal cord using two-photon microscopy. J Vis Exp. (59), e2760 (2012).
- Davalos, D., et al. Stable in vivo imaging of densely populated glia, axons and blood vessels in the mouse spinal cord using two-photon microscopy. J Neurosci Methods. 169 (1), 1-7 (2008).
- Shen, Z., Lu, Z., Chhatbar, P. Y., O'Herron, P., Kara, P. An artery-specific fluorescent dye for studying neurovascular coupling. Nat Methods. 9 (3), 273-276 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon