Method Article
Metodi funzionali e fisiologici per valutare la rigenerazione mediana del nervo nel ratto
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Presentato è un protocollo per produrre diversi tipi di lesioni nervose mediane (MN) e la riparazione nel ratto. Inoltre, il protocollo mostra come valutare il recupero funzionale del nervo utilizzando diversi test comportamentali non invasivi e misurazioni fisiologiche.
Abstract
L'obiettivo principale di questa indagine è quello di mostrare come creare e riparare diversi tipi di lesioni nervose mediane (MN) nel ratto. Inoltre, vengono presentati diversi metodi per simulare la fisioterapia postoperatoria. Molteplici strategie standardizzate vengono utilizzate per valutare il recupero motorio e sensoriale utilizzando un modello MN di lesione e riparazione del nervo periferico, consentendo così un facile confronto dei risultati. Diverse opzioni sono incluse per fornire un ambiente simile alla fisioterapia postoperatoria ai ratti che hanno subito lesioni da MN. Infine, la carta fornisce un metodo per valutare il recupero del MN utilizzando diversi test non invasivi (ad esempio, test di presa, test del pungiglione, test del deflusso della scala, test di arrampicata su fune e analisi della pista a piedi), e misurazioni fisiologiche (termografia a infrarossi, elettroeuromiografia, valutazione della forza di flessione e determinazione del peso muscolare del carpire radiale). Di conseguenza, questo modello sembra particolarmente appropriato per replicare uno scenario clinico, facilitando l'estrapolazione dei risultati alla specie umana.
Anche se il nervo sciatico è il nervo più studiato nella ricerca del nervo periferico, l'analisi del ratto MN presenta vari vantaggi. Ad esempio, vi è una minore incidenza di contratture articolari e di automutilazione dell'arto interessato negli studi sulla lesione MN. Inoltre, il MN non è coperto da masse muscolari, rendendo la sua dissezione più facile di quella del nervo sciatico. Inoltre, il recupero di MN è osservato prima, perché il MN è più corto del nervo sciatico. Inoltre, il MN ha un percorso parallelo al nervo ulnare nel braccio. Quindi, il nervo ulnare può essere facilmente utilizzato come innesto nervoso per riparare le lesioni da MN. Infine, il MN nei ratti si trova nell'arto anteriore, simile all'arto superiore umano; negli esseri umani, l'arto superiore è il sito della maggior parte delle lesioni nervose periferiche.
Introduzione
Le lesioni nervose periferiche si verificano regolarmente a seguito di traumi, infezioni, vasculite, autoimmunità, malignità e/o radioterapia1,2. Purtroppo, la riparazione del nervo periferico continua a presentare risultati clinicamente imprevedibili e spesso deludenti3,4. È ampiamente concorso il consenso sulla necessità di una notevole ricerca di base e traslazionale per migliorare la prospettiva delle persone colpite4,5,6,7.
Il ratto MN mostra grandi somiglianze con quella degli esseri umani8,9 ( Figura1). Originario del plesso brachiale nella regione ascellare, questo nervo scende nell'aspetto mediale del braccio, raggiungendo il gomito e ramificandosi verso la maggior parte dei muscoli nel compartimento ventrale dell'avambraccio. Il MN raggiunge la mano, dove innerva i muscoli thenar e i primi due muscoli lumcali, nonché a parte della pelle della mano del ratto9 (Figura 1).
Utilizzando il ratto MN, è possibile replicare adeguatamente le lesioni nervose periferiche in esseri umani10,11,12. Questo nervo ha diversi potenziali vantaggi di ricerca rispetto al nervo sciatico abitualmente usato. Poiché il MN si trova nell'arti anteriori dei ratti (simile agli arti superiori umani), può essere danneggiato sperimentalmente con un impatto molto minore sul benessere del ratto, rispetto al nervo sciatico, che innerva una parte sostanziale dell'arto pelvico13. Inoltre, negli esseri umani la maggior parte delle lesioni cliniche si verificanellione superiore, che corrisponde all'arto anteriore del ratto10,11,12,14,15,16.
Questo documento mostra come produrre diversi tipi di lesioni MN nel ratto. Inoltre, vengono presentati diversi modi per simulare la fisioterapia postoperatoria. Infine, vengono descritti i test per valutare il ripristino funzionale del MN. Sono disponibili diverse strategie standardizzate per valutare il recupero motorio e sensoriale utilizzando un modello MN di lesione e riparazione del nervo periferico, consentendo così un facile confronto dei risultati. Il modello MN è particolarmente adatto per replicare lo scenario clinico, facilitando l'estrapolazione dei risultati alla specie umana.
Protocollo
Tutte le procedure che coinvolgono soggetti animali sono state approvate dal Comitato istituzionale per la cura e l'uso degli animali e dal comitato etico della Nova University Medical School di Lisbona, Portogallo (08/2012/CEFCM).
1. Chirurgia mediana del nervo
NOTA: Seguire la tecnica asettica durante l'intervento chirurgico. Utilizzare strumenti protettivi personali (PPE) e indossare un abito chirurgico sterile17. Autoclave tutti gli strumenti chirurgici necessari prima dell'intervento chirurgico (vedere la Tabella dei Materiali).
- Usa topi Wistar di 12 settimane. Fornire loro cibo e acqua ad libitum con 12 h cicli luce-scuro 7 giorni prima dell'intervento chirurgico. Prima dell'anestesia, pesare il ratto per determinare la quantità di anestetico necessaria.
- Anestesizzare il ratto con un'iniezione intraperitoneale di una miscela di ketamina (40-80 mg/kg di peso corporeo) e xylazina (5-10 mg/kg di peso corporeo). Controllare la profondità dell'anestesia per la mancanza di risposta a un pizzico di punta e osservando la frequenza respiratoria per tutta la procedura18,19. Fornire analgesia aggiuntiva se si osserva una frequenza respiratoria superiore a 110 cicli/min o risposta motoria alla pizzicatura delle dita dei piedi18,20.
- Iniettare 1 mg/kg di melosticam sottocutaneamente per fornire analgesia preventiva20,21.
- Per evitare l'abrasione corneale durante l'intervento chirurgico, applicare il gel oftalmico su entrambi gli occhi.
- Utilizzare una crema depilatoria per rimuovere i capelli sopra l'aspetto mediale sulla destra. Una volta fatto, lavare con salina calda per rimuovere la crema17.
- Posare il ratto in posizione supina su una piastra di riscaldamento. Applicare uno scrub chirurgico a base di iodio o clorhexidina sul sito operativo. Lasciare per almeno 15 s e poi pulire con etanolo. Ripetere l'applicazione 3x. Assicurarsi che lo scrub sia a contatto con la pelle per almeno 2 minuti prima di procedere con l'intervento chirurgico.
NOTA: Contattare l'autorità di controllo delle infezioni presso l'unità di ricerca per protocolli alternativi per prevenire l'infezione del sito chirurgico19. - Drappo l'area chirurgica17.
NOTA: eseguire tutte le procedure in condizioni asettiche rigorose19. - Incise la pelle nell'aspetto mediale del braccio destro e della regione pettorale al piano fasciale profondo, utilizzando una lama del bisturi numero 15. Cauterizzare con attenzione i vasi sanguinanti utilizzando un cavolo elettrico.
- Dividere con attenzione la fascia brachiale, che si presenta come una ottace biancacheche che copre i muscoli, utilizzando un termocautorio o un paio di forbici smussate, avendo cura di non danneggiare le strutture vascolari e nervose nell'aspetto mediale del braccio.
- Aprire un paio di forbici senza mezzi termini sotto l'inserimento terminale del muscolo principale pettorali, al fine di prendere in giro questo muscolo lontano dall'arteria ascellare sottostante e vena, così come dai rami terminali del plesso brachiale.
- Dividere l'inserimento del muscolo principale pettorale con un cavolo elettrico. Esporre e sezione il muscolo minore pettorale.
- Tunantise il MN dai vasi brachiali e dal nervo ulnare partendo dalla regione ascellare fino al gomito. Ciò consente l'esposizione dei diversi rami terminali del plesso brachiale, vale a dire la mediana, l'ulnare, il radiale, l'ascellare e i nervi muscolo-cutanei (Figura 2).
- Separare diversi gruppi sperimentali come descritto di seguito.
- Creare il gruppo Sham eliminando solo il nome di proprietà.
- Creare il gruppo Crush comprimendo il MN nella parte centrale del braccio per 15 s utilizzando un numero 5 di psiche di microchirurgia, o uno strumento simile22,23.
- Creare il gruppo Excision utilizzando una coppia di forbici microchirurgiche per accise un segmento di 10 mm dalla parte centrale del MN nel braccio. Ligate il ceppo prossimale del nervo con una sutura in nylon 8/0 per prevenire la crescita assonale.
- Create il gruppo Innesto utilizzando il segmento di 10 mm del MN descritto in quest'ultimo passaggio e ruotandolo di 180 gradi. Suturare i ceppi prossimali e disatti del MN sezionato all'innesto nervoso con punti di nylon interrotti 10/0.
- Chiudere la ferita cutanea con punti di nylon 5/0 interrotti10,24.
- Fornire analgesia postoperatoria con 7 mL di acetaminofene aromatizzato alla ciliegia mescolato con 43 mL di acqua di rubinetto25 per ottenere una concentrazione di 4,48 mg/mL in bottiglie d'acqua di plastica da 50 ml messe a disposizione dei ratti ad libitum per 3 giorni25.
2. Alloggio e fisioterapia
- Consentire ai ratti di avere contatto con gli apparati di fisioterapia 2-4 settimane prima dell'intervento chirurgico, al fine di garantire un adattamento più facile e veloce alle impostazioni di esercizio. Eseguire gli esercizi seguendo le procedure descritte di seguito.
- Una volta al giorno, posiziona ogni ratto all'interno di una singola sfera fisioterateralistica e successivamente posiziona la sfera in una stanza con pochi ostacoli. Lasciate che il topo ambulato ed esplorare la stanza liberamente per mezz'ora.
- Ospita i ratti individualmente in gabbie solitarie con ruote da corsa incorporate per aiutarli ad esercitarsi.
- Forma gruppi di 4-5 animali e ospita questi gruppi in gabbie personalizzate. Personalizza le gabbie includendo scale, corde, ruote da corsa e altri elementi di arricchimento ambientale.
- Riporta i singoli ratti in gabbie personalizzate il giorno dopo l'intervento.
- Riprendere gli esercizi di fisioterapia 3 giorni dopo l'intervento chirurgico.
3. Test funzionali
- Una settimana prima di iniziare a eseguire i test funzionali, familiarizzare i ratti con le prelibatezze alimentari da utilizzare come rinforzo positivo. Fornire questo rinforzo dopo il completamento di ogni test, prima e dopo l'intervento chirurgico. Dopo il periodo di allenamento iniziale di 3 settimane, riprendere tutti i test 1 settimana dopo l'intervento chirurgico.
- Condurre i test la sera, quando i ratti sono naturalmente più attivi. Riprendere i test 1 settimana dopo l'intervento chirurgico.
- Eseguire il test di presa posizionando il ratto su una griglia e sollevarlo per la coda, lasciandogli afferrare la griglia con le zampe anteriori11,26. Assegnare un punteggio "Positivo" se il ratto può afferrare la griglia con entrambe le zampe anteriori. Assegna un punteggio "Negativo" se il topo non riesce ad afferrare la griglia con la zampa infortunata.
NOTA: un test di afferratura positivo indica che il componente del motore del MN funziona16,27. - Eseguire un Test Prick Pin28,29.
- Crea una piattaforma di plastica con un motivo a griglia quadrata da 4 mm x 4 mm. Fornire supporto a questa griglia con una cornice metallica lunga 21 cm.
- Posizionare il ratto sulla piattaforma e coprire la griglia con una scatola di plastica trasparente 15,5 cm x 15,5 cm x 11 cm. Attendere alcuni minuti fino a quando le normali attività (ad esempio, esplorativa e toelettatura principale) si attenuano.
- Iniziare il test quando il ratto è fermo e in piedi sulle sue quattro zampe.
- Con l'aiuto di uno specchio, inserire un aestesiometro (ad esempio, il numero 4 von Frey capelli con una forza di piegatura di 25 g) attraverso la rete e colpire l'aspetto palmar della zacca anteriore nel territorio della pelle del MN (Figura 1). Ripetere la valutazione 5 volte su ogni zampa anteriore in alternativa, in attesa di alcuni secondi dopo ogni valutazione.
- Verificare la piegatura del filamento Von Frey30 per la valutazione corretta. Segnare le risposte di ritiro come segue: "0" per nessuna risposta di prelievo, "1" se il ratto rimuove lentamente la zampa dal filamento, "2" se il ratto risponde rapidamente allo stimolo e rimuove la zampa o lecca la zampa.
NOTA: Se si osservano l'ambulation e il morso del filamento, ripetere lo stimolo, perché queste sono considerate risposte ambigue.
- Sessioni di formazione
NOTA: Allenare i ratti ogni giorno per 3 settimane prima di eseguire l'intervento chirurgico la sera in un ambiente di scarsa illuminazione. Le sessioni di allenamento sono consigliate appositamente per l'arrampicata su corda, il gradino della scala e le prove delle piste a piedi. Questi possono essere fatti nell'ordine presentato prima, iniziando con il test di arrampicata corda, rung scala, e infine test piste a piedi. Lasciare lo stesso animale qualche minuto di riposo prima di un nuovo test.- Durante la prima settimana, posizionare il ratto sull'ultimo terzo della scala / corda / corridoio, vicino all'ingresso della scatola. Condizionare l'animale a muoversi verso l'apertura della scatola toccando delicatamente e/o tirando la punta della coda. Fornire al ratto un trattamento alimentare una volta che entra nella scatola, permettendogli alcuni secondi di riposo prima di ripetere il test. Ripetere 5 volte ogni giorno per 5 giorni.
- Durante la seconda settimana, posizionare l'animale sul secondo terzo della scala/corda/corridoio Ripetere i gradini in 3.5.1.
- Durante la terza settimana, posizionare il ratto sul fondo della scala / corda / corridoio, sul lato opposto dell'ingresso della scatola. Ripeti i passaggi in 3.5.1, ma premia l'animale solo quando completa correttamente il test.
- Eseguire il test di Ladder Rung.
NOTA: Questo test viene utilizzato per valutare la resistenza dell'arto anteriore, il passo, il posizionamento e la coordinazione31.- Posizionare il ratto nella parte inferiore della scala (120 cm x 9 cm x 2 cm con 18 passi di 1,5 cm di spessore, distanziati di 4 cm di distanza) e toccare delicatamente la coda del ratto. Assicurarsi che la scala sia posizionata ad un'inclinazione di 10 gradi e che conduca ad un'apertura di 13,20 cm x 11 cm su una scatola in legno scuro di 31,5 cm x 35 cm x 35 cm.
- Avviare il timer una volta che il topo inizia a salire la scala e fermare il timer una volta che il muso del topo attraversa l'ingresso della scatola.
- Registrare il tempo e ripetere il test 3x, ciascuno separato almeno da un intervallo di 1 min.
- Arrampicata su corda
NOTA: Questo test viene utilizzato per valutare la resistenza di presa, che dipende dal recupero MN32.- Metti il topo sul fondo della corda e convincilo a salire toccando delicatamente la coda. Avviare il timer una volta che l'animale inizia a salire e fermarlo nel momento in cui il muso dei ratti attraversa l'ingresso della piattaforma.
- Per ogni test, registrare il tempo impiegato per salire sulla piattaforma e il numero di scivolamenti della zampa ferita mentre il topo sale la corda. Considerare il test valido se l'animale non esita durante il compito o non smette di salire. Fornire al ratto uno spuntino dopo aver eseguito correttamente l'operazione.
- Registrare il tempo e ripetere il test 3x, ognuno separato di almeno un intervallo di 1 minuto.
- Tracce a piedi
NOTA: Questo test viene utilizzato per la valutazione del recupero del motore anteriore33,34.- Impostare un apparato costituito da una passerella confinata 16,5 cm di altezza x 8,7 cm di larghezza x 43 cm di lunghezza. Assicurarsi che questo porti ad un'apertura rettangolare di 8,8 cm x 8,2 cm in una delle pareti di una scatola nera in legno 23 cm x 36 cm x 28 cm. Includere una porta scorrevole verticale per chiudere rapidamente l'ingresso della scatola. Includere una parte superiore rimovibile da utilizzare per il recupero del ratto33,34.
- Posizionare un pezzo di carta millimetrata sul pavimento del modellatore. Afferra il topo per la coda e lascialo tenere un pennello da pittura imbevuto di blu di metilene. Posizionare il ratto all'ingresso del corridoio per farlo camminare all'interno della scatola. Rimuovere la carta millimetrata dal pavimento del corridoio e ripetere la prova fino a ottenere una buona impressione rappresentativa di entrambe le zampe anteriori.
- Dalle stampe ottenute, selezionarne una con chiare stampe a zampa anteriore successive, fotografarle in formato tiff o jpeg e misurare i seguenti parametri utilizzando il software ad accesso aperto FIJI35.
NOTA: In primo luogo, calibrare ogni immagine utilizzando i contrassegni nella carta millimetrata (Analyze Imposta scala) In secondo luogo, convertire ogni immagine in un formato a 8 bit (Immagine Proprietà Type (Tipo) 8 bit). Successivamente, utilizzare lo strumento selezione rettangolare per selezionare la stampa della zampa. Ritagliare questa parte dell'immagine (Immagine Ritagliare). In ogni immagine, evidenziare le impronte e rimuovere lo sfondo sottenendo l'immagine (Immagine Proprietà Adjust (Regolare) Soglia).- Misurare il fattore di posizione misurando l'area di impressione della zampa. Utilizzare lo strumento selezione rettangolare per selezionare la stampa della zampa e premere Ctrl .
- Misurare il fattore di lunghezza di stampa misurando la lunghezza più lunga dell'impressione della zampa (per i passaggi 3.8.3.2–3.8.3.6, utilizzare lo strumento Selezione linea diretta per selezionare i due punti più distanti e premere CTRL .
- Misurare il fattore di diffusione delle dita misurando la larghezza più ampia dell'impressione della zampa.
- Misurare il fattore di diffusione delle dita intermedio misurando la larghezza più larga tra la seconda e la terza dito.
- Misurare la lunghezza del passo misurando la distanza tra i punti omologhi delle successive impronte di zampe su un determinato lato.
- Misurare la base del supporto misurando la distanza perpendicolare tra la parte centrale dell'impressione della zampa e la direzione di movimento29,33,36.
NOTA: Eseguire le ultime due misurazioni in due coppie di impronte di zampa bilaterali consecutive rappresentative33.
4. Misurazioni fisiologiche
- Termografia a infrarossi (IRT)37,38,39.
- Assicurarsi che la temperatura della stanza in cui verranno eseguite le misurazioni sia compresa tra 18 e 25 gradi utilizzando un normale idrotermo digitale con una risoluzione termica di 0,1 gradi centigradi. Assicurarsi che non siano presenti fonti di calore significative (ad esempio, computer o frigoriferi).
- Acclimatari i ratti portandoli nella sala di valutazione 2 h prima della valutazione. Prima di iniziare l'esperimento, anestesizzare il ratto come descritto sopra (passaggi 1.3–1.6) o seguendo il protocollo dell'istituzione. Verificare la mancanza della risposta a un pizzico di punta prima di iniziare l'esperimento.
- Accendere la telecamera termografica a infrarossi 15 minuti prima dell'acquisizione e non spegnerla durante le valutazioni. Impostare il parametro di emissività della fotocamera in modo che corrisponda a quello della pelle del ratto (z) 0,98)37,40,41.
- Posizionare il ratto sul suo dorsum su una superficie pulita e stabile con una spugna di polietilene. Assicurarsi che non vi siano materiali riflettenti e altre possibili fonti di artefatti. Fissare le zampe anteriori con attenzione in supinazione con nastro adesivo a doppia faccia. Inserire un termometro digitale 2 cm all'interno del retto per monitorare la temperatura centrale del ratto durante tutte le valutazioni.
- Tenere la fotocamera termografica ad un angolo di 90 gradi e una distanza di 30 cm dal ratto. Concentra la fotocamera sul corpo di tutto l'animale. Ottenere tre immagini termografiche a infrarossi distanziati di 30 s l'uno dall'altro.
- Trasferire i termogrammi acquisiti su un computer e analizzarli utilizzando un software di analisi. Definire la temperatura della superficie plantare di entrambe le zampe anteriori utilizzando una regione rettangolare di interesse fissa (ad esempio, 9 x 11 pixel) nel territorio plantare del MN, ad esempio al centro del primo pedale metacarpale (Figura 1). Utilizzando il software gratuito FLIR Tools, selezionare la termografia facendo doppio clic su di essa. Sulla barra degli strumenti a sinistra, selezionare il pulsante " Aggiungi strumento dimisurazione della casella" e disegnare un rettangolo di 9x1 pixel sull'area plantare di entrambe le anteriori. Durante la regolazione del rettangolo, la sua dimensione in pixel può essere confermata. Eseguilo su entrambe le zampe anteriori. Sul lato destro dell'immagine si trovano le temperature massime, minime e medie.
- Sopra il ROI disegnato in precedenza, fare clic con il pulsante destro del mouse e selezionare Esporta. Le temperature mediche, massime e minime, nonché una matrice di temperature del ROI vengono quindi esportate in un documento .csv. Questi dati possono essere successivamente esplorati utilizzando un software di analisi dei dati.
- Valutazione Electroneuromyographic (ENMG)
- Impostare uno stimolatore elettrico. Nastro un paio di aghi di agopuntura usa e getta (0,25 mm x 25 mm) con un impedimento trascurabile [<1 ) e 25 mm tra di loro per creare elettrodi per la stimolazione. Ora collega lo stimolatore e l'elettrodo a un'unità di acquisizione dati per prendere i segnali in entrata e convertirli in segnali digitali che possono essere elaborati con il software del computer.
- Eseguire le valutazioni nella stessa stanza, e sempre nelle stesse condizioni ambientali controllate42,43,44. Pizzicare la zampa anteriore per assicurarsi che i ratti siano profondamente anestesizzati prima di iniziare l'acquisizione dei dati.
NOTA: L'anestesia profonda è di fondamentale importanza per ridurre al minimo la variabilità associata a movimenti volontari e/o involontari spontanei da parte dei ratti43. - Esporre il MN su entrambi i lati sotto il microscopio chirurgico come descritto nei passaggi 1.8–1.13. Utilizzare una lama bisturi numero 15 per prolungare le incisioni brachiali negli avambracci con un'incisione mediana ventrale.
- Esponi l'aspetto superficiale dei muscoli a sublimi del digitorum flessore separando senza mezzi termini la fasciaante antebrachiale sovrastante usando le forbici iride. Inserire l'ago di terra nel muscolo del quadricipite femorale dell'arto posteriore sinistro per collegare la spina di terra del segnale.
- Iniziare con la zampa anteriore giusta e posizionare gli elettrodi di registrazione nel ventre muscolare a sublimi del digitorum flessore della zampa anteriore e l'elettrodo di stimolazione proximal al sito di lesione nel MN. Inumidire questi elettrodi con la salina.
- Assicurarsi che il software sia impostato come segue: porta di ingresso del canale 1 (CH1) – stimolatore a 0-10 V; e porta di ingresso del canale 2 (CH2) - EMG a 30–1,000 Hz. Iniziare scegliendo un'ampiezza di stimolazione di 10 mV e registrare i potenziali CMAP velocità di campionamento di 50 kHz per una durata di 40.000 ms. Aumenta gradualmente l'ampiezza di stimolazione in 10 mV passi fino a raggiungere 2.000 mV. Ripetere lo stesso per la zampa sinistra42,43,44.
NOTA: il segnale viene amplificato a 1.000x e filtrato utilizzando una banda da 30-1.000 Hz. L'uscita di stimolazione è impostata per un singolo impulso con una durata di 1 ms42,43,44. - Aprire il file registrato nel software dell'apparato di registrazione.
NOTA: Per impostazione predefinita, lo schermo mostrerà le finestre di traino in alto in rosso, gli impulsi stimolatori, e sotto in blu il registratore ENMG. Lo scorrimento della barra di scorrimento orizzontale sotto la scala cronologica consente la visualizzazione dell'intero record. I due strumenti principali, lo strumento zoom e lo strumento I-Beam, si trovano nella parte inferiore destra del pannello. Utilizzando lo strumento zoom, è possibile ottimizzare la visualizzazione dei CMAP ed esplorare la grafica. Per garantire un buon raccordo nella schermata di visualizzazione, potrebbe essere necessario regolare la visualizzazione dopo lo zoom. A tale scopo, selezionare Visualizza Ridimensionamento automatico delle forme d'onda. Lo strumento I-beam consente la selezione di aree specifiche dei grafici e delle prestazioni delle misure desiderate. Nella parte superiore dei grafici, ci sono tre piccole finestre in cui vengono visualizzate le misure. P-P mostra il valore medio di ampiezza dell'area selezionata in volt (sia nel record dello stimolatore che negli ENMG), mentre Delta-T mostra l'intervallo di tempo di tale selezione. - Misurare i parametri dal potenziale di azione muscolare composta (CMPA, descritto nella Tabella 1) utilizzando gli strumenti di misurazione omonimi dal plug-in software " Toolbox per laclassificazione senza supervisione dei MUAP e dei potenzialidi azione in EMG "45.
- Per ogni ratto, determinare un valore minimo di tensione di stimolazione dopo il quale l'ampiezza CMAPs non aumenta ulteriormente. Iniziare da uno stimolo di 0,05 mV e dare successivi stimoli crescenti in tensioni incrementali di 0,05 mV.
- Applicare uno stimolo del 20% al di sopra di questa tensione per ottenere un valore di stimolazione sopramassile.
- Dopo aver determinato quest'ultimo valore e applicato lo stimolo corrispondente, registrare i parametri CMAP successivi.
- Valutazione della forza di flessione
- Utilizzare lo stesso stimolatore e gli elettrodi di stimolazione per stimolare elettricamente l'MN come nel passaggio 4.2. Impostare il canale di ingresso CH1 come stimolatore (0-10 V) e le impostazioni di uscita per la durata degli stimoli di 30 s con impulsi di 1 ms di durata e frequenza di 1 Hz. Collegare un dinamometro, con una risoluzione di d - 0,001 N a un computer.
NOTA: La visualizzazione in tempo reale dei dati può essere ottenuta costruendo un grafico di forza per volta (N/s) utilizzando il software precedentemente installato sul computer e collegato a un dinamometro46. - Posizionare il ratto come descritto al punto 4.1.4. Posizionare un anello di sutura di seta 5/0 attraverso il secondo spazio interosse di entrambe le zampe anteriori. Fissare il circuito di sutura al gancio del dinamometro e la zampa anteriore allineata con il dinamometro senza mettere eccessiva tensione sulla linea di sutura.
- Fissare la zampa contralaterale con nastro adesivo per evitare interferenze di movimento spurie nelle letture del dinamometro.
- Impostare il dinamometro su zero facendo clic sul pulsante .
- Regolare lo stimolatore a una stimolazione ad ampiezza sovramassimale di 1,5 V regolando il nodo di tensione.
- Sul PC, aprire il software AFH-01. Aprire il separatore "Dispositivo" e selezionare il dispositivo FH5. Creare un nuovo file ("Measurements1" è il nome fornito per impostazione predefinita) e rinominare il file.
- Posizionare l'elettrodo sulla parte prossimale del MN, fare clic sul gioco nella parte inferiore del programma, registrare il tiro sul dinamometro per 30 s.
- Importare i valori ottenuti in un software di analisi dei dati. Calcolare i valori di forza massima e media e l'area sotto la curva (AUC) per il grafico della forza x del tempo per ogni valutazione.
- Ripetere l'operazione per la zampa anteriore sinistra.
- Utilizzare lo stesso stimolatore e gli elettrodi di stimolazione per stimolare elettricamente l'MN come nel passaggio 4.2. Impostare il canale di ingresso CH1 come stimolatore (0-10 V) e le impostazioni di uscita per la durata degli stimoli di 30 s con impulsi di 1 ms di durata e frequenza di 1 Hz. Collegare un dinamometro, con una risoluzione di d - 0,001 N a un computer.
- Peso muscolare
- Eutanasia i ratti in anestesia generale da essanguinazione47,48.
- Raccogliere il muscolo flessore carpi radialis da entrambi gli avambracci, sezionando il muscolo dalla sua origine fino all'inserimento del tendine distale, utilizzando una lama del bisturi numero 15.
- Pesare i muscoli con una scala di precisione9,49.
Risultati
Un totale di 34 ratti sono stati suddivisi in modo casuale nei seguenti gruppi: Sham (n - 17), Escisione (n - 17) e Innesto del Nervo (n - 10) per l'operazione. Tutti i ratti sono sopravvissuti all'intervento chirurgico e il periodo postoperatorio senza eventi. Una settimana dopo l'intervento chirurgico e per i successivi 100 giorni, tutti gli animali sono stati sottoposti ai test funzionali descritti sopra una volta alla settimana. I risultati rappresentativi di ciascuno di questi test sono descritti di seguito.
Test di presa
La percentuale di ratti con una risposta positiva nella prova di presa è stata più alta per il gruppo Sham. Questo valore è gradualmente aumentato nel tempo nei ratti dei gruppi Crush e Nerve Graft (Figura 3).
Test di pungiglione di spillo
I ratti del gruppo Sham hanno avuto i punteggi migliori nel test cumulativo di puntura di schienani rispetto ai ratti del gruppo Nerve Graft. Entrambi avevano punteggi migliori rispetto ai ratti nel gruppo Excision (Figura 4).
Test di corsa ladder
La velocità dei ratti nel test di corsa della scala era più alta nel gruppo Sham che nei ratti sottoposti alla lesione MN. Tra questi ultimi, il tempo per eseguire la scala tendeva a diminuire nel tempo, parallelamente al recupero MN (Figura 5).
Prova di corda
Come nel test di corsa della scala, il tempo impiegato dai ratti per scalare la corda era più breve nel gruppo Sham rispetto ai gruppi in cui il MN è stato ferito. La velocità dei ratti in questo test è aumentata quando il MN è stato permesso di recuperare (Figura 6).
Analisi dei sentieri a piedi
L'analisi delle tracce a piedi tendeva a mostrare cambiamenti nella morfologia delle impronte delle zampe (Figura 7). Questi cambiamenti sono stati spesso più pronunciati nelle lesioni schiaccianti che nelle lesioni nervose segmentali50.
Termography a infrarossi
La termografia è stata utile quando si esaminano le differenze di temperatura tra le zampe anteriori nei primi 30 giorni dopo l'intervento chirurgico. Le differenze di temperatura erano più evidenti nei ratti con un MN più gravemente ferito, come in quelli del gruppo Excision (Figura 8 e Figura 9).
Electroneuromyography
La tabella 1 riassume l'importanza biologica delle misurazioni dell'elettroeuromiografia, fornendo risultati rappresentativi per i diversi gruppi sperimentali. Vari modelli sono stati osservati con elettroeuromiografia. Un CMAP normale era tipico di un ratto del gruppo Sham, mentre un CMAP polifasico era associato a un grado variabile di lesione del MN, come nei gruppi Crush e Nei gruppi Nerve Graft (Figura 10). Nel gruppo Excision non è stato osservato alcun CMAP.
Forza flexion polso
Dato che la flessione del polso dipende principalmente dalla MN, questo test è stato utilizzato per valutare il recupero motorio nel territorio di questo nervo. La forza di flessione del polso era più vicina alla normalità quando il recupero era massimo (Figura 11).
Peso muscolare e morfologia
Il peso e la morfologia del muscolo flessore carpis radialis dipendevano dal recupero MN, in quanto questo muscolo è innervato esclusivamente dal MN9,10. Così, peso normale e morfologia sono stati osservati nel gruppo Sham. Una perdita di peso e tropismo muscolare è stata osservata nei gruppi Crush, Nerve Graft, e Excision (Figura 12).
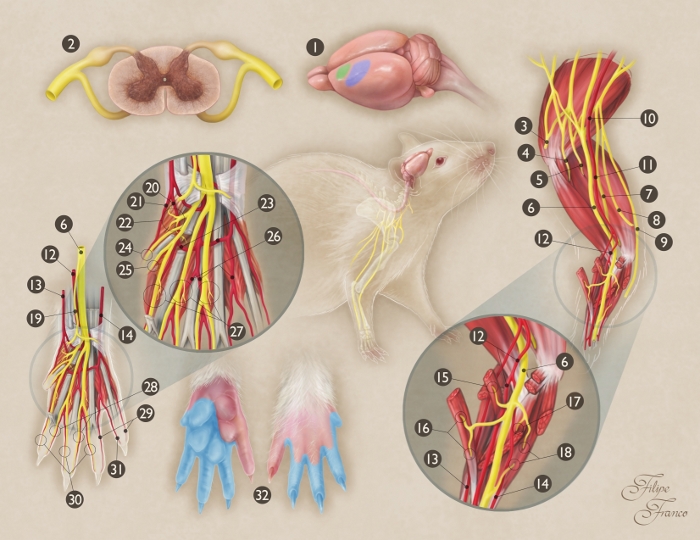
Figura 1: Rappresentazione schematica dell'anatomia del nervo mediano del ratto.
(1) Origine e terminazione del nervo mediano nel cervello del ratto (area verde - area motoria primaria; area blu - area sensoriale primaria). (2) Sezione trasversale del midollo spinale a livello di segmento C7; (3)Nervo ascellare; (4) Nervo muscoloso; (5)Nervo radiale; (6) Nervo mediano; (7) Nervo ulnare; (8) Ramo cutaneo mediale del braccio; (9) Ramo cutaneo mediale dell'avambraccio; (10) Arteria ascellare; (11) Arteria Brachiale; (12) Arteria mediana; (13) Arteria radiale superficiale; (14) Arteria Ulnar; (15) Ramo motore del nervo mediano al muscolo pronatore teres; (16) Ramo motore del nervo mediano al muscolo della carpis radialis flessore; (17) Ramo motore del nervo mediano al muscolo del digitalo superficiale flessore superficialis; (18) Ramo motore del nervo mediano al muscolo del cereno flessore profundus; (19) Ramo sensoriale del nervo mediano verso la regione del narina; (20) Arteria comune palmar del primo spazio interosseo; (21) Arteria digitale palmar radiale della prima cifra; (22) Ramo motorio del nervo mediano ai muscoli thenar; (23) Arco arterioso Palmar; (24) Nervo digitale palmar radiale della prima cifra; (25) Ulnar palmar nervo digitale della prima cifra; (26) Arteria comune palmar del terzo spazio interosseo; (27) I rami motori delle divisioni terminali del nervo mediano ai primi tre muscoli lumcali; (28) Ulnar palmar nervi digitali della seconda, terza e quarta cifra; (29) Le arterie digitali di Ulnar palmar alla quarta e alla quinta cifra; (30) Nervi digitali palmari radiali della seconda, terza e quarta cifra; (31) Arteria digitale radiale palmar della quinta cifra; (32) Territorio cutaneo del nervo mediano nella pedana (regione blu-ombreggiata). Fare clic qui per visualizzare una versione più grande di questa figura.
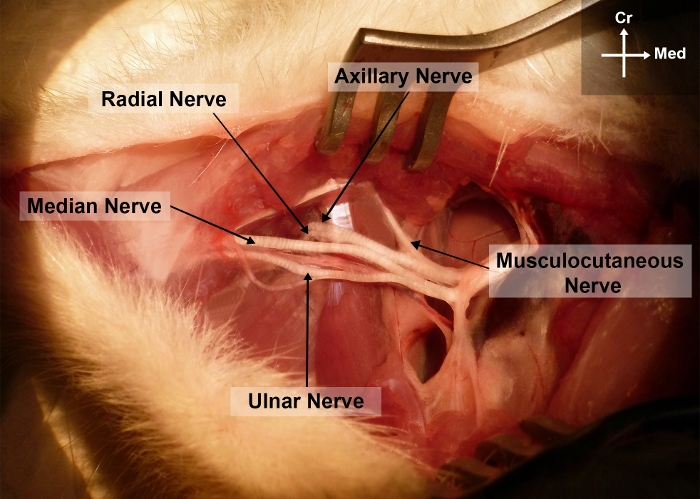
Figura 2: Fotografia dell'arti gliarti destro del ratto che mostra l'anatomia chirurgica del nervo mediano nel braccio e nelle regioni ascellari.
Cr, craniale; Io, mediale Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
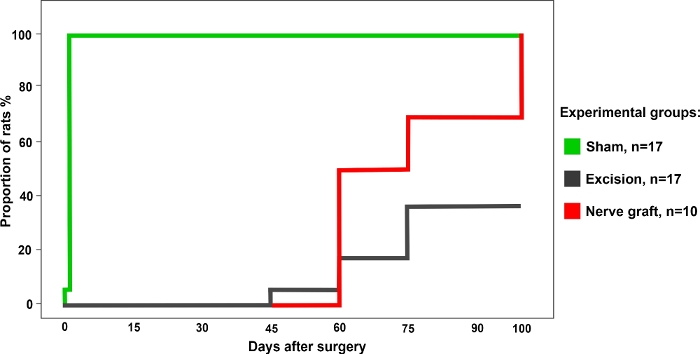
Figura 3: Percentuale di ratti con un test di presa positivo nel diverso gruppo sperimentale per un periodo di 100 giorni dopo l'intervento chirurgico. Fare clic qui per visualizzare una versione più grande di questa figura.
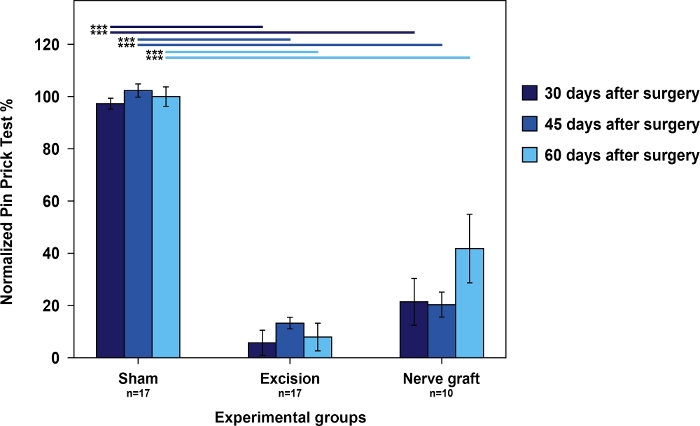
Figura 4: Valutazione della tiratura utilizzando i risultati cumulativi dei test di puntura di pin nella zampa anteriore operata normalizzata alla zampa contraplaterale nei diversi gruppi sperimentali.
Le barre verticali rappresentano intervalli di confidenza del 95%. Le linee orizzontali nella parte superiore della figura indicano differenze statisticamente significative tra i gruppi sperimentali, ovvero "p<0,01". Fare clic qui per visualizzare una versione più grande di questa figura.
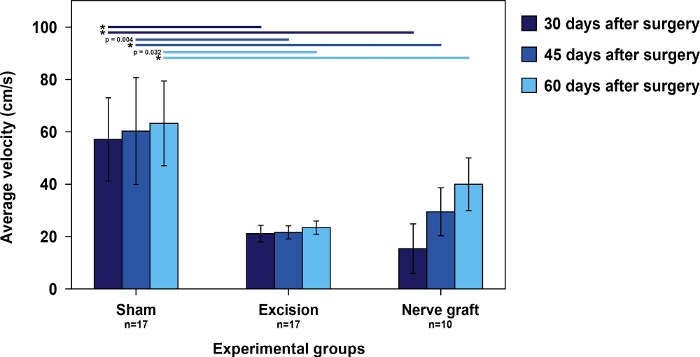
Figura 5: Velocità media nel test di corsa della scala nei diversi gruppi sperimentali.
Le barre verticali rappresentano intervalli di confidenza del 95%. Gli asterischi nella parte superiore della figura indicano differenze statisticamente significative tra i gruppi, ovvero p<0,001. Fare clic qui per visualizzare una versione più grande di questa figura.
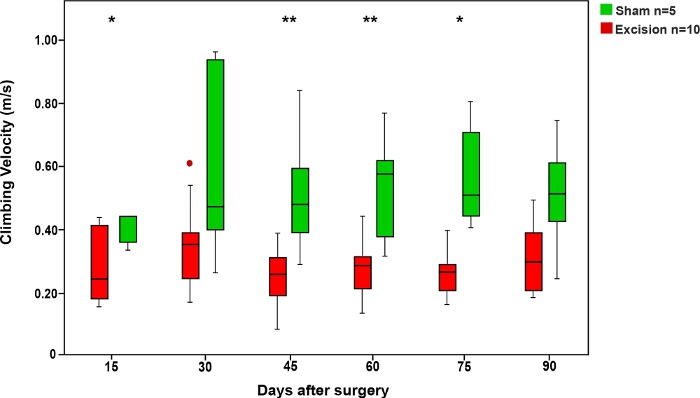
Figura 6: Velocità media di arrampicata nella prova di fune nei gruppi Sham ed Excision.
Le barre verticali rappresentano intervalli di confidenza del 95%. Gli asterischi nella parte superiore della figura mostrano differenze statisticamente significative tra i gruppi, ovvero p<0,05; <0,01. Fare clic qui per visualizzare una versione più grande di questa figura.
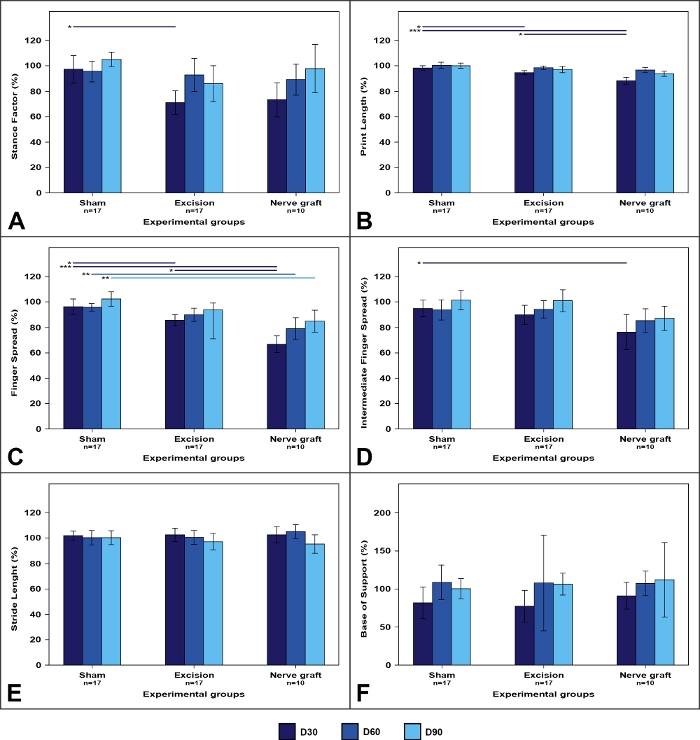
Figura 7: Parametri della pista a piedi nei diversi gruppi sperimentali.
I valori sull'arto azionato sono espressi come percentuali di mezzi normalizzati all'arto contralaterale. (A) Fattore di posizione; (B) Lunghezza di stampa; (C) Fattore di diffusione delle dita; (D) Fattore intermedio di diffusione delle dita; (E) Lunghezza del passo; (F) Base di sostegno. Le barre verticali rappresentano intervalli di confidenza del 95%. Le linee orizzontali nella parte superiore della figura indicano differenze statisticamente significative tra i gruppi sperimentali. D30, D60, D90 : 30, 60 e 90 giorni dopo l'intervento chirurgico, <0,05; <0,01; p<0.001. Fare clic qui per visualizzare una versione più grande di questa figura.
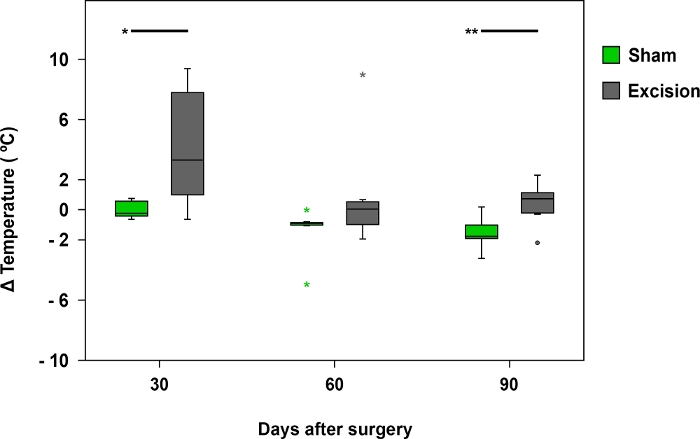
Figura 8: Differenza media di temperatura registrata dalla termografia a infrarossi.
I grafici a scatola rappresentano la differenza di temperatura tra la regione palmar del nervo mediano sul lato operato (lato destro) e il lato contralaterale (a sinistra) nei gruppi Sham (n - 17) ed Excision (n - 17), .p<0.05; <0,01. Fare clic qui per visualizzare una versione più grande di questa figura.
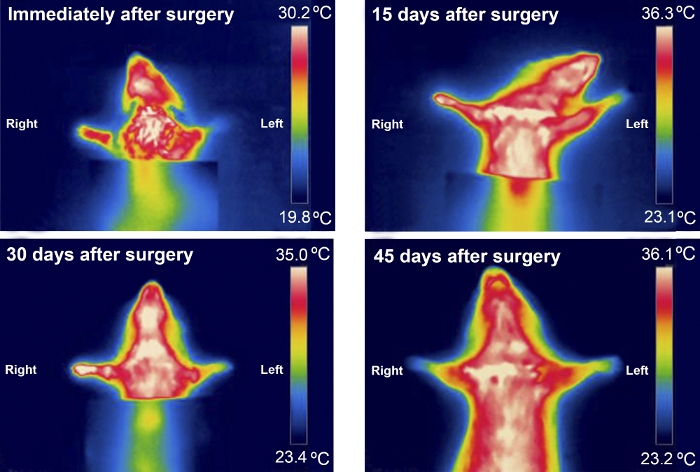
Figura 9: Tipico modello termografico a infrarossi di un animale del gruppo di escissione durante i primi 45 giorni dopo l'intervento chirurgico. Fare clic qui per visualizzare una versione più grande di questa figura.
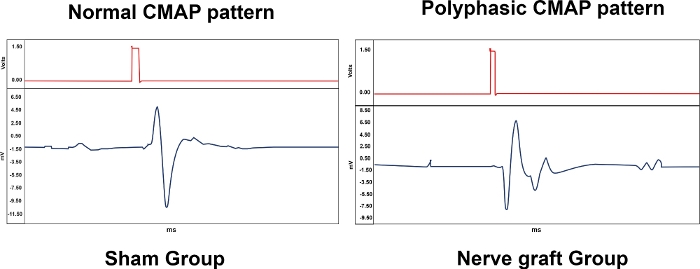
Figura 10: Modelli tipici di Compound Muscle Action Potentials (CMAP) da un animale dei gruppi Sham e Nerve Graft 90 giorni dopo l'intervento chirurgico. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
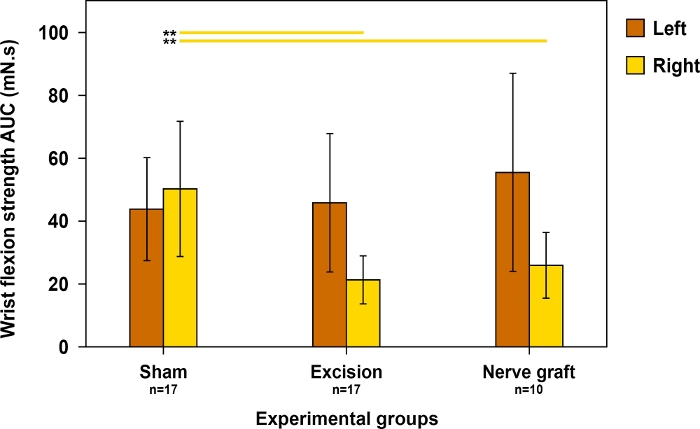
Figura 11: Valutazione della forza di flessione del polso su entrambe le zampe 90 giorni postoperatori in diversi gruppi sperimentali.
La forza di flessione del polso è stata valutata utilizzando l'area sotto la curva (AUC) in un periodo di tempo di 30 s e utilizzando la stimolazione supratetanica. Le linee verticali indicano intervalli di confidenza del 95%. Le linee orizzontali nella parte superiore della figura evidenziano differenze statisticamente significative tra i gruppi, ovvero p;0,01 . Fare clic qui per visualizzare una versione più grande di questa figura.
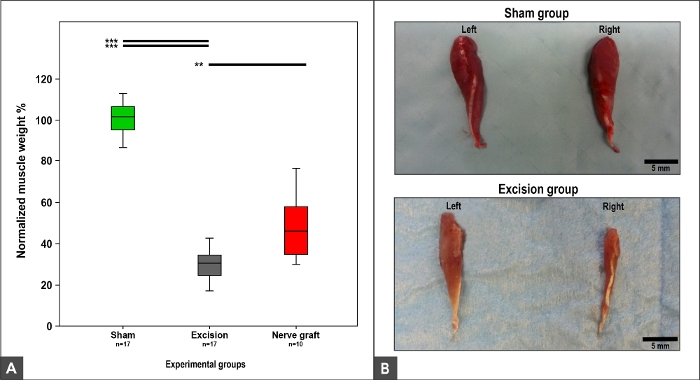
Figura 12: Flexor carpi radialis peso muscolare e aspetto macroscopico 100 giorni dopo l'intervento chirurgico.
(A) Box plot raffiguranti il peso muscolare standardizzato di carpi radialis in diversi gruppi sperimentali, il p<0.01; p<0.001. (B) Fotografie dei muscoli sui lati destro e sinistro nei gruppi sperimentali Sham ed Excision. Fare clic qui per visualizzare una versione più grande di questa figura.
| Parametro | Significato del parametro | Gruppo Sham | Gruppo di escissione | Gruppo NG |
| Soglia di stimolazione neurologica (%) | Valutazione della rigenerazione del nervo, in quanto vi è un numero minimo di fibre nervose necessarie per produrre un CMAP o una contrazione muscolare visibile12 | 281,63 x 271,65 | 5359.98 : 3466,52 | 2108,12 - 2115,13 |
| Soglia di stimolazione motoria (%) | Valutazione della rigenerazione del nervo, in quanto vi è un numero minimo di fibre nervose necessarie per produrre un CMAP o una contrazione muscolare visibile12 | 462,52 : 118,91 | 1694,10 - 503,24 | 1249,50 : 503,24 |
| Latenza (%) | Valutazione della velocità di conduzione nervosa nelle fibre nervose più veloci, vale a dire le più grandi fibre mielinate44 | 113,55 x 25,04 | N/D | 132,80 - 69,95 |
| Velocità di trasduzione neuromuscolare (%) | Valutazione della velocità di conduzione nervosa nelle fibre nervose più veloci, vale a dire le più grandi fibre mielinate44 | 92,01 - 20,88 | N/D | 91,30 x 26,51 |
| Ampiezza CMAP (%) | Valutazione del numero di unità motorie reinnervated34 | 110,63 : 45,66 | N/D | 41,60 x 24,84 |
| Durata CMAP (%) | Valutazione della sincronia dell'innervazione muscolare, che dipende dal grado di reinnervazione muscolare e mielinizzazione delle fibre motorie innervanti44,45 | 101.12 - 23,92 | N/D | 151,06 - 54,52 |
|
NG, innesto nervoso CMAP, potenziale di azione muscolare composta. N/D, non applicabile Tutti i parametri sono espressi come percentuali dei valori contralaterali medi. Le variabili numeriche sono espresse come media - deviazione standard. | ||||
Tabella 1: valutazione elettroeuromiografica alla fine dell'esperimento.
Discussione
Questo documento presenta un protocollo per creare diversi tipi di lesioni MN e riparare nel ratto. Inoltre, illustra come valutare il recupero funzionale di questo nervo utilizzando diversi test comportamentali non invasivi e misurazioni fisiologiche.
In particolare, molti dei test funzionali descritti in questo documento, vale a dire il Ladder Running Test e il Rope Test, dipendono in modo significativo dalla volontà del ratto di svolgere il compito con l'aspettativa di ottenere la ricompensa alimentare51,52,53. Va notato che alcuni ceppi di ratto sono più suscettibili all'allenamento e l'esecuzione riproduciva in questo tipo di test51,52,53. Ad esempio, i ratti Lewis si comportano male in questi test sia in fase di allenamento che successivamente51,52,53.
L'alloggiamento dei ratti dovrebbe consentire un'ampia libertà di movimento in accordo con il loro naturale comportamento esplorativo, oltre a consentire agli animali sperimentali di familiarizzare con alcuni degli elementi presenti nei test funzionali19. Pertanto, vengono mostrate diverse forme di alloggiamento che consentono una maggiore libertà di movimento. Le grandi gabbie sono personalizzate con elementi di arricchimento che vengono successivamente utilizzati nei test funzionali (ad esempio, corde e scale).
Probabilmente, questi elementi arricchenti così come le gabbie con ruote da corsa incorporate e le singole sfere di allenamento forniscono una forma di fisioterapia postoperatoria simile a quella offerta ai pazienti umani operati sul sistema nervoso periferico10.
Significativamente, anche se alcuni autori sostengono sezionare i tessuti sottocutanei e fasciatura muscolare senza mezzi termini o da taglio pulito con un numero 15 bisturi, l'uso di termocauterio quando si sezionano queste strutture è raccomandato per ridurre al minimo il rischio di ematoma postoperatorio.
Va notato che numerosi test sono stati ideati per testare diversi aspetti della riparazione del nervo periferico nel ratto, vale a dire la rigenerazione assonale, la reinnervazione del bersaglio e il recupero funzionale, alcuni dei quali esulano dall'ambito di questo studio29,54,55,56. Ad esempio, l'analisi cinematica29,36,55 e la valutazione itomorfometrica29,36,57 sono ampiamente impiegati da più autori. Inoltre, molti di questi test comportano variazioni per massimizzare l'efficienza e/o la riproducibilità54. Ad esempio, l'algisemetria meccanica (cioè la valutazione delle risposte agli stimoli meccanici dolorosi) può essere valutata qualitativamente utilizzando un dato filamento von Frey, come descritto nel presente documento, o semiquantitativamente utilizzando filamenti di von Frey successivi, o anche quantitativamente utilizzando dispositivi elettronici che applicano pressioni crescenti fino a quando non viene osservata una risposta di ritiro fino a quando non viene osservata una risposta di ritiro30,54.
Allo stesso modo, anche se diversi autori usano l'analisi della pista a piedi per valutare la riparazione del nervo anteriore nel ratto, altri autori sostengono che le singole lesioni MN spesso non riescono a produrre cambiamenti riproducibili nei pawprint10,58,59. Inoltre, alcuni hanno dichiarato che questi cambiamenti non possono essere proporzionali al recupero muscolare10,60. Tenendo questo in mente, alcuni ricercatori hanno sostenuto l'uso di a piedi analisi pista nella preda principalmente quando si valuta il recupero dopo la frantumazione lesioni neve piuttosto che dopo la ricostruzione del nervo segmentale10,50,61.
Il test di presa è ampiamente utilizzato per valutare il recupero motorio dei muscoli controllati dal MN16,27. Per garantire uniformità e riproducibilità dei dati ottenuti con questo test, si raccomanda l'applicazione del test di presa utilizzando la metodologia consolidata proposta da Bertelli et al.16. Tuttavia, il protocollo attuale differisce in quanto non immobilizza regolarmente la zampa contralaterale per evitare indebito stress11,27. Va anche notato che altri autori, dopo aver immobilizzato la zampa illesa, valutano quantitativamente il test di grasping utilizzando un dinamometro o una scala27,56. Tuttavia, questa valutazione quantitativa può essere influenzata dalla forza che il ricercatore applica alla coda del ratto26. Inoltre, è difficile distinguere tra la forza generata dai muscoli digital flexor (esclusivamente innervati dal MN nel ratto e l'oggetto del Grasping Test9) dalla forza prodotta dai flessori del polso, che includono il flessore carpi ulnaris che riceve la sua innervazione dal nervo ulnare9,10,27. Per cercare di eludere questi potenziali pregiudizi, questo protocollo utilizza una scala ordinale simile alla scala del Consiglio di Ricerca Medica comunemente utilizzata per classificare la forza muscolare in esseri umani10,11,62. In alternativa, altri autori hanno descritto una valutazione dettagliata della presa utilizzando l'analisi video e un sistema di punteggio basato su video11,63.
Un potenziale svantaggio dell'uso del MN rispetto al nervo sciatico è che una maggiore quantità di informazioni è disponibile per quanto riguarda quest'ultimo nervo. Questo, a sua volta, può fare un confronto dei dati ottenuti con il MN con quello delle opere sperimentali precedenti più difficili46,48,64. Inoltre, la dimensione più piccola del MN rispetto al nervo sciatico rende la manipolazione chirurgica più impegnativa8,12,27,56,65.
Contrariamente alla metodologia descritta in questo documento, la valutazione dell'elettroeuromiografia può essere eseguita utilizzando elettrodi monopolari transcutanei posizionati nel braccio e nelle regioni del campo di guida51. Nonostante sia meno invasivo, questo metodo comporta il rischio di potenziale confusione a causa della possibilità di costimolazione del nervo ulnare nella regione del braccio9,51.
La maggior parte degli autori concordano sul fatto che non tutti i test utilizzati nel ratto forniscono risultati concordanti, poiché la riparazione del nervo periferico dipende da una complessa serie di fattori, che comprendono la sopravvivenza dei neuroni, l'allungamento e la potatura assonale, la sinaptogenesi, la riconquista di successo degli organi sensoriali e delle unità motorie denervated e la plasticità cerebrale7,10,50,66,67.
Infine, va notato che un avvertimento significativo dei modelli di roditori è che i nervi periferici del ratto sono molto più vicini ai loro organi finali e hanno aree trasversali molto più piccole rispetto alle strutture umane omologhe. Tuttavia, questa differenza di dimensioni garantisce dati sperimentali più veloci nei roditori e migliori risultati complessivi nei ratti rispetto agli esseri umani sono da aspettarsi68. Infatti, diversi autori avvertono che è necessario prestare attenzione quando si cerca di estrapolare dati sperimentali ottenuti nella riparazione del nervo periferico utilizzando roditori per gli esseri umani7,69. I modelli Primate sono considerati70più comparabili. Tuttavia, il loro uso è associato a vincoli etici, logistici e di bilancio71.
Anche se il nervo sciatico è il nervo più comunemente usato nella ricerca sul nervo periferico, il ratto MN presenta molteplici vantaggi. Ad esempio, le lesioni MN sono associate a una minore incidenza di contratture congiunte e all'automutilazione della zampa interessata11,12,16,56. Significativamente, l'autotomia successiva alla transezione del nervo sciatico affligge l'11-70% dei ratti. Ciò potrebbe rendere impossibili le valutazioni attuali come l'indice sciatico14. Questo, a sua volta, rende ingombrante la stima del numero di animali necessari per ottenere un determinato potere statistico15.
Inoltre, poiché il MN è più corto del nervo sciatico, il recupero del nervo si osserva prima58,72,73,74,75,76. Inoltre, il MN non è coperto da masse muscolari, rendendo la sua dissezione tecnicamente più facile di quella del nervo sciatico16. Inoltre, il MN ha un percorso parallelo al nervo ulnare nel braccio. Quindi, il nervo ulnare può essere facilmente utilizzato come innesto nervoso per riparare le lesioni da MN. Infine, negli esseri umani, la maggior parte delle lesioni nervose periferiche si verificano nell'arto superiore, che supporta ulteriormente l'uso di questo nervo nel ratto77,78.
Probabilmente, i roditori sono gli animali sperimentali più comunemente utilizzati nel regno della riparazione del nervo periferico48,79. Come mostrato, il ratto MN è un modello conveniente di lesione e riparazione del nervo periferico. Infatti, ci sono molteplici strategie standardizzate disponibili per valutare il recupero motorio e sensoriale, permettendo un confronto più facile dei risultati36,46,60,80,81,82. Molti di questi metodi non sono invasivi, consentendo una valutazione giornaliera.
Inoltre, la fisioterapia fa parte dello standard di cura dei pazienti che si riprendono da lesioni nervose periferiche. Come dimostrato in questo documento, ci sono diverse strategie per fornire un ambiente postoperatorio simile alla fisioterapia ai ratti sottoposti a lesioni MN4,5. Quindi, questo modello è particolarmente adatto a replicare lo scenario clinico, facilitando l'estrapolazione dei risultati alla specie umana12,27,48,56,58,83.
Come mostrato in questo documento, sono disponibili più strategie standardizzate per valutare il recupero motorio e sensoriale nel modello MN del ratto. La maggior parte di queste sono procedure non invasive, consentendo una valutazione frequente. Inoltre, poiché la maggior parte delle lesioni nervose periferiche nella specie umana si verificano nell'arto superiore, le impostazioni di fisioterapia sperimentale menzionate possono imitare in modo più appropriato il recupero nel contesto clinico. Probabilmente, questo può facilitare l'estrapolazione dei risultati alla specie umana, convalidando ulteriormente l'uso di questo nervo nel ratto.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Diogo Casal ha ricevuto una sovvenzione dal Programma per l'Educazione Medica Avanzata, che è sponsorizzato da Pitào Calouste Gulbenkian, Fundao Champalimaud, Ministério da Saàde e Fundao para a Cioncia e Tecnologia, Portogallo. Gli autori sono molto grati al sig. Figure 1 Gli autori desiderano ringraziare l'aiuto tecnico del signor Alberto Severino nelle riprese e nel montaggio del video. Infine, gli autori desiderano ringraziare la signora Sara Marques per il suo aiuto in tutti gli aspetti logistici relativi all'acquisizione e alla manutenzione degli animali.
Materiali
| Name | Company | Catalog Number | Comments |
| Acetaminophen | Amazon | https://www.amazon.com/Childrens-Tylenol-grape-flavor-ages/dp/B0051VVVZG | |
| Acland clamps | Fine Science Tools | 00398 V | http://www.merciansurgical.com/aclandclamps.pdf |
| Acland Single Clamps B-1V (Pair) | Fine Science Tools | 396 | http://www.merciansurgical.com |
| Biogel Surgical Gloves | Medex Supply | 30465 | https://www.medexsupply.com |
| BSL Analysis | BIOPAC Systems | https://www.biopac.com/ | |
| Castroviejo needle holders | Fine Science Tools | 12565-14 | http://s-and-t.ne |
| Clamp applicator | Fine Science Tools | CAF-4 | http://www.merciansurgical.com/acland-clamps.pdf |
| Constante voltage stimulator | BIOPAC Systems | STM200 | https://www.biopac.com/product/constant-voltage-stimulator-unipolar-pulse/ |
| Cutasept skin disinfectant | Bode Chemie | http://www.productcatalogue.bode-chemie.com/products/skin/cutasept_f.php | |
| Dafilon 10-0 | G1118099 | http://www.bbraun.com/cps/rde/xchg/bbraun-com/hs.xsl/products.html?prid=PRID00000816 | |
| Derf Needle Holders 12 cm TC | Fine Science Tools | 703DE12 | http://www.merciansurgical.com |
| Dry heat sterilizer | Quirumed | 2432 | http://www.quirumed.com/pt/material-de-esterilizac-o/esterilizadores |
| Dynamometer | SAUTER | FH5 | https://www.sauter.eu/shop/en/measuring-instruments/force-measurement/FH-S/ |
| Electroneuromiography setup | BIOPAC Systems | MP36 | https://www.biopac.com/product/biopac-student-lab-basic-systems/ |
| Ethilon 5-0 | W1618 | http://www.farlamedical.co.uk/ | |
| FLIR Software | FLIR | ||
| Graeffe forceps 0.8 mm tips curved | Fine Science Tools | 11052-10 | http://www.finescience.de |
| Graph paper | Ambar | ||
| Heat Lamp HL-1 | Harvard Apparatus | 727562 | https://www.harvardapparatus.com/webapp/wcs/stores/servlet/haisku3_10001_11051_39108_-1_HAI_ProductDetail_N_37610_37611_37613 |
| Heparin Sodium Solution (Heparin LEO 10000IU/ml) | Universal Drugstore | http://www.universaldrugstore.com/medications/Heparin+LEO/10000IU%2Fml | |
| High-Temperature Cautery | Fine Science Tools | AA03 | http://www.boviemedical.com/products_aaroncauteries_high.asp |
| Homeothermic Blanket System with Flexible Probe | Harvard Apparatus | 507220F | https://www.harvardapparatus.com/webapp/wcs/stores/servlet/haisku3_10001_11051_39108_-1_HAI_ProductDetail_N_37610_37611_37613 |
| Infrared camera | FLIR | E6 | http://www.flir.eu/instruments/e6-wifi/ |
| Instrapac - Adson Toothed Forceps (Extra Fine) | Fine Science Tools | 7973 | http://www.millermedicalsupplies.com |
| Iris Scissors 11.5 cm Curves EASY-CUT | Fine Science Tools | EA7613-11 | http://www.merciansurgical.com |
| Ketamine hydrochloride/xylazine hydrochloride solution | Sigma- Aldrich | K113 | https://www.sigmaaldrich.com/catalog/product/sigma/k113?lang=pt®ion=PT |
| Lacri-lube Eye Ointment 5g | Express Chemist | LAC101F | http://www.expresschemist.co.uk/lacri-lube-eye-ointment-5g.html |
| Mayo Scissors 14 cm Straight Chamfered Blades EASY-CUT | Fine Science Tools | EA7652-14 | http://www.merciansurgical.com |
| Meloxicam | Recropharma | Mobic | https://www.recropharma.com/product-pipeline/meloxicam |
| Methylene Blue solution | Sigma- Aldrich | https://www.sigmaaldrich.com/catalog/product | |
| Micro Jewellers Forceps 11 cm straight 00108 | Fine Science Tools | JF-5 | http://www.merciansurgical.com |
| Micro Jewellers Forceps 11cm angulated 00109 | Fine Science Tools | JFA-5b | http://www.merciansurgical.com |
| Micro retractor | Fine Science Tools | RS-6540 | http://www.finescience.de |
| Micro Scissors Round Handles 15 cm Straight | Fine Science Tools | 67 | http://www.merciansurgical.com |
| Micro-vessel dilators 11 cm 0.3 mm tips 00124 | Fine Science Tools | D-5a.2 | http://www.merciansurgical.com |
| Monosyn 5-0 | 15423BR | http://www.mcfarlanemedical.com.au/15423BR/SUTURE-MONOSYN-5_or_0-16MM-70CM-(C0023423)-BOX_or_36/pd.php | |
| Normal saline for irrigation | Hospira, Inc. | 0409-6138-22 | http://www.hospira.com/en/search?q=sodium+chloride+irrigation%2C+usp&fq=contentType%3AProducts |
| Operating microscope | Leica Surgical Microsystems | http://www.leica-microsystems.com/products/surgical-microscopes/ | |
| Skin Skribe Surgical Skin Marker | Moore Medical | 31456 | https://www.mooremedical.com/index.cfm?/Skin-Skribe-Surgical-Skin-Marker/&PG=CTL&CS=HOM&FN=ProductDetail&PID=1740&spx=1 |
| Snacks | Versele-Laga | Complete Crock-Berry | http://www.versele-laga.com/en/complete/products/complete-crock-berry |
| Straight mosquito forcep | Fine Science Tools | 91308-12 | http://www.finescience.de |
| Surgical drapes | Barrier | 800430 | http://www.molnlycke.com/surgical-drapes/ |
| Veet Sensitive Skin Hair Removal Cream Aloe Vera and Vitamin E 100 ml | Veet | http://www.veet.co.uk/products/creams/creams/veet-hair-removal-cream-sensitive-skin/ |
Riferimenti
- Lad, S. P., Nathan, J. K., Schubert, R. D., Boakye, M. Trends in median, ulnar, radial, and brachioplexus nerve injuries in the United States. Neurosurgery. 66 (5), 953-960 (2010).
- Murovic, J. A. Upper-extremity peripheral nerve injuries: a Louisiana State University Health Sciences Center literature review with comparison of the operative outcomes of 1837 Louisiana State University Health Sciences Center median, radial, and ulnar nerve lesions. Neurosurgery. 65 (4), 11-17 (2009).
- Dy, C. J., Isaacs, J., Dy, C. J., Isaacs, J. . American Society for Surgery of the Hand surgical anatomy: nerve reconstruction Vol. 1. , (2017).
- Trehan, S. K., Model, Z., Lee, S. K. Nerve Repair and Nerve Grafting. Hand Clinics. 32 (2), 119-125 (2016).
- Boyd, K. U., Fox, I. K., Mackinnon, S. E. . Nerve surgery Vol. 1. , 75-100 (2015).
- Geuna, S., et al. Update on nerve repair by biological tubulization. Journal of Brachial Plexius Peripheral Nerve Injury. 9 (1), 3 (2014).
- Sulaiman, W., Gordon, T. Neurobiology of peripheral nerve injury, regeneration, and functional recovery: from bench top research to bedside application. Ochsner Journal. 13 (1), 100-108 (2013).
- Angelica-Almeida, M., et al. Brachial plexus morphology and vascular supply in the wistar rat. Acta Medica Portuguesa. 26 (3), 243-250 (2013).
- Bertelli, J. A., Taleb, M., Saadi, A., Mira, J. C., Pecot-Dechavassine, M. The rat brachial plexus and its terminal branches: an experimental model for the study of peripheral nerve regeneration. Microsurgery. 16 (2), 77-85 (1995).
- Casal, D., et al. Reconstruction of a 10-mm-long median nerve gap in an ischemic environment using autologous conduits with different patterns of blood supply: A comparative study in the rat. PLoS One. 13 (4), 0195692 (2018).
- Stößel, M., Rehra, L., Haastert-Talini, K. Reflex-based grasping, skilled forelimb reaching, and electrodiagnostic evaluation for comprehensive analysis of functional recovery-The 7-mm rat median nerve gap repair model revisited. Brain and Behavior. 7 (10), 00813 (2017).
- Manoli, T., et al. Correlation analysis of histomorphometry and motor neurography in the median nerve rat model. Eplasty. 14, 17 (2014).
- Ronchi, G., et al. The Median Nerve Injury Model in Pre-clinical Research - A Critical Review on Benefits and Limitations. Frontiers in Cellular Neuroscience. 13, 288 (2019).
- Weber, R. A., Proctor, W. H., Warner, M. R., Verheyden, C. N. Autotomy and the sciatic functional index. Microsurgery. 14 (5), 323-327 (1993).
- Charan, J., Kantharia, N. D. How to calculate sample size in animal studies. Journal of Pharmacology & Pharmacotherapeutics. 4 (4), 303-306 (2013).
- Bertelli, J. A., Mira, J. C. The grasping test: a simple behavioral method for objective quantitative assessment of peripheral nerve regeneration in the rat. Journal of Neuroscience Methods. 58 (1-2), 151-155 (1995).
- Casal, D., et al. A Model of Free Tissue Transfer: The Rat Epigastric Free Flap. Journal of Visualized Experiments. (119), e55281 (2017).
- Bertens, A. P. M. G., Van Zuthphen, L. F., Baumas, V., Beymen, A. C. Anaesthesia, analgesia and euthanasia. Principles of Laboratory Animal Science. , 277-311 (2001).
- Pritchett-Corning, K. R., Luo, Y., Mulder, G. B., White, W. J. Principles of rodent surgery for the new surgeon. Journal of Visualized Experiments. (47), e2586 (2011).
- Lee-Parritz, D. Analgesia for rodent experimental surgery. Israel Journal of Veterinary Medicine. 62 (3), 74 (2007).
- Roughan, J. V., Flecknell, P. A. Evaluation of a short duration behaviour-based post-operative pain scoring system in rats. European Journal of Pain. 7 (5), 397-406 (2003).
- Bauder, A. R., Ferguson, T. A. Reproducible mouse sciatic nerve crush and subsequent assessment of regeneration by whole mount muscle analysis. Journal of Visualized Experiments. (60), e3606 (2012).
- Ronchi, G., et al. Functional and morphological assessment of a standardized crush injury of the rat median nerve. Journal of Neuroscience Methods. 179 (1), 51-57 (2009).
- Matsumine, H., et al. Vascularized versus nonvascularized island median nerve grafts in the facial nerve regeneration and functional recovery of rats for facial nerve reconstruction study. Journal of Reconstructive Microsurgery. 30 (2), 127-136 (2014).
- Mickley, A. G., Hoxha, Z., Biada, J. M., Kenmuir, C. L., Bacik, S. E. Acetaminophen Self-administered in the Drinking Water Increases the Pain Threshold of Rats (Rattus norvegicus). Journal of the American Association for Laboratory Animal Science. 45 (5), 48-54 (2006).
- Mandillo, S., et al. Reliability, robustness, and reproducibility in mouse behavioral phenotyping: a cross-laboratory study. Physiological Genomics. 34 (3), 243-255 (2008).
- Papalia, I., Tos, P., Stagno d'Alcontres, F., Battiston, B., Geuna, S. On the use of the grasping test in the rat median nerve model: a re-appraisal of its efficacy for quantitative assessment of motor function recovery. Journal of Neuroscience Methods. 127 (1), 43-47 (2003).
- Costa, L. M., Simoes, M. J., Mauricio, A. C., Varejao, A. S. Chapter 7: Methods and protocols in peripheral nerve regeneration experimental research: part IV-kinematic gait analysis to quantify peripheral nerve regeneration in the rat. International Reviews in Neurobiology. 87, 127-139 (2009).
- Geuna, S., Varejao, A. S. Evaluation methods in the assessment of peripheral nerve regeneration. Journal of Neurosurgery. 109 (2), 360-362 (2008).
- Howard, R. F., Hatch, D. J., Cole, T. J., Fitzgerald, M. Inflammatory pain and hypersensitivity are selectively reversed by epidural bupivacaine and are developmentally regulated. Anesthesiology. 95 (2), 421-427 (2001).
- Metz, G. A., Whishaw, I. Q. Cortical and subcortical lesions impair skilled walking in the ladder rung walking test: a new task to evaluate fore- and hindlimb stepping, placing, and co-ordination. Journal of Neuroscience Methods. 115 (2), 169-179 (2002).
- Thallmair, M., et al. Neurite growth inhibitors restrict plasticity and functional recovery following corticospinal tract lesions. Nature Neuroscience. 1 (2), 124-131 (1998).
- Brown, C. J., et al. Self-evaluation of walking-track measurement using a Sciatic Function Index. Microsurgery. 10 (3), 226-235 (1989).
- Hruska, R. E., Kennedy, S., Silbergeld, E. K. Quantitative aspects of normal locomotion in rats. Life Science. 25 (2), 171-179 (1979).
- Ferreira, T., Rasband, W. ImageJ user guide. ImageJ/Fiji. 1, 155-161 (2012).
- Dijkstra, J. R., Meek, M. F., Robinson, P. H., Gramsbergen, A. Methods to evaluate functional nerve recovery in adult rats: walking track analysis, video analysis and the withdrawal reflex. Journal of Neuroscience Methods. 96 (2), 89-96 (2000).
- Ludwig, N., Formenti, D., Gargano, M., Alberti, G. Skin temperature evaluation by infrared thermography: Comparison of image analysis methods. Infrared Physics & Technology. 62, 1-6 (2014).
- Bennett, G. J., Ochoa, J. L. Thermographic observations on rats with experimental neuropathic pain. Pain. 45 (1), 61-67 (1991).
- Wakisaka, S., Kajander, K. C., Bennett, G. J. Abnormal skin temperature and abnormal sympathetic vasomotor innervation in an experimental painful peripheral neuropathy. Pain. 46 (3), 299-313 (1991).
- Muntean, M. V., et al. Using dynamic infrared thermography to optimize color Doppler ultrasound mapping of cutaneous perforators. Medical Ultrasonography. 17 (4), 503-508 (2015).
- Shterenshis, M. Challenges to Global Implementation of Infrared Thermography Technology: Current Perspective. Central Asian Journal of Global Health. 6 (1), 289 (2017).
- Wilbourn, A. J., Mackinnon, S. E. . Nerve surgery Vol. 1. , 59-74 (2015).
- Wu, Y., Martínez, M. &. #. 1. 9. 3. ;. M., Balaguer, P. O., Turker, H. . Electrodiagnosis in New Frontiers of Clinical Research. , (2013).
- Werdin, F., et al. An improved electrophysiological method to study peripheral nerve regeneration in rats. Journal of Neuroscience Methods. 182 (1), 71-77 (2009).
- Sedghamiz, H., Santonocito, D. Unsupervised Detection and Classification of Motor Unit Action Potentials in Intramuscular Electromyography Signals. 2015 E-health and Bioengineering Conference IEEE. , 1-6 (2015).
- Hadlock, T. A., Koka, R., Vacanti, J. P., Cheney, M. L. A comparison of assessments of functional recovery in the rat. Journal of the Peripheral Nervous System. 4 (3-4), 258-264 (1999).
- Carstens, E., Moberg, G. P. Recognizing pain and distress in laboratory animals. Ilar Journal. 41 (2), 62-71 (2000).
- Tos, P., et al. Chapter 4: Methods and protocols in peripheral nerve regeneration experimental research: part I-experimental models. International Reviews in Neurobiology. 87, 47-79 (2009).
- Galtrey, C. M., Fawcett, J. W. Characterization of tests of functional recovery after median and ulnar nerve injury and repair in the rat forelimb. Journal of the Peripheral Nervous System. 12 (1), 11-27 (2007).
- Giusti, G., et al. Return of motor function after segmental nerve loss in a rat model: comparison of autogenous nerve graft, collagen conduit, and processed allograft (AxoGen). Journal of Bone and Joint Surgery American. 94 (5), 410-417 (2012).
- Stossel, M., Rehra, L., Haastert-Talini, K. Reflex-based grasping, skilled forelimb reaching, and electrodiagnostic evaluation for comprehensive analysis of functional recovery-The 7-mm rat median nerve gap repair model revisited. Brain and Behavior. 7 (10), 00813 (2017).
- Nikkhah, G., Rosenthal, C., Hedrich, H. J., Samii, M. Differences in acquisition and full performance in skilled forelimb use as measured by the 'staircase test' in five rat strains. Behavioral Brain Research. 92 (1), 85-95 (1998).
- Whishaw, I. Q., Gorny, B., Foroud, A., Kleim, J. A. Long-Evans and Sprague-Dawley rats have similar skilled reaching success and limb representations in motor cortex but different movements: some cautionary insights into the selection of rat strains for neurobiological motor research. Behavioral Brain Research. 145 (1-2), 221-232 (2003).
- Navarro, X. Functional evaluation of peripheral nerve regeneration and target reinnervation in animal models: a critical overview. European Journal of Neuroscience. 43 (3), 271-286 (2016).
- Costa, L. M., Simões, M. J., Maurício, A. C., Varejão, A. S. P. . International Review of Neurobiology. 87, 127-139 (2009).
- Ronchi, G., et al. Functional and morphological assessment of a standardized crush injury of the rat median nerve. Journal of Neuroscience Methods. 179 (1), 51-57 (2009).
- Raimondo, S., et al. Chapter 5: Methods and protocols in peripheral nerve regeneration experimental research: part II-morphological techniques. International Reviews in Neurobiology. 87, 81-103 (2009).
- Bontioti, E. K. M., Dahlin, L. B. Regeneration and functional recovery in the upper extermity of rats after various types of nerve injuries. Journal of the Peripheral Nervous System. 8, 159-168 (2003).
- Schönfeld, L. M., Dooley, D., Jahanshahi, A., Temel, Y., Hendrix, S. Evaluating rodent motor functions: Which tests to choose. Neuroscience & Biobehavioral Reviews. 83, 298-312 (2017).
- Urbancheck, M. S. Rat walking tracks do not reflect maximal muscle force capacity. Journal of Reconstructive Microsurgery. 15 (2), 143-149 (1999).
- Cudlip, S. A., Howe, F. A., Griffiths, J. R., Bell, B. A. Magnetic resonance neurography of peripheral nerve following experimental crush injury, and correlation with functional deficit. Journal of Neurosurgery. 96 (4), 755-759 (2002).
- Wang, Y., Sunitha, M., Chung, K. C. How to measure outcomes of peripheral nerve surgery. Hand Clinics. 29 (3), 349-361 (2013).
- Wang, H., Spinner, R. J., Sorenson, E. J., Windebank, A. J. Measurement of forelimb function by digital video motion analysis in rat nerve transection models. Journal of the Peripheral Nervous System. 13 (1), 92-102 (2008).
- Yanase, Y., Tamai, S., Usui, M., Yoshizu, T. . Experimental and Clinical Reconstructive Microsurgery. , 44-51 (2004).
- Barton, M. J., et al. Morphological and morphometric analysis of the distal branches of the rat brachial plexus. Italian Journal of Anatomy and Embryology. 121 (3), 240-252 (2016).
- Vincent, R., Slutsky, D. J., Hentz, V. R. Adult and obstetrical brachial plexus injuries. Peripheral Nerve Surgery: Practical applications in the upper extremity. , 299-317 (2006).
- Dahlin, L. B., Slutsky, D. J., Hentz, V. R. . Peripheral Nerve Surgery: Practical Applications in the Upper Extremity. , 1-22 (2006).
- Vargel, I., et al. A comparison of various vascularization-perfusion venous nerve grafts with conventional nerve grafts in rats. Journal of Reconstructive Microsurgery. 25 (7), 425-437 (2009).
- Grinsell, D., Keating, C. Peripheral nerve reconstruction after injury: a review of clinical and experimental therapies. BioMed Research International. 2014, 698256 (2014).
- Wang, D., et al. A simple model of radial nerve injury in the rhesus monkey to evaluate peripheral nerve repair. Neural Regeneration Research. 9 (10), 1041-1046 (2014).
- Casal, D., et al. Unconventional Perfusion Flaps in the Experimental Setting: A Systematic Review and Meta-Analysis. Plastic Reconstructive Surgery. 143 (5), 1003-1016 (2019).
- Bontioti, E. . End-to-side nerve repair. A study in the forelimb of the rat. , (2005).
- Bodine-Fowler, S. C., Meyer, R. S., Moskovitz, A., Abrams, R., Botte, M. J. Inaccurate projection of rat soleus motoneurons: a comparison of nerve repair techniques. Muscle Nerve. 20 (1), 29-37 (1997).
- Valero-Cabre, A., Navarro, X. H reflex restitution and facilitation after different types of peripheral nerve injury and repair. Brain Research. 919 (2), 302-312 (2001).
- Wall, P. D., et al. Autotomy following peripheral nerve lesions: experimental anaesthesia dolorosa. Pain. 7 (2), 103-111 (1979).
- Bertelli, J. A., Taleb, M., Saadi, A., Mira, J. C., Pecot-Dechavassine, M. The rat brachial plexus and its terminal branches: an experimental model for the study of peripheral nerve regeneration. Microsurgery. 16, 77-85 (1995).
- Wood, M. J., Johnson, P. J., Myckatyn, T. M., Mackinnon, S. E., Yee, A. . Nerve Surgery Vol. 1. , 1-40 (2015).
- Rosberg, H. E. Epidemiology of hand injuries in a middle-sized city in southern Sweden - a retrospective study with an 8-year interval. Scandinavian Journal of Plastic and Reconstructive Surgery and Hand Surgery. 38, 347-355 (2004).
- Gordon, T., Borschel, G. H. The use of the rat as a model for studying peripheral nerve regeneration and sprouting after complete and partial nerve injuries. Experimental Neurology. 287, 331-347 (2017).
- Bertelli, J. A., Ghizoni, M. F. Concepts of nerve regeneration and repair applied to brachial plexus reconstruction. Microsurgery. 26 (4), 230-244 (2006).
- Bertelli, J. A., Mira, J. C. Behavioural evaluating methods in the objective clinical assessment of motor function after experimental brachial plexus reconstruction in the rat. Journal of Neuroscience Methods. 46, 203-208 (1993).
- Bertelli, J. A., Mira, J. C. The grasping test: a simple behavioral method for objective quantitative assessment of peripherla nerve regeneration in the rat. Journal of Neuroscience Methods. 58 (1-2), 151-155 (1995).
- Ronchi, G., et al. Standardized crush injury of the mouse median nerve. Journal of Neuroscience Methods. 188 (1), 71-75 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon