È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Analisi dei difetti cardiaci congeniti negli embrioni dei topi utilizzando metodi istologici qualitativi e quantitativi
In questo articolo
Riepilogo
In questo protocollo, descriviamo le procedure per analizzare qualitativamente e quantitativamente i fenotipi dello sviluppo nei topi associati a difetti cardiaci congeniti.
Abstract
I difetti cardiaci congeniti (CHD) sono il tipo più comune di difetto alla nascita nell'uomo, che colpisce fino all'1% di tutte le nascite vive. Tuttavia, le cause alla base della CHD sono ancora poco conosciute. Il topo in via di sviluppo costituisce un modello prezioso per lo studio della CHD, perché i programmi di sviluppo cardiaco tra topi e esseri umani sono altamente conservati. Il protocollo descrive in dettaglio come produrre embrioni di topo dello stadio gestazionale desiderato, metodi per isolare e preservare il cuore per l'elaborazione a valle, metodi quantitativi per identificare i tipi comuni di CHD mediante istologia (ad esempio, setto ventricolare difetti, difetti del setto atriale, dotto brevettato arteriosus) e metodi di storitomorfometria quantitativa per misurare i fenotipi comuni della compattazione muscolare. Questi metodi articolano tutti i passaggi coinvolti nella preparazione, raccolta e analisi dei campioni, consentendo agli scienziati di misurare correttamente e riproducibilmente la CHD.
Introduzione
Le CHD sono il tipo più comune di difetto alla nascita nell'uomo e sono la principale causa di decessi correlati ai difetti alla nascita1,2,3,4,5,6. Anche se circa il 90% dei neonati sopravvive alla CHD, è spesso associata a una significativa morbilità e interventi medici nel corso degli anni, imponendo un pesante onere alla vita dei pazienti e al sistema sanitario7,8,9,10. Al di fuori di fattori puramente genetici, le cause della CHD sono poco comprese4. Le cause non identificate rappresentano il 56-66% di tutti i casi di CHD secondo l'American Heart Association e altre fonti2,3,4,11. I fattori ben noti includono mutazioni genetiche, CNV, varianti a singolo nucleotide de novo e aneuploidia. Si sospetta che anche i fattori ambientali e dietetici siano fonti importanti che contribuiscono alla CHD, come suggerito da studi epidemiologici che collegano lo stile di vita materno2,12, privazione economica e razza13,e dalla ricerca su fattori come l'acido folico11,14 e l'acido retinoico lipidico bioattivo15,16. Lo studio dei meccanismi e delle cause della CHD e di altri difetti cardiovascolari è importante sviluppare strategie preventive e nuove opzioni terapeutiche1,4,17,18,19.
Il topo in via di sviluppo è un modello fondamentale per studiare la CHD nei mammiferi. Tuttavia, alcuni dei metodi e delle analisi impiegati, come le dissezioni che preservano la morfologia del cuore, l'analisi delle fasi di sviluppo e l'identificazione dei difetti associati alla CHD, possono essere scoraggianti per gli scienziati che sono nuovi all'analisi dei cuori murini. L'obiettivo dei metodi descritti in questo protocollo è quello di offrire linee guida qualitative e quantitative per questi processi. Così, in questo protocollo spieghiamo come eseguire accoppiamenti a tempo per produrre embrioni dello stadio gestazionale desiderato, sezionare le femmine incinte per il recupero del cuore intatto (compresi i tessuti associati come il tratto di deflusso), la fissazione del cuore e la preparazione per criostatista, metodi di istologia di base, analisi quantitative dei difetti cardiaci comuni e analisi qualitativa della compattazione del muscolo cardiaco, un fenomeno precursore comune ad alcuni tipi di CHD.
Protocollo
Tutti gli animali utilizzati negli esperimenti citati in questo documento sono stati trattati utilizzando le linee guida per la cura degli animali del Michigan State University Institutional Animal Care and Use Committee (IACUC).
1. Accoppiamento a tempo di topi C57BL6/J per la produzione di embrioni
- Una volta che i topi hanno raggiunto l'età riproduttiva (6-8 settimane), li mettono insieme in formato di allevamento degli harem (cioè due femmine per un maschio). Prepararli per l'allevamento a volte nel pomeriggio o la sera.
NOTA: I topi spesso si riproducono entro 1 h dopo che le luci sono state spente all'interno della loro struttura abitativa. Le femmine dovrebbero essere ritirate dall'allevamento a circa 6-8 mesi e i maschi devono essere utilizzati entro e non oltre 12 mesi di età. - Se si utilizza il metodo della pesata per determinare la fecondazione, allevare topi in grandi gruppi, perché il metodo di pesata fa sì che l'accoppiamento a tempo proceda a un ritmo più lento rispetto ai metodi in cui vengono monitorati solo i tappi di copula.
- La mattina successiva, verificare la presenza di tappi di copulazione tra le 8:00-12 PM. Assicurarsi che questo sia fatto nei momenti corretti. Se il test della spina viene eseguito prima delle 8 del mattino, c'è il rischio che la spina sia troppo profonda nel canale vaginale per essere osservata. Se il test della spina viene eseguito più tardi delle 12:00, c'è il rischio che la spina si sia staccata.
- Afferrare la femmina dalla base della coda e studiare l'apertura al canale vaginale con l'uso di una punta micropipetta. Una spina di copulazione sarà simile a una barriera mucosale (Figura 1A), che potrebbe essere un po 'difficile da vedere in alcuni casi. La crosta è anche un'indicazione che un tappo di copulazione è o era presente. Se non c'è barriera mucosale (Figura 1B) allora la femmina probabilmente non si è accoppiata o la spina di copulazione potrebbe essere già caduto.
- Fare riferimento alla mattina della copulazione come e0.5.
NOTA: Con i topi C57BL6/J, i tappi di copula possono essere difficili da identificare. Pertanto, a volte i topi accoppiati anche se non è stato osservato alcun tappo. La copulazione non sempre porta al concepimento. Questo è spesso più probabile nei topi C57BL6/J. Pertanto, monitorare la progressione del peso per confermare la gravidanza (vedere il punto 1.4). Il pesare può aiutare a identificare le femmine che sono incinte e confermare che i tappi hanno portato al concepimento. Prestare attenzione quando si accoppiano le femmine per notti consecutive. Se si osserva che un particolare maschio è bravo a produrre una spina di copulazione, quel maschio può essere attendibile per accoppiarsi per notti consecutive con la stessa femmina. - Tenete a mente che le probabilità di gravidanza sono più alte con topi che sono allevatori comprovati, come sono stati allevati con successo prima. Per aumentare le possibilità di avere allevatori comprovati, i maschi utilizzati non dovrebbero essere troppo vecchi.
- Seguendo il test della spina, pesare le femmine. Questa pesatura deve essere seguita 7-10 giorni dopo. Se l'aumento di peso supera 1,73 g, allora il topo è probabilmente incinta20. Se l'aumento di peso è inferiore a 1,73 g, è probabilmente estraneo alla gravidanza e il topo dovrebbe essere reintrodotto nella popolazione riproduttiva.
NOTA: i topi C57BL6/J producono piccole cucciolate (da cinque a sei embrioni in media). Pesare nei metodi per determinare la gravidanza sono accurati per la maggior parte. L'utilizzo di questo metodo fornisce un tasso di falsi positivi del 12,8% ed escluderà il 3% delle femmine che sono effettivamente incinte20. Se il ricercatore è preoccupato che il tempo gestazionale desiderato sia successivo, procedere al passaggio 1.5 - Facoltativo: il giorno in cui la dissezione sta per avvenire, assicurarsi che la gravidanza è progredita con l'ispezione fisica. Afferra la femmina dalla base della coda e allunga il corpo. Questo è più facile da fare posizionando il mouse sul polso e tirando delicatamente la base della coda. Se la femmina è incinta, allora probabilmente ci sarà aumento di peso specificamente nel torso inferiore, e apparirà come piccoli grumi.
NOTA: La gravidanza può essere palpabile già e12.5 e sarà palpabile da e14.5 nella maggior parte dei casi. I topi C57BL6/J hanno piccole dimensioni di lettiera, quindi la femmina potrebbe essere incinta anche se non ci sono segni fisici.
2. Dissezione di femmine ed embrioni per il recupero del cuore
- Prima dell'inizio della dissezione, preparare le seguenti soluzioni a temperatura ambiente.
- Sciogliere l'acido etilenediaminetracetraacetico (EDTA) in salina tampina tamponata di fosfato (PBS) a una concentrazione di 0,5 mM.
NOTA: Una volta preparato, è preferibile mantenere la soluzione sul ghiaccio e utilizzarla solo a 4 gradi centigradi. Se la contaminazione è un problema, dovrebbe essere autoclaved prima dell'uso. - Sciogliere la paraformaldeide (PFA) in PBS ad una concentrazione del 4%.
NOTA: Una volta preparato, è preferibile mantenere la soluzione sul ghiaccio e utilizzarla solo a 4 gradi centigradi. Conservare a 4 gradi centigradi o più freddo per lo stoccaggio a lungo termine. La concentrazione della soluzione PFA può variare a seconda delle applicazioni a valle dei campioni di tessuto. Questa percentuale viene utilizzata per la colorazione ematossina ed eosina, l'immunostochimica e la colorazione immunofluorescente.
- Sciogliere l'acido etilenediaminetracetraacetico (EDTA) in salina tampina tamponata di fosfato (PBS) a una concentrazione di 0,5 mM.
- Una volta che la femmina ha raggiunto la fase gestazionale desiderata, il topo deve essere eutanasia all'ora corretta della giornata secondo le linee guida approvate per l'uso degli animali. Se i tempi sono nella mezza giornata (ad esempio, e15.5) dovrebbero essere sacrificati vicino alle 12:00. Se i tempi sono in giorni interi (ad esempio, e15.0) dovrebbero essere sacrificati vicino alle 12:0.
NOTA: Si presume che il concepimento avvenga vicino a mezzanotte durante la notte in cui i topi sono accoppiati. Tuttavia, è difficile determinare l'ora esatta del concepimento. A causa di questo, la tempistica è stimata, non esatto. - Dopo aver appuntato i quattro arti verso il basso, fare con attenzione un'incisione a forma di I lungo il busto, a partire da circa l'uretra verso l'alto verso lo sterno.
- L'utero sarà probabilmente situato appena sopra la regione pelvica. L'utero del topo è a forma di Y; quindi, sarà probabilmente molto lungo e avvolto intorno al busto. Rimuoverlo sollevandolo delicatamente. Eseguire questa operazione usando i lati delle pinze fini in un movimento di scooping. I tessuti superficiali dell'utero possono essere afferrato con molta attenzione dalle punte delle pinze sottili quando inizialmente tira fuori l'utero. Utilizzare le forbici per tagliare l'utero dal corpo.
NOTA: Tenendo presente l'insolito a forma di Y dell'utero, assicurarsi che l'intero utero venga rimosso. - Immergere l'utero in PBS ghiacciato. Fissare un'estremità dell'utero verso il basso e allungarlo in un'unica riga.
- Tagliare l'utero in sezioni, ogni sezione contenente un embrione separato. Sbucciare delicatamente l'embrione con pinze sottili. Questo è più facile da fare con un paio di pinze in ogni mano. Una volta rimosso, collocare immediatamente l'embrione in una nuova parabola Petri piena di soluzione PBS-EDTA a 4 gradi centigradi.
NOTA: È possibile utilizzare anche la soluzione PBS normale, ma l'EDTA impedisce la coagulazione nei campioni. - Mettere in scena gli embrioni utilizzando Theiler Staging21. Poiché la messa in scena può variare tra gli embrioni all'interno di una singola cucciolata, mettere in scena ogni singolo embrione.
NOTA: Questo può anche fornire lungimiranza nei possibili difetti cardiaci congeniti negli embrioni. Tipicamente, i sintomi di un difetto cardiaco congenito possono essere osservati nella morfologia embrionale. Possono essere presenti altri difetti importanti spesso associati a determinate condizioni cardiache. - Il cuore può essere rimosso in una varietà di modi a seconda dell'età dell'embrione.
NOTA: Se non è chiaro se il tratto di deflusso rimarrà intatto durante la rimozione, rimuovere più tessuti che solo il cuore (mantenendo intatto il tratto di deflusso e riducendo al minimo il contatto diretto tra il cuore e le pinze) o analizzare l'intero embrione.- Utilizzando un mirino di dissezione e due paia di pinze fini, posizionare l'embrione sulla schiena e stabilizzare l'accesso al torace. Questo può essere fatto sia fissando le braccia con le pinze o rimuovendo le braccia e tenendo il busto in posizione.
- Utilizzare il punto acuto di una seconda coppia di pinze sottili per fare un'incisione lungo lo sterno dell'embrione ed estendere tra le clavicoli all'ombelico. Iniziare facendo incisioni molto sottili e superficiali mentre si lavora gradualmente verso l'interno della cavità toracica. Il cuore dovrebbe diventare a malapena visibile. Non contattarlo con le pinze durante queste incisioni superficiali.
- Sbucciare la gabbia toracica utilizzando il primo paio di pinze per spremere delicatamente sul busto dell'embrione, leggermente caudale alla gabbia toracica. Il cuore dovrebbe saltarsi fuori o diventare evidente. Il cuore potrebbe richiedere un po 'di gentilmente convincere a venire fuori. Utilizzare il lato delle pinze, assicurandosi che il punto delle pinze non entri mai in contatto con il cuore. Per mantenere pulito l'area di lavoro e le pinze, mantenere una cancellazione senza laminznelle nelle vicinanze.
- Afferrare delicatamente i vasi sanguigni polmonari con i lati delle pinze, assicurandosi di non recidere il tessuto e tirare il cuore dalla cavità toracica. Quindi, pulisci il cuore.
NOTA: Per gli embrioni e13.5 e più giovani il cuore è coperto dal pericardio. Questo deve essere rimosso per raggiungere il cuore.
- Utilizzando uno stereoscopio, scattare una fotografia del cuore per riferimento futuro.
- Sciacquare i cuori in soluzione PBS-EDTA per 1-2 min, e poi metterli in 4% soluzione PFA per circa 45-60 min per risolverli. Se si desidera l'analisi dell'intero embrione, immergere durante la notte. Il volume della soluzione PFA deve essere 5-6 volte il volume del tessuto da fissare.
NOTA: Questo tempo di incubazione può variare a seconda degli studi successivi. Questo tempo di incubazione viene utilizzato per la colorazione ematossina ed eosina, l'immunostochimica e la colorazione immunofluorescente. - Lavare 5-10 min con PBS-glicine 3x e riporre in PBS. L'azide di sodio o la penicillina/streptomicina possono anche essere aggiunti per ridurre al minimo la crescita batterica e preservare i tessuti intatti. I cuori possono ora essere conservati a breve termine a 4 gradi centigradi.
3. Preparazione dei tessuti
NOTA: i tessuti possono essere preparati utilizzando l'incorporamento dello Strumento di personalizzazione di Office (temperatura di taglio ottimale) o l'incorporamento della paraffina. Ci sono vantaggi e svantaggi per entrambi i metodi e l'obiettivo dell'analisi deve essere considerato quando si decide quale metodo di incorporamento deve essere utilizzato.
- Incorporamento dello Strumento di personalizzazione di Office
NOTA: Questo metodo può essere preferibile all'incorporamento di formalina/paraffina perché le criosezioni conservano la reattività dell'antigene, possono ancora essere utilizzate per la colorazione ematossia e eosina e producono fette più velocemente.- Preparare una soluzione di saccarosio disciolto in PBS ad una concentrazione del 30% (w/v).
- Trasferire i tessuti su un nuovo tubo conico da 15 mL o in un tubo di microcentrismo da 1,5 ml contenente saccarosio PBS-30%. Inizialmente, il tessuto galleggia.
- Mettetelo a 4 gradi centigradi in frigorifero. Il tessuto sarà pronto per l'incorporamento dello OCT quando affonda sul fondo del tubo, di solito in 24-40 h.
NOTA: I tessuti muscolari soffrono in modo significativo durante i cicli di congelamento/scongelamento e perdono la loro morfologia nativa. Il saccarosio viene assorbito dal tessuto e funziona come agente crioconservante che consente una migliore conservazione della morfologia. Assicurarsi che ci sia abbastanza soluzione nel tubo per il galleggiamento dei tessuti da monitorare sufficientemente. Il pSIoperico è facilmente contaminato dai batteri, quindi controlla frequentemente la soluzione per verificarne la nuvolosità, che indica una crescita eccessiva fungina o batterica. Per ridurre al minimo il rischio di contaminazione è possibile aggiungere penicillina/streptomicina o azide di sodio alla soluzione PBS-sucrose. - Rimuovere i cuori con una pipetta Pasteur, assicurarsi che l'apertura della pipetta è abbastanza ampia da non strappare il tessuto. Se necessario, tagliare la pipetta con le forbici. Se si lavora con embrioni interi, utilizzare le pinze per recuperare il campione.
NOTA: Eseguire questa operazione delicatamente. Anche se l'apertura della pipetta è abbastanza ampia da recuperare i cuori, i bordi della pipetta possono ancora strappare i tessuti. Le pinze possono indentare campioni di tessuto se usati in modo troppo aggressivo. - Lasciare asciugare brevemente il tessuto su una salvietta senza laino. Posizionare il campione in uno stampo dell'OFFICE nella posizione desiderata per il taglio (ad esempio, sagittale, trasversale, coronale). Aggiungere il composto dello Strumento di personalizzazione di Office fino a quando il campione non è completamente sommerso, assicurandosi che non vi siano bolle a contatto con il tessuto.
- Posizionare lo stampo a -20 gradi durante la notte o per diversi giorni e quindi spostare lo stampo a -80 gradi centigradi. Dopo 24 h lo stampo è pronto per la criosezione. I tessuti in questo formato possono essere conservati a lungo termine.
- Incorporamento paraffino
- Utilizzando etanolo, disidratare i tessuti in questa successione: 50% etanolo per 10 min, 70% etanolo per 10 min, 80% etanolo per 10 min, 95% etanolo per 10 min, 100% etanolo per 10 min (fare questo 3x).
- Immergere i tessuti in una serie di soluzioni di etanolo/xilene in questa successione: soluzione 2:1 etanolo/xilene per 10-15 min, Soluzione di etanolo/xilene 1:1 per 10-15 min, soluzione 1:2 etanolo/xilene per 10-15 min, 100% xilene per 10-15 min (fate questo 3x).
- Per sostituire lo xilene con la paraffina, immergere i tessuti in un forno a vuoto (impostato tra 54-58 gradi centigradi) in questa successione: soluzione di xilene/paraffina 2:1 per 30 min, 1:1 soluzione di xilene/paraffina per 30 min, 1:2 xilene/paraffin a soluzione per 30 min, 100% paraffina per 1-2 h, 100% paraffina per 1-2 h o per una notte.
NOTA: Riscaldare i tessuti oltre i 60 gradi centigradi per lunghi periodi di tempo causerà la degradazione dei polimeri di paraffina e la fragilità del tessuto. - Utilizzando la paraffina fresca, incorporare i tessuti nella posizione desiderata.
4. Sezione Cryostat per tessuti incorporati dello Strumento di personalizzazione di Office
- Al criostato, posizionare tutti i campioni all'interno per un minimo di 1 h se i campioni sono stati precedentemente conservati nel congelatore -80 . Dovrebbero rimanere lì fino a quando tutte le sezioni sono state raccolte.
- Assicurarsi che il criostato sia impostato con le impostazioni di temperatura corrette. La temperatura ambientale all'interno della camera criostatta dovrebbe essere di circa -20 gradi centigradi e il braccio del criostato dovrebbe essere di circa -24 gradi centigradi.
NOTA: Questa temperatura può variare a seconda di come il blocco risponde al sezionamento. Se il taglio incoerente è un problema, la temperatura dell'ambiente potrebbe essere abbassata. - Rimuovere il blocco dello Strumento di personalizzazione di Sistema dal suo stampo tirando ai bordi del lato aperto dello stampo per allentarlo e quindi pizzicando il blocco all'estremità chiusa, dove lo stampo si restringe.
- Per montare il blocco dello strumento di personalizzazione di Office, posizionare lo OCT a temperatura ambiente sul mandrino, partendo dal centro e lavorando fino al bordo. L'intero mandrino non ha bisogno di essere coperto.
- Posizionare il blocco dello Strumento di personalizzazione di Office (vedere il passaggio 3.1) sullo stampo. Il bordo del blocco che era contro il lato chiuso dello stampo dovrebbe essere rivolto verso l'alto sul mandrino. Lasciare congelare lo strumento office per il mandrino fino a quando non è bianco opaco, circa 5-10 min.
- Posizionare il mandrino sul braccio per altri 5-10 min per il blocco di venire alla temperatura del braccio. Per ottenere una sezione parallela, regolare il braccio fino a quando il bordo del blocco è parallelo allo stage e c'è una distanza uniforme tra lo stage e il bordo inferiore del blocco è lo stesso dello stage e del bordo superiore del blocco.
- Inserire la lama e regolare la distanza del blocco dalla lama per prendere le sezioni.
- Prendere fette con uno spessore di 10 m. Mantenere affettare fino a quando il punto di interesse non viene raggiunto manualmente o utilizzando la funzione di taglio.
- Per raccogliere le sezioni, utilizzare un piccolo pennello piatto e un pennello di dettaglio. Quando lo stampo inizia a essere tagliato, utilizzare il pennello piatto per tirare delicatamente la fetta contro il supporto. Quando si taglia il campione, il movimento deve essere continuo e senza pausa, anche se la velocità può dipendere dalla fermezza del campione.
- Durante il taglio, utilizzare il pennello piatto per guidare delicatamente la fetta come è fatta. La fetta non ha bisogno di essere a filo con lo stadio a questo punto, in modo da lasciare fluttuante per non causare lacrime o tira e influenzare l'istologia.
NOTA: Quando si tagliano embrioni interi, questa parte può essere particolarmente difficile, soprattutto quando si cambiano i tipi di tessuto. Assicurarsi che le fette siano fatte senza pause e che il pennello non trascini troppo aggressivamente sulle fette. Quando i tipi di tessuto cambiano, la fetta può rompersi, quindi mantenere la temperatura fredda è fondamentale. Se la rottura è un problema, diminuire la temperatura o aumentare lo spessore del campione. - Sospendere il movimento del blocco una volta che il campione è completamente tagliato, ma la sezione non è ancora libera dal blocco. Senza spostare il pennello piatto dalla fetta, utilizzare il pennello di dettaglio per accarezzare la fetta verso il basso per renderla piatta e congelare contro lo stage.
- Tenere la sezione per 10 s prima di rimuovere il pennello di dettaglio e completare la sezione. Usate i due pennelli per appiattire delicatamente la fetta contro lo stage, evitare qualsiasi rotolamento e tenerla contro il palco per 20-30 dollari.
- Capovolgere la fetta e appiattirla di nuovo sul palco. Spostare una diapositiva caricata elettrostaticamente abbastanza vicino da attirare la fetta e aderire alla diapositiva senza dover toccare il vetrino sullo stage. Etichettare le diapositive con una matita.
- Conservare i vetrini in una scatola ermetica per proteggere i tessuti dall'accumulo di ghiaccio durante lo stoccaggio. Per la conservazione a breve termine, i vetrini devono essere conservati a -20 gradi centigradi prima di colorare. Per lo stoccaggio a lungo termine, mantenerli a -80 gradi centigradi.
5. Sezione microtoma per tessuti incorporati paraffina
- Posizionare i blocchi sul ghiaccio prima del sezionamento per raffreddare i campioni. Quando è fresco, le fette di paraffina più facilmente e possono produrre fette più sottili.
- Preparare un bagno d'acqua a 40-45 gradi con acqua ultrapura.
- Mettere la lama nel supporto all'interno del microtoma. Assicurarsi che sia sicuro e quindi impostare l'angolo di gioco. Assicurarsi che l'angolo di gioco sia corretto. Questo può essere controllato seguendo le istruzioni del produttore.
- Inserire il blocco di paraffina nel microtoma. Assicurarsi che sia orientato correttamente in modo che la lama tagli direttamente attraverso il blocco.
- Assicurarsi che la lama sia orientata correttamente con il blocco creando un paio di fette. Fatelo con attenzione in modo da poter apportare modifiche.
- Tagliare il blocco fino a raggiungere il punto di interesse.
- Fare le sezioni con lo spessore desiderato. Tenere conto del fatto che le prime fette saranno probabilmente scartate.
- Raccogliere le sezioni e spostarle nel bagno d'acqua con pinze. Questo dovrebbe rendere le sezioni appiattite. Utilizzare le pinze per regolarle in base alle esigenze.
- Spostare una diapositiva caricata elettrostaticamente abbastanza vicino per attirare la fetta e aderire al vetrino. Etichettare le diapositive con una matita.
- Inserire tutte le diapositive raccolte in un rack di diapositive. Lasciare asciugare i vetrini durante la notte a 37 gradi centigradi.
6. Deparaffinazione dei tessuti
- Lavare i vetrini nella seguente sequenza: 3 min in xilene (2x), 3 min in una soluzione di etanolo 1:1 xilene/100%, 3 min in 100% etanolo (2x), 3 min in 95% etanolo, 3 min in 70% etanolo, 3 min in 100% etanolo.
7. Colorazione ematossina ed eosina
- Preparare i vetrini per la colorazione.
- Se si utilizzano tessuti preparati da Office, immergere in acqua distillata per 4 min fino a quando lo OCT non si dissolva e lasciare asciugare.
- Se si utilizzano tessuti incorporati di paraffina, devono essere deparaffinizzati. Vedere il passaggio 6.1.
- Posizionare il vetrino filtrato 0.1% ematossilina per 10 min. Mettere il vetrino in acqua distillata, cambiando l'acqua 1x immediatamente e poi di nuovo dopo 3 min.
- Posizionare la diapositiva in 0,5% eosina per 10 s o tuffo 12x. Immergere il vetrino in acqua distillata fino a quando l'eosina non stria più, circa 2-3 tuffi.
- Disidratare lo scivolo immergendo lo scivolo immergendolo nel 50% di etanolo per 10 s, 75% etanolo per 10 s, 95% etanolo per 1 min. Immergersi in xilene fino a quando lo xilene esce liscio, s.5-7.
- Lasciare evaporare e montare lo xilene con un supporto di montaggio ad essiccazione rapida che ha un indice di rifrazione vicino al vetro.
8. Analisi qualitativa dei difetti cardiaci comuni
- Scatta immagini di tutti i campioni utilizzando un microscopio invertito o stereo e la rispettiva fotocamera. Prendere immagini macroscopiche e microscopiche, a seconda dei tipi di difetti analizzati. Le immagini macroscopiche possono essere scattate con qualsiasi ingrandimento inferiore a 10x. Le immagini microscopiche devono essere scattate con un ingrandimento di 40 volte superiore o superiore. Le foto scattate in questa carta sono state scattate con ingrandimento 5 volte utilizzando un microscopio stereo e un obiettivo aria 40x (lente N.A. di 0,55) utilizzando un microscopio invertito.
NOTA: Le immagini macroscopiche sono un buon punto di partenza perché forniscono una vista all'intero cuore (Figura 3). Man mano che i modelli vengono identificati, le aree specifiche possono essere incentrate e studiate ulteriormente. - Allineare tutte le immagini affiancate sullo schermo di un computer. Avere tutte le immagini dei campioni di controllo su un lato dello schermo e tutte le immagini di campioni sperimentali sull'altro lato dello schermo. È meglio analizzare un gruppo di trattamento alla volta.
- Cercare le differenze nei fenotipi tra i gruppi di trattamento, a partire dalle aree chiave in cui si comsvolgono difetti cardiaci comuni. Questo varia a seconda che le immagini siano macroscopiche, che ritraggono l'anatomia grossolana del cuore, o microscopica, che ritraggono l'anatomia microscopica del tessuto cardiaco.
- Iniziare la ricerca di difetti cardiaci macroscopici comuni, come i difetti del setto ventricolare (Figura 2A), i difetti del setto atriale (Figura 2B) e il dotto brevettato arteriosus (Figura 2C). Tutti questi difetti sono più facilmente visibili nella vista trasversale del cuore.
- Per identificare i difetti del setto, considerare l'osservazione di più fette, perché potrebbero essere osservate in un piano del tessuto e non in un altro.
NOTA: A volte un difetto non è la mancanza di un setto, ma un buco nel setto. Pertanto, prestare attenzione a non confondere una lacrima per un difetto setto. La ricerca di consistenze tra le sezioni vicine in una regione specifica può confermare se si tratta effettivamente di un difetto o di uno strappo da affettare. - Per identificare i difetti nel tratto di deflusso, come il dotto brevettato arteriosus, utilizzare più fette per seguire i principali vasi sanguigni mentre lasciano il cuore. Creare un'immagine dei principali vasi sanguigni l'uno rispetto all'altro. Un esempio è descritto in Figura 2C.
NOTA: Alcune irregolarità possono essere dovute allo stadio di sviluppo di un embrione (ad esempio, il dotto brevettato arteriosus si chiude postnatale, subito dopo la nascita; il setto ventricolare non si chiude completamente fino a quando non si chiude completamente fino a 14,5). Alcuni altri comuni difetti cardiaci macroscopici che non sono inclusi nelle figure includono truncus atereriosus persistente, che possono essere rilevati più facilmente a e16.5 e versioni successive; doppio ventricolo destro (DORV), che può essere rilevato in fette in cui il cuore entra nel tratto di deflusso; e un'aorta di override22. Un difetto cardiaco microscopico comune include una compattazione muscolare ridotta (Figura 4).
9. Analisi quantitativa della compattazione muscolare cardiaca utilizzando tessuti macchiati di ematossia e eosina
- Utilizzando la vista macroscopica dei campioni di tessuto colorato (Figura 4A), identificare una regione di interesse per l'immagine con un ingrandimento 40x (Figura 4B). Per questa carta, è stata utilizzata la parete del ventricolo sinistro. Salvare l'immagine nel formato desiderato. Per questo documento, le immagini sono state salvate come file .tif.
- Aprire l'immagine nel software ImageJ.
- Impostare l'immagine su 8 bit. Ciò consente all'immagine di utilizzare lo strumento di soglia nel passaggio successivo23,24. A tale scopo, selezionare "Immagine Proprietà Type (Tipo) 8 bit".
- Impostare la soglia della foto. Lo scopo di questo passaggio è selezionare solo i pixel che rappresentano lo sfondo, esclusi i pixel che rappresentano i tessuti23,24.
NOTA: Questa superficie verrà sottratta in un secondo momento. Una soglia corretta selezionerà i pixel che il ricercatore vuole escludere dalla superficie del tessuto muscolare. Pertanto, il risultato finale dovrebbe includere il tessuto in scala di grigi e lo sfondo verrà selezionato.- Fare clic su"ImageJ Proprietà Image . Proprietà Adjust (Regolare) Soglia". Spostare la barra superiore per apportare regolazioni di soglia. Chiudere la finestra di regolazione della soglia senza apportare altre modifiche una volta selezionate le sezioni desiderate21.
- Utilizzare lo strumento Selezioni poligono per selezionare lo spazio occupato dal tessuto. Assicurarsi con attenzione che i contorni tracciano i bordi del tessuto, perché tracce sciolte forniranno false misurazioni.
- Regolare le impostazioni di misurazione in ImageJ in modo che il software misura solo l'area dei pixel che sono stati selezionati utilizzando lo strumento soglia nel passaggio 9.423. "ImageJ Proprietà Analyze . Impostare le misure Area e Limite alla soglia". Selezionare solo Area e Limita alla soglia.
- Misurare l'area dei pixel evidenziati. "ImageJ Proprietà Analyze . Misura". Questo valore rappresenta l'area dello spazio negativo.
- Misurare l'area dell'intera regione di interesse. Questa è l'area selezionata utilizzando lo strumento Selezioni poligono. "Immagine J Proprietà Analyze . Impostare le misure Area". Selezionare Solo Area e deselezionare Limita alla soglia. Quindi misurare, selezionando "Immagine J Proprietà Analyze . Misura".
- Calcolare l'area che il tessuto muscolare effettivo sta occupando all'interno della regione di interesse. Sottrarre l'area dello spazio negativo dall'area dell'intera area di interesse. Questo valore è l'area del tessuto muscolare.
- Calcolare l'indice di compattazione muscolare (MCI). Dividere l'area del tessuto muscolare per l'area della regione di interesse.
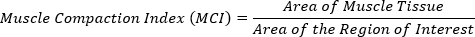
Maggiore è il valore MCI, più il muscolo è compattato. Questi valori MCI possono quindi essere utilizzati per l'analisi statistica per verificare la ricerca di cambiamenti significativi nella compattazione muscolare tra i gruppi di trattamento (Figura 4C).
Risultati
L'indice di compattazione muscolare è stato confrontato tra cuori che si sviluppano in due ambienti diversi, un controllo e un gruppo sperimentale. Questi protocolli sono stati utilizzati per analizzare quantitativamente la compattazione del tessuto muscolare, che ha permesso l'analisi statistica. La compattazione muscolare ha dimostrato di essere significativamente ridotta nei cuori sperimentali rispetto agli embrioni che si sono sviluppati in condizioni non sperimentali.
Discussione
Questo protocollo esplora le tecniche coinvolte nell'analisi dello sviluppo cardiaco nei cuori embrionali. Alcune limitazioni di questo metodo sono la destrezza fisica richiesta per le tecniche preparatorie, che possono richiedere pratica, e abilità con l'imaging al microscopio. Se le fette ottenute al criostato sono disordinate, la colorazione ematossialina ed eosina non sarà chiara, o se le immagini scattate al microscopio hanno scarsa illuminazione, il metodo utilizzato con ImageJ non funzionerà. Una limitazione de...
Divulgazioni
Gli autori non hanno alcuna divulgazione da segnalare.
Riconoscimenti
L'Aguirre Lab è supportato dal National Heart, Lung, and Blood Institute of the National Institutes of Health sotto il numero di premio K01HL135464 e dall'American Heart Association sotto il premio numero 19IPLOI34660342.
Materiali
| Name | Company | Catalog Number | Comments |
| 15 mL Conical Tube(s) | Fisher Scientific | # 1495970C | |
| C57BL/6J Mice | Jackson Labs | C57BL/6J - stock 000664 | |
| Coplin Staining Jars (x6) | VWR Scientific | # 25457-006 | |
| Coverslips 24X50MM #1.5 | VWR Scientific | # 48393-241 | |
| Cryostat - Leica CM3050S | Leica | N/A | |
| Dissecting Dish(s) | Fisher Scientific | # 50930381 | |
| Dumont #5 - Fine Forceps (x2) | Fine Science Tools | # 11254-20 | |
| Eosin Y Solution | Millipore Sigma | # HT110116-500ML | |
| Ethyl Alcohol (Pure, 200 proof) | Fisher Scientific | # BP2818-500 | |
| Ethylenediaminetetraacetic acid (EDTA) | Millipore Sigma | # E9884-100G | |
| Eukitt | Millipore Sigma | # 03989-100ML | |
| Fine Scissors | Fine Science Tools | # 14060-10 | |
| Fluorescent Stereo Microscope Leica M165 FC | Leica | N/A | |
| Glycine | Millipore Sigma | # 410225-250G | |
| Graefe Forceps | Fine Science Tools | # 11052-10 | |
| Graphpad Prism 8 Software | Graphpad | ||
| ImageJ Software | ImageJ | ||
| Kimwipes | Fisher Scientific | # 06666A | |
| Mayer's hematoxylin solution | Millipore Sigma | # MHS16-500ML | |
| Micropipette tip(s) - p200 | Fisher Scientific | # 02707448 | |
| Microsoft Excel Software | Microsoft | ||
| OCT Compound | VWR Scientific | # 102094-106 | |
| Olympus CkX53 Microscope | Olympus | ||
| Paint Brushes (at least 2) | |||
| Paraformaldehyde | VWR Scientific | # 0215014601 | Make into 4% solution (dissolved in PBS) |
| Pasteur pipette(s) | Fisher Scientific | # 13-711-7M | |
| Penicillin-Streptomycin | ThermoFisher Scientific | # 15140122 | |
| Phosphate Buffered Saline (PBS) | ThermoFisher Scientific | # 70011044 | Dilute from 10x to 1x before using |
| Scale | Mettler Toledo | # MS1602TS | |
| Scale | Mettler Toledo | # MS105 | |
| Scalpel Handle #3 | VWR Scientific | # 10161-918 | |
| Scalpel Blades | VWR Scientific | # 21909-612 | |
| Square Mold | VWR Scientific | # 100500-224 | For OCT molds |
| Sucrose | Millipore Sigma | # S9378-500G | |
| Superfrost Plus Slides | Fisher Scientific | # 1255015 | |
| Surgical Scissors | Fine Science Tools | # 14002-14 | |
| Tissue-Tek Accu-Edge Disposable Microtome Blades | VWR Scientific | # 25608-964 | |
| Travel Scale | Acculab | VIC 5101 | |
| Xylene | Millipore Sigma | 214736-1L |
Riferimenti
- Kathiresan, S., Srivastava, D. Genetics of human cardiovascular disease. Cell. 148 (6), 1242-1257 (2012).
- Sun, R., Liu, M., Lu, L., Zheng, Y., Zhang, P. Congenital Heart Disease: Causes, Diagnosis, Symptoms, and Treatments. Cell Biochemistry and Biophysics. 72 (3), 857-860 (2015).
- Hoffman, J. I. E., Kaplan, S. The incidence of congenital heart disease. Journal of the American College of Cardiology. 39 (12), 1890-1900 (2002).
- Fahed, A. C., Gelb, B. D., Seidman, J. G., Seidman, C. E. Genetics of congenital heart disease: The glass half empty. Circulation Research. 112 (4), 707-720 (2013).
- Pelech, A. N., Broeckel, U. Toward the etiologies of congenital heart diseases. Clinics in Perinatology. 32 (4), 825-844 (2005).
- Zaidi, S., Brueckner, M. Genetics and Genomics of Congenital Heart Disease. Circulation Research. 120 (6), 923-940 (2017).
- Kenny, L. A., et al. Transplantation in the single ventricle population. Annals of Cardiothoracic Surgery. 7 (1), 152-159 (2018).
- Navaratnam, D., et al. Exercise-Induced Systemic Venous Hypertension in the Fontan Circulation. The American Journal of Cardiology. 117 (10), 1667-1671 (2016).
- De Leval, M. R., Deanfield, J. E. Four decades of Fontan palliation. Nature Reviews Cardiology. 7 (9), 520-527 (2010).
- Buckberg, G. D., Hoffman, J. I. E., Coghlan, H. C., Nanda, N. C. Ventricular structure-function relations in health and disease: part II. Clinical considerations. European Journal of Cardio-Thoracic Surgery : Official Journal of the European Association for Cardio-thoracic Surgery. 47 (5), 778-787 (2015).
- Jenkins, K. J., et al. Noninherited risk factors and congenital cardiovascular defects: Current knowledge - A scientific statement from the American Heart Association Council on Cardiovascular Disease in the Young. Circulation. 115 (23), 2995-3014 (2007).
- Botto, L. D., et al. Lower rate of selected congenital heart defects with better maternal diet quality : a population-based study. Archives of Disease in Childhood - Fetal and Neonatal Edition. 101 (1), F43-F49 (2016).
- Knowles, R. L., et al. Ethnic and socioeconomic variation in incidence of congenital heart defects. Archives of Disease in Childhood. 102 (6), 496-502 (2017).
- Feng, Y., et al. Maternal Folic Acid Supplementation and the Risk of Congenital Heart Defects in Offspring : A Meta-Analysis of Epidemiological Observational Studies. Scientific Reports. 17 (5), 8506 (2015).
- Rhinn, M., Dolle, P. Retinoic acid signalling during development. Development. 139 (5), 843-858 (2012).
- Liu, Y., et al. Circulating retinoic acid levels and the development of metabolic syndrome. The Journal of Clinical Endocrinology & Metabolism. 101 (February), 2015 (2016).
- Kurian, L., et al. Identification of novel long noncoding RNAs underlying vertebrate cardiovascular development. Circulation. 131 (14), 1278-1290 (2015).
- Aguirre, A., Sancho-Martinez, I., Izpisua Belmonte, J. C. Reprogramming toward heart regeneration: Stem cells and beyond. Cell Stem Cell. 12 (3), 275-284 (2013).
- Srivastava, D. Making or breaking the heart: from lineage determination to morphogenesis. Cell. 126 (6), 1037-1048 (2006).
- Heyne, G. W., et al. A simple and reliable method for early pregnancy detection in inbred mice. Journal of the American Association for Laboratory Animal Science. 54 (4), 368-371 (2015).
- . Stage Definition Available from: https://www.emouseatlas.org/emap/ema/theiler_stages/StageDefinition/stagedefinition.html (1998)
- Part 4-Measure Areas using Thresholding. Science Education Resource Center Available from: https://serc.carleton.edu/eet/measure_sat2/part_4.html (2017)
- . Examples of Image Analysis Using ImageJ Available from: https://imagej.nih.gov/ij/docs/pdfs/examples.pdf (2007)
- MacIver, D. H., Adeniran, I., Zhang, H. Left ventricular ejection fraction is determined by both global myocardial strain and wall thickness. IJC Heart and Vasculature. 1 (7), 113-118 (2015).
- Towbin, J. A., Ballweg, J., Johnson, J. Left Ventricular Noncompaction Cardiomyopathy. Heart Failure in the Child and Young Adult: From Bench to Bedside. , 269-290 (2018).
- Choi, Y., Kim, S. M., Lee, S. C., Chang, S. A., Jang, S. Y., Choe, Y. H. Quantification of left ventricular trabeculae using cardiovascular magnetic resonance for the diagnosis of left ventricular non-compaction: evaluation of trabecular volume and refined semi-quantitative criteria. Journal of Cardiovascular Magnetic Resonance. 18 (1), 24 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon