Method Article
Un approccio microfluidico per lo studio della cristallizzazione di ghiaccio e clatrato idrato
In questo articolo
Riepilogo
Il presente protocollo descrive la cristallizzazione di microscopici cristalli di ghiaccio e clatrati idrati in dispositivi microfluidici, consentendo lo scambio di liquidi attorno ai cristalli formati. Ciò fornisce possibilità senza precedenti per esaminare il processo di cristallizzazione e i meccanismi di legame degli inibitori.
Abstract
Una descrizione meccanicistica accurata della cristallizzazione dell'acqua è impegnativa e richiede alcuni elementi chiave: un eccellente controllo della temperatura per consentire la formazione di singoli cristalli microscopici e un adeguato sistema di microscopia accoppiato alla fase fredda. Il metodo qui descritto aggiunge un'altra importante caratteristica che include lo scambio di soluzioni attorno a ghiaccio e cristalli di clatrato idrato. Il sistema descritto comprende una combinazione di strumenti unici e sviluppati internamente, tra cui microfluidica, fasi fredde ad alta risoluzione e microscopia a fluorescenza. La fase fredda è stata progettata per dispositivi microfluidici e consente la formazione di cristalli di ghiaccio/idrato di dimensioni micron all'interno di canali microfluidici e lo scambio di soluzioni intorno ad essi. La risoluzione della temperatura e la stabilità della fase fredda è di un millikelvin, che è fondamentale per controllare la crescita di questi piccoli cristalli. Questo sistema diversificato viene utilizzato per studiare i diversi processi di cristallizzazione del ghiaccio e dell'idrato e il meccanismo con cui viene inibita la crescita di questi cristalli. Il protocollo descrive come preparare dispositivi microfluidici, come far crescere e controllare cristalli microscopici nei canali microfluidici e come l'utilizzo del flusso di liquidi intorno ai cristalli di ghiaccio / idrato offre nuove informazioni sulla cristallizzazione dell'acqua.
Introduzione
Le proteine antigelo (AFP) e le glicoproteine antigelo (AFGP) proteggono vari organismi adattati al freddo dai danni del gelo1. AFP e AFGPs (generalizzati come AF(G)Ps) inibiscono la crescita dei cristalli di ghiaccio legandosi irreversibilmente alle loro superfici e inibendo un'ulteriore crescita a causa dell'effetto Gibbs-Thomson 2,3,4,5. Il divario risultante che si forma tra la temperatura di fusione, che è in gran parte invariata, e la temperatura di congelamento recentemente depressa è chiamato isteresi termica (TH) e rappresenta un parametro misurabile corrispondente all'attività AFP6. L'uso di AFP per inibire la crescita del ghiaccio ha applicazioni di vasta portata e diversificate, offrendo potenziali miglioramenti in vari campi, tra cui la crioconservazione, la qualità degli alimenti surgelati e la protezione delle colture esposte al freddo.
La cristallizzazione dell'acqua a basse temperature e alte pressioni in presenza di piccole molecole organiche provoca la formazione di clatrati idrati (o idrati gassosi), dove l'idrato più abbondante è l'idrato di metano7. La cristallizzazione degli idrati di metano nelle linee di flusso gas/olio può causare tappi, che potrebbero causare esplosioni dovute all'accensione del gas 8,9,10. Gli attuali sforzi per prevenire la cristallizzazione degli idrati nelle linee di flusso includono l'uso di inibitori termodinamici (alcoli e glicoli) e cinetici (principalmente polimeri)11,12,13,14. È stato anche scoperto che gli AFP si legano ai cristalli di idrato di clatrato e inibiscono la loro crescita, il che indica il potenziale uso di AFP per ostacolare la formazione di tappi, fornendo così una soluzione più verde15.
La microfluidica è un metodo prevalente utilizzato per studiare le proprietà dei fluidi a minuscoli volumi di campioni (fino a fL) che vengono fatti fluire attraverso una rete di microcanali16. I microcanali seguono uno schema creato su un wafer di silicio (lo stampo) utilizzando la litografia17. Un materiale comunemente usato per fabbricare dispositivi microfluidici è il polidimetilsilossano (PDMS), che è economico e relativamente semplice da lavorare nei laboratori di ricerca. Il design delle caratteristiche (canali) è composto in relazione allo scopo specifico del dispositivo; pertanto, può essere utilizzato per una varietà di applicazioni, tra cui il rilevamento del DNA18, la diagnosi medica19 e i processi di cristallizzazione 3,20,21.
Il presente protocollo descrive un metodo microfluidico unico per la coltivazione di ghiaccio di dimensioni micron e cristalli di idrato con vari inibitori, tra cui AFP e AFGP. Per questi esperimenti, sono stati utilizzati idrati di tetraidrofurano (THF) per imitare le proprietà degli idrati di gas metano22, che richiedono attrezzature specializzate per il controllo della pressione e della temperatura23. Gli AF(G)P marcati con fluorescenza sono stati utilizzati per visualizzare e analizzare l'adsorbimento delle proteine sulla superficie cristallina e, accoppiato con l'imaging fluorescente, l'approccio microfluidico ha permesso di ottenere le caratteristiche chiave del processo di legame di queste molecole alle superfici cristalline.
Protocollo
1. Fabbricazione di dispositivi microfluidici
- Coprire la superficie interna di una capsula di Petri con un foglio di alluminio e posizionare lo stampo pre-preparato nella capsula di Petri.
- Fabbricare gli stampi utilizzando le tecniche di litografia descritte nei riferimenti. I due progetti di dispositivi utilizzati nel presente lavoro sono illustrati nella Figura 1.
- Preparare 30-40 mL della miscela PDMS pesando una miscela 1:10 (in peso) dell'agente di polimerizzazione e dell'elastomero (vedere Tabella dei materiali) e mescolando continuamente per circa 5 minuti fino a quando la miscela appare bianca e quasi opaca.
NOTA: posizionare un bicchiere di plastica sulla bilancia, versare l'elastomero nella tazza, quindi aggiungere l'agente polimerizzante per ottenere un rapporto di peso 1:10. - Versare la miscela PDMS nella piastra di Petri con lo stampo e degassare in un essiccatore fino a quando non rimangono bolle (circa 30 minuti).
- Cuocere lo stampo con il PDMS liquido in forno o su piastra calda a 70 °C fino ad ottenere una consistenza simile alla gomma. Questo processo richiede circa un'ora.
- Ritagliate il dispositivo tracciando le caratteristiche con un bisturi, avendo cura di spingere in avanti con il bisturi anziché verso il basso poiché lo stampo è fragile. Rimuovere il dispositivo PDMS ritagliato, mettendolo capovolto in una nuova capsula di Petri. Rimuovere polvere e particelle di sporco dalla superficie inferiore attaccando e rimuovendo un pezzo di nastro adesivo (vedere Tabella dei materiali).
- Utilizzare un ago da siringa smussato (20 G) per perforare i fori nel dispositivo in base al modello stampato, utilizzando un microscopio se necessario. Assicurarsi che il foro penetri attraverso l'altro lato del dispositivo e utilizzare una pinzetta per rimuovere i pezzi perforati.
- Lavare accuratamente un coprivetrino (18 x 18 mm, spessore 0,14 mm) con acqua e sapone, quindi con isopropanolo. Utilizzare la pressione dell'aria per asciugare il vetrino pulito.
- Inserire il PDMS pulito e lo slip di copertura nel detergente al plasma, chiudere le valvole e accendere l'alimentazione, l'aspirapolvere e la pompa. Lasciare funzionare il pulitore al plasma per circa un minuto, impostare la RF su HI e consentire all'aria di entrare nel pulitore al plasma utilizzando la valvola fine.
- Quando il colore della finestra di visualizzazione cambia da viola a rosa, lasciare agire il pulitore al plasma per 50 secondi e spegnere l'RF. Tenere la pompa accesa per un minuto e, dopo averla spenta, aprire gradualmente la valvola principale per consentire all'aria di entrare nel pulitore al plasma.
NOTA: Un metodo alternativo per ottenere risultati comparabili è il legame termico. Per questo metodo, adagiare lo stampo sul vetrino di copertura e posizionarlo su una piastra riscaldante impostata a 70-80 °C per circa 60 minuti.
- Quando il colore della finestra di visualizzazione cambia da viola a rosa, lasciare agire il pulitore al plasma per 50 secondi e spegnere l'RF. Tenere la pompa accesa per un minuto e, dopo averla spenta, aprire gradualmente la valvola principale per consentire all'aria di entrare nel pulitore al plasma.
- Premere la superficie PDMS sul vetrino pulito e verificare che siano incollati osservando che non si stacchi quando si solleva leggermente il vetrino.
- Fissare l'ago di un ago smussato a 90° (18 G) con un paio di pinze e togliere il connettore della siringa di plastica per rimuoverlo. Inserire un'estremità dell'ago in un tubo Tygon (0,020" ID, 0,060" OD, vedere Tabella dei materiali) e l'altra estremità in uno dei fori perforati del dispositivo. Ripetete il processo per gli altri fori.
- Per rimuovere le bolle d'aria, iniettare acqua/tampone nei canali con una siringa di vetro (una pompa è facoltativa, ma qui non è stata utilizzata alcuna pompa). Filtrare tutti i liquidi con un filtro da 0,22 μm prima di iniettarli nel dispositivo.
- Utilizzare un agente bloccante come una soluzione BSA all'1% per impedire il legame di AFP marcati con fluorescenza sulle pareti PDMS. Iniettare l'agente bloccante nel canale di ingresso e lasciarlo rimanere nei microcanali per 20 minuti. Quindi, iniettare la soluzione tampone nel canale di ingresso per eliminare la soluzione BSA.
NOTA: Il dispositivo PDMS risultante è fissato a un coprivetrino lungo la superficie inferiore, collegato a tubi nei fori di ingresso e uscita e rivestito con un agente bloccante nei suoi canali.
2. Configurazione del dispositivo microfluidico
- Applicare una piccola quantità di olio ad immersione sulla superficie dello stadio freddo di rame (vedere Tabella dei materiali) e distribuirlo con una salvietta priva di lanugine per creare un sottile strato di olio. Quindi, posizionare un disco di zaffiro pulito (vedere Tabella dei materiali) sullo strato di olio creato. Applicare una goccia di olio ad immersione sul centro del disco di zaffiro e posizionare il dispositivo PDMS sulla goccia in modo che le caratteristiche del dispositivo siano allineate sul foro di visualizzazione del palcoscenico freddo.
- Tenere il dispositivo in posizione e fissare il tubo alle pareti esterne della scatola di alluminio che ospita il palcoscenico freddo utilizzando del nastro adesivo. Prendi nota del posizionamento di ciascun tubo specifico.
- Usare una siringa di vetro per iniettare 4-5 μL di soluzione di AF(G)P (vedere Tabella dei materiali) nel canale di ingresso. Chiudere il coperchio della fase fredda.
NOTA: La concentrazione delle soluzioni AFP può essere variata e decisa in base alla loro intensità di fluorescenza. Nel presente protocollo, l'intervallo di concentrazioni era di 5-40 μL.
3. Formazione di singoli cristalli nei canali microfluidici
- Spurgare la fase fredda con aria secca / azoto per evitare la formazione di condensa al suo interno. Attivare un bagno di raffreddamento a circolazione per far circolare l'acqua attraverso la fase fredda e fungere da dissipatore di calore.
- Avviare il programma di controllo della temperatura e impostare la temperatura su -25 °C.
NOTA: Il congelamento si verifica quando il campione raggiunge una temperatura di ~-20 °C, che può essere osservata come un improvviso oscuramento e irruvidimento del campione. Qualsiasi obiettivo può essere utilizzato a questo punto, preferibilmente l'obiettivo 4x, che consente all'utente di osservare la totalità dei canali microfluidici. - Lentamente, aumentando la temperatura di circa 1 °C/5 s, avvicinarsi al punto di fusione del campione, che può variare da -1 a -0,2 °C a seconda del tampone utilizzato nella soluzione di AF(G)P. Quando la temperatura si avvicina al punto di fusione, attendere fino a quando alcuni cristalli singoli sono isolati.
NOTA: Se necessario, il ghiaccio indesiderato può essere sciolto localmente utilizzando un laser IR (980 nm) (vedi Tabella dei materiali), che è fissato sul microscopio. Il laser scioglie i cristalli di ghiaccio vicini finché è acceso. - A questo punto, si consiglia di passare a obiettivi 10x o 20x per osservare meglio i singoli cristalli. Dopo aver ottenuto un singolo cristallo nella posizione desiderata, far crescere il cristallo diminuendo leggermente la temperatura (di ~ 0,01 ° C) fino a quando i bordi del cristallo incontrano le pareti del canale.
- Passare all'obiettivo 50x, iniettare la soluzione di AF(G)P nei canali e osservare l'aumento dell'intensità della fluorescenza, indicando che la soluzione proteica è stata iniettata con successo nei canali. Eseguire questo passaggio con attenzione per evitare lo scioglimento del cristallo di ghiaccio durante lo scambio di soluzioni. Monitorare e regolare attentamente sia la portata (applicando una pressione maggiore/minore sulla siringa di vetro) che la temperatura durante il processo di sostituzione della soluzione.
- Lasciare alle proteine il tempo sufficiente per accumularsi e legarsi sulla superficie del cristallo.
NOTA: Questo varia in base ai tassi di accumulo e adsorbimento di AF(G)P 5,25. In un tipico esperimento, sono consentiti 5-10 minuti per l'accumulo di AFP
4. Misurazione dell'attività dell'isteresi termica (TH)
Nota : questo passaggio è facoltativo.
- Determinare il punto di fusione del cristallo regolando la temperatura con piccoli passi di 0,002 °C e osservando la temperatura massima a cui un piccolo cristallo può essere sottoposto senza che si sciolga.
- Sulla funzione RAMP del regolatore di temperatura, impostare la velocità di raffreddamento su -0,05 a -0,01 °C/4 s e attivare il RAMP . Nota la temperatura esatta alla quale si verifica l'improvvisa crescita dei cristalli.
NOTA: questo valore è chiamato temperatura di scoppio e corrisponde alla temperatura di congelamento. La differenza tra le temperature di fusione e congelamento è l'attività TH25.
5. Scambio di soluzioni attorno a singoli cristalli
- Assicurarsi che la temperatura del campione sia nello spazio TH per evitare la fusione o la crescita del cristallo durante l'esperimento.
- Registrare il processo di scambio della soluzione utilizzando il programma di imaging NIS Elements (vedere la tabella dei materiali) per una successiva analisi dei dati di fluorescenza. Iniettare lentamente la soluzione tampone nel secondo ingresso del dispositivo microfluidico e osservare una diminuzione del segnale fluorescente ad una velocità che dipende dalla pressione applicata alla siringa.
- Utilizzare questa rappresentazione visiva per assicurarsi che la pressione applicata non sia troppo elevata in modo da non causare la fusione del cristallo. Vedere la Figura 2 per una sequenza di immagini che illustra il processo di scambio della soluzione.
- Misurare l'intensità della fluorescenza nel canale microfluidico utilizzando il programma di imaging.
NOTA: Il segnale dovrebbe raggiungere il picco nella regione vicino alla superficie del cristallo, indicando il legame AFP, e dovrebbe essere relativamente basso nella soluzione circostante, che è stata lavata con tampone. - Misurare l'attività TH dopo lo scambio della soluzione dopo il passaggio 4.
- Ripetere l'esperimento isolando un nuovo cristallo (passi 3.3-3.5). Iniettare la soluzione di AFP con una siringa di vetro e ripetere la sostituzione della soluzione (punti 5.1-5.3). Ottenere un nuovo cristallo singolo (fasi 3.3-3.5) e far fluire la soluzione AFP nei canali usando la siringa di vetro.
6. Esperimenti con clatrati idrati
- Per ottenere idrati di THF, preparare una soluzione THF/acqua con un rapporto molare di 1:15, che è un rapporto di volume di 1:3,326. Mantenere questo rapporto in tutte le soluzioni utilizzate nei seguenti esperimenti, comprese quelle contenenti AF(G)P o altri inibitori.
- Seguire i passaggi 1 e 2 per preparare il dispositivo microfluidico e posizionarlo nella fase fredda. Impostare la temperatura a -25 °C; il campione si congelerà a ~-20 °C come descritto al punto 3.2.
- Dopo che la soluzione di THF è stata congelata, aumentare lentamente la temperatura fino a quando tutto il ghiaccio si è sciolto.
NOTA: Il punto di fusione del ghiaccio è leggermente depresso dal THF. - Per garantire che tutti i cristalli di ghiaccio si sciolgano ad esclusione degli idrati, mantenere la temperatura a 1 °C per 3 minuti.
- Impostare la temperatura a -2 °C e osservare l'abbondanza di idrati che compaiono nei canali microfluidici in assenza di inibitori.
NOTA: Gli idrati di THF hanno la forma di ottaedri (Figura 2) e, in alcuni casi, i cristalli sono molto sottili; Pertanto, un'osservazione chiara potrebbe essere difficile. In questi casi, si consiglia di ripetere i passaggi 6.4-6.5 per ottenere nuovi cristalli. - Iniettare l'AF(G)P/inibitore nel canale microfluidico usando la siringa di vetro regolando la temperatura per assicurarsi che i cristalli ottenuti non si sciolgano/crescano. Attendere alcuni minuti affinché le molecole inibitrici adsorbano la superficie cristallina.
- Se necessario, misurare l'attività TH seguendo il passaggio 4.
- Invertire la soluzione attorno ai cristalli come descritto nei punti 5.2-5.3.
Risultati
Scambio di soluzioni con cristalli di ghiaccio
Uno scambio di soluzioni di successo attorno a un cristallo di ghiaccio è presentato nella Figura 3. Il timestamp su ogni snapshot indica che lo scambio della soluzione è stato relativamente veloce; Tuttavia, è possibile uno scambio più lento. L'intensità di fluorescenza proveniente dalle molecole AFGP adsorbite dal ghiaccio è chiaramente osservata dopo che lo scambio è completo (Figura 3, a destra). Un'analisi quantitativa della concentrazione di AFP sulla superficie del ghiaccio viene monitorata utilizzando uno strumento di regione di interesse designato (ROI) (Figura 4). In questo esperimento4, è stato utilizzato AFP di tipo III (isoforma QAE) diluito in 50 mM Tris-HCl (pH 7,8) e 100 mM NaCl. La soluzione viene scambiata attorno a un cristallo di forma bipiramidale e viene monitorata l'intensità della fluorescenza nella soluzione e sul ghiaccio. Il grafico rosso che indica il segnale di fluorescenza nella soluzione è diminuito di un fattore 100 durante lo scambio della soluzione, mentre il segnale calcolato (grafico verde) sulla superficie del ghiaccio rimane costante. Il segnale calcolato delle molecole adsorbite di ghiaccio è stato ottenuto sottraendo il segnale proveniente dalla soluzione (moltiplicato per una costante che si riferisce allo spessore del canale microfluidico) dal segnale proveniente dal ghiaccio4.
Scambio di soluzioni con idrati di THF
Gli esperimenti microfluidici con idrati di THF sono stati condotti in modo simile agli esperimenti con il ghiaccio. Dopo che i cristalli di idrato sono stati autorizzati ad assorbire le molecole inibitrici dalla soluzione, una soluzione priva di inibitori è stata iniettata nei canali. La Figura 5 presenta gli idrati di THF dopo lo scambio della soluzione con due tipi di inibitori: AFGP1-5 marcato con isotiocianato di fluoresceina (FITC) (Figura 5A) e safranina O (vedi Tabella dei materiali), che è un colorante a fluorescenza26 (Figura 5B). Questa è la prima dimostrazione di un legame AFGP alla superficie di un idrato di clatrato.
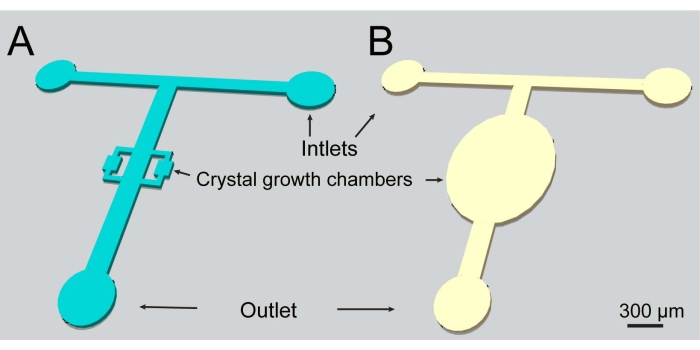
Figura 1: Una rappresentazione schematica dei canali microfluidici utilizzati nel presente studio. Entrambi i design includono due ingressi e una presa. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: Gli idrati di THF si sono formati nel canale microfluidico dopo che la temperatura è stata raffreddata a ~-2 °C. La morfologia di tutti i cristalli presentati è un tetraedro; Tuttavia, alcuni cristalli sono orientati in modo diverso. Barra di scala = 20 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 3: Un esperimento rappresentativo che mostra lo scambio di soluzioni attorno a un singolo cristallo di ghiaccio in un canale microfluidico. Inizialmente, la soluzione conteneva AFGP1-5 marcato con FITC e non sono stati osservati AFGP adsorbiti dal ghiaccio. Dopo che la soluzione è stata scambiata con una soluzione priva di AFGP, le proteine che erano state precedentemente adsorbite sulla superficie del ghiaccio sono state chiaramente rilevate (immagine a destra). Barra di scala = 25 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
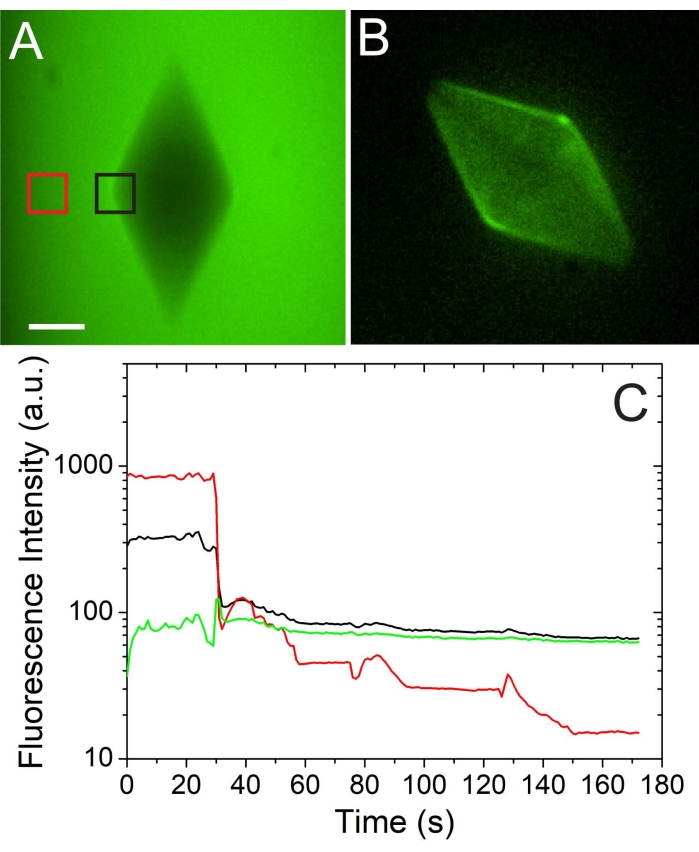
Figura 4: Analisi quantitativa e qualitativa della concentrazione di AFP sulla superficie del ghiaccio. (A) Un cristallo di ghiaccio ad alta concentrazione di soluzione AFP (prima dello scambio della soluzione). (B) Lo stesso cristallo dopo che la soluzione di AFP è stata scambiata con una soluzione tampone priva di AFP. Barra della scala = 20 μm. (C) Analisi quantitativa dell'intensità di fluorescenza sulla superficie del ghiaccio (nero) e nella soluzione (rosso) durante uno scambio di soluzione. La curva verde rappresenta l'intensità calcolata sulla superficie del ghiaccio. La cifra è adattata con il permesso del riferimento4. Fare clic qui per visualizzare una versione ingrandita di questa figura.
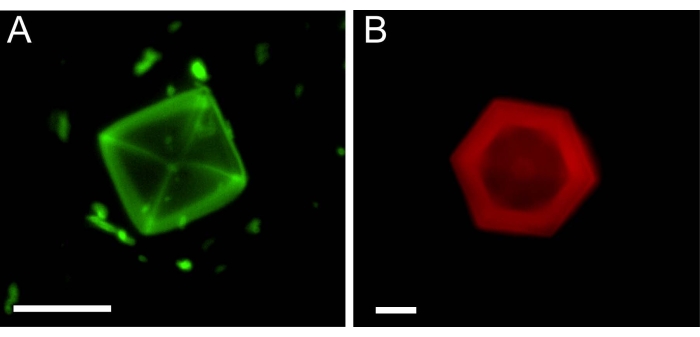
Figura 5: Singoli cristalli di THF idrato in canali microfluidici dopo che la soluzione intorno a loro (A, AFGP1-5) o (B, Safranina O) è stata scambiata. L'immagine di cui al punto (B) è riprodotta a partire dal riferimento26. Barra di scala = 25 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
Il presente protocollo è stato progettato per utilizzare la combinazione del flusso microfluidico con cristalli microscopici al fine di rivelare nuove intuizioni sulla crescita dei cristalli e sulla sua inibizione. Uno stadio freddo27 a temperatura controllata a risoluzione millikelvin consente il controllo di singoli cristalli microscopici situati all'interno di canali microfluidici, consentendo così lo scambio di soluzioni intorno ad essi. Mentre la fabbricazione di dispositivi microfluidici è standard e simile alle pratiche comuni17,18, il controllo sulla crescita e la fusione dei cristalli all'interno del dispositivo è unico e nuovo. Il componente più critico di questo sistema è l'eccellente controllo della temperatura, che si ottiene utilizzando raffreddatori termoelettrici Peltier, feedback da un termistore che si trova vicino al campione e un regolatore di temperatura ad alta risoluzione che governa il circuito di feedback.
Un altro passo critico è lo scambio della soluzione stessa, poiché i cristalli potrebbero sciogliersi o crescere durante questo processo; Pertanto, la temperatura deve essere regolata durante lo scambio della soluzione per prevenire la crescita / fusione. La formazione di cristalli nei canali microfluidici interferisce con il flusso del liquido e pone la sfida principale di questo sistema; Pertanto, la crescita di questi cristalli deve essere controllata. Qui, un laser IR (980 nm) è stato montato sul microscopio invertito ed è stato utilizzato per sciogliere localmente cristalli di ghiaccio / idrato indesiderati28. Se tale laser non può essere utilizzato, i connettori metallici del dispositivo microfluidico possono essere riscaldati da un ulteriore dispositivo di raffreddamento termoelettrico Peltier, che scioglierà il ghiaccio nell'ingresso / uscita del dispositivo.
Il metodo qui descritto include strumenti sviluppati in casa (fase fredda) e richiede formazione, poiché alcuni dei passaggi sopra menzionati sono impegnativi. Poiché la concentrazione della soluzione che circonda i cristalli può cambiare anche quando il flusso non è previsto, una semplice fase di calibrazione5 può fornire una stima affidabile della concentrazione basata sul segnale di fluorescenza. Un'altra possibile soluzione al flusso indesiderato (durante le misurazioni TH, ad esempio) sono le valvole microfluidiche, che sono descritte nel riferimento4.
Questo sistema è stato utilizzato anche per esplorare il comportamento di crescita del ghiaccio D 2 O nel liquidoH2O, uno studio che ha rivelato un nuovo fenomeno di microscopiche superfici di ghiaccio smerlate27. Pertanto, la microfluidica può essere utilizzata nello studio di vari sistemi cristallini che rispondono bene ai cambiamenti di temperatura.
Divulgazioni
Nessuno
Riconoscimenti
Si ringraziano i donatori dell'American Chemical Society Petroleum Research Fund per il sostegno a questa ricerca (numero di sovvenzione 60191-UNI5). Gli autori desiderano ringraziare il Prof. Ido Braslavsky per aver aperto la strada all'uso di dispositivi microfluidici per studiare le proteine antigelo e il ghiaccio. Gli autori sono grati al Prof. Arthur DeVries, al Prof. Konrad Meister e al Prof. Peter Davies per aver fornito campioni di proteine antigelo.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.22-micron filters | Fisher Scientific | ||
| 90-degree bent blunt needles | 18 Gauge | ||
| Antifreeze proteins and antifreeze glycoproteins | A gift | See references 5 and 28 | |
| Blunt needles | 18 Gauge and 20 Gauge | ||
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | ||
| Cold stage | Home made | ||
| Cover slips | Globe Scientific | 18 X 18 mm, 0.14 mm thickness | |
| Glass syringe | |||
| Infrared laser 980 nm | Opto Engine LLC | ||
| Inverted microscope, Eclipse Ti - S | Nikon | ||
| Invisible tape | Staples | ||
| lint-free wipe | Kimwipes | ||
| Newport 3040 temperature controller | Newport | ||
| NIS-Elements Imaging Software | Nikon | ||
| Oil vacuum pump | Harrick Plasma | ||
| Plasma cleaner | Harrick Plasma | PDC-32G | |
| Polydimethylsiloxane (Dow Corning Sylgard 184 Silicone Elastomer kit) | Dow Corning Syglard | ||
| Safranine O | Sigma-Aldrich | S2255-25G | |
| Sapphire disc | Ted Pella Inc | 16005-1010 | 25.4 mm diameter, 0.3 mm thickness |
| sCMOS Camera, Neo 5.5 | Andor | ||
| Tetrahydrofuran (THF) | Sigma-Aldrich | 401757-100ML | |
| Tygon Microbore tubing for microfluidic device | Cole-Parmer | 0.020" ID, 0.060"OD, 100 ft/roll. | |
| Tygon tubing for water circulation and nitrogen gas | Cole-Parmer | 1/8” ID, 3/16” OD |
Riferimenti
- Bar Dolev, M., Braslavsky, I., Davies, P. L. Ice-Binding Proteins and Their Function. Annual Review of Biochemistry. 85 (1), 515-542 (2016).
- Raymond, J. A., DeVries, A. L. Adsorption inhibition as a mechanism of freezing resistance in polar fishes. Proceedings of the National Academy of Sciences of the United States of America. 74 (6), 2589-2593 (1977).
- Celik, Y., et al. Microfluidic experiments reveal that antifreeze proteins bound to ice crystals suffice to prevent their growth. Proceedings of the National Academy of Sciences of the United States of America. 110 (4), 1309-1314 (2013).
- Drori, R., Davies, P. L., Braslavsky, I. When are antifreeze proteins in solution essential for ice growth inhibition. Langmuir. 31 (21), 5805-5811 (2015).
- Meister, K., DeVries, A. L., Bakker, H. J., Drori, R. Antifreeze glycoproteins bind irreversibly to ice. Journal of the American Chemical Society. 140 (30), 9365-9368 (2018).
- Braslavsky, I., Drori, R. LabVIEW-operated Novel Nanoliter Osmometer for Ice Binding Protein Investigations. Journal of Visualized Experiments. (72), e4189(2013).
- Ruppel, C. D., Kessler, J. D. The interaction of climate change and methane hydrates. Reviews of Geophysics. 55 (1), 126-168 (2017).
- Mozaffar, H., Anderson, R., Tohidi, B. Effect of alcohols and diols on PVCap-induced hydrate crystal growth patterns in methane systems. Fluid Phase Equilibria. 425, 1-8 (2016).
- Sa, J. H., et al. Inhibition of methane and natural gas hydrate formation by altering the structure of water with amino acids. Scientific Reports. 6, 31582(2016).
- Lederhos, J. P., Long, J. P., Sum, A., Christiansen, R. L., Sloan, E. D. Effective kinetic inhibitors for natural gas hydrates. Chemical Engineering Science. 51 (8), 1221-1229 (1996).
- Sun, T., Davies, P. L., Walker, V. K. Structural Basis for the Inhibition of Gas Hydrates by α-Helical Antifreeze Proteins. Biophysical Journal. 109 (8), 1698-1705 (2015).
- Zeng, H., Wilson, L. D., Walker, V. K., Ripmeester, J. A. Effect of antifreeze proteins on the nucleation, growth, and the memory effect during tetrahydrofuran clathrate hydrate formation. Journal of the American Chemical Society. 128 (9), 2844-2850 (2006).
- Zeng, H., Wilson, L. D., Walker, V. K., Ripmeester, J. A. The inhibition of tetrahydrofuran clathrate-hydrate formation with antifreeze protein. Canadian Journal of Physics. 81 (1-2), 17-24 (2003).
- Walker, V. K., et al. Antifreeze proteins as gas hydrate inhibitors. Canadian Journal of Chemistry. 93 (8), 839-849 (2015).
- Gordienko, R., et al. Towards a green hydrate inhibitor: imaging antifreeze proteins on clathrates. PloS One. 5 (2), 8953(2010).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), 368-373 (2006).
- Cole, R. H., Tran, T. M., Abate, A. R. Double emulsion generation using a polydimethylsiloxane (PDMS) co-axial flow focus device. Journal of Visualized Experiments. (106), e53516(2015).
- Dutse, S. W., Yusof, N. A. Microfluidics-based lab-on-chip systems in DNA-based biosensing: An overview. Sensors. 11 (6), 5754-5768 (2011).
- Burklund, A., Tadimety, A., Nie, Y., Hao, N., Zhang, J. X. J. Advances in diagnostic microfluidics. Advances in Clinical Chemistry. 95, 1-72 (2020).
- Sui, S., Perry, S. L. Microfluidics: From crystallization to serial time-resolved crystallography. Structural Dynamics. 4 (3), 032202(2017).
- Haleva, L., et al. Microfluidic cold-finger device for the investigation of ice-binding proteins. Biophys Journal. 111 (6), 1143-1150 (2016).
- Vlasic, T. M., Servio, P. D., Rey, A. D. THF hydrates as model systems for natural gas hydrates: Comparing their mechanical and vibrational properties. Industrial and Engineering Chemistry Research. 58 (36), 16588-16596 (2019).
- Chen, W., Pinho, B., Hartman, R. L. Flash crystallization kinetics of methane (sI) hydrate in a thermoelectrically-cooled microreactor. Lab on a Chip. 17 (18), 3051-3060 (2017).
- Qin, D., Xia, Y., Whitesides, G. M. Soft lithography for micro- and nanoscale patterning. Nature Protocols. 5 (3), 491-502 (2010).
- Drori, R., Celik, Y., Davies, P. L., Braslavsky, I. Ice-binding proteins that accumulate on different ice crystal planes produce distinct thermal hysteresis dynamics. Journal of the Royal Society Interface. 11 (98), 20140526(2014).
- Soussana, T. N., Weissman, H., Rybtchinski, B., Drori, R. Adsorption-inhibition of clathrate hydrates by self-assembled nanostructures. ChemPhysChem. 22 (21), 2182-2189 (2021).
- Drori, R., Holmes-Cerfon, M., Kahr, B., Kohn, R. v, Ward, M. D. Dynamics and unsteady morphologies at ice interfaces driven by D2O-H2O exchange. Proceedings of the National Academy of Sciences of the United States of America. 114 (44), 11627-11632 (2017).
- Deng, J., Apfelbaum, E., Drori, R. Ice growth acceleration by antifreeze proteins leads to higher thermal hysteresis activity. Journal of Physical Chemistry B. 124 (49), 11081-11088 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon