Method Article
Generazione, screening ad alto rendimento e biobanca di sferoidi cardiaci derivati da cellule staminali pluripotenti indotte dall'uomo
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui viene presentato un insieme di protocolli per la generazione e la crioconservazione di sferoidi cardiaci (CS) da cardiomiociti derivati da cellule staminali pluripotenti indotti dall'uomo coltivati in un formato multidimensionale ad alto rendimento. Questo modello tridimensionale funziona come una solida piattaforma per la modellazione delle malattie, gli screening ad alto rendimento e mantiene la sua funzionalità dopo la crioconservazione.
Abstract
I cardiomiociti derivati da cellule staminali pluripotenti indotti dall'uomo (hiPSC-CM) sono di fondamentale importanza per la modellizzazione e la terapia delle malattie cardiache umane. Recentemente abbiamo pubblicato una strategia economica per la massiccia espansione di hiPSC-CM in due dimensioni (2D). Due limitazioni principali sono l'immaturità delle celle e la mancanza di disposizione tridimensionale (3D) e scalabilità nelle piattaforme HTS (High-Throughput Screening). Per superare queste limitazioni, i cardiomiociti espansi formano una fonte cellulare ideale per la generazione di colture cellulari cardiache 3D e tecniche di ingegneria tissutale. Quest'ultimo ha grandi potenzialità in campo cardiovascolare, fornendo HTS più avanzato e fisiologicamente rilevante. In questo articolo descriviamo un flusso di lavoro compatibile con HTS con facile scalabilità per la generazione, la manutenzione e l'analisi ottica degli sferoidi cardiaci (CS) in un formato a 96 pozzetti. Questi piccoli CS sono essenziali per colmare il divario presente negli attuali modelli di malattia in vitro e / o nella generazione per le piattaforme di ingegneria tissutale 3D. I CS presentano morfologia, dimensioni e composizione cellulare altamente strutturate. Inoltre, le hiPSC-CM coltivate come CS mostrano una maggiore maturazione e diverse caratteristiche funzionali del cuore umano, come la manipolazione spontanea del calcio e l'attività contrattile. Automatizzando l'intero flusso di lavoro, dalla generazione di CS all'analisi funzionale, aumentiamo la riproducibilità intra e inter-batch, come dimostrato dall'imaging ad alta produttività (HT) e dall'analisi della gestione del calcio. Il protocollo descritto consente la modellazione di malattie cardiache e la valutazione degli effetti farmacologici/terapeutici a livello di singola cellula all'interno di un complesso ambiente cellulare 3D in un flusso di lavoro HTS completamente automatizzato. Inoltre, lo studio descrive una procedura semplice per la conservazione a lungo termine e la biobanca di interi sferoidi, offrendo così ai ricercatori l'opportunità di creare un deposito funzionale di tessuti di prossima generazione. L'HTS combinato con lo stoccaggio a lungo termine contribuirà in modo sostanziale alla ricerca traslazionale in una vasta gamma di settori, tra cui la scoperta e la sperimentazione di farmaci, la medicina rigenerativa e lo sviluppo di terapie personalizzate.
Introduzione
La scoperta delle cellule staminali pluripotenti indotte dall'uomo (hiPSCs) ha offerto opportunità senza precedenti per studiare lo sviluppo umano e le malattie a livello cellulare. Negli ultimi dieci anni, utilizzando lezioni di sviluppo, sono stati stabiliti vari protocolli per garantire l'efficiente differenziazione delle hiPSCs in cardiomiociti (CM)1,2,3,4. I cardiomiociti derivati da hiPSC (hiPSC-CMs) possono servire come risorsa per modellare le malattie cardiovascolari geneticamente ereditabili (CVD), testare la sicurezza cardiaca per nuovi farmaci e strategie rigenerative cardiache 5,6,7,8. Nonostante la differenziazione cardiaca diretta delle hiPSC, il numero indefinito di CM rimane una sfida nel campo cardiaco, poiché le hiPSC-CM mature generalmente non proliferano e le cellule umane primarie non sono disponibili in quantità elevate.
Recentemente, abbiamo descritto che l'attivazione concomitante della segnalazione Wnt con una coltura a bassa densità cellulare ha determinato una massiccia risposta proliferativa (fino a 250 volte) di hiPSC-CMs 9,10. Questa strategia economica per la massiccia espansione di hiPSC-CM tramite passata seriale in formato pallone di coltura facilita la standardizzazione e il controllo di qualità di un gran numero di hiPSC-CM funzionali. Inoltre, per tenere il passo con la domanda di grandi lotti di hiPSC-CM da vari donatori, è stata descritta la biobanca di hiPSC-CM10. Tuttavia, i monostrati di cardiomiociti seminati in questi piatti di coltura standard non sono rappresentativi della complessa struttura 3D presente nel cuore. Inoltre, l'immaturità delle hiPSC-CMs è rimasta un ostacolo, non essendo quindi all'altezza dell'imitazione del fenotipo biologico e fisiologico dell'ambiente cardiovascolare in vivo.
Sono stati sviluppati nuovi modelli 3D in vitro in cui le hiPSC-CM mostrano un comportamento fisiologico più vicino come l'auto-organizzazione 11,12, il rimodellamento della matrice extracellulare (ECM) 13, la maturazione migliorata 14,15,16 e la contrazione sincronizzata17,18,19 . I modelli 3D sono stati utilizzati per la scoperta di farmaci, test di cardiotossicità farmacologica, modellazione di malattie, terapie rigenerative e persino i primi studi clinici 20,21,22,23,24. Uno dei modelli più utilizzati è il tessuto cardiaco ingegnerizzato a base di fibrina (EHT), che presenta una disposizione simile al tessuto e contrattilità cardiaca13,17,25. In precedenza, abbiamo dimostrato che gli EHT generati da hiPSC-CM espansi mostravano contrattilità comparabile a quelli di hiPSC-CM non espansi, dimostrando funzionalità cellulare non compromessa dopo l'espansione9. Tuttavia, anche se la generazione di EHT da hiPSC-CM è stata ben consolidata, si prevedono ulteriori sviluppi per quanto riguarda la creazione di una piattaforma di valutazione HT. Qui, la rapida generazione di un gran numero di sferoidi cardiaci autoaggreganti (CS) in formato a 96 pozzetti consente un miglioramento delle condizioni 3D per scopi di screening ad alta produttività (HTS).
Nel complesso, il vantaggio dei CS come coltura cellulare 3D è la loro elevata riproducibilità e scalabilità. In particolare, i CS combinati con la gestione robotica dei campioni possono standardizzare e automatizzare la coltura di CS, il trattamento farmacologico e l'analisi ad alto contenuto20. Qui, descriviamo protocolli ottimizzati per generare CS di alta purezza e alta qualità, che possono essere efficacemente crioconservati e sottoposti a screening per la funzione cardiaca eseguendo misurazioni transitorie di Ca2+ utilizzando un sistema ottico di acquisizione e analisi del calcio. Questo modello fornisce uno strumento semplice ma potente per eseguire schermi ad alto rendimento su centinaia di migliaia di sferoidi17,18.
Protocollo
NOTA: le hiPSC-CM utilizzate in questo studio sono state generate secondo i protocolli di coltura e differenziazione CM hiPSC precedentemente descritti26,27. Opzionalmente, gli hiPSC-CM possono essere espansi e crioconservati come recentemente pubblicato prima di iniziare il protocollo CS (sezione 4)10.
1. Preparazione di terreni di coltura cellulare, soluzioni e aliquote
- Preparare il terreno basale
- Equilibrare la penicillina-streptomicina e il mezzo (RPMI 1640) a temperatura ambiente (RT) e assicurarsi che si sia scongelato completamente. Mescolare 500 ml del mezzo e 5 ml di penna/streptococco. Conservare a 4 °C per un massimo di 8 settimane; equilibrare a 37 °C prima dell'uso.
- Preparare RPMI + B27
- Equilibrare il supplemento B27 e il mezzo basale a RT. Assicurarsi di scongelare completamente il supplemento. Mescolare 490 mL del mezzo basale e 10 mL del supplemento 50x B27. Conservare a 4 °C per un massimo di 2 settimane; equilibrare a 37 °C prima dell'uso.
- Preparazione del materiale di riverniciatura hiPSC-CM
- Aggiungere l'inibitore della protein chinasi (ROCK) associato a Rho e contenente bobina a spirale (concentrazione finale di 2 μM) e il 10% di sostituzione del siero knockout (KSR) ai mezzi RPMI + B27. Aggiungere l'inibitore ROCK direttamente al supporto RM secondo necessità. Non memorizzare i terreni di coltura una volta integrati.
- Preparare i supporti di scongelamento CM
- Aggiungere una concentrazione 1:100 di integratore di sopravvivenza cellulare (ad es. Revitacell) e 20% KSR a RPMI + B27 media ed equilibrare a 37 °C prima dell'uso.
- Preparare l'integratore per la maturazione
- Il mezzo di maturazione precedentemente descritto formula28 è costituito da: 3 mM di glucosio, 10 mM di L-lattato, 5 mg/ml di vitamina B12, 0,82 mM di biotina, 5 mM di creatina monoidrato, 2 mM di taurina, 2 mM di L-carnitina, 0,5 mM di acido ascorbico, 1x NEAA, 0,5% (p/v) albumax, 1x B27 e 1% KOSR. Per preparare una bottiglia piena (500 ml) di supplemento di maturazione, rimuovere 65 ml da una bottiglia di DMEM senza glucosio e integrare con 2,7 g di glucosio, 5,6 g di L-lattato, 0,025 mg di vitamina B12, 1 mg di biotina, 3,73 g di creatina monoidrato, 1,25 g di taurina, 1,975 g di L-carnitina, 0,7125 g di acido ascorbico, 50 ml di NEAA, 12,5 g di albumax e 5 ml di penicillina-streptomicina.
- Filtrare attraverso un'unità filtrante monouso sterile con membrana in polietersulfone (PES) poroso da 0,22 μm.
- Aliquote in 45 mL (per preparare 500 mL di terreno di maturazione) o 4,5 mL (per preparare 50 mL di terreno di maturazione). Conservare a 20 °C per un massimo di 6 mesi.
- Preparare i mezzi di maturazione
- Equilibrare il supplemento B27, knockout SR, penicillina-streptomicina, il supplemento di maturazione28 e il mezzo DMEM senza glucosio a RT. Assicurarsi di scongelare completamente il supplemento. Mescolare 435 ml del mezzo DMEM senza glucosio con 10 ml del supplemento 50x B27, 5 ml di penicillina-streptomicina, 5 ml di SR knockout e 45 ml di supplemento di maturazione. Conservare a 4 °C per un massimo di 2 settimane; equilibrare a 37 °C prima dell'uso.
- Preparare il mezzo fluorescente brillante
- Equilibrare penicillina-streptomicina e DMEM fluorobrite mezzo a RT. Assicurarsi che il supplemento è completamente scongelato. Mescolare 500 ml del mezzo fluorbrite DMEM con 5 ml di penicillina-streptomicina. Conservare a 4 °C per un massimo di 1 mese; equilibrare a 37 °C prima dell'uso.
- Preparare la soluzione detergente non ionica
- Mescolare il 20% p/v di detersivo non ionico in polvere (ad esempio, F-127) con PBS. Filtrare con un filtro da 0,22 μm e conservare a 4 °C per un massimo di 6 mesi; equilibrare a RT prima dell'uso.
- Preparare il mezzo di colorante di calcio
- Mescolare la soluzione detergente non ionica (concentrazione finale dello 0,04% v/v) e 0,1x del colorante di calcio (ad es. Cal520 AM) in mezzo fluorescente brillante. In un tubo conico da 50 ml, aggiungere 10 μL di Cal520 e 20 μL della soluzione detergente non ionica. Mescolare fino a completa dissoluzione. Tenere la soluzione al buio prima di aggiungere alle celle.
2. Preparazione dei buffer
- Preparare il tampone di permeabilizzazione e blocco: Questo buffer contiene 10 mL di PBS, 5% wt/v BSA e 0,3% v/v Triton-X-100.
- Preparare il tampone per citometria a flusso: questo tampone contiene 50 ml di PBS, 1% wt/v BSA e 0,3% v/v Triton-X-100.
- Tampone di lavaggio con citometria a flusso: Questo tampone contiene 50 ml di PBS e 1% in peso / v BSA.
- Tampone di lavaggio sferoidale (SWB): Questo tampone contiene 1 mL di Triton-X-100, 2 mL di SDS al 10% (p/v in DPBS) e 2 g di BSA in 1 L di PBS.
NOTA: SWB può essere conservato a 4 °C per un massimo di 2 settimane. - Preparare la soluzione di incorporamento (ES): Per preparare 100 ml della soluzione di incorporamento, mescolare 50 ml di glicerolo con 9,09 ml di dH2O, 1 ml di tampone Tris (1 M, pH 8,0) e 200 μL di EDTA (0,5 M). Aggiungere 22,7 g di fruttosio e mescolare a RT al buio fino a quando non si scioglie. Quando è limpido, aggiungere 22,2 g di fruttosio e mescolare fino a quando non si scioglie. Quindi aggiungere 15 g di urea e mescolare fino a dissoluzione (conservare a 4 °C al buio).
- Preparare il buffer PBT (PBS con Tween-20). Questo buffer contiene PBS/Tween-20 (0,1% v/v). Per 1 L di PBS, aggiungere 1 mL di Tween-20.
3. Preparazione di piccole molecole
- Ricostituire la polvere di tiazovivina (inibitore di ROCK) in aliquote 10 mM da 50 μL in DMSO e conservare a -20 °C per un massimo di 6 mesi. Proteggere dalla luce.
- Preparare 2,5 mM di aliquote da 10 μL ciascuna di Cal-520 AM in DMSO e conservarle a -20 °C per un massimo di 6 mesi. Proteggere dalla luce.
4. Generazione di sferoidi cardiaci
NOTA: Per grandi quantità di CS, seminare fino a 1 milione di CM in una piastra di attacco ultra-bassa a 6 pozzetti con 2 ml di materiale di riplaccatura hiPSC-CM. Questo studio ha utilizzato un minimo di 2.500 (2,5k CS) fino a 20.000 (20k CS) hiPSC-CM per pozzetto di una piastra da 96 pozzetti.
- Per una piastra da 96 pozzetti, preparare una coltura cellulare contenente almeno 2 x 106 cardiomiociti derivati da cellule staminali pluripotenti indotti dall'uomo (hiPSC-CMs)10.
- Quando le hiPSC-CM in coltura raggiungono la confluenza, aggiungere 0,1 mL/cm2 di soluzione sterile di distacco cardiaco (ad es. triplo) a ciascun pozzetto. Incubare la piastra a 37 °C per 15 min.
- Utilizzando un pipet da 5 ml, dissociare meccanicamente le cellule lavando con 2 ml di mezzo basale caldo per ottenere una sospensione a singola cellula. Confermare il distacco con un microscopio a campo luminoso (ingrandimento 4x); Le celle appariranno bianche e avranno una forma rotonda.
- Trasferire la sospensione cellulare in un tubo conico da 15 mL e centrifugare per 3 minuti a 300 x g.
- Aspirare il surnatante e risospendere le cellule in 1 mL di mezzo di riplaccatura hiPSC-CM.
- Utilizzando una punta del pipetta da 1.000 μL, dissociare meccanicamente il pellet cellulare. La soluzione appare omogenea dopo tre o quattro miscele. Contare le celle. Trasferire la quantità appropriata di celle in 100 μL del mezzo di riplaccatura in ciascun pozzo da 96 pozzetti a fondo tondo di attacco ultra-basso.
- Posizionare la piastra di CS su uno shaker orbitale a 70 giri / min nell'incubatore per 24 ore. Impostare le condizioni dell'incubatore su 37 °C, 5% CO 2, 21% O2 e 90% umidità.
- Aspirare 50 μL di mezzo da ciascun pozzetto e aggiungere 100 μL di RPMI + B27 di mezzo per pozzetto per le prime 48 ore.
NOTA: Tenere sempre 50 μL del mezzo nella piastra a 96 pozzetti per evitare aspirazioni accidentali e rotture sferoidi. - Aspirare 100 μL del mezzo da ciascun pozzetto e aggiungere 100 μL del mezzo di maturazione per pozzetto. Mantenere le cellule nel mezzo di maturazione e rinfrescare il terreno ogni 2-3 giorni.
5. Crioconservazione dei CS
NOTA: i CS possono essere crioconservati per la conservazione a lungo termine. La crioconservazione può essere eseguita dal giorno 3 dopo la generazione di CS. I CS possono essere crioconservati direttamente nei pozzetti di una piastra a 96 pozzetti o come sospensione CS nei criovi.
- Pre-raffreddare la piastra posizionando la piastra sul ghiaccio per 10 minuti.
- Centrifugare la piastra sferoidale per 3 minuti a 70 x g.
- Rimuovere il surnatante fino a quando rimangono 50 μL e aggiungere 200 μL di mezzo di congelamento hiPSC ghiacciato per pozzetto.
NOTA: Mantenere la sospensione CS sul ghiaccio per tutta la durata della procedura. Nel caso di una piastra a 6 pozzetti con sferoidi, congelare un pozzetto in un crioviale medio di congelamento da 500 μL. - Sigillare la piastra con pellicola sigillante a piastra.
NOTA: la piastra da 96 pozzetti deve essere conservata in una scatola di polistirolo o, quando non disponibile, è possibile realizzare uno stampo in silicone come descritto al punto 5.5.1. - Per garantire uno scambio termico uniforme tra la piastra del pozzetto e il congelatore, posizionare con cura la piastra in una scatola di polistirolo o in uno stampo in silicone.
- Per preparare lo stampo in silicone: mescolare energicamente due componenti del kit di elastomero di silicio in un rapporto 10:1. De-bubble la soluzione utilizzando una pompa per vuoto per 15-20 minuti. Successivamente, gettare la soluzione all'interno della parte inferiore della piastra del pozzetto e de-bolla utilizzando una pompa per vuoto per 10 minuti. Mettere lo stampo in forno e polimerizzare a 60 °C per 8 ore per ottenere un elastomero semiflessibile che viene staccato dalla piastra.
- Congelare la piastra a -80 °C per un minimo di 4 ore nella scatola di polistirolo o nello stampo in silicone preparato.
- Trasferire la piastra in un serbatoio di azoto liquido o in un congelatore a -150 °C per la conservazione a lungo termine.
6. Scongelamento degli sferoidi cardiaci
NOTA: Non scongelare più di una lastra alla volta per garantire un rapido processo di scongelamento.
- Preparare 20 mL di mezzo basale preriscaldato a 37 °C in un tubo conico da 50 ml.
- Raccogliere la piastra cellulare con CS dall'azoto liquido e metterla nell'incubatore per 15 minuti. Impostare le condizioni dell'incubatore su 37 °C, 5% CO 2, 21% O2 e 90% umidità.
- Rimuovere il surnatante e il pellet cellulare rimane e risospendere ogni pozzetto in un mezzo basale caldo. Utilizzare 200 μL di terreno per pozzetto.
- Centrifugare per 3 min a 70 x g.
- Ripetere i passaggi 6.3 e 6.4.
- Rimuovere il surnatante fino a quando il pellet cellulare rimane e aggiungere 200 μL di mezzo di scongelamento CM in ciascun pozzetto.
- Posizionare la piastra di CS su uno shaker orbitale a 70 giri / min in un'incubatrice per 24 ore. Impostare le condizioni dell'incubatore su 37 °C, 5% CO 2, 21% O2 e 90% umidità.
- Aspirare 50 μL del mezzo da ciascun pozzetto e aggiungere 100 μL di RPMI + B27 di mezzo per pozzetto per le prime 48 ore.
- Aspirare 100 μL del mezzo da ciascun pozzetto e aggiungere 100 μL di terreno di maturazione per pozzetto. Mantenere le cellule nel mezzo di maturazione e rinfrescare il terreno ogni 2-3 giorni.
7. Valutazione dei transitori intracellulari di Ca2+
NOTA: i CS sono in coltura per un totale di 3 settimane; 2 settimane prima del congelamento e 1 settimana dopo lo scongelamento. I controlli "freschi" sono abbinati all'età.
- Dopo 1 settimana di coltura, i CS scongelati sono ottimali per l'imaging ottico di gestione del calcio. Utilizzare un colorante di calcio (ad esempio, Cal520AM) per valutare l'assorbimento e il rilascio di Ca2+ dalle cellule.
- Trattarli con 100 μL di terreno colorante di calcio per pozzetto e incubare per 60 minuti nell'incubatore. Impostare le condizioni dell'incubatore su 37 °C, 5% CO 2, 21% O2 e 90% umidità.
NOTA: Cal520AM è sensibile alla luce. Esegui tutte le procedure di caricamento e gli esperimenti al buio. - Preparare il sistema di acquisizione e analisi del calcio.
- Alimentare il microscopio, assicurandosi che l'opzione di controllo ambientale sia attiva.
- Regolare le dimensioni dell'apertura della fotocamera e dell'inquadratura per ridurre al minimo l'area di sfondo.
NOTA: Qui è stato utilizzato il microscopio Leica Thunder DMi8; Anche altri sistemi di microscopi sono applicabili fino a quando non consentono una frequenza di campionamento superiore a 30 fotogrammi / secondo (fps).
- Registra un video con un flusso costante di 2-10 picchi entro 10 secondi e scansiona attraverso la piastra a 96 pozzetti, inizialmente spostandosi a sinistra, poi verso il basso a zig-zag per coprire l'intera piastra. Misurare il segnale di calcio utilizzando un laser a 488 nm; Imposta il contrasto su uno sfondo nero con un segnale verde brillante durante il rilascio di calcio.
- Dopo aver acquisito i transitori Ca2+ , analizzare i dati con il software di analisi delle tracce di fluorescenza (ad esempio, CyteSeer, Vala Sciences) secondo le istruzioni del produttore.
8. Analisi citometriche a flusso di sferoidi cardiaci dissociati
NOTA: In questo studio, la citometria a flusso è stata utilizzata per determinare la vitalità dei CS prima e dopo il processo di scongelamento.
- Raccogliere i CS in un tubo conico da 15 mL utilizzando un pipet da 5 mL per evitare danni sferoidi e centrifugare per 3 minuti a 70 x g. Aspirare il surnatante e aggiungere 1 mL di PBS.
- Centrifugare per 3 min a 200 x g. Aspirare il surnatante e dissociare i CS aggiungendo 1 mL di soluzione di distacco cardiaco (ad es. triplo). Incubare il tubo a 37 °C per 15 min.
- Utilizzando un pipet da 5 ml, dissociare meccanicamente le cellule lavando con 2 ml di mezzo basale fino a quando le singole cellule possono essere viste quando osservate al microscopio.
- Centrifugare per 3 min a 200 x g.
- Aspirare il surnatante e fissare i CM con 200 μL di soluzione di paraformaldeide (PFA) al 4% in 1x PBS. Incubare per 10 minuti a RT.
- Centrifugare per 3 min a 200 x g. Aspirare il surnatante e aggiungere 1 mL di PBS.
NOTA: Punto di pausa: Gli hiPSC-CM fissi possono essere conservati a 4 °C per un massimo di 4 settimane. - Trasferire la sospensione cellulare in un tubo FACS e centrifugare per 3 minuti a 200 x g. Aspirare il surnatante e risospendere 1 x 105 cellule in 50 μL del tampone di permeabilizzazione.
- Incubare le cellule per 30 minuti a 4 °C.
- Per l'analisi della citometria a flusso di immunofluorescenza, eseguire i passaggi 8.9.1-8.9.4.
- Risospendere le cellule nel tampone citometrico a flusso (50 μL) contenente l'anticorpo α-actinina ad una diluizione di 1:300. In un'altra provetta FACS, risospendere 1 x 105 cellule nel tampone citometrico a flusso (50 μL) con il rispettivo controllo isotipo (ad esempio, IgM del topo FITC, isotipo κ [diluizione 1:200]). Allo stesso modo, risospendere 1 x 105 cellule in 50 μL di tampone citometrico a flusso per il controllo negativo.
- Incubare le cellule per 30 minuti a 4 °C.
- Aggiungere 2,5 ml di tampone citometrico a flusso e centrifugare le cellule a 200 x g per 3 minuti a 4 °C; Scartare il surnatante e ripetere questo passaggio di lavaggio due volte.
- Risospendere le cellule in 50 μL di tampone citometrico a flusso con l'anticorpo secondario capra-antitopo (diluizione 1:300).
NOTA: Posizionare il tubo al buio poiché la soluzione di anticorpi secondari è sensibile alla luce.
- Per il controllo della vitalità con ioduro di propidio (PI), aggiungere 150 μL di PI per campione (1:1.000) e incubare per 15 minuti.
NOTA: Posizionare il tubo al buio poiché la soluzione PI è sensibile alla luce. - Regolare le porte secondo la strategia di gating standard come mostrato nella Figura supplementare 1 e analizzare le cellule con un citometro a flusso.
9. Colorazione con immunofluorescenza di interi sferoidi 3D
NOTA: Questo protocollo si basa sul protocollo per l'imaging 3D ad alta risoluzione di organoidi interi su marcatura immunofluorescente, che è stato precedentemente pubblicato29 e adattato per gli sferoidi cardiaci. Durante la procedura, tutte le punte dei pipet e i tubi conici possono essere rivestiti con BSA-PBS all'1% in peso / v per evitare che gli sferoidi si attacchino alla plastica. Per rivestire i materiali, immergersi nell'1% BSA-PBS. Fare attenzione a non danneggiare gli sferoidi utilizzando il pipet da 5 ml, evitando interruzioni meccaniche.
- Raccogliere i CS in un tubo rivestito da 15 ml con un pipet da 5 ml. Gli sferoidi sono visibili agli occhi. Raccogliere ~ 20-50 sferoidi per combinazione di anticorpi. Centrifugare per 3 min a 70 g e aspirare il surnatante.
- Risospendere accuratamente gli sferoidi in 1 mL di soluzione ghiacciata di paraformaldeide (PFA) al 4% ghiacciata in 1x PBS utilizzando una punta rivestita da 1 ml.
- Fissare a 4 °C per 45 min. Dopo 20 minuti, risospendere delicatamente gli sferoidi utilizzando una punta rivestita da 1 ml. Questo uniforma la fissazione tra tutti gli sferoidi.
- Aggiungere 10 ml di PBS ghiacciato al tubo e mescolare delicatamente capovolgendo il tubo. Incubare per 10 min a 4 °C e centrifugare a 70 x g per 3 min.
NOTA: Da questo passaggio in poi, il rivestimento delle punte e dei tubi conici non è generalmente necessario in quanto i CS non si attaccano alla punta dopo il fissaggio. - Bloccare i CS risospendendo il pellet in SWB ghiacciato (200 μL di SWB per pozzetto) e trasferire gli sferoidi in una piastra di coltura in sospensione a 24 pozzetti.
NOTA: i CS di un grande pellet possono essere suddivisi su più pozzetti per eseguire diverse colorazioni. Utilizzare ~ 20-50 CS per combinazione di anticorpi. - Incubare a 4 °C per almeno 15 min.
- Aggiungere 200 μL di SWB in un pozzo vuoto per fungere da pozzo di riferimento.
NOTA: Per la colorazione immunofluorescente, è possibile utilizzare anche piastre a 48 o 96 pozzetti per ridurre l'uso di anticorpi. Tuttavia, i risultati di colorazione e lavaggio possono essere ridotti a causa del minor volume per pozzetto. - Lasciare che gli sferoidi si depositino sul fondo della piastra, lasciando la piastra inclinata di un angolo di 45° per 5 minuti.
- Rimuovere l'SWB, lasciando i CS in 200 μL del SWB (utilizzare il pozzetto di riferimento per stimare il volume minimo di 200 μL).
- Aggiungere 200 μL di SWB con gli anticorpi primari 2x concentrati (ad esempio, ɑ-actina [1:200] e troponina T [1:200]) e incubare per una notte a 4 °C mentre si oscilla/scuote (40 rpm su uno shaker orizzontale).
- Il giorno successivo, aggiungere 1 mL di SWB a ciascun pozzetto.
- Lasciare che gli sferoidi si depositino sul fondo della piastra lasciando la piastra con un angolo di 45° per 5 minuti.
- Rimuovere l'SWB, lasciando 200 μL nella piastra. Aggiungere 1 mL di SWB e lavare per 2 ore con oscillazione/agitazione lenta.
- Ripetere i passaggi 9.12 e 9.13 altre due volte.
- Lasciare che i CS si depositino sul fondo della piastra lasciando la piastra inclinata di 45° per 5 minuti. Rimuovere l'SWB, lasciando 200 μL in ciascun pozzetto
- Aggiungere 200 μL di SWB con anticorpi secondari, anticorpi coniugati e coloranti 2x concentrati (ad esempio, DAPI [1 μg/mL], topo-AF488 [1:500], coniglio-AF568 [1:500]), e incubare per una notte a 4 °C al buio, oscillando/agitando lentamente.
- Il giorno successivo, ripeti i passaggi 9.12 e 9.13 altre due volte.
- Trasferire con cautela i CS in un tubo da 1,5 ml e ruotare verso il basso a 70 x g per 3 minuti.
- Rimuovere il maggior numero possibile di SWB mediante pipettaggio senza interrompere i CS.
- Aggiungere la soluzione di incorporamento (ES; almeno 50 μL, a RT) utilizzando una punta da 200 μL con l'estremità tagliata e risospendere delicatamente per evitare la formazione di bolle e incubare a RT per 20 minuti.
- Nel frattempo, crea un contenitore quadrato su un vetrino con smalto per unghie o sigillante siliconico.
- Tagliare l'estremità di una punta da 200 μL e trasferire i CS in ES al centro del contenitore quadrato.
- Posiziona una copertina quadrata sopra. Per ridurre le bolle d'aria, posizionare prima un lato del coprivetrino, quindi abbassare lentamente il coprivetrino da un lato all'altro fino a quando non c'è aria intrappolata sotto la superficie, quindi rilasciare il vetrino.
- Spingere delicatamente su tutti i bordi della copertina per sigillarla allo smalto o al sigillante siliconico.
- Lascia la diapositiva durante la notte a RT. Il giorno dopo, la diapositiva è pronta per l'imaging.
NOTA: la pulizia ottica da parte dell'ES può causare un lieve restringimento del tessuto. Tuttavia, ciò non può influire sulla morfologia complessiva dei CS. La procedura di colorazione può essere messa in pausa qui conservando i vetrini a 4 °C (per almeno 1 settimana) o a -20 °C (per almeno 6 mesi).
Risultati
Il protocollo mostrato nella Figura 1A descrive la generazione di CS da hiPSC-CM precedentemente espansi. I CS acquisiscono una struttura 3D entro il giorno 1 dopo la semina in piastre a fondo tondo ultra-basso e possono essere coltivati fino a 6 settimane (Figura 1B). Come valutato mediante colorazione con immunofluorescenza, la maggior parte delle cellule nei CS di 3 settimane esprimeva proteine sarcomeriche come α-actina e troponina T e mostrava una regolare organizzazione del sarcomero (Figura 1C). Per la quantificazione delle cellule α-actinina positive, è stata eseguita l'analisi della citometria a flusso. In accordo con i risultati dell'immunofluorescenza, i dati di citometria a flusso hanno dimostrato livelli elevati comparabili di α-actina sia nel giorno 0 (76,9% ± 16,6%) che nei CS di 3 settimane (71,1% ± 22,7%) (Figura 1D), indicando una composizione cellulare costante e altamente pura durante la coltivazione. C'è stato un aumento dell'espressione dei geni cardiaci per le giunzioni (GJA1, JPH2 e PKP2), i desmosomi (DES) e i mitocondri (ATP5A) negli sferoidi derivati da hiPSC-CM (giorno 42) rispetto agli hiPSC-CM coltivati in 2D per 90 giorni (Figura 1E). L'espressione di questi geni è un segno distintivo dell'interazione cellula-cellula e della maturazione30.
Successivamente, le proprietà funzionali dei CS, vale a dire la velocità di battitura e la manipolazione di Ca2+, sono state valutate in diversi punti temporali (Figura 2). I parametri transitori del calcio come il tempo di salita, il tempo di picco, il tempo di decadimento e la durata transitoria del calcio (CTD90) sono stati valutati come indicato nella Figura 2A,B. La percentuale di CS battuti è simile nelle prime 3 settimane post-generazione, ma è diminuita significativamente nella settimana 6 (Wk6) CS (Figura 2C). Il tasso di battitura è stato significativamente ridotto a Wk3 rispetto a Wk1 e, analogamente alla percentuale di CS battenti, è diminuito drasticamente a Wk6 (Figura 2D). A Wk6, è stato osservato un deterioramento della CS, che può spiegare il calo sia della frequenza di battitura che del numero di CS battenti. La misurazione dei parametri transitori del calcio ha indicato un valore di picco significativamente più alto a Wk2 (Figura 2E), mentre il tempo di salita, il tempo di decadimento e CTD90 sono stati significativamente aumentati a Wk3 rispetto a Wk1 (Figura 2F-H ). Nel loro insieme, questi risultati mostrano che gli sferoidi derivati da hiPSC-CM sono funzionalmente ottimali intorno alle settimane 2 e 3 post-generazione.
La figura 3 mostra l'effetto della dimensione dello sferoide sulla frequenza di battitura e sulla manipolazione del calcio. I CS sono stati generati seminando 2,5 x 10 4, 5 x 10 4, 10 x 10 4 e 20 x 10 4 hiPSC-CM in un pozzo di una piastra da 96 pozzetti per un totale di 24 CS / pozzetti per condizione (Figura 3A). Come previsto, la dimensione dello sferoide è aumentata all'aumentare del numero di cellule utilizzate, passando da 178 ± 36 μm a 351 ± 65 μm (Figura 3A, pannello di destra). I transitori di Ca2+ sono stati misurati in CS di 3 settimane alle quattro diverse densità di semina (Figura 3B). Le misurazioni dei CS di battitura hanno indicato che solo circa il 50% dei CS di dimensioni più piccole (2,5K e 5K CS) stavano battendo, mentre la percentuale di CS di dimensioni più grandi (10K e 20K CS) era significativamente più alta (circa l'85%) (Figura 3C). Un tasso di battitura simile (circa 28 bpm) è stato mostrato da 5K-, 10K- e 20K-CS, che era significativamente più alto rispetto a 2.5K-CSs (Figura 3D). I valori di picco delle immagini di calcio erano simili in tutte le condizioni testate (Figura 3E), tuttavia, il tempo di salita (Figura 3F), il tempo di decadimento (Figura 3G) e CTD90 (Figura 3H) sono stati significativamente aumentati in CS di dimensioni maggiori (10K- e 20K-CS) rispetto a quelli più piccoli (2.5K- e 5K-CSs). Nel loro insieme, questi risultati mostrano che gli sferoidi derivati da hiPSC-CM sono ottimali per lo screening della gestione del calcio quando viene utilizzata una densità di semina compresa tra 10K e 20K hiPSC-CM / pozzetto.
Successivamente, abbiamo valutato l'impatto della crioconservazione sulla vitalità e la funzione del CS. Prima dell'analisi, i CS scongelati sono stati mantenuti in coltura per 1 settimana (Figura 4A). Come mostrato dai test di vitalità cellulare di citometria a flusso (Figura 4B) e Calcein-AM (Figura 4C), la crioconservazione non ha influenzato la vitalità cellulare all'interno dei CS. Inoltre, i CS scongelati hanno mostrato livelli di espressione simili di proteine sarcomeriche rispetto ai CS freschi di età corrispondente (Figura 4D). Questi dati indicano che i CS possono essere crioconservati in modo efficiente per la successiva analisi della funzione cardiaca e lo screening ad alta produttività.
Infine, l'attività di battitura e la manipolazione di Ca2+ sono state misurate sia in CS freschi che crioconservati (Figura 5). La percentuale di CS battuti è stata misurata in diversi punti temporali dopo lo scongelamento, rispettivamente, a 2, 5 e 7 giorni. Mentre la maggior parte dei CS freschi ha mostrato attività di battitura nel tempo, chiaramente i CS crioconservati hanno avuto bisogno fino a 1 settimana di coltura per recuperare la loro attività di battitura (Figura 5B). Non vi è stato alcun cambiamento significativo nel tasso di battitura dei CS scongelati rispetto a quelli freschi; tuttavia, non è stata osservata alcuna attività spontanea di battitura in alcuni CS congelati (Figura 5C). Sebbene i valori di picco siano stati significativamente ridotti nei CS congelati/scongelati rispetto a quelli freschi (Figura 5D), non sono stati osservati cambiamenti significativi nel tempo di salita, nel tempo di decadimento e nel CTD90 dei CS congelati/scongelati rispetto ai CS freschi (Figura 5E-G). Questi dati indicano che, dopo lo scongelamento, è importante lasciare che i CS si riprendano nell'incubatore per almeno 1 settimana prima di misurare l'attività di battitura e il transitorio Ca2+.
Nel loro insieme, questi risultati mostrano che la crioconservazione degli sferoidi derivati da hiPSC-CM preserva la vitalità dei cardiomiociti, la struttura sarcomerica e le loro caratteristiche funzionali come l'attività di battitura spontanea e la manipolazione del calcio. Pertanto, gli sferoidi derivati dall'hiPSC-CM rappresentano un modello adatto per ricapitolare accuratamente l'elettrofisiologia cardiaca in vitro.
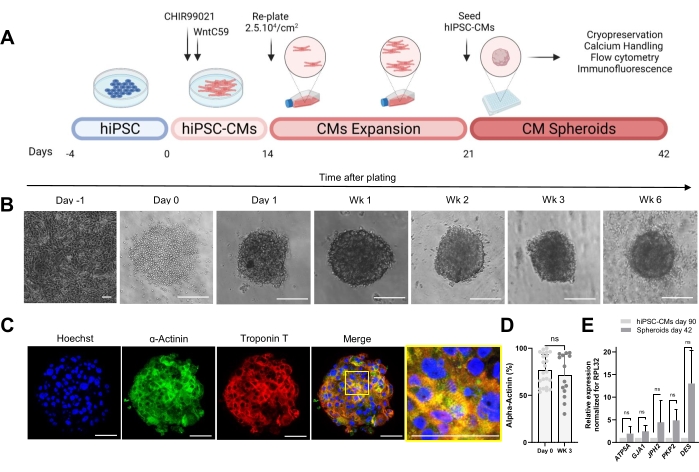
Figura 1: Generazione di sferoidi cardiaci . (A) Rappresentazione schematica del differenziamento cardiaco diretto basato su Wnt, la successiva espansione di hiPSC-CMs e la generazione di CS. Creato con biorender.com. (B) Immagini in campo chiaro in diversi punti temporali della coltura CS. Barra scala, 200 μm. Wk rappresenta la settimana. (C) Immagini rappresentative di immunofluorescenza per le proteine sarcomeriche cardiache α-actina e troponina T in CS di 3 settimane. Immunofluorescenza: Hoechst (blu), α-actina (verde) e troponina T (rossa). Barra scala, 200 μm. L'immagine unita ingrandita a destra mostra l'organizzazione del sarcomero. Barra della scala, 50 μm. (D) Quantificazione della citometria a flusso di cellule α-actinina positive prima (giorno 0) e 3 settimane dopo la formazione di CS. (n = 14-23 per condizione. (E) RT-qPCR eseguita su hiPSC-CMs coltivati per 90 giorni (2D) e campioni sferoidi coltivati per 42 giorni per stabilire i livelli di espressione di diversi geni cardiaci correlati a giunzioni cellulari, filamenti intermedi e mitocondri. (n = 1-3 lotti). I dati sono rappresentati come media ± SD. NS (non significativo) calcolato da un test t spaiato. Fare clic qui per visualizzare una versione ingrandita di questa figura.
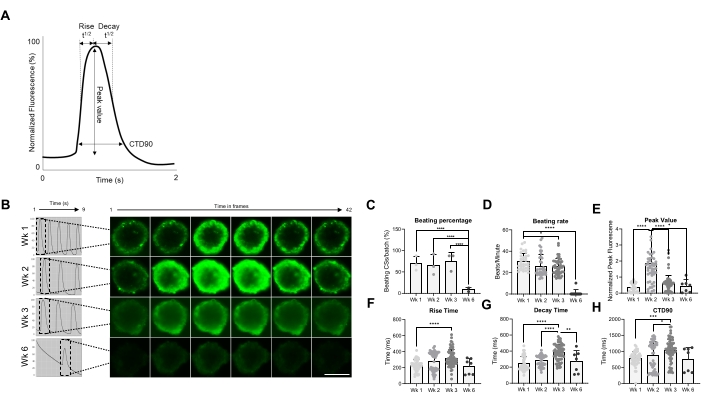
Figura 2: Beating rate e trattamento del calcio nei CS in diverse settimane dopo la generazione. (A) Esempi di parametri transitori di calcio calcolati dall'algoritmo di analisi Vala sciences in Cyteseer Software. (B) Tracce transitorie rappresentative di calcio e immagini time-lapse dei CS in diversi punti temporali (settimane) post-generazione. Barra della scala, 200 μm. (C) La quantificazione del corso temporale dell'attività di battitura spontanea è espressa come percentuale di CS che battono. (D) Tasso di battitura dei CS durante il tempo di coltura. (E-H) Quantificazione dei transitori di calcio che mostrano valore di picco, tempo di salita, tempo di decadimento e CTD90. I dati mostrati sono medi ± SD. Repliche biologiche = tre, repliche tecniche = 38, 50, 66 e 7, rispettivamente. *p < 0,05, ****p < 0,001; ANOVA unidirezionale seguito dal test di confronto multiplo post hoc di Tukey. Abbreviazioni; CTD = durata transitoria del calcio, Wk = settimana, CSs = sferoidi cardiaci umani. Fare clic qui per visualizzare una versione ingrandita di questa figura.
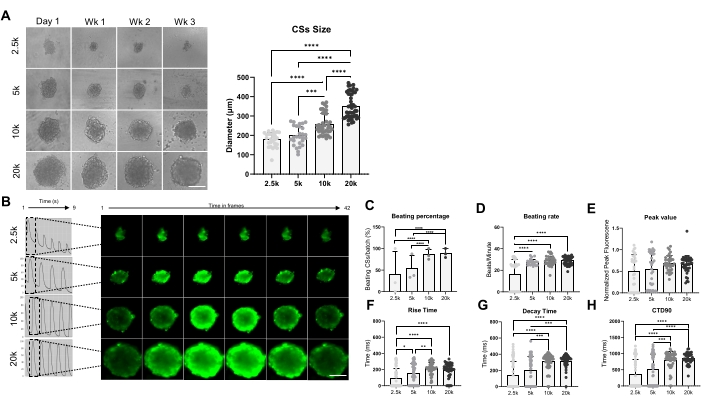
Figura 3: Beating rate e manipolazione del calcio nei CS generati utilizzando diverse densità di semina cellulare. (A) Imaging a campo chiaro (a sinistra) e misurazioni delle dimensioni (a destra) dei CS generati utilizzando un numero diverso di hiPSC-CM. Barra della scala, 200 μm. (B) Tracce transitorie rappresentative di calcio e immagini time-lapse dei 2.5K-20K-CSs. (C,D) Percentuale di battimento e tasso di battimento di 2,5K-20K-CS. (E-H) Valore di picco, tempo di salita, tempo di decadimento e CTD90 in 2,5K-20K-CS. I dati sono medi ± SD. Repliche biologiche = tre, repliche tecniche = 28-39. *p < 0,05, ****p < 0,001; ANOVA unidirezionale seguito dal test di confronto multiplo post hoc di Tukey. Abbreviazioni: CTD = durata transitoria del calcio, Wk = settimana, k = x 1.000 cellule, CSs = sferoidi cardiaci. Fare clic qui per visualizzare una versione ingrandita di questa figura.
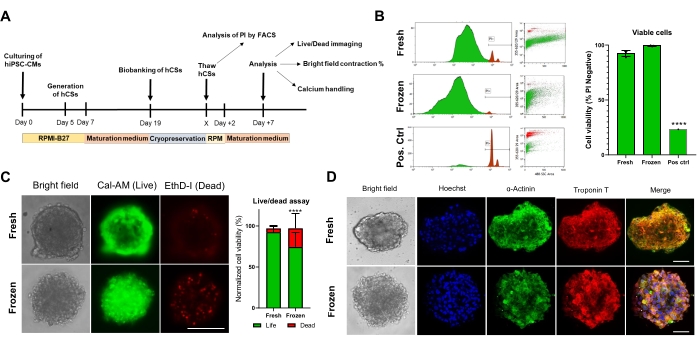
Figura 4. Effetto della crioconservazione sulla vitalità e sulla struttura degli sferoidi cardiaci. (A) Rappresentazione schematica della generazione di CS, del successivo biobanking e dello scongelamento. (B) Test di vitalità cellulare di citometria a flusso in CS sia freschi che crioconservati. Come controllo positivo, è stato utilizzato un trattamento con soluzione Triton-X al 10% per 5 minuti. (n = 4 per condizione). I dati sono rappresentati come media ± DS. ****p < 0,001; ANOVA unidirezionale seguito dal test di confronto multiplo post hoc di Tukey. (C) Test di vitalità delle cellule di calceina-AM in CS freschi rispetto a quelli scongelati dopo 7 giorni di coltura (n = 15-17 per condizione, ****p < 0,001, mediante t-test accoppiato; barra della scala, 200 μm). (D) Colorazione rappresentativa in campo chiaro (a sinistra) e immunofluorescenza per l'espressione di α-actina e troponina T in CS freschi e scongelati. Immunofluorescenza: Hoechst (blu), α-actina (verde) e troponina T (rossa). Le immagini unite sulla destra mostrano striature di sarcomero nei CS. Barra di scala, 50 μm. Abbreviazioni: X = giorno di scongelamento a scelta, PI = ioduro di propidio, Cal-AM = calceina-AM, EthD-I = Ethidium Homodimer I. Fare clic qui per visualizzare una versione ingrandita di questa figura.
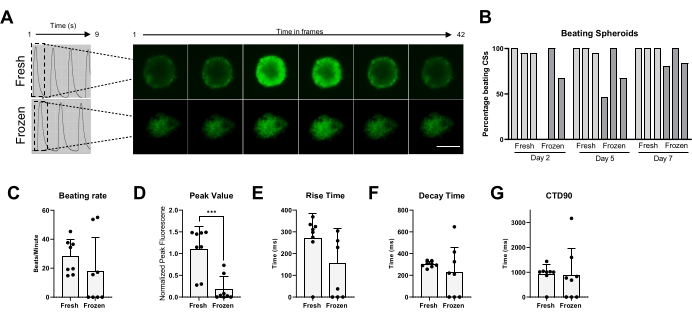
Figura 5: Transitori di calcio nei CS freschi rispetto a quelli scongelati. (A) Tracce transitorie rappresentative di calcio e immagini time-lapse dei CS prima della crioconservazione e 1 settimana dopo lo scongelamento. (B) Percentuale di battitura di sferoidi cardiaci freschi e congelati/scongelati. Le barre rappresentano singoli esperimenti. (C) Tasso di battitura di sferoidi cardiaci freschi e congelati/scongelati. (D-G) Quantificazione dei parametri transitori del calcio: valore di picco, tempo di salita, tempo di decadimento e CTD90. I dati sono medi ± DS. *p < 0,05, ****p < 0,001; ANOVA unidirezionale seguito dal test di confronto multiplo post hoc di Tukey. Abbreviazioni; CTD = durata transitoria del calcio, CSs = sferoidi cardiaci. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Figura supplementare 1: Strategie rappresentative di gating per l'analisi della citometria a flusso. (A) Strategia rappresentativa di gating per hiPSC-CMs positivi all'α-actinina in una popolazione pura rispetto al controllo negativo e al controllo isotipo. Il numero di cellule analizzate positive all'α-actina è 25 x 105. Abbreviazioni; SSC = dispersione laterale, PI+ = ioduro di propidio positivo. (B) Strategia di gating rappresentativa per l'analisi di vitalità sia nel controllo fresco, scongelato, positivo (Triton-X) che negativo (non colorato). Clicca qui per scaricare questo file.
Discussione
La scoperta di farmaci cardiaci è ostacolata dalla dipendenza da modelli animali e cellulari non umani con un throughput e una fedeltà fisiologica inadeguati per eseguire con precisione le letture. La biologia hiPSC-CM accoppiata con strumentazione HT e sonde fisiologiche ha il potenziale per reintrodurre modelli umani nelle prime fasi della modellazione delle malattie cardiache e della scoperta di farmaci. Abbiamo sviluppato un metodo di generazione del tessuto cardiaco 3D che produce CS funzionali e di alta qualità per una piattaforma ottimale di modellazione delle malattie cardiache e screening farmacologico. Inoltre, la combinazione della tecnologia sferoidale nei sistemi di bioreattori 3D per la produzione industriale di EV consente un passo necessario verso la traduzione clinica della terapia basata su EV. Il metodo qui descritto si basa su diversi fattori cruciali ed è una variante dei protocolli esistenti 9,10,28,29. Questi metodi includono: 1) la generazione di costrutti tissutali 3D, 2) il numero di cellule ottimali e la tempistica prima dello screening, 3) migliorare la sensibilità e la capacità di alta produttività degli strumenti e 4) essere in grado di congelare gli sferoidi prima di qualsiasi analisi funzionale. A differenza dei protocolli descritti in precedenza, il protocollo proposto descrive la generazione di fino a 1.500 sferoidi al giorno e l'idoneità per HTS. L'analisi convenzionale di un centinaio di composti su 6 x 0,5 dosi logaritmiche per 10 repliche utilizzando i sistemi di imaging del calcio a 96 pozzetti esistenti o tessuti cardiaci ingegnerizzati multiplex a 24 pozzetti richiede circa 500-3 miliardi di hiPSC-CMs31,32. L'applicazione proposta rende gli screening cardiaci meno costosi ed efficaci in termini di tempo rispetto ai sistemi convenzionali poiché le piastre a 96 pozzetti richiedevano solo il 10% della densità di semina rispetto al metodo descritto. Inoltre, rispetto ai protocolli precedenti, come il metodo hanging-drop, la generazione di sferoidi mediante autoaggregazione in piastre di attacco ultra-basse consente l'imaging automatizzato di alta qualità di singoli microtessuti33.
Questo piccolo modello 3D imita il fenotipo biologico e fisiologico dell'ambiente cardiovascolare in vivo . Come precedentemente dimostrato, i transitori di calcio aumentano drasticamente nei costrutti di tessuto cardiaco 3D rispetto alle colture cellulari monostrato 2D34.
Successivamente, abbiamo scoperto che la densità di semina e il corretto tempo di coltura sono anche fattori critici per uno screening CS di successo. Le densità di 10K-20K hiPSC-CMs per sferoide e lo screening tra le settimane 2-3 dopo la generazione erano ottimali, mentre gli sferoidi troppo piccoli o troppo vecchi mostrano una manipolazione disturbata del calcio (Figura 2 e Figura 3). Pertanto, è importante mantenere le densità di semina il più coerenti possibile, poiché le dimensioni influenzano i parametri funzionali. Inoltre, sebbene questo metodo ottico fornisca buoni risultati per le colture 3D vive come un intero tessuto, ottenere dati all'interno di sferoidi più grandi a livello (sub-) cellulare è difficile senza fare affidamento su metodi istologici che richiedono tempo. Recentemente, sono stati pubblicati diversi approcci che utilizzano il "clearing ottico", che consente l'acquisizione di interi sferoidi 3D con l'opportunità di quantificare i marcatori a singola cellula. Qui, abbiamo adattato un protocollo di 3 giorni dalla raccolta CS all'analisi delle immagini, che è ottimizzato per l'imaging 3D utilizzando la microscopia confocale29 (Figura 1C e Figura 4D).
Infine, con l'aumento delle applicazioni di tessuto cardiaco 3D e delle applicazioni commerciali, la domanda di conservazione a lungo termine e biobanking specifico per il paziente da parte di vari donatori è in aumento. La crioconservazione è una strategia efficace per generare piastre HTS da più lotti nel tempo. Il congelamento di hiPSC-CMs è stato descritto in precedenza e non è diverso rispetto ad altri tipi di cellule in coltura 10,35,36. Recentemente, sono stati descritti approcci per il congelamento di piastre con celle2D 37. Qui, abbiamo scoperto che il kit di crioconservazione PSC è la condizione ottimale rispetto ad altri tre (dati non mostrati) e abbiamo utilizzato questo mezzo per il congelamento efficiente degli sferoidi. Dopo la crioconservazione, la vitalità rimane elevata (Figura 4B,C), ma le proprietà elettrofisiologiche dei CS sono influenzate ed è necessario un periodo di incubazione dopo lo scongelamento. Infatti, 1 settimana dopo lo scongelamento, i CS hanno mostrato attività di battitura spontanea e manipolazione del calcio. Tuttavia, è stato descritto che le hiPSC-CM fresche e recuperate non mostrano sempre proprietà molecolari e fisiologiche identiche38. Questa limitazione deve essere considerata quando le hiPSC-CM crioconservate vengono utilizzate per valutare le letture cardiache indotte da farmaci. Inoltre, sebbene si modula efficacemente il numero di cellule per sferoide e la tempistica ottimale dell'imaging transitorio del calcio, gli sferoidi cardiaci potrebbero essere migliorati mescolando cellule cardiomiocitarie derivate da hiPSC con cellule endoteliali, fibroblasti, giunzioni cellula-cellula e matrici extracellulari, come chitosano, collagene IV, fibronectina, matrigel o laminina, imitando l'ambiente cardiaco in vivo 39, 40. Nel complesso, proponiamo un protocollo passo-passo per generare in modo efficiente CS che sono adatti per applicazioni a valle come la modellazione delle malattie e lo screening dei farmaci HT.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo VALA sciences per il pacchetto software Cyteseer e l'ottimizzazione dell'analisi automatica 3D del calcio. Desideriamo riconoscere il sostegno della fondazione PLN (RM). P.A.D. e F.S. sono supportati da CUREPLaN Leducq. J.P.G.S. è supportato da H2020-EVICARE (#725229) del Consiglio Europeo della Ricerca (ERC). J.W.B. è supportato dalla UMC Utrecht Clinical Fellowship, dalla Netherlands Heart Institute Fellowship e dalla CVON-Dosis young talent grant; Netherlands Heart Foundation (CVON-Dosis 2014-40). N.C. è supportato dal programma di gravitazione "Materials Driven Regeneration" dell'Organizzazione olandese per la ricerca scientifica (RegmedXB #024.003.013) e dalle azioni Marie Skłodowska-Curie (accordo di sovvenzione RESCUE #801540). V.S.-P. è sostenuto dal Fondo Alliance (UMCU, UU, TU/e). A.v.M. è sostenuta dal progetto BRAVE (H2020, ID:874827), finanziato dall'UE,
Materiali
| Name | Company | Catalog Number | Comments |
| 24 wells suspenion plate | Corning | 3738 | |
| 96 wells Ultra-Low Attachment Multiple Well Plate | Corning | CLS3474-24EA | |
| Albumax | Thermo Fisher Scientific | 11020021 | |
| Anti-α-Actinin (Sarcomeric) antibody | Sigma-Aldrich | A7811 | Dilution: 1:200 |
| Anti-Cardiac Troponin T antibody (ab45932) | Abcam | ab45932 | Dilution: 1:200 |
| Ascorbic acid | Sigma-Aldrich | A8960 | |
| B-27 supplement | Thermo Fisher Scientific | 17504-044 | |
| Biotin | Sigma-Aldrich | B4639 | |
| Bovine serum albumin fraction V (BSA) | Roche | 10735086001 | |
| Cal-520, AM | Abcam | ab171868 | |
| Confocal microscope | Leica | DMi8 | |
| Confocal microscope software | Leica | Las X | |
| Conical tubes 15 mL | Greiner Bio-One | 5618-8271 | |
| Creatine monohydrate | Sigma-Aldrich | C3630 | |
| DAPI | Thermo Fisher Scientific | D3571 | Concentration: 1 µg/mL |
| DMEM no glucose | Thermo Fisher Scientific | 11966025 | |
| EDTA | Thermo Fisher Scientific | 15575020 | |
| Fructose | Sigma-Aldrich | 76050771.05 | |
| Glucose | Sigma-Aldrich | G7021 | |
| Glycerol | Boom | 76050771.05 | |
| Goat anti-mouse Alexa Fluor 488 | Invitrogen | A11029 | Dilution: 1:500 |
| Goat anti-rabbit Alexa Fluor 568 | Invitrogen | A11011 | Dilution: 1:500 |
| Horizontal shaker | IKA | 4003000 | |
| Human induced pluripotent stem cell lines | (Stanford Cardiovascular Institute (S-CVI) Biobank) | CVI-273 (control 1) | |
| Human induced pluripotent stem cell lines | Germany | 141 (control 2) 144 (control 3) | |
| Hydrochloric acid (HCl) | Ajax Firechem | 265.2.5L-PL | 10 M stock solution, corrosive |
| Isotype control, FITC mouse IgM κ isotype | BD | 556652 | |
| KnockOut Serum Replacement | Thermo Fisher Scientific | 10828 | Protect from light |
| L-carnitine | Sigma-Aldrich | C0283 | |
| Myocyte calcium and contractility system | Leica | Thunder, DMi8 | |
| Non essential amino acids (NEAA) | Thermo Fisher Scientific | 11140 | |
| Paraformaldehyde solution 4% in 1x PBS, pH 7.0–7.6 | Santa Cruz | SC281692 | Hazardous |
| PBS, pH 7.4 | Thermo Fisher Scientific | 10010023 | |
| Penicillin/streptomycin | Thermo Fisher Scientific | 15140 | |
| PES Membrane Vacuum Filter system | Corning | 431097 | |
| PI/RNase Staining Solution | Invitrogen | F10797 | Dilution: 1:1000 |
| Pluronic F-127 | Sigma-Aldrich | P2443 | |
| PSC Cryopreservation Kit | Thermo Fisher Scientific | A2644601 | |
| RevitaCell | Thermo Fisher Scientific | A2644501 | |
| RPMI 1640 medium | Thermo Fisher Scientific | 11875 | |
| Silicone Elastomer Kit | SYLGARD | 184 | |
| Sodium dodecyl sulfate solution (10%) | Sigma-Aldrich | 71736 | |
| Sodium L-Lactate | Sigma-Aldrich | 71718 | |
| Taurine | Sigma-Aldrich | T0625 | |
| Tris Fisher | Scientific | 11486631 | |
| Triton X-100 | Merck | X100-1L | Hazardous |
| Trypan blue solution, 0.4% | Thermo Fisher Scientific | 15250061 | |
| TrypLE Select Enzyme (10x) | Thermo Fisher Scientific | A1217701 | |
| Tween-20 | Sigma-Aldrich | P1379 | |
| Urea | Sigma-Aldrich | 51456 | |
| Vitamin B12 | Sigma-Aldrich | V6629 | |
| Y-27632 dihydrochloride (Rho-kinase inhibitor) | Tocris | 1254 | Protect from light |
Riferimenti
- Burridge, P. W., et al. Chemically defined and small molecule-based generation of human cardiomyocytes. Nature Methods. 11 (8), 855-860 (2014).
- Kattman, S. J., et al. Stage-specific optimization of activin/nodal and BMP signaling promotes cardiac differentiation of mouse and human pluripotent stem cell lines. Cell Stem Cell. 8 (2), 228-240 (2011).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences. 109 (27), 1848-1857 (2012).
- Paige, S. L., et al. Endogenous Wnt/beta-catenin signaling is required for cardiac differentiation in human embryonic stem cells. PLoS One. 5 (6), 11134 (2010).
- Gintant, G., et al. Use of human induced pluripotent stem cell-derived cardiomyocytes in preclinical cancer drug cardiotoxicity testing: A scientific statement from the American Heart Association. Circulation Research. 125 (10), 75-92 (2019).
- Ahmed, R. E., et al. A brief review of current maturation methods for human induced pluripotent stem cells-derived cardiomyocytes. Frontiers in Cell and Developmental Biology. 19 (8), 178 (2020).
- Liu, C., et al. Generating 3D human cardiac constructs from pluripotent stem cells. EBioMedicine. 76, 103813 (2022).
- Musunuru, K., et al. Induced pluripotent stem cells for cardiovascular disease modeling and precision medicine: A scientific statement from the American Heart Association. Circulation: Genomic and Precision Medicine. 11 (1), 000043 (2018).
- Buikema, J. W., et al. Wnt activation and reduced cell-cell contact synergistically induce massive expansion of functional human iPSC-derived cardiomyocytes. Cell Stem Cell. 27 (1), 50-63 (2020).
- Maas, R. G. C., et al. Massive expansion and cryopreservation of functional human induced pluripotent stem cell-derived cardiomyocytes. Cell STAR Protocols. 2 (1), 100334 (2021).
- Tremblay, C., et al. A new construction technique for tissue-engineered heart valves using the self-assembly method. Tissue Engineering Part C: Methods. 20 (11), 905-915 (2014).
- Lewis-Israeli, Y. R., et al. Self-assembling human heart organoids for the modeling of cardiac development and congenital heart disease. Nature Communications. 12 (1), 5142 (2021).
- Goldfracht, I., et al. Engineered heart tissue models from hiPSC-derived cardiomyocytes and cardiac ECM for disease modeling and drug testing applications. Acta Biomaterialia. 1 (92), 145-159 (2019).
- Fleischer, S., et al. Comprehensive human stem cell differentiation in a 2D and 3D mode to cardiomyocytes for long-term cultivation and multiparametric monitoring on a multimodal microelectrode array setup. Biosensors and Bioelectronics. 126, 624-631 (2019).
- Branco, M. A., et al. Transcriptomic analysis of 3D cardiac differentiation of human induced pluripotent stem cells reveals faster cardiomyocyte maturation compared to 2D culture. Science Reports. 9 (1), 9229 (2019).
- Ergir, E., et al. Generation and maturation of human iPSC-derived cardiac organoids in long term culture. bioRxiv. , (2022).
- Lemoine, M. D., et al. Human iPSC-derived cardiomyocytes cultured in 3D engineered heart tissue show physiological upstroke velocity and sodium current density. Scienctific Reports. 7 (1), 5464 (2017).
- Kofron, C. M., et al. A predictive in vitro risk assessment platform for pro-arrhythmic toxicity using human 3D cardiac microtissues. Science Reports. 11 (1), 10228 (2021).
- Giacomelli, E., et al. Human-iPSC-derived cardiac stromal cells enhance maturation in 3D cardiac microtissues and reveal non-cardiomyocyte contributions to heart disease. Cell Stem Cell. 26 (6), 862-879 (2020).
- Richards, D. J., et al. Human cardiac organoids for the modelling of myocardial infarction and drug cardiotoxicity. Nature Biomedical Engineering. 4 (4), 446-462 (2020).
- Tenreiro, M. F., et al. Next generation of heart regenerative therapies: progress and promise of cardiac tissue engineering. npj Regenerative Medicine. 6 (1), 30 (2021).
- Hansen, A., et al. Development of a drug screening platform based on engineered heart tissue. Circulation Research. 107 (1), 35-44 (2010).
- McDermott-Roe, C., et al. Investigation of a dilated cardiomyopathy-associated variant in BAG3 using genome-edited iPSC-derived cardiomyocytes. Journal of Clinical Investigation Insight. 4 (22), 128799 (2019).
- National Library of Medicine (U.S.). Safety and efficacy of induced pluripotent stem cell-derived engineered human myocardium as biological ventricular assist tissue in terminal heart failure. National Library of Medicine. , (2020).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Oh, J. G., et al. Generation of ventricular-like HiPSC-derived cardiomyocytes and high-quality cell preparations for calcium handling characterization. Journal of Visualized Experiments. 155, 60135 (2020).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions. Nature Protocols. 8 (1), 162-175 (2013).
- Feyen, D. A. M., et al. Metabolic maturation media improve physiological function of human iPSC-derived cardiomyocytes. Cell Reports. 32 (3), 107925 (2020).
- van Ineveld, R. L., et al. Single-cell resolution three-dimensional imaging of intact organoids. Journal of Visualized Experiments. (160), e60709 (2020).
- Guo, Y., Pu, W. T. Cardiomyocyte maturation: New phase in development. Circulation Research. 126 (8), 1086-1106 (2020).
- Ding, B., et al. Three-dimensional renal organoids from whole kidney cells: Generation, optimization, and potential application in nephrotoxicology in vitro. Cell Transplantation. 29, 963689719897066 (2020).
- Denning, C., et al. Cardiomyocytes from human pluripotent stem cells: From laboratory curiosity to industrial biomedical platform. Biochimica Biophysica Acta. 1863, 1728-1748 (2016).
- Amaral, R. L. F., et al. Comparative analysis of 3D bladder tumor spheroids obtained by forced floating and hanging drop methods for drug screening. Frontiers in Physiology. 8, 605 (2017).
- Daily, N. J., et al. Improving cardiac action potential measurements: 2D and 3D cell culture. Journal of Bioengineering and Biomedical Science. 5 (3), 168 (2015).
- Preininger, M. K., et al. Cryopreservation of human pluripotent stem cell-derived cardiomyocytes: Strategies, challenges, and future directions. Advances in Experimental Medicine and Biology. 951, 123-135 (2016).
- Kim, Y. Y., et al. Cryopreservation of human embryonic stem cells derived-cardiomyocytes induced by BMP2 in serum-free condition. Reproductive Science. 18 (3), 252-360 (2011).
- Daily, M. I., et al. Cryopreservation of primary cultures of mammalian somatic cells in 96-well plates benefits from control of ice nucleation. Cryobiology. 93, 62-69 (2020).
- Zhang, J. Z., et al. Effects of cryopreservation on human induced pluripotent stem cell-derived cardiomyocytes for assessing drug safety response profiles. Stem Cell Reports. 16 (1), 168-181 (2021).
- Yeh, H. -. Y., et al. The calcium-dependent regulation of spheroid formation and cardiomyogenic differentiation for MSCs on chitosan membranes. Biomaterials. 33 (35), 8943-8954 (2012).
- Scalise, M., et al. From spheroids to organoids: The next generation of model systems of human cardiac regeneration in a dish. International Journal of Molecular Sciences. 22 (24), 13180 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon