Method Article
Meccanismo dell'inibizione dell'apoptosi dei podociti da parte di Kemeng Fang nei ratti con nefropatia membranosa attraverso la via di segnalazione PI3K/AKT
In questo articolo
Riepilogo
Il presente protocollo descrive la creazione di un modello animale di nefropatia membranosa (MN) e come l'inibizione di Kemeng Fang riduca l'apoptosi dei podociti di ratto MN attivando la via di segnalazione PI3K/AKT.
Abstract
La nefropatia membranosa (MN) è un tipo patologico comune di sindrome nefrosica dell'adulto. Fino al 20% dei pazienti con MN sviluppa una malattia renale allo stadio terminale (ESRD). I podociti hanno un'importante funzione nel mantenimento della barriera di filtrazione glomerulare e svolgono un ruolo cruciale nell'insorgenza e nello sviluppo di proteinuria e MN. La via di segnalazione PI3K/AKT è coinvolta nell'intero processo di crescita, differenziazione e apoptosi dei podociti. Kemeng Fang (KMF) è una formula di medicina tradizionale cinese che è stata utilizzata per ritardare il danno renale. Tuttavia, il meccanismo terapeutico del KMF nel MN non è chiaro. Qui, il modello di ratto MN è stato stabilito mediante iniezioni ascellari, inguinali e della vena caudale di albumina sierica bovina cationizzata (C-BSA), e quindi sono stati somministrati inibitori KMF e PI3K (LY294002). I dati sulla funzionalità epatica, la funzionalità renale, i lipidi nel sangue, la patologia renale, la funzione dei podociti, il livello di espressione della via di segnalazione PI3K/AKT e la trascrittomica dei ratti hanno dimostrato che KMF ha un effetto protettivo sui podociti dei ratti MN attivando la via di segnalazione PI3K/AKT e può prevenire efficacemente la progressione di MN.
Introduzione
La nefropatia membranosa (MN) è un tipo patologico comune di sindrome nefrosica dell'adulto, con un tasso di incidenza annuale di circa 5-10 per 100.000 individui. Si manifesta per lo più tra i 30 e i 50 anni ed è rara nei bambini (circa il 5%). È significativamente più diffuso negli uomini che nelle donne (2:1). Inoltre, fino al 20% dei pazienti con MN sviluppa la malattia renale allo stadio terminale (ESRD). Inoltre, c'è una tendenza all'aumento in cui i pazienti con MN sviluppano ESRD anno dopo anno 1,2,3. La caratteristica patologica della MN è che l'immunoglobina G granulare (IgG) e il complesso di attacco della membrana del sistema del complemento (MAC) sono fortemente depositati nella membrana basale glomerulare (GBM) adiacente ai podociti. Questa deposizione porta all'ispessimento del GBM e alla rottura dell'integrità della barriera di filtrazione glomerulare, portando infine alla proteinuria4.
La terapia di supporto, gli immunosoppressori e gli anticorpi monoclonali mirati sono i metodi principali per il trattamento della MN. Sebbene questi interventi possano ridurre significativamente la proteinuria e ritardare la progressione del deterioramento renale, presentano anche molte carenze. Innanzitutto, la terapia di supporto è adatta solo per i pazienti a basso rischio5. In secondo luogo, gli immunosoppressori possono causare reazioni avverse, come necrosi della testa del femore, infezione secondaria e inibizione della funzione ematopoietica del midollo osseo6. In terzo luogo, è necessaria un'ampia ricerca di studi randomizzati controllati per fornire una medicina basata sull'evidenza per l'uso di anticorpi monoclonali come ofamizumab, otuzumab, daretozumab e isatuximab 7,8,9. Pertanto, la ricerca attiva di metodi di trattamento efficaci per la MN ha un grande significato nel ritardare l'insorgenza della ESRD e nel migliorare la qualità della vita dei pazienti con MN.
I podociti, noti anche come cellule epiteliali viscerali glomerulari, sono attaccati al lato esterno del GBM e l'endotelio capillare del GBM forma insieme la barriera di filtrazione del sangue glomerulare. Hanno funzioni importanti, come il mantenimento della barriera di filtrazione delle proteine glomerulari, la sintesi della normale membrana basale e il supporto strutturale per il plesso capillare glomerulare 10,11. La ricerca ha dimostrato che l'apoptosi dei podociti svolge un ruolo cruciale nell'insorgenza e nello sviluppo di proteinuria e MN, e la via di segnalazione PI3K/AKT è coinvolta nell'intero processo di crescita, differenziazione e apoptosi dei podociti 12,13,14.
Un numero crescente di studi ha dimostrato che la medicina cinese ha vantaggi significativi nel trattamento della MN, che può ridurre significativamente la creatinina ematica, la proteinuria e il danno renale ritardato15,16. KMF è un composto della medicina tradizionale cinese con ingredienti derivati da 13 piante: Codonopsis pilosula (Franch.) Nannf. (Dangshen, DS); Astragalus membranaceus (Fisch.) Elastico. (Huangqi, quartier generale); Coptis chinensis Francese. (Huanglian, HL); Perilla frutescens (L.) Britt. (Suye, SY); Rehmannia glutinosa (Gaertn.) DC. (Shudihuang, SDH); Ligusticum chuanxiong Hort. (Chuanxiong, CX); Euryale ferox Salisb. (Qianshi, QS); Sabia japonica Massima. (Qinfengteng, QFT); Rhus chinensis Mill. (Wubeizi, WBZ); Lobelia chinensis Our. (Banbianlian, BBL); Oldenlandia diffusa (Willd.) Roxb. (Baihuasheshecao, BHSSC; Tabella 1). La KFM ha molte funzioni, come tonificare il rene (miglioramento della funzione renale), migliorare il qi (rafforzare l'immunità), promuovere la diuresi e dragare i collaterali (promuovere la circolazione sanguigna). Tuttavia, il meccanismo terapeutico della KMF nel MN non è chiaro17,18.
Attualmente, ci sono molti modi per costruire modelli MN, tra cui il modello di nefrite di Heymann, il modello di nefrite C-BSA, il modello murino α3NC1, in cui il modello di nefrite di Heymann, la principale proteina patogena dell'antigene megalina non si trova nel MN umano, quindi è diverso dalla patogenesi del MN umano, modello murino α3NC1, solo il background genetico DBA / 1 del tasso di successo del modello murino è più alto, Il resto dei topi ha avuto meno successo nella modellazione, o addirittura non è stato in grado di essere modellato 19,20,21. Il modello di nefrite C-BSA è economico e semplice da utilizzare e la sua patogenesi è molto simile a quella del modello animale MN umano19. Il principio di base è che, poiché il GBM è caricato negativamente e il C-BSA è caricato positivamente, può facilmente attraversare il GBM per diventare un antigene piantato, che induce gli anticorpi circolanti ad accumularsi lì per formare un complesso immunitario in situ, costruendo così un modello MN22,23. Lo scopo di questo studio è stato quello di osservare l'effetto terapeutico della KMF sulla MN e il suo meccanismo molecolare mediante una combinazione di trascrittomica e biologia molecolare e di fornire una base scientifica affidabile per il trattamento della MN con KMF.
Protocollo
Questo studio è stato esaminato e approvato dal Comitato per la gestione e l'uso degli animali sperimentali del Centro provinciale per il controllo e la prevenzione delle malattie di Hubei (numero ID: 202220144). I ratti sono stati sottoposti a un ciclo luce/buio di 12 ore in condizioni non patogene di 23 ± 1 °C e 50%-60% di umidità atmosferica. Abbiamo acquistato 100 ratti maschi Sprague-Dawley di 8 settimane dal Centro provinciale per il controllo e la prevenzione delle malattie di Hubei (numero di licenza: SYXK [E] 2022-0065) e sono stati sottoposti a alimentazione adattativa in un ambiente specifico privo di agenti patogeni per 1 settimana con un normale mangime di mantenimento e bevendo acqua sterile.
1. Preparazione del farmaco
- Preparazione del KMF
- I medicinali cinesi utilizzati sono stati forniti dall'ospedale affiliato all'Università di Medicina Tradizionale Cinese di Changchun, la composizione e il dosaggio specifici sono riportati nella Tabella 1. Per la preparazione, utilizzare un totale di 147 g di medicinali a crudo: Codonopsis pilosula (20 g), Astragalus membranaceus (30 g), Coptis chinensis (3 g), Perilla frutescens (6 g), Rehmannia glutinosa (15 g), Ligusticum chuanxiong (15 g), Euryale ferox (15 g), Sabia japonica (10 g), Rhus chinensis (3 g), Lobelia chinensis (15 g), Oldenlandia diffusa (15 g). Mescolare e immergere in 1470 ml di acqua distillata per 30 minuti.
- Mettere la miscela di erbe in una pentola di ceramica e scaldare a 100 °C per 90 minuti per decotto. Filtrare attraverso due strati di garza medica e conservare a temperatura ambiente.
- Aggiungere nuovamente acqua distillata (1470 ml) alla miscela di erbe rimanente e ripetere ancora una volta l'operazione di decotto di cui sopra, come descritto al punto 1.1.2. Conservare il filtrato a temperatura ambiente.
- Miscelare i due filtrati di cui sopra ed essiccare in forno a 80 °C per 10 ore fino a quando la soluzione acquosa non è completamente evaporata e solo il soluto viene trattenuto sotto forma di polvere.
- Pesare la polvere e scioglierla in soluzione salina per ottenere una soluzione contenente 1,323 g, 2,646 g e 5,292 g di farmaco per 4 ml (le concentrazioni erano rispettivamente 0,331 g/mL, 0,662 g/mL e 1,323 g/mL), che è il dosaggio giornaliero del farmaco somministrato ai ratti.
- Preparazione del cloridrato di Benadryl
- Aggiungere la compressa di Benadryl cloridrato (90 g) in 100 mL di soluzione fisiologica e agitare bene per scioglierla completamente.
- Preparazione dell'inibitore PI3K LY294002
- Aggiungere 82,3 mg di polvere di LY294002 in 1,1 ml di DMSO e agitare bene per scioglierlo completamente. Successivamente, aggiungere 198,9 ml di soluzione fisiologica per diluirla e ottenere una concentrazione di 0,41 mg/ml.
- Preparazione dell'emulsionante C-BSA
- Aggiungere 67 mL di etilendiammina anidra a 500 mL di acqua bidistillata e mescolare. Aggiungere lentamente 350 ml di acido cloridrico 6 M e regolare il pH a 4,75. Mantenere la temperatura della soluzione finale a 25 °C.
- Sciogliere 5 g di albumina sierica bovina naturale in 25 mL di acqua bidistillata e mantenere la soluzione a una temperatura costante di 25 °C agitando costantemente. Aggiungere 1,8 g di cloridrato di carbodiimmide e 30 ml di tampone di acido acetico 4 M con pH 4,75 dopo 2 ore per ottenere la soluzione di C-BSA.
- Dializzare la soluzione ottenuta in acqua bidistillata a 4 °C per 72 h (con cambio dell'acqua ogni 3-5 h) utilizzando carta selenitica e liofilizzare per ottenere polvere liofilizzata di C-BSA, Conservare a -80 °C24.
- Aggiungere 100 mg di polvere essiccata di C-BSA in 50 ml di soluzione salina per formare una soluzione di C-BSA. Mescolare questo con un volume uguale di adiuvante di Freund incompleto per un'emulsione completa; la sua concentrazione è di 1 mg/mL.
- Preparazione della soluzione di C-BSA
- Aggiungere 640 mg di polvere secca di C-BSA in 100 ml di PBS e agitare bene per scioglierlo completamente; la sua concentrazione è di 6,4 mg/mL.
2. Istituzione del modello animale MN
NOTA: L'esperimento è stato diviso in otto gruppi: gruppo di controllo normale (CON), gruppo modello (MOD), gruppo benazepril cloridrato (BEN), gruppo KMF a basso dosaggio (KM-L), gruppo KMF a dose media (KM-M), gruppo KMF ad alto dosaggio (KM-H), gruppo inibitore PI3K (PI3K) e inibitore PI3K + gruppo KMF a dosaggio medio (PI3K + KM-M). Ad eccezione del gruppo di controllo normale, a tutti i gruppi è stato somministrato C-BSA per produrre il modello MN.
- Alla nona settimana eseguire la pre-immunizzazione: iniezioni sottocutanee multiple di emulsionante C-BSA nell'ascella e nell'inguine.
NOTA: La collottola (interscapolare) è un sito alternativo per la somministrazione sottocutanea dell'emulsionante C-BSA.- Afferrare la pelle posteriore dei ratti con la mano sinistra e girare l'addome verso l'alto con la pelle addominale tesa. Iniettare l'emulsionante C-BSA per via sottocutanea nelle ascelle e nell'inguine dei ratti utilizzando una siringa da 2,5 ml alla dose di 1 ml/400 g una volta a giorni alterni per 1 settimana.
- Immunizzazione formale: Iniezione nella vena caudale di una soluzione di C-BSA
- Alla decima settimana, togliete i ratti dalle loro gabbie e metteteli sul coperchio della barra metallica con la coda rivolta verso lo sperimentatore.
- Pulisci la coda del topo con un batuffolo di cotone imbevuto di alcol e pizzica entrambi i lati della coda del topo con il pollice e l'indice della mano sinistra per riempire la vena e mantenere la vena rivolta verso l'alto.
- Tenere una siringa da 1 ml nella mano destra in modo che l'ago sia a 30° rispetto alla vena caudale. Tenere la punta dell'ago smussata verso l'alto e l'ago parallelo al vaso subito dopo aver pizzicato delicatamente la pelle. Se c'è un ritorno di sangue dall'ago, iniettarlo nuovamente insieme a una dose di C-BSA di 2,5 ml/kg 3 volte a settimana per 4 settimane.
- Dopo il completamento dell'iniezione, utilizzare un batuffolo di cotone asciutto per premere il punto di iniezione per circa 1 minuto per fermare l'emorragia. Rimuovi i topi dall'immobilizzatore e rimettili nella gabbia.
3. Analisi del KMF
- Pesare 1 g di campione in una provetta da centrifuga da 2 mL, aggiungere 600 μl di MeOH (conservato a -20 °C contenente acido 2-ammino-3-(2-cloro-fenil)-propionico (4 ppm)) e agitare la miscela per 30 s.
- Aggiungere circa 100 mg di perle di vetro e mettere la miscela in un tritatutto per 90 s a 60 Hz.
- Eseguire l'ecografia a 40 kHz per 15 minuti a temperatura ambiente.
- Centrifugare per 10 minuti a 15.984 x g, 4 °C e filtrare il surnatante attraverso una membrana da 0,22 μm. Trasferire un flacone di rilevamento per il rilevamento LC-MS.
4. Trattamenti farmacologici
NOTA: Gli esseri umani adulti hanno bisogno di 147 g di KMF al giorno. Secondo la formula di conversione della dose sperimentale di ratto e farmaco umano, la dose sperimentale equivalente per ratto (g/kg) = dose umana (g)/peso corporeo (70 kg) x 6,3, la dose giornaliera del ratto era di circa 13,23 g/kg.
- Alla 14a settimana, usando la mano sinistra, afferrare la pelle sul dorso dei ratti, girare l'addome verso l'alto e stringere la pelle addominale. Tenere l'ago di una siringa da 10 ml nella mano destra e inserirlo in bocca da un lato, scivolando lungo il palato e la parete posteriore della faringe e più avanti fino allo stomaco utilizzando l'azione di deglutizione.
- Somministrare il farmaco lentamente usando l'indice della mano destra ed estrarre l'ago gastrico al termine della somministrazione. Il dosaggio del farmaco somministrato è di 10 ml/kg per una durata totale di 4 settimane.
- Per i gruppi CON e MOD, somministrare 10 mL/kg/die di soluzione salina mediante sonda gastrica.
- Per il gruppo BEN, somministrare 9 mg/kg/die di Benadryl cloridrato soluzione acquosa mediante sonda gastrica.
- Per il gruppo KM-L, somministrare 3,3075 g/kg/die di estratto acquoso di KMF mediante sonda gastrica. Per il gruppo KM-M, somministrare 6,615 g/kg/die di estratto acquoso di KMF mediante sonda gastrica. Per il gruppo KM-H, somministrare 13,23 g/kg/die di estratto acquoso di KMF mediante sonda gastrica.
- Per il gruppo PI3K, somministrare 2,1 mg/kg/die LY294002 mediante sonda gastrica.
- Per il gruppo PI3K+KM-M, somministrare 2,1 mg/kg/die LY294002 (5 ml/kg) + 6,615 g/kg/die di estratto acquoso KMF (5 mL/kg) mediante gavage.
5. Valutazione dell'efficacia del KMF
- Rilevazione degli indici biochimici del sangue e delle urine
- Dalla 14a settimana in poi, raccogliere l'urina ogni 2 settimane dopo l'inizio dell'esperimento. Metti un singolo ratto in una gabbia metabolica per 24 ore. Limitare la dieta e fornire libero accesso all'acqua potabile. Raccogliere l'urina utilizzando una provetta da centrifuga da 50 ml posizionata sotto la gabbia metabolica.
- Centrifugare l'urina a 15.984 x g per 10 minuti e utilizzare il surnatante per stimare il livello di proteine urinarie secondo le istruzioni del kit per il test delle proteine urinarie.
- Alla 18a settimana, sopprimere i ratti per inalazione di isoflurano al 5%. Usa un unguento veterinario sugli occhi per prevenire la secchezza. Confermare la morte utilizzando il metodo della lussazione cervicale. Afferra la pelle sul dorso dei ratti con la mano sinistra e taglia i baffi dei ratti con le forbici.
- Disinfettare la pelle intorno ai bulbi oculari con etanolo e rimuovere rapidamente i bulbi oculari utilizzando una pinza emostatica. Raccogliere il sangue caduto nella provetta da centrifuga e centrifugare per 10 minuti a 15.984 x g dopo essere rimasto a temperatura ambiente per 30 minuti. Raccogli il surnatante.
- Rileva l'alanina aminotransferasi (ALT), l'aspartato transaminasi (AST), l'albumina (ALB), i trigliceridi (TG), il colesterolo totale (TC), l'azoto ureico nel sangue (BUN), la creatinina sierica (Scr), la proteina totale (TP) e altri indici ematici utilizzando un analizzatore biochimico automatico.
- Separazione dei tessuti renali
- Dopo che il sangue è stato prelevato dai ratti, fissarli sulla placca chirurgica e tagliare lentamente il pelo e lo strato muscolare sulla linea mediana dell'addome, spingendo i tubi intestinali aperti per esporre l'aorta addominale e i reni25.
- Bloccare l'aorta addominale sopra il rene destro utilizzando pinze arterie chirurgiche. Collegare un ago per il cuoio capelluto a una siringa da 5 ml per perforare sotto il blocco e perfondere il tampone PBS per irrigare i reni fino a quando entrambi i reni diventano bianchi o pallidi.
- Rimuovere i reni e separare bruscamente il periostio. Dividere il rene destro in provette per il congelamento e conservare in frigorifero a -80 °C. Fissare il rene sinistro in una soluzione di paraformaldeide al 4%.
- Dopo 24 ore di fissazione, rimuovere il rene. Eseguire la disidratazione, la trasparenza e l'inclusione di paraffina. Dopo che il blocco di cera si è solidificato, affettare con un'affettatrice a uno spessore di 3 μm, pescare con un vetrino antideiscenza, cuocere le fette a 98 °C per 20 minuti e conservarle per26 minuti.
- Analisi istopatologica renale
- Sottoporre le sezioni a deceratura graduale dello xilene e disidratazione con etanolo anidro e risciacquare con acqua distillata. Sottoporre a xilene per 15 minuti, seguito da una soluzione di xilene fresco per 15 minuti. Passare all'etanolo anidro per 5 minuti, passare all'etanolo anidro fresco per 5 minuti, seguito da etanolo al 90% per 5 minuti, quindi etanolo all'80% per 5 minuti, quindi etanolo al 70% per 5 minuti e infine sciacquare con acqua distillata.
- Seguire le istruzioni per la colorazione con ematossilina-eosina (H&E), acido-Schiff periodico (PAS) e i kit di colorazione Masson per la colorazione del campione.
- Eseguire la disidratazione con etanolo anidro a gradiente e la ripulitura dello xilene.
- Mettere le fette in un'incubatrice a temperatura costante, impostare la temperatura a 90 °C e cuocere per 20 minuti. Dopo la cottura, rimuovere le fette e aggiungere la gomma neutra a goccia. Copriteli con un vetro di copertura.
- Osservare al microscopio ottico con un ingrandimento di 200x e raccogliere immagini.
- Analisi in immunofluorescenza (IF) dei tessuti renali
- Decerare le sezioni e disidratarle come descritto al punto 5.3.1. Collocare i campioni in una soluzione tampone EDTA 0,01 M per la fissazione ad alta pressione e calore elevato (125 °C a 103 KPa) per 15 minuti. Lasciare raffreddare il campione in modo naturale e lavare 3 volte per 3 minuti ciascuna in PBS.
- Porre le sezioni in una soluzione di perossido di idrogeno al 3% e incubare per 10 minuti. Lavare i campioni 3 volte per 5 minuti ciascuno in PBS. Quindi, posizionare le sezioni nel siero di capra al 10%, incubare per 30 minuti e lavare 3 volte per 3 minuti ciascuna in PBS.
- Aggiungere l'anticorpo primario IgG (1:100) e C3 (1:100) goccia per goccia e incubare in una scatola umida a 4 °C per una notte. Il rapporto di diluizione degli anticorpi primari è mostrato nella Tabella 2. Togliete le sezioni dal frigorifero e lavatele con TBST 3 volte per 3 minuti ciascuna.
- Aggiungere l'anticorpo secondario fluorescente (1:100) goccia a goccia, incubare a 37 °C per 1 ora e lavare con TBST 3 volte per 3 minuti ciascuno.
NOTA: Questo passaggio e tutti i passaggi successivi devono essere eseguiti al buio27,28. - Incubare con 4',6-diamidino-2-fenilindolo (DAPI) per 5 minuti a temperatura ambiente ed evitare la luce, lavare con soluzione fisiologica tamponata con tween 20 (TBST) 3 volte per 5 minuti ciascuno per rimuovere il DAPI in eccesso.
- Aggiungere il quencher per autofluorescenza in un cerchio, incubare per 5 minuti e risciacquare con acqua corrente per 10 minuti. Agitare per asciugare le sezioni e sigillare con sigillante estinguente antifluorescenza. Osservare al microscopio a fluorescenza a 200x e raccogliere immagini.
- Analisi immunoistochimica (IHC) del tessuto renale
- Decerare le sezioni e disidratarle come descritto al punto 5.3.1. Riparare ad alta pressione (125 °C · 103KPa) in soluzione tampone EDTA 0,01M per 15 minuti. Dopo il raffreddamento naturale, lavare con PBS 3 volte per 3 minuti ciascuno.
- Bloccare la perossidasi endogena e il metodo di sigillatura del siero come descritto al punto 5.4.2.
- Aggiungere l'anticorpo primario WT-1 (1:200) e la nefrrina (1:100) goccia per goccia e incubare in una scatola umida in frigorifero a 4 °C per una notte29.
- Togliere le sezioni dal frigorifero a 4 °C, lavare con PBS 3 volte per 5 minuti ciascuna. Aggiungere l'anticorpo secondario (1:200) goccia a goccia, incubare a 37 °C per 30 minuti e lavare con PBS 3 volte per 3 minuti ciascuno.
- Aggiungere gocce di soluzione cromogenica di diaminobenzidina (DAB) appena preparata e osservare al microscopio ottico a 200x. Il segnale positivo è giallo brunastro o marrone brunastro. Lavare immediatamente la soluzione colorante con acqua di rubinetto quando si osserva un cambiamento di colore nella sezione.
- Utilizzare l'ematossilina per colorare per 3 minuti, quindi aggiungere alcol di acido cloridrico all'1% per la differenziazione e risciacquare con acqua di rubinetto per 10 minuti.
- Disidratare le sezioni, trasparenti e sigillare, come descritto al punto 5.2.4. Osservare al microscopio ottico a 200x e raccogliere immagini.
- Analisi della colorazione terminale con deossinucleotidiltransferasi dUTP nick-end Labeling (TUNEL) del tessuto renale
- Utilizzare il passaggio 5.3.1 per deparaffinare e disidratare le sezioni. Disegnare dei cerchi intorno ai tessuti utilizzando una penna immunoistochimica e aggiungere 100 μL di soluzione di lavoro della proteinasi K goccia a goccia a ciascun campione. Incubare a 37 °C per 20 minuti, lavare con PBS 3 volte per 5 minuti ciascuno e conservare i campioni trattati in una scatola umida.
- Mettere le sezioni in una soluzione di perossido di idrogeno al 3%, incubare per 10 minuti e lavare con PBS 3x per 5 minuti ciascuna.
- Aggiungere il tampone di equilibrio (100 μL) goccia a goccia al cerchio per coprire il tessuto e incubare per 20 minuti a temperatura ambiente.
- Aggiungere 50 μL di soluzione di lavoro per la marcatura (soluzione di equilibrio: soluzione per marcatura fluorescente: enzima TDT = 35 μL:10 μL:5 μL) per goccia a ciascun campione, incubare in una scatola umida a 37 °C per 60 minuti, al riparo dalla luce, e lavare con PBS 3 volte per 5 minuti ciascuno.
- Aggiungere DAPI e incubare con DAPI per 5 minuti a temperatura ambiente alla luce, lavare con PBS 3 volte per 5 minuti ciascuno.
- Dopo che le sezioni sono state agitate a secco e sigillate con sigillante anti-fluorescenza, osservare al microscopio a fluorescenza a 200x e raccogliere le immagini.
- Preparazione del campione per l'analisi al microscopio elettronico del tessuto renale
- Fissare i tessuti renali con glutaraldeide al 2,5% a 4 °C per 2-4 ore e lavare 3 volte per 15 minuti ciascuno in PBS.
- Fissare in acido di osmio (1%) a temperatura ambiente al riparo dalla luce per 2 ore e lavare con PBS 3 volte per 15 min ciascuno.
- Eseguire la disidratazione con alcol e acetone in gradiente, utilizzando acetone e agente incorporante Immergere in gradienti 1:1, 1:2 e 1:31 rispettivamente per 2 ore, 4 ore e 8 ore. Successivamente, utilizzare un agente di inclusione puro e incorporare i campioni a 37 °C per una notte.
- Dopo 8 ore, porre la piastra incorporata in un forno a 60 °C per la polimerizzazione per 48 ore. Affettare il blocco di resina lavorato sopra in un'affettatrice ultrasottile, con uno spessore della fetta impostato a 60-80 nm; Usa una rete di rame per rimuovere le fette.
- Utilizzare una soluzione di perossido di idrogeno acetato al 2% e alcol per la colorazione per 8 minuti, seguita da un lavaggio 3 volte con etanolo al 70% e acqua ultrapura. Completare con lavaggio con etanolo al 2,6% e acqua ultrapura.
- Osservare e acquisire immagini con un microscopio elettronico a trasmissione.
- Analisi quantitativa del saggio di reazione a catena della polimerasi in tempo reale (qRT-PCR)
- Aggiungere 20 mg di tessuto renale congelato nella provetta da microcentrifuga e macinare accuratamente con un trituratore di tessuti ad alta velocità fino a quando non c'è più massa tissutale visibile.
- Raccogliere il surnatante dopo la centrifugazione a 15,984 x g per 10 min. Aggiungere 250 μl di cloroformio e capovolgere la provetta per 15 s; La soluzione viene miscelata accuratamente. Lasciare riposare a temperatura ambiente per 3 min, quindi centrifugare a 15,984 x g per 10 min a 4 °C.
- Raccogliere la fase acquosa superiore e trasferirla in una nuova provetta da centrifuga priva di RNasi. Aggiungere un volume uguale di etanolo al 70% (preparazione acquosa priva di RNasi), capovolgere e mescolare.
- Aggiungere la soluzione alla colonna adsorbente caricata nella provetta di raccolta per il lavaggio dell'RNA. Dopo il lavaggio Buffer RW, lasciare asciugare la colonna a temperatura ambiente per 5 minuti.
- Posizionare la colonna in una nuova provetta da centrifuga priva di RNasi, aggiungere 30-50 μL di acqua priva di RNasi al centro della colonna, lasciare riposare a temperatura ambiente per 1 minuto e quindi centrifugare a 15.984 x g per 1 minuto. Raccogliere la soluzione di RNA e conservarla a -80 °C.
- Estrarre la soluzione di RNA dal congelatore e pre-denaturarla a 90 °C per 10 minuti, seguita da 40 cicli di 95 °C per 15 s, 60 °C per 35 s e 72 °C per 25 s, e infine lisata nell'ordine di 95 °C per 15 s, 60 °C per 60 s, 95 °C per 15 s (Tabella supplementare 1).
- Utilizzando la β-actina come riferimento interno, calcolare l'espressione relativa di WT-1 e Nefrrina utilizzando il metodo 2¬-ΔΔCt basato sul valore Ct di ciascun campione (ΔΔCt = valore Ct del gene bersaglio - valore Ct del gene di riferimento interno)30. Informazioni dettagliate sugli inneschi sono riportate nella Tabella 3.
- Analisi Western blot (WB)
- Preparare il lisato secondo il rapporto tra inibitore della proteasi:inibitore della fosfatasi:RIPA= 1:1:100 e aggiungere 500 μL di lisato in una provetta da microcentrifuga.
- Aggiungere 100 mg di tessuto renale congelato alla provetta da microcentrifuga e macinare accuratamente con un trituratore di tessuti ad alta velocità fino a quando non c'è più massa tissutale visibile.
- Rimuovere la provetta da microcentrifuga, limare con ghiaccio per 30 minuti, quindi centrifugare a 15,984 x g per 10 minuti. Aspirare il surnatante e conservarlo a -80 °C.
- Rilevare la concentrazione proteica secondo le istruzioni del kit per il dosaggio della concentrazione proteica dell'acido bicinconninico (BCA) e aggiungere la soluzione di PBS goccia a goccia per garantire una concentrazione proteica costante in ciascun gruppo.
- Aggiungere 5 tamponi per il campionamento delle proteine alla provetta per microcentrifuga, incubare a 100 °C per 15 minuti per denaturarlo completamente e rimuoverlo dopo il raffreddamento.
- Separare le proteine mediante elettroforesi su gel SDS-PAGE al 12,5%, prima utilizzando 80 V, facendo in modo che tutti i campioni vengano pressati in una linea blu piatta, quindi regolando la tensione a 130 V, fino a quando il blu di bromofenolo non fuoriesce dal fondo della piastra in gel. Interrompere l'elettroforesi.
- Rimuovere il gel. Bagnare la carta da filtro con il tampone di trasferimento a membrana. Attivare la membrana in fluoruro di polivinilidene (PVDF) in metanolo per 30 secondi. Quindi, disponi tutto nel seguente ordine: rete di spugna/carta da filtro/gel/membrana PVDF/carta da filtro/carta da filtro/rete di spugna nella clip utilizzata per il trasferimento della membrana.
- Posizionare il gel nel polo negativo, la membrana in PVDF nel polo positivo e trasferire la membrana con una corrente di 200 MA per 90 min.
- Rimuovere la membrana in PVDF e lavare con TBST una volta per 5 minuti. Aggiungere la soluzione di chiusura a temperatura ambiente agitando per 90 min. Lavare con TBST 3 volte per 5 minuti ciascuno.
- Aggiungere gli anticorpi primari PI3K (1:1000), PIK3CA (1:1000), AKT (1:1000), P-AKT (1:1000), BAD (1:1000), P-BAD (1:1000), BCL-2 (1:1000), bax (1:4000) e c-caspasi3 (1:1000) e incubare in una scatola umida per una notte a 4 °C in frigorifero31,32.
- Togliere la membrana in PVDF dal frigorifero a 4 °C, lavare con TBST 3 volte per 5 minuti ciascuno. Aggiungere l'anticorpo secondario (1:10.000) goccia a goccia, incubare a 37 °C per 90 minuti e lavare con TBST 3 volte per 3 minuti ciascuno.
- Preparare la soluzione di sviluppo secondo il rapporto (A: B=1:1) e svilupparla sulla macchina secondo le istruzioni.
Risultati
Risultati dell'analisi dei componenti di KMF
Nei modi di ioni positivi e negativi analizzati da LC-MS/MS, sono stati identificati rispettivamente 147 e 120 composti (Figura 1A-B). Alcuni composti e il loro peso molecolare calcolato in MF, il valore m/z, il tempo di ritenzione e gli ioni genitori sono mostrati nella Tabella supplementare 2.
KMF ha migliorato i disturbi del metabolismo lipidico e il danno epatico e renale nei ratti MN
Utilizzando ratti SD e C-BSA, abbiamo stabilito un modello MN. Dopo 1 settimana di iniezioni di C-BSA nella vena caudale, i ratti MN hanno mostrato vari gradi di affaticamento mentale, diminuzione dell'appetito, crescita lenta, colore dei capelli opaco, pelo soffice, risposta ritardata e perdita di peso, con alcuni ratti che hanno sviluppato edema scrotale. Dopo 4 settimane di somministrazione, dosi diverse di KMF hanno ridotto significativamente i livelli di espressione delle proteine totali urinarie 24 h (24 h-UTP), Scr e BUN, migliorando la funzionalità renale (Figura 2A-C); riduzione dei livelli di espressione di ALT e AST e aumento dei livelli di espressione di TP e ALB, migliora la funzionalità epatica (Figura 2D-G); ha ridotto i livelli di espressione di TC e TG e ha migliorato la funzione di regolazione dei lipidi (Figura 2H-I). Questi risultati suggeriscono che la KMF ha un effetto protettivo sulla funzione renale; Tuttavia, il suo meccanismo d'azione specifico non è ancora chiaro.
KMF migliora il danno istopatologico del tessuto renale nei ratti MN
Per verificare se il KMF potesse migliorare il danno renale nei ratti MN, utilizzando H&E, PAS, Masson e IF ha rilevato un danno istopatologico del tessuto renale. La colorazione H&E e PAS ha mostrato ipertrofia glomerulare, lieve proliferazione delle cellule mesangiali, dilatazione tubulare renale e degenerazione vacuolare delle cellule epiteliali tubulari renali nel gruppo MOD (Figura 3A). La colorazione di Masson ha mostrato un aumento significativo dell'area di fibrosi renale nel gruppo MOD (Figura 3B-C). L'immunofluorescenza ha mostrato che l'intensità relativa della fluorescenza di IgG e C3 nel gruppo MOD era significativamente più alta di quella nel gruppo CON (Figura 3D-F). Dopo la somministrazione di inibitori KMF, BEN o PI3K + KM-M, il grado di ipertrofia glomerulare, così come il grado di proliferazione delle cellule legate, è stato ridotto, l'area di fibrosi renale è stata significativamente ridotta e l'intensità relativa della fluorescenza di IgG e C3 è stata significativamente inferiore. Questi risultati indicano che il KMF può alleviare il danno patologico renale nei ratti MN.
KMF allevia i danni ai podociti attivando la via di segnalazione PI3K/AKT
Il danno dei podociti chiave nel MN è stato osservato anche utilizzando i metodi qui descritti, vale a dire IHC, PCR, TUNEL e TEM. I risultati di IHC e PCR hanno mostrato che, rispetto al gruppo CON, il gruppo MOD ha avuto una significativa diminuzione dei livelli di espressione delle proteine marcatrici funzionali e specifiche dei podociti, WT-1 e Nefrina, indicando un danno ai podociti, mentre il trattamento KMF aumenta i livelli di espressione di WT-1, Nefrin e allevia il danno ai podociti (Figura 4A-E). I risultati della colorazione TUNEL hanno mostrato una grave apoptosi dei podociti nel gruppo MOD, mentre il trattamento KMF ha ridotto significativamente l'intensità della fluorescenza e ridotto l'incidenza di apoptosi (Figura 4F-G). I risultati della TEM hanno mostrato che la membrana basale del glomerulo nel gruppo MOD era significativamente ispessita in modo non uniforme e che i mitocondri dei podociti mostravano un grave rigonfiamento, una matrice rada e un bombardamento vuoto della matrice, con cristae ridotte o assenti. Dopo la somministrazione di KMF, l'ispessimento della membrana basale glomerulare è stato significativamente ridotto e la morfologia dei mitocondri podocitari è stata significativamente ripristinata (Figura 4H). Questi risultati indicano che il KMF può alleviare il danno ai podociti nei ratti MN.
Un'ulteriore rilevazione dell'espressione delle proteine26,27 correlate alla via di segnalazione PI3K/AKT da parte di WB ha rivelato che, rispetto al gruppo CON, il gruppo MOD ha mostrato un aumento significativo dei livelli di espressione di PI3K, PIK3CA, AKT, P-AKT, BAD, BAX e C-caspasi3, mentre i livelli di espressione di P-BAD e BCL-2 sono diminuiti significativamente. Mentre il trattamento con KMF riduce i livelli di espressione di PI3K, PIK3CA, AKT, P-AKT, BAD, BAX e C-caspasi3, aumenta i livelli di espressione di P-BAD e BCL-2 (Figura 4I-J). Questi risultati indicano inoltre che KMF può migliorare il danno ai podociti nei ratti MN attivando la via di segnalazione PI3K/AKT.
Esplorazione dei possibili meccanismi della terapia KMF per MN basata sulla trascrittomica
Per rivelare ulteriormente i bersagli e i potenziali meccanismi di KMF nel trattamento della MN, è stata condotta un'analisi trascrittomica basata su Tandem Mass Tag (TMT). I risultati hanno mostrato che c'erano 898 geni differenzialmente espressi (DEG) tra i gruppi CON e MOD, inclusi 372 geni sovraregolati e 526 geni sottoregolati (Figura 5A-B). Allo stesso modo, c'erano 360 DEG tra i gruppi KM-L e MOD, inclusi 202 geni sovraregolati e 158 sottoregolati (Figura 5C-D). Per identificare i geni e le vie di segnalazione che possono essere influenzati, è stata condotta l'analisi funzionale dell'arricchimento dell'arricchimento dell'Ontologia genica (GO) e dell'Enciclopedia di Kyoto dei geni e dei genomi (KEGG) (Figura 5E-H). I risultati hanno mostrato che i processi biologici del DEG si concentrano principalmente sui processi cellulari e sulla regolazione biologica, mentre le funzioni del DEG si concentrano principalmente sulle interazioni neuroattive ligando-recettore, come le vie di segnalazione CAMP, PPAR, PI3K-AKT e p53. Questi risultati suggeriscono che KMF può trattare la MN influenzando queste vie di segnalazione, con la via di segnalazione PI3K/AKT convalidata negli esperimenti. Infine, i primi 100 DEG sono stati selezionati in ordine di grado di valore per costruire la rete di interazione proteina-proteina (PPI) (Figura 5I-J).
Figura 1: Cromatogramma ionico di picco LC-MS/MS. (A) Modalità di ioni positivi. (B) Modalità ioni negativi. Clicca qui per visualizzare una versione più grande di questa figura.
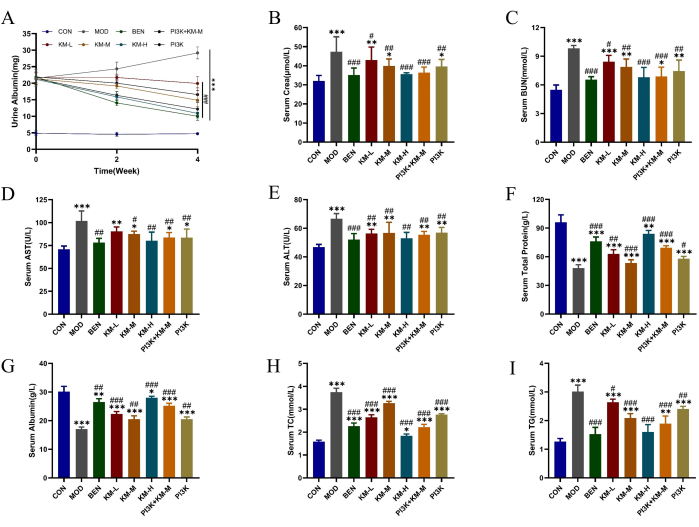
Figura 2: KMF migliora il disturbo del metabolismo lipidico e il danno epatico e renale nei ratti MN. (A-C) Gli effetti di Kemeng Fang sulla funzione renale, tra cui albumina nelle urine delle 24 ore, cera sierica e BUN sierico. (D-G) Gli effetti di Kemeng Fang sulla funzionalità epatica includono alanina aminotransferasi (ALT), aspartato transaminasi (AST), proteine totali e albumina sierica. (H-I) L'effetto di Kemeng Fang sulla regolazione del metabolismo dei lipidi nel sangue, inclusi i trigliceridi (TG) e il colesterolo totale (TC). I dati sono espressi come medie ± deviazioni standard di 3-6 campioni indipendenti, utilizzando l'ANOVA unidirezionale nel test T, rispetto al gruppo bianco, *p<0,05, **p<0,01, ***p<0,001 e rispetto al gruppo modello, #p < 0,05, ##p < 0,01, ###p < 0,001. Clicca qui per visualizzare una versione più grande di questa figura.
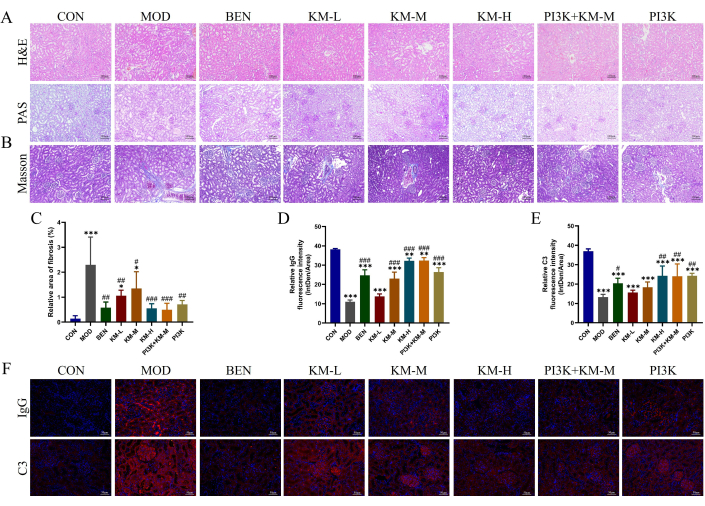
Figura 3: Kemeng Fang migliora il danno istopatologico ai reni dei ratti MN. (A) Esame istologico renale, inclusi H&E e PAS (200x). (B-C) Analisi semiquantitativa dell'area relativa della fibrosi renale (fibre di collagene blu) utilizzando la colorazione Masson e il software Image J. (D-F) Analisi semiquantitativa dell'intensità di fluorescenza relativa (Intden/Area; dove Intden è l'intensità di fluorescenza regionale totale, l'area è l'area regionale) di IgG e C3 nel tessuto renale utilizzando i software IF e Image J. Clicca qui per visualizzare una versione più grande di questa figura.
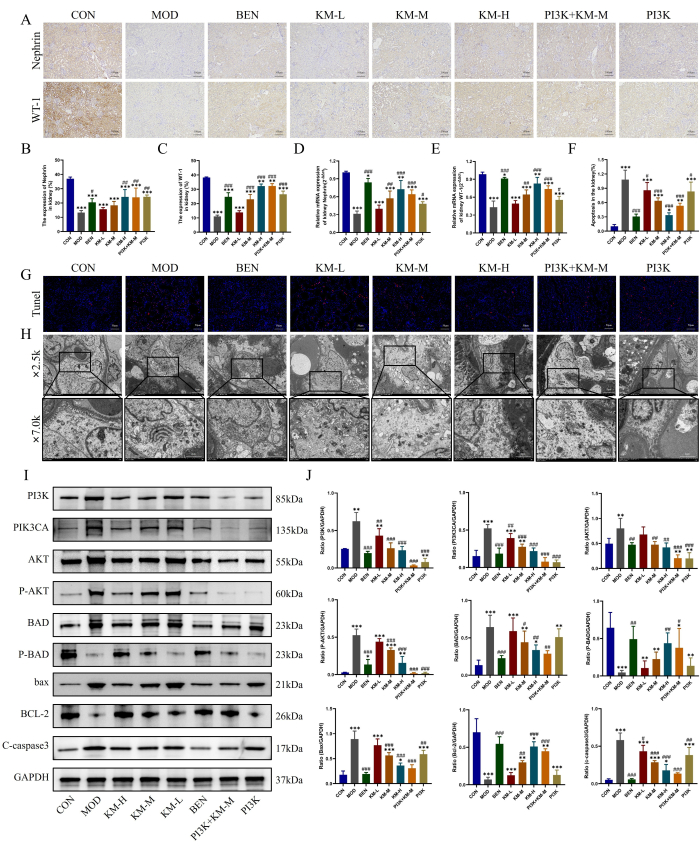
Figura 4: Kemeng Fang allevia il danno ai podociti attivando la via di segnalazione PI3K/AKT. (A-C) L'IHC è stato utilizzato per rilevare i livelli di espressione relativa di due proteine marcatrici dei podociti, WT-1 e Nefrina, nel tessuto renale. (D-E) Rilevamento con PCR dell'espressione relativa dell'mRNA di due proteine marcatrici dei podociti, WT-1 e Nephrin, nel tessuto renale. (F-G) La colorazione TUNEL è stata utilizzata per rilevare l'incidenza dell'apoptosi nel tessuto renale. (H) Osservazione della membrana basale glomerulare e della struttura mitocondriale dei podociti utilizzando TEM (2.500x, bar=5 μM; 7.000x, bar=2 μM). (I-J) Rilevamento WB dei livelli relativi di espressione proteica di PI3K, PIK3CA, AKT, P-AKT, BAD, P-BAD, BCL-2, bax e C-caspasi3 nel tessuto renale. Clicca qui per visualizzare una versione più grande di questa figura.
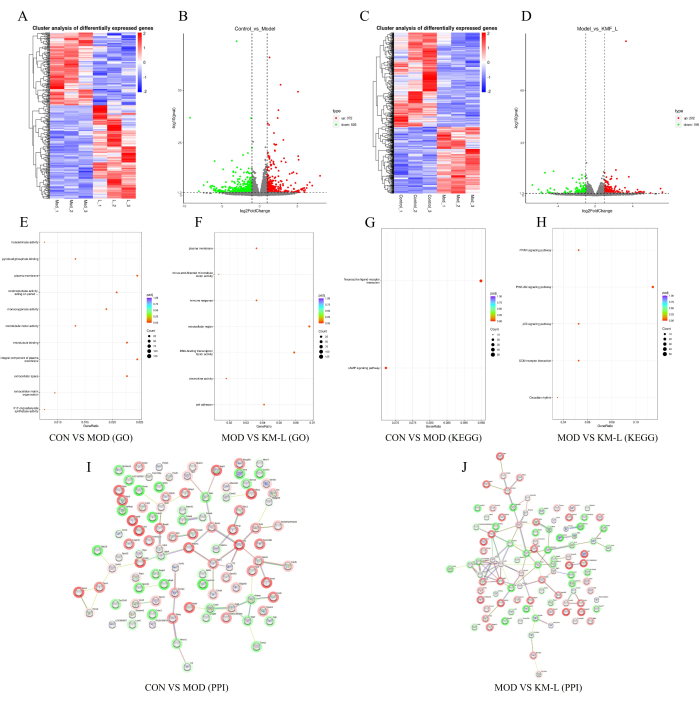
Figura 5: Esplorazione del possibile meccanismo di Kemeng Fang nel trattamento della MN sulla base della trascrittomica. (A-B) Mappe di calore geniche differenziali e grafici vulcanici tra i gruppi CON e MOD, con il blu che rappresenta la sottoregolazione e il rosso che rappresenta la sovraregolazione. (C-D) Mappe di calore geniche differenziali e grafici vulcanici tra i gruppi MOD e KM-L, con il blu che rappresenta la sottoregolazione e il rosso che rappresenta la sovraregolazione. (E) Arricchimento GO tra i gruppi CON e MOD. (F) Arricchimento GO tra i gruppi MOD e KM-L. (G) Arricchimento del KEGG tra i gruppi CON e MOD. (H) Arricchimento KEGG tra i gruppi MOD e KM-L. (I) Grafico dell'interazione proteina-proteina (PPI) dei primi 100 geni differenzialmente espressi tra i gruppi CON e MOD. (J) Grafico PPI dei primi 100 gradi di grado tra i gruppi MOD e KM-L. Clicca qui per visualizzare una versione più grande di questa figura.
| NO. | Nome cinese | Nome latino | Famiglia | Parte utilizzata | Dose(g) |
| 1 | Dangshen (DS) | Codonopsis pilosula (Franch.) Nannf. | Campanulaceae | Radice | 20 |
| 2 | Huangqi (Quartier Generale) | Astragalus membranaceus (Fisch.) Elastico. | Leguminose | Radice | 30 |
| 3 | Huanglian (HL) | Coptis chinensis Francese. | Ranunculaceae | Radice e tubero | 3 |
| 4 | Suye (SY) | Perilla frutescens (L.) Britt | Labiatae | foglia | 6 |
| 5 | Shudihuang (SDH) | Rehmannia glutinosa (Gaertn.) DC. | Scrophulariaceae | Radice e tubero | 15 |
| 6 | Chuanxiong (CX) | Ligusticum chuanxiong Hort. | Ombrellifere | Radice e tubero | 15 |
| 7 | Qianshi (QS) | Euryale ferox Salisb. | Nymphaeaceae | Seme | 15 |
| 8 | Qinfengteng (QFT) | Sabia japonica Massima. | Sabiaceae | Radice, tubero e foglia | 10 |
| 9 | Wubeizi (WBZ) | Rhus chinensis Mulino. | Anacardiaceae | foglia | 3 |
| 10 | Banese (BBL) | Lobelia chinensis Our. | Campanulaceae | Tubero e foglia | 15 |
| 11 | Baihuasheshecao (BHSSC) | Oldenlandia diffusa (Willd.) Roxb. | Rubiaceae | Tubero e foglia | 15 |
Tabella 1: Composizione di Kemeng Fang (KMF).
| Anticorpo | Multiplo di diluizione |
| IgG | 1:100 |
| C3 | 1:100 |
| WT-1 | 1:200 |
| Nefrin | 1:100 |
| PI3K | 1:1000 |
| PI3K3CA | 1:1000 |
| AKT | 1:1000 |
| P-AKT | 1:1000 |
| CATTIVO | 1:1000 |
| P-CATTIVO | 1:1000 |
| BCL-2 | 1:1000 |
| Bax | 1:4000 |
| C-caspasi3 | 1:1000 |
| GAPDH | 1:1000 |
Tabella 2: Multipli di diluizione degli anticorpi.
| Gene | Abbecedario | Sequenza (5'-3') | Prodotti per PCR | |
| Ratto GAPDH | Inoltrare | ACAGCAACAGGGTGGTGGAC | 253 punti base | |
| Inverso | TTTGAGGGTGCAGCGAACTT | |||
| Ratto WT-1 | Inoltrare | AATGGACAGAAGGGCAGAGCA | 209 punti base | |
| Inverso | TGGGTACGCACACATGAAAGG | |||
| Nefrin di ratto | Inoltrare | CGGAGAACAAGAACGTGACC | 177 barili | |
| Inverso | ATTGTCTTCTCTCCGCACCA | |||
Tabella 3: Informazioni dettagliate sui primer qRT-PCR.
Tabella supplementare 1: Reazione PCR. Clicca qui per scaricare questo file.
Tabella supplementare 2: Elenco quantitativo dell'identificazione dei metaboliti. ID: numero di serie del peso molecolare del primo ordine; Nome: Risultato dell'identificazione; Mz: rapporto massa/nucleo; Rt: tempo di ritenzione (S); Massa esatta: peso molecolare accurato; Ppm: L'errore tra il peso molecolare rilevato e il peso molecolare teorico, misurato in ppm; precursor_type: modalità di ionizzazione, [M+H]+ è la modalità di ioni positivi, [M-H]- è la modalità di ioni negativi; class: Tripla classificazione nel database HMDB; sub_class: Classificazione a quattro livelli nel database HMDB; KEGG: numero composto KEGG; KEGG_Pathway: Via di segnalazione KEGG; CAS: numero di registrazione del Chemical Abstracts Service; HMDB: numero del database HMDB; Biblioteca: Banca dati; Formula: Formula molecolare teorica; KEGG: numero composto KEGG; Biblioteca: Banca dati; livello: Livello di identificazione dei metaboliti; POS: modalità ioni positivi; neg: modalità ioni negativi; KMF_1/2/3: intensità ionica totale di tre esperimenti. Clicca qui per scaricare questo file.
Discussione
Questo studio mirava a osservare gli effetti farmacologici del KMF ed esplorare il suo meccanismo specifico di inibizione dell'apoptosi dei podociti di ratto MN. In primo luogo, ha dimostrato in vivo che KMF può alleviare l'apoptosi dei podociti e ritardare la progressione del MN attivando la via di segnalazione PI3K/AKT. In secondo luogo, i risultati trascrittomici hanno mostrato che KMF può esercitare i suoi effetti attraverso le vie di segnalazione PPAR, PI3K/AKT e p53, l'interazione con il recettore della ECM, ecc. Tra questi, la via di segnalazione PI3K/AKT è stata validata in esperimenti. Questi risultati possono fornire una base scientifica per l'uso clinico della KMF come potenziale opzione terapeutica per i pazienti con MN.
La ricerca ha dimostrato che l'apoptosi dei podociti è uno dei fattori chiave che portano alla graduale progressione della MN. Inoltre, la MN limita la capacità di divisione e proliferazione dei podociti; Di conseguenza, una volta danneggiata o persa, questa sequela compromette gravemente la funzione renale. Quando il numero di podociti diminuisce al punto da non poter coprire completamente il GBM, il GBM è completamente esposto e aderisce alla capsula di Bowman, causando la compressione o addirittura il collasso dell'ansa capillare glomerulare, promuovendo infine lo sviluppo di MN in ESRD 33,34,35,36. Pertanto, ulteriori ricerche sul meccanismo specifico dell'apoptosi dei podociti e sui metodi per bloccare o inibire l'apoptosi dei podociti sono fondamentali per ritardare la progressione della MN. La ricerca ha dimostrato che la via di segnalazione PI3K/AKT ha molteplici funzioni nella regolazione dell'apoptosi cellulare, dello stress ossidativo e della risposta infiammatoria e svolge un importante ruolo regolatorio nell'insorgenza e nello sviluppo della MN. WT-1 e Nephrin sono proteine della membrana dei pori espresse sui podociti, che non solo svolgono un ruolo importante nel mantenimento della normale struttura e funzione della membrana dei pori, ma avviano anche vie di segnalazione PI3K/AKT-dipendenti e partecipano alla segnalazione dei podociti. La diminuzione dei livelli di espressione di queste proteine spesso indica un danno ai podociti 37,38,39.
PI3K è un dimero composto da una subunità regolatrice, p85, e da una subunità catalitica, p110, che può essere attivata da vari fattori di crescita e complessi. È un fattore chiave e iniziatore in questo percorso40. Il gene PIK3CA si trova sul cromosoma 3 e ha un totale di 20 esoni. La sua funzione principale è quella di codificare una delle subunità catalitiche dell'enzima PI3K, la proteina p110 α; quindi, i cambiamenti in PIK3CA possono far sì che l'enzima PI3K rimanga in uno stato di attivazione prolungata41. Una volta attivato PI3K, il secondo messaggero, PIP3, genererà e stimolerà continuamente la via di segnalazione AKT a valle, mentre p-AKT promuove la fosforilazione della molecola pro-apoptotica, Bad, dissociando il complesso pro-apoptotico di Bad con Bcl-2 e Bcl-xL, e formando un complesso con la proteina 14-3-3 nel citoplasma, perdendo così la sua funzione pro-apoptotica. Le molecole anti-apoptotiche, BCL-2 e Bcl-xL, possono essere completamente dissociate ed esercitare un effetto inibitorio sull'apoptosi dei podociti42,43. La caspasi-3 è una proteasi che svolge un ruolo fondamentale nella fase di esecuzione dell'apoptosi cellulare, portando infine all'apoptosi cellulare scindendo l'enzima di riparazione del DNA PARP in piccoli frammenti44. L'induzione del rilascio del citocromo c dai mitocondri al citoplasma da parte della proteina pro-apoptotica Bad è un passaggio chiave nell'attivazione della caspasi, e il complesso del legame di P-Bad alla proteina 14-3-3 inibisce questo processo, prevenendo così l'insorgenza della cascata apoptotica 45,46,47.
I risultati trascrittomici indicano che il trattamento con KMF per MN è strettamente correlato alle vie di segnalazione PI3K/AKT, PPAR e p53. Convalidato il percorso di segnalazione PI3K/AKT attraverso l'analisi WB. I risultati sperimentali hanno mostrato che la via di segnalazione PI3K/AKT nei ratti MN era significativamente inibita, mentre KMF poteva attivare significativamente la via di segnalazione PI3K/AKT, riducendo la generazione delle molecole pro-apoptotiche Bad e Bax e promuovendo la generazione della molecola anti-apoptotica BCL-2, aumentando così i livelli di espressione delle proteine della membrana iatale dei podociti, WT-1 e Nefrina, e ridurre l'incidenza dell'apoptosi dei podociti. Pertanto, KMF riduce l'apoptosi dei podociti attivando la via di segnalazione PI3K/AKT ed è stato riscontrato che ha un effetto protettivo sui ratti modello MN.
Tuttavia, questo studio presenta alcune limitazioni. In primo luogo, questo studio ha esplorato solo il meccanismo di inibizione del KMF dell'apoptosi dei podociti a livello di esperimenti in vivo su animali, che deve essere verificato da esperimenti cellulari in vitro e da esplorazioni approfondite del meccanismo; in secondo luogo, il danno dei podociti è anche strettamente correlato all'autofagia, all'infiammazione immunitaria e alla piroptosi, ed è necessario esplorare ulteriormente se il KMF può influenzare il MN regolando l'autofagia, l'infiammazione immunitaria e la piroptosi48,49.
La famiglia PPAR (PPAR α, PPAR β/δ, PPAR γ) è un recettore ormonale nucleare che si basa sull'attivazione del ligando e ha importanti funzioni come la partecipazione al metabolismo energetico, la regolazione dell'apoptosi cellulare e la risposta infiammatoria50,51. Influenzano la trascrizione genica formando eterodimerizzazione con il recettore X dell'acido retinoico (RXR), dove PPAR γ regolano entrambi il fattore infiammatorio NF-κB. La chiave per l'attivazione di B risiede nella sua funzione di proteggere i podociti dai danni 52,53,54. Diversi studi hanno dimostrato che gli agonisti del γ PPAR (TZD, come il pioglitazone) hanno effetti protettivi renali indipendenti dagli effetti ipoglicemizzanti, proteggendo direttamente i podociti dai danni e riducendo la proteinuria e il danno glomerulare in vari modelli animali di malattia renale 55,56,57,58,59. Ci sono anche rapporti che indicano che la PPAR può ridurre l'apoptosi dei podociti inibendo l'attivazione della Caspasi-360. Le ultime ricerche indicano che un nuovo tipo di γ PPAR, il regolatore selettivo GQ-16, è più efficace della TZD nel ridurre la proteinuria e le complicanze correlate alla sindrome nefrosica, il che porta anche l'alba al trattamento della malattia renale61. KMF ha un effetto protettivo sull'apoptosi dei podociti di ratto MN attivando la via di segnalazione PI3K/AKT. Sulla base dell'importante ruolo della via di segnalazione PPAR nei reni, in futuro è necessaria un'ulteriore esplorazione approfondita della relazione tra KMF, PPAR e MN.
Divulgazioni
Tutti gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla Fondazione provinciale di scienze naturali di Jilin (n. YDZJ202301ZYTS145 e n. YDZJ202301ZYTS208).
Materiali
| Name | Company | Catalog Number | Comments |
| 2-Amino-3-(2-chloro-phenyl)-propionic acid | Aladdin | 103616-89-3 | |
| 30% H2O2 | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10011218 | |
| 812 embedding agent | SPI | 90529-77-4 | |
| Acetone | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10000418 | |
| Acetonitrile | Thermo | 75-05-8 | |
| Ammonia | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10002118 | |
| Ammonium formate | Sigma | 540-69-2 | |
| Analytical balance | Changzhou Lucky Electronic Equipment Co., Ltd | FA | |
| Anhydrous ethanol | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10009218 | |
| Anti fluorescence quenching and sealing agent | southernbiotech | 0100-01 | |
| Automatic biochemical analyzer | Rayto Life and Analytical Sciences | Chemray240 | |
| BCA Protein Assay Kit | Solarbio | PC0020 | |
| Benazepril hydrochloride tablets | Xinya Minhang | H20044840 | |
| Blender | Kylin-Bell | BE-2600 | |
| Brick and stone cutting blade | Daitome | Ultra45 | |
| BSA | ZSGB-BIO | ZLI-9027 | |
| Buffer RW | Beijing Baiao Leibo | WK191 | |
| Carbodiimide hydrochloride | Hubei Xinghengye Technology | 25952-53-8 | |
| Cell apoptosis detection kit | Elabscience | E-CK-A322 | |
| Chemiluminescence imaging system | Hangzhou Shenhua Technology Co., Ltd | SH-523 | |
| Chloroform | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10006818 | |
| Constant temperature drying oven | Thermo Fisher | Heto PowerDiy LL3000 | |
| Cover glass slide | Jiangsu Shitai Experimental Equipment Co., Ltd | 10212450C | |
| CY3 Conjugated AffiniPure Goat Anti-rabbit IgG (H+L) | BOSTER | BA1032 | |
| DAB reagent kit | Servicebio | G1212-200T | |
| DAPI | Blue Cloud Sky | C1002 | |
| Decolorization shaker | Wuhan Lingsi Biotechnology Co., Ltd | TSY-B | |
| Dehydration machine | Wuhan Junjie Electronics Co., Ltd | JJ-12J | |
| DL2000 DNA Marker | TIANGEN | MD114 | |
| DMSO | MCE | HY-Y0320 | |
| dNTP | TIANGEN | CD117 | |
| EBlot L1 Rapid Wet Rotation Instrument | Kingsray Biotechnology Co., Ltd | L00686C | |
| ECL substrate solution | affinity | KF8003 | |
| Electric constant temperature water bath pot | Fisaff Instrument (Hebei) Co., Ltd | DK-20000-IIIL | |
| Electrophoresis instrument power supply | Beijing Longfang Technology Co., Ltd | LF-600S | |
| Embedding machine | Wuhan Junjie Electronics Co., Ltd | JB-P5 | |
| Equilibrium buffer | Wuhan Lingsi Biotechnology Co., Ltd | E8090 | |
| Ethylenediamine | Ruichengkang Pharmaceutical Technology | 107-15-3 | |
| FA series multifunctional analytical electronic balance | Changzhou Lucky Electronic Equipment Game Company | FA1204 | |
| Filter membrane | Jinteng | Nylon6-0.22μm | |
| Formaldehyde solution | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10010018 | |
| Formic acid | TCI | 64-18-6 | |
| Freezing centrifuge | Xiangyi | H1850-R | |
| Frozen platform | Wuhan Junjie Electronics Co., Ltd | JB-L5 | |
| Glacial acetic acid | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10000218 | |
| Glass bead | Sigma | G8772-500G | |
| Glass slide | Nantong Meiweide Life Science Co., Ltd | PC2-301 | |
| glycine | Biofroxx | 30166428 | |
| Hematoxylin | Wuhan Lingsi Biotechnology Co., Ltd | G1140 | |
| High speed refrigerated centrifuge | Hunan Kecheng Instrument Equipment Co., Ltd | H1-16KR | |
| Horizontal agarose electrophoresis tank | Long Fang | LF-31DS | |
| Horizontal shaker | Jiangsu Haimen Qilin Bell Instrument Manufacturing Co., Ltd | TS-1 | |
| HRP Conjugated AffiniPure Goat Anti-rabbit IgG (H+L) | BOSTER | BA1054 | |
| hydrochloric acid | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10011028 | |
| Imaging system | Nikon | Nikon DS-U3 | |
| Incomplete Freund's adjuvant | MCE | ISA-51 | |
| Intelligent digital magnetic heating stirrer | Hangzhou Miou Instrument Co., Ltd | TP-350E+ | |
| Isoflurane | Sigma | 26675-46-7 | |
| Isopropanol | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 80109218 | |
| KCl | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10020318 | |
| KH2PO4 | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 1115GR500 | |
| Liquid chromatograph | Thermo | IQLAAAGABHFAPUMBJC | |
| marker(10-250KD) | Mei5bio | MF028-plus-01 | |
| marker(20-120KD) | GenScript | M00521 | |
| Mass spectrometer | Thermo | IQLAAEGAAPFALGMBDK | |
| Masson staining kit | BASO | BA4079B | |
| Methanol | Thermo | 67-56-1 | |
| microscope | Nikon | ECLIPSE Ci | |
| microwave oven | Galanz Microwave Oven Electrical Appliance Co., Ltd | P70D20TL-P4 | |
| Multi sample tissue grinder | Shanghai Jingxin Industrial Development Co., Ltd | Tissuelyser-24L | |
| Multiskan FC ELISA reader | Thermo scientific | 1410101 | |
| Na2HPO4.12H2O | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10017618 | |
| NaCl | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10000218 | |
| Neutral resin | Wuhan Lingsi Biotechnology Co., Ltd | G8590 | |
| Normal Goat Serum | Solarbio | SL038 | |
| Organizational spreading machine | Zhejiang Jinhua Kedi Instrument Equipment Co., Ltd | KD-P | |
| Osmic acid | Ted Pella Inc | 18450 | |
| oven | Shanghai Huitai Instrument Manufacturing Co., Ltd | DHG-9140A | |
| Palm centrifuge | Wuhan Lingsi Biotechnology Co., Ltd | D1008E | |
| Paraformaldehyde | Solarbio | P1110 | |
| PAS staining kit | BASO | BA4114B | |
| Pathological slicer | Shanghai Leica Instrument Co., Ltd | RM2016 | |
| PBS | Solarbio | P1020 | |
| PCR instrument | Hangzhou Miou Instrument Co., Ltd | PR-96 | |
| PH meter | Sedolis Scientific Instruments (Beijing) Co., Ltd | PB-10 | |
| PH meter | Sedolis Scientific Instruments (Beijing) Co., Ltd | 2018C132-11 | |
| PI3K inhibitor LY294002 | MCE | HY-10108 | |
| Pipette gun | Dragon | KE0003087/KA0056573 | |
| Protein phosphatase inhibitor complex | Meilunbio | MB12707-1 | |
| PVDF membrane (0.22 μm) | Solarbio | ISEQ00010 | |
| PVDF membrane (0.45 μm) | Solarbio | YA1701 | |
| Quick primary/secondary antibody diluent | Solarbio | A1811 | |
| Rabbit anti-AKT | Affinity | AF0836 | |
| Rabbit anti-BAD | Affinity | AF6471 | |
| Rabbit anti-C3 | Affinity | DF13224 | |
| Rabbit anti-GAPDH | Hangzhou Xianzhi | AB-P-R 001 | |
| Rabbit anti-IgG | CST | 3900S | |
| Rabbit anti-Nephrin | bioss | bs-10233R | |
| Rabbit anti-P-AKT | Affinity | AF0016 | |
| Rabbit anti-p-BAD | invitrogen | PA5-105023 | |
| Rabbit anti-PI3K | Affinity | AF6241 | |
| Rabbit anti-PIK3CA | Bioss | Bs-2067R | |
| Rabbit anti-WT-1 | Affinity | DF6331 | |
| Real-Time PCR System | ABI | QuantStudio 6 | |
| RIPA Lysis Buffer | Meilunbio | MA0151 | |
| SDS | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10019318 | |
| Slide and cover glass | Jiangsu Shitai Experimental Equipment Co., Ltd | 10212432C | |
| Super pure water instrument | Zhiang Instrument (Shanghai) Co., Ltd | Clever-S15 | |
| SYBR Green Master Mix | VAZYME | Q111-02 | |
| Taq Plus DNA Polymerase | TIANGEN | ET105-02 | |
| Tissue grinder | Beautiful Wall | MB-96 | |
| Transmission electron microscope | HITACHI | HT7800/HT7700 | |
| Tris-base | Biofroxx | 10019318 | |
| Trizol | Ambion | 15596-026 | |
| TUNEL Cell Apoptosis Detection Kit (FITC) | Beijing Baiao Leibo | SY0475 | |
| Tween 20 | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 30189328 | |
| Ultra micro UV visible spectrophotometer | Hangzhou Miou Instrument Co., Ltd | ND-100 | |
| Ultra thin slicer | Leica | Leica UC7 | |
| Ultrasonic cleaner | shumei | KQ- 800DE | |
| Upright optical microscope | Nikon | Nikon Eclipse CI | |
| Urinary Protein Test Kit | Nanjing Jiancheng Bioengineering Research Institute | C035-2 | |
| Vertical electrophoresis tank | Beijing 61 Instrument Factory | DYCZ-24DN | |
| Vortex mixer | Wuhan Lingsi Biotechnology Co., Ltd | MX-F | |
| Western Blocking Buffer | Solarbio | SW3010 | |
| xylene | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10023418 |
Riferimenti
- McQuarrie, E. P., Mackinnon, B., Stewart, G. A., Geddes, C. C., Registry, S. R. B. Membranous nephropathy remains the commonest primary cause of nephrotic syndrome in a northern European Caucasian population. Nephrol Dial Transplant. 25 (3), 1009-1011 (2010).
- Ronco, P. H., Debiec, H. Pathophysiological advances in membranous nephropathy: time for a shift in patient's care. Lancet. 385 (9981), 1983-1992 (2015).
- Xu, X., et al. Long-term exposure to air pollution and increased risk of membranous nephropathy in China. J Am Soc Nephrol. 27 (12), 3739-3746 (2016).
- Fogo, A. B., Lusco, M. A., Najafian, B., Alpers, C. E. AJKD atlas of renal pathology: Membranous nephropathy. Am J Kidney Dis. 66 (3), e15-e17 (2015).
- Li, X., Zhang, X. Comments on the 2021 Kidney Disease: Improving Global Outcomes (KDIGO) clinical practice guideline for anticoagulant therapy in patients with membranous nephropathy. Kidney Int. 101 (1), 186-187 (2022).
- Ruggenenti, P., Fervenza, F. C., Remuzzi, G. Treatment of membranous nephropathy: time for a paradigm shift. Nat Rev Nephrol. 13 (9), 563-579 (2017).
- Klomjit, N., Fervenza, F. C., Zand, L. Successful treatment of patients with refractory PLA2R-associated membranous nephropathy with Obinutuzumab: A report of 3 cases. Am J Kidney Dis. 76 (6), 883-888 (2020).
- Podestà, M. A., Ruggiero, B., Remuzzi, G., Ruggenenti, P. Ofatumumab for multirelapsing membranous nephropathy complicated by rituximab-induced serum-sickness. BMJ Case Rep. 13 (1), e232890-e232896 (2020).
- Stehlé, T., et al. Anti-CD38 therapy for PLA2R-positive membranous nephropathy resistant to conventional immunosuppression. Kidney Int. 101 (2), 416-418 (2022).
- Trimarchi, H., Coppo, R. Podocytopathy in the mesangial proliferative immunoglobulin A nephropathy: new insights into the mechanisms of damage and progression. Nephrol Dial Transplant. 34 (8), 1280-1285 (2019).
- Kopp, J. B., et al. Podocytopathies. Nat Rev Dis Primers. 6 (1), 68-72 (2020).
- Hoxha, E., Reinhard, L., Stahl, R. A. K. Membranous nephropathy: new pathogenic mechanisms and their clinical implications. Nat Rev Nephrol. 18 (7), 466-478 (2022).
- Chiou, T. T., et al. Rapamycin attenuates PLA2R activation-mediated podocyte apoptosis via the PI3K/AKT/mTOR pathway. Biomed Pharmacother. 144 (8), 112349-112356 (2021).
- Chen, J., et al. Danshen injection induces autophagy in podocytes to alleviate nephrotic syndrome via the PI3K/AKT/mTOR pathway. Phytomedicine. 107 (7), 154477-154489 (2022).
- Wang, Y., et al. Fangji Huangqi decoction ameliorates membranous nephropathy through the upregulation of BNIP3-mediated mitophagy. J Ethnopharmacol. 324 (13), 117734-117743 (2024).
- Wei, L., et al. Shenqi granule upregulates CD2AP and α-actinin4 and activates autophagy through regulation of mTOR/ULK1 pathway in MPC5 cells. J Ethnopharmacol. 303 (16), 115942-115954 (2023).
- Wang, P., et al. A review of the botany, phytochemistry, traditional uses, pharmacology, toxicology, and quality control of the Astragalus memeranaceus. Front Pharmacol. 14 (2), 1242318-1242325 (2023).
- Wang, Q., et al. Traditional Chinese medicine method of tonifying kidney for hypertension: Clinical evidence and molecular mechanisms. Front Cardiovasc Med. 20229 (16), 1038480-1038487 (2022).
- Tang, X., et al. Experimental models for elderly patients with membranous nephropathy: Application and advancements. Exp Gerontol. 185 (8), 112341-112353 (2024).
- Zhang, J. J., et al. Murine membranous nephropathy: immunization with α3(IV) collagen fragment induces subepithelial immune complexes and FcγR-independent nephrotic syndrome. J Immunol. 188 (7), 3268-3277 (2012).
- Hopfer, H., et al. The importance of cell-mediated immunity in the course and severity of autoimmune anti-glomerular basement membrane disease in mice. FASEB J. 17 (8), 860-868 (2003).
- Fleuren, G., Grond, J., Hoedemaeker, P. J. In situ formation of subepithelial glomerular immune complexes in passive serum sickness. Kidney Int. 17 (5), 631-637 (1980).
- Border, W. A., Ward, H. J., Kamil, E. S., Cohen, A. H. Induction of membranous nephropathy in rabbits by administration of an exogenous cationic antigen. J Clin Invest. 69 (2), 451-461 (1982).
- Border, W. A., Ward, H. J., Kamil, E. S., Cohen, A. H. Induction of membranous nephropathy in rabbits by administration of an exogenous cationic antigen. J Clin Invest. 69 (2), 451-461 (1982).
- Rubio-Navarro, A., et al. Phenotypic characterization of macrophages from rat kidney by flow cytometry. J Vis Exp. (116), e54599(2016).
- Hou, Y., et al. Longzhibu disease and its therapeutic effects by traditional Tibetan medicine: Ershi-wei Chenxiang pills. J Ethnopharmacol. 249, 112426(2020).
- Sethi, S., et al. Hematopoietic stem cell transplant-membranous nephropathy is associated with protocadherin FAT1. J Am Soc Nephrol. 33 (5), 1033-1044 (2022).
- Gong, Q., Lai, T., Liang, L., Jiang, Y., Liu, F. Targeted inhibition of CX3CL1 limits podocytes ferroptosis to ameliorate cisplatin-induced acute kidney injury. Mol Med. 29 (1), 140-148 (2023).
- Li, H., et al. IL-23 reshapes kidney resident cell metabolism and promotes local kidney inflammation. J Clin Invest. 131 (12), e142428-e142441 (2021).
- Wang, C., et al. Artificially cultivated Ophiocordyceps sinensis alleviates diabetic nephropathy and its podocyte injury via inhibiting P2X7R expression and NLRP3 inflammasome activation. J Diabetes Res. 356 (11), 1390418-1390431 (2018).
- Cheng, H., et al. PI3K/Akt signaling pathway and Hsp70 activate in hippocampus of rats with chronic manganese sulfate exposure. J Trace Elem Med Biol. 50 (12), 332-338 (2018).
- Ji, K., et al. The immunoreaction and antioxidant capacity of juvenile blunt snout bream (Megalobrama amblycephala) involves the PI3K/Akt/Nrf2 and NF-κB signal pathways in response to dietary methionine levels. Fish Shellfish Immunol. 105 (10), 126-134 (2020).
- Chiou, T. T., et al. Rapamycin attenuates PLA2R activation-mediated podocyte apoptosis via the PI3K/AKT/mTOR pathway. Biomed Pharmacother. 144 (3), 112349-112357 (2021).
- Lv, Q., Yang, F., Chen, K., Zhang, Y. Autophagy protects podocytes from sublytic complement induced injury. Exp Cell Res. 341 (2), 132-138 (2016).
- Mundel, P., Shankland, S. J. Podocyte biology and response to injury. J Am Soc Nephrol. 13 (12), 3005-3015 (2002).
- Sun, Z., Xu, Q., Ma, Y., Yang, S., Shi, J. Circ_0000524/miR-500a-5p/CXCL16 axis promotes podocyte apoptosis in membranous nephropathy. Eur J Clin Invest. 51 (3), e13414-e13422 (2021).
- Huber, T. B., et al. Nephrin and CD2AP associate with phosphoinositide 3-OH kinase and stimulate AKT-dependent signaling. Mol Cell Biol. 23 (14), 4917-4928 (2003).
- Ai, Z., et al. Deciphering the pharmacological mechanisms of Rostellularia procumbens (L) Nees. Extract alleviates adriamycin-induced nephropathy in vivo and in vitro. Phytomedicine. 113 (6), 154736-154742 (2023).
- Wang, X., et al. Nicorandil alleviates apoptosis in diabetic cardiomyopathy through PI3K/Akt pathway. J Cell Mol Med. 23 (8), 5349-5359 (2019).
- Fox, M., Mott, H. R., Owen, D. Class IA PI3K regulatory subunits: p110-independent roles and structures. Biochem Soc Trans. 48 (4), 1397-1417 (2020).
- Miricescu, D., et al. PI3K/AKT/mTOR signaling pathway in breast cancer: From molecular landscape to clinical aspects. Int J Mol Sci. 22 (1), 173-179 (2020).
- Feng, C., et al. Neuroprotective effect of Danhong injection on cerebral ischemia-reperfusion injury in rats by activation of the PI3K-Akt pathway. Front Pharmacol. 11 (4), 298-312 (2020).
- Zhou, Y., et al. 1,3-Dicaffeoylquinic acid targeting 14-3-3 tau suppresses human breast cancer cell proliferation and metastasis through IL6/JAK2/PI3K pathway. Biochem Pharmacol. 172 (12), 113752-113761 (2020).
- Li, J., et al. Tetrandrine inhibits colon carcinoma HT-29 cells growth via the Bcl-2/Caspase 3/PARP pathway and G1/S phase. Biosci Rep. 39 (5), (2019).
- Downward, J. How BAD phosphorylation is good for survival. Nat Cell Biol. 1 (2), E33-E35 (1999).
- Fan, J., et al. A model of ischemia and reperfusion increases JNK activity, inhibits the association of BAD and 14-3-3, and induces apoptosis of rabbit spinal neurocytes. Neurosci Lett. 473 (3), 196-201 (2010).
- Chipuk, J. E., Green, D. R. How do BCL-2 proteins induce mitochondrial outer membrane permeabilization. Trends Cell Biol. 18 (4), 157-164 (2008).
- Yin, L., Yu, L., He, J. C., Chen, A. Controversies in podocyte loss: Death or detachment. Front Cell Dev Biol. 9 (11), 771931-771942 (2021).
- Yang, C., et al. Research progress on multiple cell death pathways of podocytes in diabetic kidney disease. Mol Med. 29 (1), 135-143 (2023).
- Calvier, L., et al. PPARγ links BMP2 and TGFβ1 pathways in vascular smooth muscle cells, regulating cell proliferation and glucose metabolism. Cell Metab. 25 (5), 1118-1134 (2017).
- Dai, Z. W., Cai, K. D., Xu, L. C., Wang, L. L. Perilipin2 inhibits diabetic nephropathy-induced podocyte apoptosis by activating the PPARγ signaling pathway. Mol Cell Probes. 53 (3), 101584-101596 (2020).
- Kota, B. P., Huang, T. H., Roufogalis, B. D. An overview on biological mechanisms of PPARs. Pharmacol Res. 51 (2), 85-94 (2005).
- Wahli, W. Peroxisome proliferator-activated receptors (PPARs): from metabolic control to epidermal wound healing. Swiss Med Wkly. 132 (7-8), 83-91 (2002).
- Agrawal, S., He, J. C., Tharaux, P. L. Nuclear receptors in podocyte biology and glomerular disease. Nat Rev Nephrol. 17 (3), 185-204 (2021).
- Miglio, G., et al. Protective effects of peroxisome proliferator-activated receptor agonists on human podocytes: proposed mechanisms of action. Br J Pharmacol. 167 (3), 641-653 (2012).
- Miglio, G., et al. The subtypes of peroxisome proliferator-activated receptors expressed by human podocytes and their role in decreasing podocyte injury. Br J Pharmacol. 162 (1), 111-125 (2011).
- Agrawal, S., Guess, A. J., Benndorf, R., Smoyer, W. E. Comparison of direct action of thiazolidinediones and glucocorticoids on renal podocytes: protection from injury and molecular effects. Mol Pharmacol. 80 (3), 389-399 (2011).
- Sonneveld, R., et al. Sildenafil prevents podocyte injury via PPAR-γ-mediated TRPC6 inhibition. J Am Soc Nephrol. 28 (5), 1491-1505 (2017).
- Agrawal, S., et al. Pioglitazone enhances the beneficial effects of glucocorticoids in experimental nephrotic syndrome. Sci Rep. 6 (3), 24392-24404 (2016).
- Kanjanabuch, T., et al. PPAR-gamma agonist protects podocytes from injury. Kidney Int. 71 (12), 1232-1239 (2007).
- Bryant, C., et al. Selective modulator of nuclear receptor PPARγ with reduced adipogenic potential ameliorates experimental nephrotic syndrome. iScience. 25 (4), 104001(2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon