Legge dei gas perfetti
Panoramica
Fonte: Laboratorio del Dr. Andreas Züttel - Laboratori federali svizzeri per la scienza e la tecnologia dei materiali
La legge dei gas ideali descrive il comportamento dei gas più comuni in condizioni quasi ambientali e la tendenza di tutta la materia chimica nel limite diluito. È una relazione fondamentale tra tre variabili di sistema macroscopiche misurabili (pressione, temperatura e volume) e il numero di molecole di gas nel sistema, ed è quindi un collegamento essenziale tra l'universo microscopico e quello macroscopico.
La storia della legge del gas ideale risale alla metà del 17 ° secolo quando la relazione trala pressione e il volume dell'aria è risultata inversamente proporzionale, un'espressione confermata da Robert Boyle e che ora chiamiamo legge di Boyle (Equazione 1).
P  V-1 (Equazione 1)
V-1 (Equazione 1)
Il lavoro inedito di Jacques Charles nel 1780, che fu esteso a numerosi gas e vapori da Joseph Louis Gay-Lussac e riportato nel 1802, stabilì la relazione direttamente proporzionale tra la temperatura assoluta e il volume di un gas. Questa relazione è chiamata legge di Charles (Equazione 2).
V  T (Equazione 2)
T (Equazione 2)
Guillaume Amontons è in genere accreditato di aver scoperto per la prima volta la relazione tra la temperatura e la pressione dell'aria all'interno di un volume fisso all'inizio del 18° secolo. Questa legge fu estesa anche a numerosi altri gas da Joseph Louis Gay-Lussac all'inizio del 19° secolo ed è quindi indicata come legge di Amontons o legge di Gay-Lussac, dichiarata come mostrato nell'equazione 3.
P  T (Equazione 3)
T (Equazione 3)
Insieme, queste tre relazioni possono essere combinate per dare la relazione nell'equazione 4.
V  T (Equazione 4)
T (Equazione 4)
Infine, nel 1811, fu proposto da Amedeo Avogadro che due gas qualsiasi, tenuti nello stesso volume e alla stessa temperatura e pressione, contenevano lo stesso numero di molecole. Ciò ha portato alla conclusione che tutti i gas possono essere descritti da una costante comune, la costante di gas ideale R, che è indipendente dalla natura del gas. Questa è nota come legge del gas ideale (Equazione 5). 1,2
Fotovoltaico  T (Equazione 5)
T (Equazione 5)
Procedura
1. Misurazione del volume del campione
- Pulire accuratamente il campione e asciugarlo.
- Riempire un cilindro graduato ad alta risoluzione con acqua distillata sufficiente per coprire il campione. Prendere nota del volume iniziale
- Lascia cadere il campione nell'acqua e nota il cambiamento di volume. Questo è il volume del campione, V.
- Rimuovere il campione e asciugarlo. Nota: in alternativa, misurare la lunghezza o le lunghezze laterali del campione e calcolarne il volume utilizzando
Risultati
La legge del gas ideale è una valida descrizione delle effettive proprietà del gas di numerosi gas comuni in condizioni vicine all'ambiente(figura 1 inset) ed è quindi utile nel contesto di molte applicazioni. I limiti della legge del gas ideale nel descrivere i sistemi in condizioni di alte pressioni o basse temperature possono essere spiegati dalla crescente importanza delle interazioni molecolari e/o dalla dimensione finita delle molecole di gas che contribuiscono alle proprietà del sistema. Perta...
Applicazione e Riepilogo
La legge del gas ideale è un'equazione così fondamentale delle scienze chimiche che ha una pletora di usi sia nelle attività quotidiane di laboratorio che nei calcoli e nella modellazione di sistemi anche altamente complessi, almeno alla prima approssimazione. La sua applicabilità è limitata solo dalle approssimazioni inerenti alla legge stessa; a pressioni e temperature vicine all'ambiente, dove la legge del gas ideale è ben valida per molti gas comuni, è ampiamente utilizzata nell'interpretazione di sistemi e pr...
Riferimenti
- Zumdahl, S.S., Chemical Principles. Houghton Mifflin, New York, NY. (2002).
- Kotz, J., Treichel, P., Townsend, J. Chemistry and Chemical Reactivity. 8th ed. Brooks/Cole, Belmont, CA (2012).
- Rouquerol, F., Rouquerol, J., Sing, K.S.W., Llewellyn, P., Maurin, G. Adsorption by Powders and Porous Solids: Principles, Methodology and Applications.Academic Press, San Diego, CA. (2014).
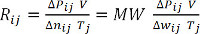 (Equazione 9)
(Equazione 9)