このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
高齢者の細胞の伸長によって酵母年表寿命の定量化
要約
酵母の老化時系列は定常期での時間に関連付けられている細胞の生存率の損失を指します。ここでは、定量的に酵母系列寿命を決定するためのハイスループット法を説明します。
要約
出芽酵母
プロトコル
パート1:高齢化の文化の調製
- YEPD寒天プレート上に凍結ストック(1%酵母エキス、2%バクトペプトン、2%寒天、2%グルコース)から興味のストリーク株。
- 30˚Cで48時間、または、単一のコロニーが現れるまで、細胞をインキュベートする。
- 試験管のYEPD液体培地(1%酵母エキス、2%バクトペプトン、2%グルコース)5mlに、単一のコロニーと接種を選んでください。
- シェーカーやローラードラムのどちらかを使用して一定の撹拌を維持しながら30˚Cでの培養は一晩成長する。
- 一晩培養液50μLと合成完全(SC)培地(表1)5 mLを接種する。一般的に3つのSCの培養物は検査対象の各菌株については寿命の解析の三乗の生物学的な複製を提供するために、各菌株準備されている。
- 30℃の培養実験全体(一般的に2週間以上)のためのローラードラム上˚Cで一定の攪拌を維持する。
パート2:実行可能性、年齢の点を取る
SCメディアの文化の2日後、細胞は静止期にある必要がありますし、最初の年齢の点は取られる準備ができています。それ以降の年齢の点は、最低2週間は、2〜3日ごとに注意が必要です。各年齢の点のための:
- YEPD 145μLを各ウェルに充填して接種するためのBioscreen 100 -よくハニカムプレートを準備します。のみYEPDとデータ解析のための無細胞以降でうまく満たさ少なくとも一つを残しておくことを忘れないでください。
- インキュベーターから老化の文化を取り外します。
- 簡潔に渦文化のいずれかをこぼさないように注意しながら、ハニカムプレートに接種される最初の文化。
- 混合培養の5μLを削除し、ハニカムプレートの最初のウェルに、それをピペット。前と5μLアリコートを除去した後、各試験管の口炎。
- それぞれの文化に対応するウェルの位置をメモしておいているそれぞれの老化の文化について、この手順を繰り返します。同一のよく位置は、実験全体を通して、年齢ポイントごとに、後続のために使用する必要があります。
- 接種が終了するときに30˚Cのインキュベーターに文化を交換してください。
パート3:Bioscreen C MBRのマシンをロード
- 蓋を持ち上げて、インキュベーターのコンパートメントを公開し、サンプルトレイにカバーを取り外します。
- サンプルトレイ(一つだけプレートを読んでいる場合、左側のスロットを使用)に新たに接種したハニカムプレートを挿入します。
- サンプルトレイにカバーを元に戻して、インキュベーターのコンパートメントに蓋を下げます。
- 熱伝達流体が最小充填レベルを超えていることを確認してください。低い場合は、付属の熱伝達流体で1000μLピペットを使用して、よりを追加します。
- Bioscreenソフトウェア"EZExperiment"を使用して、 サッカロマイセスセレビシエに適した成長曲線を得るために次のパラメータを設定します。
- サンプル数:メディアまたは200と井戸の数を入力してください
- フィルター:420 - 580nm、広帯域
- 温度:30˚C
- 実験の長さ:1日、0時間、0秒
- 測定間隔:30分
- シェイキング:、連続揺れで、ハイ
- 朗読を開始する"スタート"をクリックします。
パート4:データ解析
一般的に六歳のポイントは、2週間のコースで行われます。年齢の点は日2、4、6、9、11、13で撮影されています。実験的な設計とテストされている菌株に応じて、それは年齢の点、多かれ少なかれ、頻繁にまたは2週間よりも長くかかることが望ましい場合があります。これはデータ分析がより簡単になりますように、各高齢化の文化は、あらゆる年齢の点で同じウェルの位置に対応することをすべての年齢の点などで同じ順序でハニカムプレートをロードすることが重要です。
- Bioscreen C MBRのマシンからの出力ファイルを取得します。ソフトウェア"EZExperimentは"Microsoft Excelなどのほか、他のソフトウェアと互換性のあるタブ区切りファイルとしてBioscreenデータを出力します。最初の列のショーは何時にODの測定は、Bioscreenハニカムプレート(図1)で各ウェルを表す以降の列で、実験中に撮影された。
- すべての列の最初のODの測定値を削除します。この読み方は"ノイズ"です。
- 各列のすべてのOD値から一人でYEPDと同様のOD値を減算することにより、データを正規化する。これは、メディアによるバックグラウンドの吸光度を削除します。
- 伸長曲線をプロットします。曲線は、年齢の関数(図2)としてシフトします。例えば、6つの時間ポイントを介してカラム1(ハニカムプレートの1ウェル)から伸長曲線をプロットすることによって、時間の経過曲線の明確な右シフトがあります。
- 各ウェルに2日目、年齢ポイントの増殖速度に基づいてのために倍の時間を(δ)を計算します。倍加時間iを計算するために使用される式S:

外径1とOD 2は連続するOD測定とT 1とT 2の測定値間の時間であることを表す場所。わずか0.2〜0.5のOD値の間の時間を倍に計算する。これらの値の平均は、そのウェルの倍加時間です。わずか0.2〜0.5のOD値の間の時間を倍に計算する。これらの値の平均は、そのウェルの倍加時間です。ほとんどの野生型酵母株は、85〜90分との間の倍加時間の値を与える必要があります。 - 各年齢の点について、最初の年齢ポイント(2日目)からの相対伸長曲線の時間シフト(Δtを)計算する。これを行う簡単な方法は、年齢ポイントの初期と年齢ポイントごとに、その後の間に0.3のODを達成するために各ウェルにかかった時間の長さの違いを決定することです。特定のは、よく0.3のODに達する時間は、OD = 0.3二つの時のポイントブラケットとの間の時間の関数としてLN(OD)に対応する線形回帰式から算出することができる。
- 生存曲線(図3)を生成するために、各年齢の時点で生存率を計算する。 100%の生存率であることが最初の年齢ポイント(2日目)を定義します。年齢ポイントごとに連続するための式を用いて生存率を計算します。
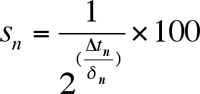
S Nが生存率である、Δtのnはタイムシフト、およびδ は n倍の時間です。 - 年齢の関数として、生細胞の割合を(またはパーセント)をプロットすることにより生存曲線(図3B)などの各ウェル(またはレプリケート井戸)の所望の生成。
- 各ウェルの生存に不可欠(SI)を計算する。 SIは、生存曲線下の面積として定義されており、式で見積もることができます。

ここで、年齢nは、年齢の点(例えば2、4、6、9、11、13)であり、S nは、その年齢時点での生存率の値です。 - SIと生存データから複製井戸の統計的パラメータを決定する。興味のある一般的な統計的なパラメータは、平均値、中央値、および複製する生物学の各セットのための分散が含まれています。 t検定または類似の分析は、異なる実験群と対照群のSIの一対比較のために使用することができます。それはまた、生物学的に複製平均から4.8に記載されて生存曲線を生成することが望ましい場合があります。
パート5:代表的な結果
実験終了時には、いくつかの異なる系統や条件の経時的老化の可能性を判断するために十分な生存曲線と実行データの分析をプロットしているでしょう。適切に実行する場合、Bioscreen C MBRのマシンから得られた成長曲線は、図2に示すもののようになっているはずですし、結果の生存曲線は、図3に示すもののようになります。一般的に、ここに記載の条件下で培養した野生型細胞は7日のオーダーの中央値系列の寿命を持つことになります。生存率の大幅な変動が異なる株で、そのような0.05%グルコース培地での成長などのいくつかの条件の下で観察され、生存期間の中央値は30日を超えることができます。

図1。Bioscreenプログラム"EZExperiment"からのデータ出力。カラム吸光度の読み取りが行われた時刻が表示されます。連続した列には、老化の培養から採取した細胞を接種したハニカムプレートのウェルを表しています。
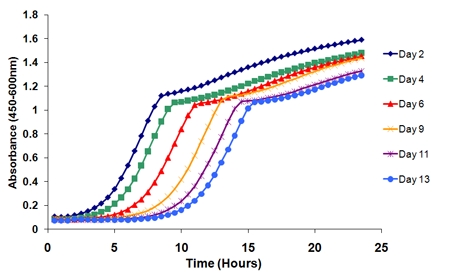
図2実験の過程で、単一の生物学的複製から伸長曲線。老化培養中の細胞が生存能力を失うように時間をかけての曲線に明瞭な変化があります。最初の時点(2日)と連続する時点間の時間の長さは、その特定の年齢で生存性を決定します。
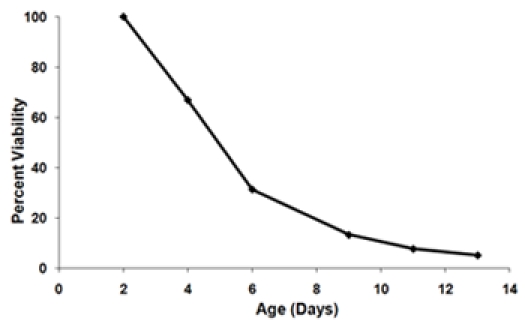
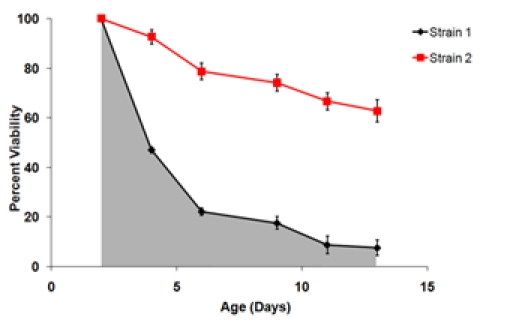
図3。 A)生存曲線は、図1から伸長データを使用して生成。 2日目時点を100%の生存率のポイントとして設定されています。B)2つの株の最終的な生存曲線は、同じ実験でテストした。これらの生存曲線は、3つの生物の平均生存率は、それぞれの菌株に対して複製表しています。エラーバーは、生物が複製内の標準偏差を表しています。生存曲線の下の斜線の領域は、歪1の生存に不可欠(SI)を表します。
| 表1。経時的老化研究のために使用される合成定義ミディアム(株backgrouND BY4743) | |
| コンポーネント | 濃度(g / L) |
| D -グルコース | 20 |
| 酵母窒素塩基(-AA/AS) | 1.7 |
| (NH 4)2 SO 4 | 5.0 |
| アデニン | 0.04 |
| L -アルギニン | 0.02 |
| L -アスパラギン酸 | 0.1 |
| L -グルタミン酸 | 0.1 |
| L -ヒスチジン | 0.1 |
| L -ロイシン | 0.3 |
| L -リジン | 0.03 |
| L -メチオニン | 0.02 |
| L -フェニルアラニン | 0.05 |
| L -セリン | 0.375 |
| L -スレオニン | 0.2 |
| L -トリプトファン | 0.04 |
| L -チロシン | 0.03 |
| L -バリン | 0.15 |
| ウラシル | 0.1 |
注:このレシピは、二倍体BY4743株にauxotrophiesを占める。アミノ酸auxotrophiesは、合成完全培地に5倍の最終濃度を追加することにより補償されるべきである。
ディスカッション
ここで説明する高スループットの時系列の寿命測定法は高精度と精度を有する株の多数の老化の可能性を定量化するための効果的な方法です。コロニー形成単位をカウントすることで生存を決定するための古典的な手法に比べてこの方法の主な進歩は、(例えば3を参照)、高解像度の成長曲線でを得るためにそのようなBioscreen C MBRのマシンのようなシェーカー/インキュベーター/プ?...
謝辞
この作品は、NIHのグラント1R21AG031965 - 01A1によってサポートされていました。 MKは、高齢化のエリソン医学財団新奨学生です。
資料
| Name | Company | Catalog Number | Comments | |
| Bacto Peptone | Reagent | BD Biosciences | 211677 | |
| Bacto Yeast Extract | Reagent | BD Biosciences | 288620 | |
| Difco Agar | Reagent | BD Biosciences | 214530 | |
| Yeast Nitrogen Base w/o A.A. and A.S. | Reagent | MidSci | J630-500G | |
| Amino Acids | Reagent | Sigma-Aldrich | ||
| Ammonium Sulfate | Reagent | Spectrum | AM185 | |
| Dextrose | Reagent | Fisher Scientific | D16-10 | |
| Bioscreen C MBR machine | Tool | Growth Curves USA | 5101370 | |
| Bioscreen 100-well Honeycomb plate | Tool | Growth Curves USA | 9502550 |
参考文献
- Steinkraus, K. A., Kaeberlein, M., Kennedy, B. K. Replicative aging in yeast: the means to the end. Annu Rev Cell Dev Biol. 24, 29 (2008).
- Kaeberlein, M., Conn, P. M. . Handbook of models for human aging. , 109 (2006).
- Fabrizio, P., Longo, V. D. The chronological life span of Saccharomyces cerevisiae. Aging Cell. 2 (2), 73 (2003).
- Murakami, C. J., Burtner, C. R., Kennedy, B. K., Kaeberlein, M. A method for high-throughput quantitative analysis of yeast chronological life span. J Gerontol A Biol Sci Med Sci. 63 (2), 113 (2008).
- Piper, P. W., Harris, N. L., MacLean, M. Preadaptation to efficient respiratory maintenance is essential both for maximal longevity and the retention of replicative potential in chronologically ageing yeast. Mech Ageing Dev. 127 (9), 733 (2006).
- Fabrizio, P., et al. Superoxide is a mediator of an altruistic aging program in Saccharomyces cerevisiae. J Cell Biol. 166 (7), 1055 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved