需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
量化老化细胞生长的酵母年谱跨度
摘要
在酵母老化的年代,是指与固定相相关的细胞活力的损失。在这里,我们描述了一个高通量的方法,定量确定酵母按时间顺序寿命。
摘要
芽殖酵母
研究方案
第1部分:老龄化的文化准备
- 到YEPD培养基琼脂平板冻结的股票(1%酵母提取物,细菌用2%的蛋白胨,2%琼脂,2%葡萄糖)利息数株。
- 在30˚C的48小时或直到出现单菌落培养的细胞。
- 选入YEPD液体培养基在试管中的5毫升(1%酵母提取物,细菌用的蛋白胨2%,2%葡萄糖)单菌落,接种。
- 拓展文化30一夜之间˚C,而保持恒定的搅拌,使用一个振动筛或滚鼓。
- 50μL过夜培养,接种5毫升合成完整的(SC)中型(见表1)。一般有三种SC文化是为宗正每一株式三份生物复制的寿命分析每个应变准备。
- 文化保持在30˚C的整个实验的辊(一般为2个或更多个星期)鼓上不断搅拌。
第2部分:考虑一个可行性的年龄点
经过两天在SC媒体文化,细胞应在固定相和,第一年龄点是准备采取。随后的年龄应采取每2-3天至少两个星期。对于每个年龄段点:
- 准备填写每孔145μLYEPD BIOSCREEN 100接种蜂窝板。只YEPD和数据分析无细胞后一定要留下,以及填补了至少一个。
- 从孵化器中取出老化的文化。
- 简言之涡接种到蜂窝板,同时小心,不要泄漏任何文化的第一个文化。
- 取出5μL的混合文化和吸管成蜂窝板的第一口井。火焰口前和每个试管中取出后,5μL等份。
- 重复此过程中,一定要注意每一种文化的相应位置以及每个老化文化。随后在整个实验的每个年龄点,应使用相同的良好阵地。
- 更换成30˚彗星孵化器的文化与接种完成。
第3部分:载入BIOSCREEN彗星的MBR机
- 揭露解除盖子孵化器舱,取出样品盘盖。
- 新接种的蜂窝板插入样品盘(如果你只阅读一个板块,使用左侧的插槽)。
- 更换样品盘盖和降低孵化器仓盖。
- 检查,以确保传热流体上面填写最低水平。如果低,增加更多的使用了1000μL移液器提供的传热流体。
- BIOSCREEN软件“EZExperiment”的使用,设置以下参数,以获得适合酿酒酵母生长曲线:
- 样品编号:输入与媒体或200井数
- 过滤器:420 - 580nm,宽带
- 温度:30˚彗星
- 实验时间:1天0小时0秒
- 测量间隔:30分钟
- 振动,连续晃动,高
- 点击“开始”开始读数。
第4部分:数据分析
通常情况下,6个年龄点采取了两个星期的课程。 2天,4,6,9,11和13年龄点。根据实验设计和被测试的菌株,它可能需要采取年龄点或多或少频繁或时间超过2周。重要的是要以相同的顺序加载每个年龄点,每个老化文化对应相同的立场以及在每一个年龄点,因为这将会使数据分析更容易蜂窝板。
- 获取BIOSCREEN彗星MBR机的输出文件。 EZExperiment“软件”将输出作为制表符分隔的文件,与Microsoft Excel以及其他软件兼容的BIOSCREEN数据。第一列显示的OD测量,在什么时候采取了在实验过程中,代表BIOSCREEN蜂窝板(图1)每口井的后续列。
- 删除从每列的第一个外径阅读。这种阅读是“噪音”。
- OD值减去单独YEPD所有的OD值在每一列以及与标准化的数据。这将删除媒体的背景吸光度。
- 绘制生长曲线。曲线将转向功能的年龄(图2)。例如,从第1列超过6个时间点(蜂窝板1)通过绘制生长曲线,随着时间的推移有一个鲜明的曲线右移。
- 每口井的第2天的年龄点的生长动力学为基础,计算倍增时间(δ)。公式用于计算倍增时间,我S:

外径1和外径2表示连续OD测量和T 1和T 2的测量之间的时间。计算倍增至0.5 OD值0.2倍。这些值的平均值,以及倍增时间。计算倍增至0.5 OD值0.2倍。这些值的平均值,以及倍增时间。大多数野生型酵母菌株的,应给予85至90分钟之间增加一倍的时间价值。 - 对于每个年龄点,计算时移(ΔT)在生长曲线的初始年龄点(2天)。一个简单的方法做到这一点是确定的时间长短不同,每口井之间的初始年龄点,每个后续的年龄点达到了0.3外径。 ,尤其是很好地达到了0.3 OD时,可以计算出相应的线性回归方程来LN(OD值)之间的时间为两个时间点包围OD = 0.3功能。
- 尚存在每个年龄段点,以产生一种生存曲线(图3)计算分数。定义的初始年龄点(2天),以100%的可行性。对于每个连续的年龄点,使用公式计算%生存:
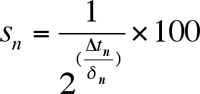
其中S n是生存的百分比,ΔTñ是时间的转变,δn是倍增时间。 - 生成绘图岁的函数活菌比例(%)生存曲线(图3B),为每口井的井(或复制)所需。
- 计算每口井的生存积分(SI)。 SI被定义为生存曲线下的面积,可以通过公式估计:

其中年龄ñ年龄点(如2,4,6,9,11和13)和S N是在这个年龄点的生存价值。 - 确定从SI和生存数据复制井的统计参数。共同关心的统计参数,包括平均数,中位数,每个生物复制方差。可用于不同的实验组和对照组的SI两两比较t检验或类似的分析。它也可能是可取的,生成的生存曲线,平均生物复制为4.8。
第5部分:代表结果
在实验完成后,你将有绘制生存曲线,并进行数据分析足以确定老化的时间为几个不同的菌株或条件的潜力。如果正确执行,从BIOSCREEN彗星MBR机获得的生长曲线看起来应该类似于图2所示的生存曲线应类似于图3所示的。一般来说,这里所描述的条件下培养的野生型细胞,将有7天的顺序中位数顺序寿命。在生存的巨大变化,观察在不同的菌株,并在某些情况下,如在0.05%的葡萄糖媒体的增长,中位生存期可超过30天。

图1。数据输出BIOSCREEN方案“EZExperiment”。 A栏显示的吸光度读数的时间。连续列表示,从老化的文化细胞接种蜂窝板的水井。
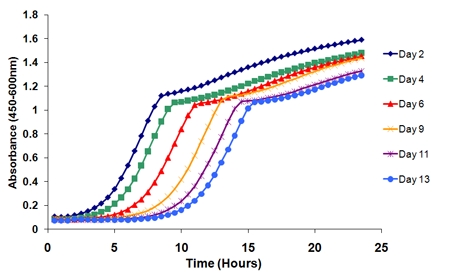
从一个单一的实验过程中的生物复制的生长曲线图2。曲线有一个独特的转变,随着时间的推移,在老龄化的文化细胞失去生存能力。初始时间点(2天)和一个连续的时间点之间的时间长度确定在那个特定的时代的可行性。
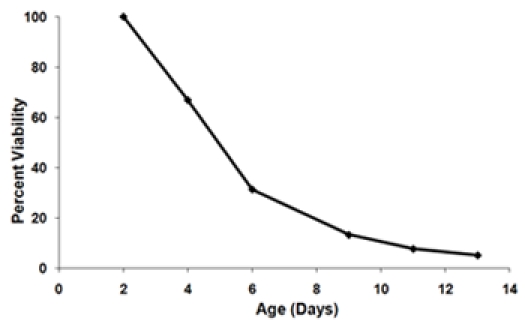
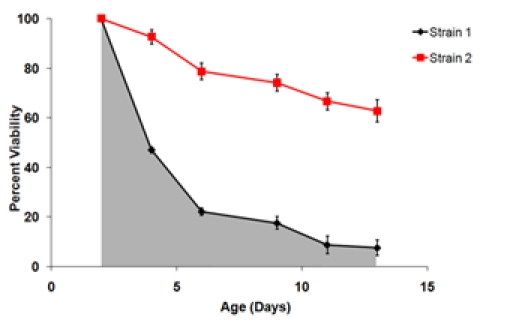
图3。 A)的生存曲线,生成从图1中使用的生长数据。第2天的时间点设置为100%的可行性点 B)最后两个菌株的存活曲线,在相同的实验测试。这些生存曲线代表三个生物复制为每一株的平均存活率。误差线表示标准偏差范围内的生物复制。下的生存曲线的阴影区域代表的生存应变1积分(SI)。
| 表1。合成的定义中等年代老化研究(株backgrouND BY4743) | |
| 组件 | 浓度(g / L的) |
| D -葡萄糖 | 20 |
| 酵母氮基(-AA/AS) | 1.7 |
| (NH 4)2 SO 4 | 5.0 |
| 腺嘌呤 | 0.04 |
| L -精氨酸 | 0.02 |
| L -天冬氨酸 | 0.1 |
| L -谷氨酸 | 0.1 |
| L -组氨酸 | 0.1 |
| L -亮氨酸 | 0.3 |
| L -赖氨酸 | 0.03 |
| L -蛋氨酸 | 0.02 |
| L -苯丙氨酸 | 0.05 |
| L -丝氨酸 | 0.375 |
| L -苏氨酸 | 0.2 |
| L -色氨酸 | 0.04 |
| L -酪氨酸 | 0.03 |
| L -缬氨酸 | 0.15 |
| 尿嘧啶 | 0.1 |
注:此配方为二倍体BY4743应变auxotrophies帐户。合成完全培养基加入终浓度5倍,氨基酸auxotrophies应该得到补偿。
讨论
高通量的时间顺序寿命试验,这里描述的是一个量化的菌株具有高准确度和精密度的大量老化潜力的有效方法。这种方法比传统方法主要事先确定计数菌落形成单位(如见3)的生存是一个摇床/孵化器/板读取装置,如使用的BIOSCREEN彗星MBR机获取高分辨率的生长曲线每个年龄点。在直接比较低吞吐量,按时间顺序寿命试验,这种方法已被证明,以达到可比性(或更好)的精度,同时可以...
致谢
这项工作是支持由美国国立卫生研究院资助1R21AG031965 - 01A1。 Mk为中老年埃利森医学基金会新学者。
材料
| Name | Company | Catalog Number | Comments | |
| Bacto Peptone | Reagent | BD Biosciences | 211677 | |
| Bacto Yeast Extract | Reagent | BD Biosciences | 288620 | |
| Difco Agar | Reagent | BD Biosciences | 214530 | |
| Yeast Nitrogen Base w/o A.A. and A.S. | Reagent | MidSci | J630-500G | |
| Amino Acids | Reagent | Sigma-Aldrich | ||
| Ammonium Sulfate | Reagent | Spectrum | AM185 | |
| Dextrose | Reagent | Fisher Scientific | D16-10 | |
| Bioscreen C MBR machine | Tool | Growth Curves USA | 5101370 | |
| Bioscreen 100-well Honeycomb plate | Tool | Growth Curves USA | 9502550 |
参考文献
- Steinkraus, K. A., Kaeberlein, M., Kennedy, B. K. Replicative aging in yeast: the means to the end. Annu Rev Cell Dev Biol. 24, 29 (2008).
- Kaeberlein, M., Conn, P. M. . Handbook of models for human aging. , 109 (2006).
- Fabrizio, P., Longo, V. D. The chronological life span of Saccharomyces cerevisiae. Aging Cell. 2 (2), 73 (2003).
- Murakami, C. J., Burtner, C. R., Kennedy, B. K., Kaeberlein, M. A method for high-throughput quantitative analysis of yeast chronological life span. J Gerontol A Biol Sci Med Sci. 63 (2), 113 (2008).
- Piper, P. W., Harris, N. L., MacLean, M. Preadaptation to efficient respiratory maintenance is essential both for maximal longevity and the retention of replicative potential in chronologically ageing yeast. Mech Ageing Dev. 127 (9), 733 (2006).
- Fabrizio, P., et al. Superoxide is a mediator of an altruistic aging program in Saccharomyces cerevisiae. J Cell Biol. 166 (7), 1055 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。