このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ニューロンとグリアの開発研究ラットの脳の集計文化の調製
要約
胎児ラット脳の集合体の培養系のためのプロトコルが記述されています。凝集体の多能性前駆細胞は、開発し、神経細胞、アストロサイト、オリゴデンドロサイトに分化することができる。
要約
中枢神経系(CNS)における成熟した神経細胞とグリア細胞への反復する前駆細胞の発生や分化は、軸索 - グリア相互作用、多能性前駆細胞の性質と分化、およびオリゴデンドログリアの進行を調査する神経科学者のための強力なプラットフォームを提供することをin vitroの系細胞および分子レベルでの系統細胞。ここでは3-4週間に無血清培地に維持することができるとニューロン - グリア相互作用と中枢神経系の髄鞘形成を研究するモデルとして我々の研究室で使用されているラット胚のforebrains、からCNSの集合体培養系を説明します。このビデオクリップは、E16ラット脳からこれらのCNSの集合体の文化を分離し、成長させる方法を紹介します。さらに、同じ脳の解剖から、高濃縮レギュラー解離ニューロン培養を容易に得ることができると、様々な研究に使用CNSニューロンや他の細胞との共培養に使用されます。
プロトコル
解剖前の準備
手術器具:オートクレーブによるすべての解剖はさみや鉗子を滅菌
カバーのクリーニング:
- 少なくとも24時間、33%塩酸で1L草のビーカー内のすべてのカバースリップを(24ウェルプレート用の直径15mm)をソーク
- すべての残留HClを除去するために時折揺れで10分間流水で洗う
- ミリポア水で洗い流してください
- 水を切る
- 95から98パーセントのエタノールでカバーガラスを浸し
- 平板と空気のきれいなティッシュにカバースリップを転送するには、カバースリップを乾燥させる
- 、ガラス製ビーカーにアルミ箔とオートクレーブでカバーをカバースリップを転送する
注:カバースリップをこの段階で保存することができます。 - 培養プレートに、個々のカバースリップを配置。コーティングのための準備
カバースリップコーティング:
- PBSとポリ- D -リジン(-20アリコート° Cとして格納されているPBS、0.5%のPDL、10 mg / mlのウシ血清アルブミン)の100 ×ストックを希釈し、フィルター滅菌(0.22μm)で
- 37℃2時間× 1:PDLソリューション(〜0.15ミリリットル/ cm 2で )°インキュベーターでCとコートのカバースリップ
- PDLソリューションを取り外して、完全無菌のddH 2 Oと、乾燥カバーグラスで3回洗浄
注:各節郭清のためのコート十分なカバーグラス/プレート。 PDLでコーティングされたカバースリップは4℃で数週間保存することができる
メディアとソリューション
解剖の培地(DM)は:10mMのHEPES(インビトロジェン15630)を添加した滅菌、氷冷ハンクス平衡塩溶液(W / OのCa 2 +、Mg 2 +を )(HBSS、インビトロジェン14175)を使用してください。
集計培地:2%B27、1 ×佐藤、0.5mMのピルビン酸ナトリウム、0.75mmのグルタミン、60μg/mlN -アセチルシステイン、5μg/ mlの:DMEM/NBB27培地はDMEM / Neurobasal(巻1時01巻)が含まれているインスリン、10nmのd -ビオチンおよび1%ペニシリン/ストレプトマイシン。凝集培養培地100mlを作るために、50 mlのDMEM(W / Oピルビン酸/グルタミン、インビトロジェン11960)、50 mlのNeurobasal培地(Invitrogen 211034)、375μlのグルタミン(100 ×、インビトロジェン35050)、5.5 mgのピルビン酸ナトリウムを混合(シグマP2256)、2 mlのB27(インビトロジェン17504)、6.3 mgのN -アセチルシステイン(シグマA8199)、佐藤株式を1 ml(100 ×ストック、下記参照)、d -ビオチン株式25μlの(4000 ×ストック、40 -20分注して保存されているPBSでμM℃のシグマB4639)、インスリン100μlの(1000 ×株式、-20分注し° C、シグマ16634として保存されている0.01N塩酸で5 mg / ml)を、1 mlのペニシリン/ストレプトマイシン(100 ×株式、インビトロジェン15140)は、ろ過滅菌し、4℃で保存します。
佐藤100 ×ストック溶液:株式の40mlを行うには:400mgのアポトランスフェリン(シグマT2252)、400 mgのBSA(シグマA9647)、として保存されているプロゲステロンの10μlの(25 mg / mlのエタノールとの混合40mlのNeurobasal -20分注し℃のシグマP8783)、64 mgのプトレシン(シグマP7505)、および亜セレン酸ナトリウム40μlの(-20アリコートとして保存されているPBSで30μM、° C、シグマS5261)。 -20℃でアリコートとして佐藤ストック溶液、および店舗を消毒フィルタリング
ニューロンのメッキ培地(PM):Neurobasal培地、2%B27、2mMグルタミン(100株、-20℃、Invitrogen社製25030に格納されているアリコート)、25μmのグルタミン酸(100株、-20℃で保存したアリコート)および1%ペニシリン/ストレプトマイシン。
ニューロン培養培地(CM):Neurobasal培地、2%B27、2mMグルタミン(100株、-20℃で保存したアリコート)及び1%ペニシリン/ストレプトマイシン。
5 - FDU株式:Neurobasal培地で100倍の株式、1mMの5 -フルオロ-2' -デオキシウリジン(Sigma社F0503)and1mMウリジン(Sigma社U3003)。フィルタは、-20℃で滅菌してアリコートとして保存
パパインの消化液(前の節郭清に新鮮なように):
- 4ミリリットルDMで3.2 mgのL -システイン(シグマC - 7352)を溶かす
- 37℃で1NのNaOH(pH試験ストリップのテスト)と水浴の場所で約7.4にpHを調整する° C
注意:(下記参照)、右組織消化する前に次のステップを実行します。 - 20単位/ mlの最終濃度にパパインを追加
- (0.22ミリメートル)滅菌フィルター処理、および37℃の水浴中で場所° C
トリプシン阻害剤溶液(前の節郭清に新鮮なように):
- 20ミリリットルDMで0.2グラムトリプシンインヒビター(Sigma社T7295)を溶かす
- pHをチェックし、1 N NaOHで〜7.4にpHを調整する
- 滅菌フィルター処理、および37℃の水浴中で場所° C
脳の解剖
セットアップ:
- 滅菌鉗子とはさみ
- 70%エタノール
- クリーンティッシュペーパーとdiapベンチで二パッド
- ベンチで子宮や胎児のための氷冷DMと10cmのペトリ皿
- 解剖顕微鏡で氷のプラットフォーム
- 氷の上にDMを2〜3 6センチメートル料理
- 37℃の水浴中で暖かいPM
- あなたの動物実験によって承認された手順と連絡委員会(IACUC)によると妊娠したSprague - Dawleyラット(E16)を安楽死させる
- 腹部領域の上におむつパッドと去勢のアルコールのラットレイ
- 皮膚のみをカットするV字型の切開を行うために腹部の皮膚とはさみのペアを保持するためにピンセットを使用して、
- 皮膚を広げますと筋肉層を介してカットして別の滅菌ピンセットやハサミを使う
- 胚嚢の連鎖を抽出し、氷冷DMを含む10cmの皿にそれらを転送する
- マイクロダイセクションのはさみを使用して、慎重に氷のプラットフォーム上でDMときれいな10cmの皿に嚢と各胚から脳、そして場所解放脳から各胚を削除
- 層流フード内や解剖顕微鏡下で、中脳/後脳のセクションを削除し、髄膜を除去するために微細な鉗子を使用し、氷のパックにDMで新しい6 cmディッシュに洗浄皮質/海馬を転送
注:この段階で、組織は酵素消化の準備ができている。 - パパインとトリプシンの阻害剤溶液およびフィルター滅菌を行う
- 皮質/海馬からDM過剰を取り除く
- 準備パパイン消化溶液の4ミリリットルを追加します。
- 50ミリリットルチューブに、すべてのコンテンツを転送し、37℃の水浴中にファルコンチューブを配置° Cを正確に5分間
- ピペットでパパイン溶液を除去
- 2〜3分間5ミリリットルトリプシン阻害剤溶液、渦巻管、および37℃の水浴中で行わ° Cを追加
- トリプシンインヒビターの溶液を除去
- ステップ13と14を3回繰り返します
- 20ミリリットル暖かいPMを追加
- すべての塊が消失するまでひいて粉にする(〜20〜30倍)
- 7分のために100xgで遠心分離
- 10ミリリットルPMでペレットを再懸濁し、遠心分離により2回洗浄する
- 定期的なニューロンの培養のためにまたは集約培養用のNBB27/DMEMで10ミリリットルPMでペレットを再懸濁します
- 70μmセルふるいを介して細胞を渡す
- 生細胞を数える
- 定期的なニューロンの培養用細胞を以下に記載または板として集約文化に進みます
注:このステップでは、高濃縮ニューロンの培養は、実験の目的に応じて2 200〜640細胞/ mmの密度で、PDLコーティングプレート上に解離細胞を播種することによって達成することができます。細胞は(〜2 - 4H)接続した後は、暖かい日に培地を交換してください。長時間培養した場合、4日目に、暖かいCMで培地の半分を交換してください。非常に神経細胞の培養、精製するため、有糸分裂阻害剤5 - FDUは(最終濃度10μM)の非神経細胞の増殖を(すなわち、DIV2 - 3の間)を阻害するDIV2で追加することができます。 2日間のCMで回復した後、細胞は、パルスは完全培地の変化に続いて別の2日間(DIV 6-7)のために5 - FDUで再び処理されます。その後、3〜4日ごとに新鮮な、温かみのあるCMで培地の半分を交換してください。 4週間までのニューロンは、実行可能です。
凝集体の調製およびメッキ
- 2 × 10 6細胞/ mlの密度で1 ×佐藤、10ng/ml CNTFおよび10μMフォルスコリンを含むNBB27/DMEM培地で解離細胞をサスペンド
- コーティングされていない6ウェルプレートの各ウェルに細胞懸濁液の2ミリリットルを転送する
- 3泊の培養。毎日、穏やかに一度P1000 Pipetmanを用いて細胞を再懸濁
注:セルの集合体(図1)を形成し始める。 - マトリゲルと集約メッキ、コートプレート/カバースリップの前日:
- 株式マトリゲル(成長因子が減少し、BD Biosciences社354230)氷の上に冷たいDMEMで1:20に希釈する
注:マトリゲルアリコートを、製造業者のプロトコルごとに用意する必要があります。すべてのヒントを、エッペンドルフチューブとストックのアリコートを作るためのソリューションは、マトリゲル重合を避けるために、寒いはずです。マトリゲルのアリコートを-80℃に維持し、4℃で解凍されています - 37℃インキュベーターで一晩希釈マトリゲル溶液を300μl/wellでコートは、以前にPDLコートしたカバースリップ
- 温かいPBSで洗い、その後暖かい滅菌のddH 2 Oでプレートを洗浄し、インキュベーターでプレートを残す。
- 株式マトリゲル(成長因子が減少し、BD Biosciences社354230)氷の上に冷たいDMEMで1:20に希釈する
- 凝集体形成後の3日間、再び静かに細胞を再懸濁し、ふるい50ミリリットルファルコンチューブに200μmのメッシュを介してサスペンション。凝集体は重力(〜3 - 5分)でチューブの底に沈降することができます
- 注意深く上清を除去
- 培地を加え、穏やか凝集体を再懸濁し、それらを再び沈殿ができます。死んだ細胞、個々の細胞および残骸を削除する場合は、この手順を数回繰り返します。上清はまだ非凝集細胞とdebriが含まれているかどうかを確認するために顕微鏡を使用して、の
- ゆっくりと同じNBB27/DMEM媒体(図1)、カウントの集計に集計を再懸濁します。
- 25から30の周りaggreggats/50ulに凝集体の密度を調整する
- メッキのための2ミリリットルエッペンドルフチューブに集約サスペンションの転送アリコート(500 -1000μl)
注:集合体は、チューブの底に落ち着く傾向があるので、それはメッキのために集約サスペンションの複数のチューブを作ることが重要です。ゆっくりと各カバースリップ上に播種した凝集体の同じような数を確保するためにコーティングされたカバースリップまたは培養プレート上にそれらを播種する前に、しばしば凝集体を懸濁します。 - インキュベーターからマトリゲルでコーティングされたカバースリップを含む培養プレートを取り出してください。各ウェルから溶液を除去、温かいPBSとのddH 2 Oでカバーグラスを洗浄し、乾燥簡潔に。彼らは現在集計播種の準備ができている
- それらは播種前に均等に分散されるように集約懸濁液を含むチューブを反転。各カバーの中央に集約し懸濁液50μlずつをロードし、ゆっくりと凝集体がカバースリップに均等にアタッチできるようにそれ以上の障害なくインキュベーターにバックプレートを置く
注:集合体の密度が非常に重要です。凝集体を播種している場合はあまりにも接近したり、播種密度が高い場合、彼らは成長するにつれて一緒にマージする傾向がある。 - 翌朝以降早期に各ウェルに4-6時間に追加のDMEM/NBB27medium(500μl)を添加
- 集計文化を維持するために、ハーフ3〜4日ごとに培地を変更してください。培地を変更すると、凝集を妨害しないように注意してください、これは穏やかにウェルの側壁に沿ってメディアを追加することによって行われます。
注:数時間プレートに付着凝集後、凝集体からの神経突起の成長を観察することができる。軸索は、最初の2週間で急速に成長し、凝集体(図2)の間に豊富な接続を形成する。グリア前駆細胞は、凝集体から放射状に移動し、星状膠細胞と成熟オリゴデンドロサイトに時間をかけて分化する。
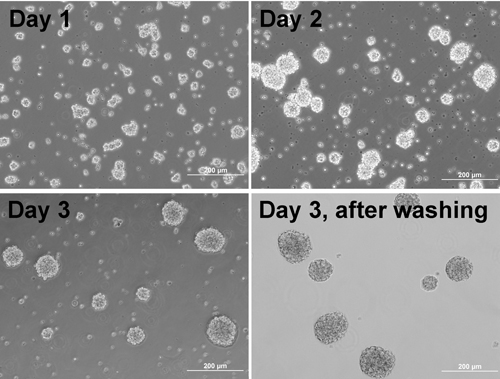
図1洗浄後に別の日と集計で凝集体を形成する細胞の位相コントラスト像。

2〜12日間マトリゲルでコーティングされたカバースリップ上に播種した後の骨材文化の図2。位相コントラスト像。
ディスカッション
初期の研究は、シナプスと回転を介したフリーフローティング集約文化1の成熟したミエリンの形成を報告した。ここで説明CNSの集合体の培養系は、細胞の開発、マイグレーションおよびin vitroでの分化の解析を容易にするために、従来の2D文化の利便性を持つ三次元凝集体における多能性前駆細胞の無血清成長を兼ね備えています。システムは、神経前駆体のために修正...
謝辞
この研究は、テキサスA&M大学からスタートアップ資金の一部で賄われていた
参考文献
- Matthieu, J. M. Myelination in rat brain aggregating cell cultures. Neuroscience. 3, 565-56 (1978).
- Chen, Y. i. n. g. Isolation and culture of rat and mouse oligodendrocyte precursor cells. Nat. Protocols. 2, 1044-10 (2007).
- Watkins, T. A., Emery, B., Mulinyawe, S., Barres, B. A. Distinct stages of myelination regulated by gamma-secretase and astrocytes in a rapidly myelinating CNS coculture system. Neuron. 60, 555-55 (2008).
- Svenningsen, A. F., Shan, W. e. i. -. S. o. n. g., Colman, D. a. v. i. d. R., Pedraza, L. i. l. i. a. n. a. Rapid method for culturing embryonic neuron-glial cell cocultures. Journal of Neuroscience Research. 72, 565-56 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved