È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Preparazione delle Culture del cervello di ratto aggregati per Neuron e Studi sullo Sviluppo Glia
In questo articolo
Riepilogo
Un protocollo per un sistema embrionale del cervello di ratto cultura globale è descritto. Progenitori multipotenti negli aggregati in grado di sviluppare e differenziarsi in neuroni, astrociti e oligodendrociti.
Abstract
Un sistema in vitro che ricapitola lo sviluppo e la differenziazione dei progenitori in neuroni maturi e glia nel sistema nervoso centrale (SNC) potrebbe fornire una piattaforma potente per i neuroscienziati di indagare AXO-gliali interazioni, le proprietà e la differenziazione di cellule progenitrici multipotenti, e la progressione della oligodendrogliale cellule lignaggio a livello cellulare e molecolare. Descriviamo qui un aggregato SNC sistema di coltura da forebrains ratto embrionale, che può essere mantenuta in un mezzo privo di siero fino a 3-4 settimane ed è utilizzato nel nostro laboratorio come modello per lo studio dei neuroni-glia l'interazione e la mielinizzazione del SNC. Questo video verrà illustrato come isolare e coltivare queste aggregato SNC culture E16 cervello di ratto. Inoltre, dalla dissezione del cervello stesso, altamente arricchito regolare culture neuronali dissociate possono essere ottenuti facilmente e utilizzati per vari studi sui neuroni del SNC o utilizzato per co-culture con altre cellule.
Protocollo
Preparazione prima della dissezione
Strumenti chirurgici: sterilizzare tutti forbici e pinze da dissezione autoclave
Coprioggetto pulizia:
- Immergere tutti coprioggetto (15 mm di diametro per 24-pozzetti) in 1L bicchiere erba nel 33% di HCl per almeno 24 ore
- Lavare con acqua corrente per 10 minuti con scuotere occasionali per rimuovere tutti i residui di HCl
- Risciacquare con acqua Millipore
- Scaricare l'acqua fuori
- Mettere a bagno in coprioggetto 95-98% di etanolo
- Coprioggetto trasferimento in un tessuto pulito in un piatto piano e aria secca i coprioggetti
- Trasferimento coprioggetto ad un bicchiere di vetro, coprite con un foglio di alluminio e autoclave
Nota: Vetrini coprioggetto possono essere memorizzati in questa fase - Luogo coprioggetto individuali in piastre di coltura. Pronto per la verniciatura
Coprioggetto rivestimento:
- Prelevare 100 x magazzino di poli-D-lisina (PDL, 10 mg / ml in 0,5% di BSA in PBS, immagazzinato come aliquote a -20 ° C) con PBS e filtro-sterilizzare (0,22 micron)
- Coprioggetto cappotto con 1 soluzione x PDL (~ 0,15 ml / cm 2) per 2 ore a 37 ° C in un incubatore
- Rimuovere la soluzione PDL e lavare 3 volte con sterili DDH 2 O e coprioggetto asciugare completamente
Nota: Cappotto abbastanza lamelle / piastre per ogni dissezione. PDL rivestite coprioggetto può essere conservato per un paio di settimane a 4 ° C.
Mezzi di comunicazione e soluzioni
Medio dissezione (DM): Utilizzare soluzione equilibrata sale sterili ghiacciata di Hank (w / o Ca 2 +, Mg 2 +) (HBSS, Invitrogen 14175) integrata con 10 mM HEPES (Invitrogen 15.630).
Terreni di coltura di aggregazione: Il mezzo DMEM/NBB27 contiene DMEM / Neurobasal (1:1 vol: vol), 2% B27, 1 x Sato, 0,5 mM di piruvato di sodio, 0,75 mm GlutaMAX, 60μg/ml N-acetilcisteina, 5 mcg / ml insulina, 10nm d-biotina e 1% di penicillina / streptomicina. Per fare 100 ml di terreno di coltura aggregato, miscelare 50 ml di DMEM (w / o piruvato / glutammina, Invitrogen 11960), 50 ml di mezzo Neurobasal (Invitrogen 211.034), 375 microlitri GlutaMax (100 x, Invitrogen 35.050), 5,5 mg di sodio piruvato (Sigma P2256), 2 ml di B27 (Invitrogen 17.504), 6,3 mg di N-Acetilcisteina (Sigma A8199), 1 ml di brodo Sato (100 x magazzino, vedi sotto), 25 l di d-Biotina magazzino (4000 x magazzino, 40 mM in PBS memorizzati come aliquote a -20 ° C. Sigma B4639), 100 ml di insulina (1000 x stock, 5 mg / ml di HCl 0.01N memorizzati come aliquote a -20 ° C, Sigma 16634) e 1 ml di penicillina / streptomicina (100 x stock, Invitrogen 15.140), filtro-sterilizzare e conservare a 4 ° C.
Sato 100 x soluzione di riserva: Per 40 ml dello stock: mescolare 40 Neurobasal ml con 400 mg di apo-transferrina (Sigma T2252), 400 mg di BSA (Sigma A9647), 10 ml di progesterone (25 mg / ml di etanolo, memorizzati come aliquote a -20 ° C. Sigma P8783), 64 mg putrescina (Sigma P7505), e 40 l di sodio selenite (30 mM in PBS, immagazzinato come aliquote a -20 ° C, Sigma S5261). Sterilizzare filtro della soluzione madre Sato, e conservare come aliquote a -20 ° C.
Neurone medio placcatura (PM): Medio Neurobasal, 2% B27, 2mM Glutammina (stock 100x, aliquote conservati a -20 ° C, Invitrogen 25.030), a 25 micron acido glutammico (100 stock, aliquote conservati a -20 ° C) e 1% penicillina / streptomicina.
Neuron terreno di coltura (CM): Medio Neurobasal, 2% B27, 2mM Glutammina (stock 100x, aliquote conservati a -20 ° C) e 1% di penicillina / streptomicina.
5-FDU magazzino: magazzino 100x, 1mm 5-fluoro-2'-deossiuridina (Sigma F0503) and1mM uridina (Sigma U3003) in un mezzo Neurobasal. Sterilizzato per filtrazione e memorizzati come aliquote a -20 ° C.
Papaina soluzione di digestione (fare ogni volta prima dissezione):
- Sciogliere 3,2 mg L-cisteina (Sigma C-7352) in 4ml DM
- Regolare il pH a circa 7,4 con NaOH 1N (test su strisce reattive pH) e posto in bagno d'acqua a 37 ° C
Nota: eseguire il passo successivo a destra prima di digestione dei tessuti (vedi sotto). - Aggiungi papaina ad una concentrazione finale di 20 unità / ml
- Filtro sterilizzare (0,22 millimetri), e posto in bagno d'acqua a 37 ° C
Soluzione di tripsina inibitore (fare ogni volta prima dissezione):
- Sciogliere 0,2 g di inibitori della tripsina (Sigma T7295) a 20ml di DM
- Controllare il pH e aggiustare il pH a ~ 7.4 con 1 N NaOH
- Filtro sterilizzare, e posto in bagno d'acqua a 37 ° C
La dissezione del cervello
Setup:
- Pinze e forbici sterilizzate
- Etanolo al 70%
- Fazzoletto di carta pulito e DIAPer pad sulla panchina
- Petri dieci centimetri di ghiaccio-freddo DM per utero e feto sulla panchina
- Piattaforma di ghiaccio al microscopio dissezione
- 2-3 piatti con DM 6 centimetri sul ghiaccio
- PM caldo in un bagno d'acqua a 37 ° C
- Euthanize una donna incinta ratto Sprague-Dawley (E16) secondo una procedura approvata dal Animal Care istituzionali e Us Committee (IACUC)
- Posare il ratto sulla rampa di pannolino e l'alcool spay sulla regione addominale
- Utilizzare una pinzetta per tenere la cute addominale e un paio di forbici per fare una incisione forma a V taglio solo la pelle
- Allargate la pelle e utilizzare un altro pinzette sterilizzate e forbici per tagliare lo strato muscolare
- Estrarre la catena delle sacche dell'embrione e trasferirli in un piatto di 10 centimetri contenente ghiacciata DM
- Utilizzando un paio di forbici microdissezione, rimuovere con attenzione ogni embrione dal sacco e il cervello da ogni embrione, e il luogo liberato cervello in un piatto pulito, con DM 10 centimetri su una piattaforma di ghiaccio
- In una cappa laminare e al microscopio dissezione, rimuovere mesencefalo / rombencefalo sezioni, e utilizzare una pinza sottile per rimuovere meningi, e trasferire le cortecce pulito / ippocampo di un nuovo piatto con DM 6 centimetri su un impacco di ghiaccio
Nota: in questa fase, il tessuto è pronto per la digestione enzimatica. - Fai la papaina e la soluzione di inibitori della tripsina e filtro sterilizzare
- Rimuovere l'eccesso di DM da cortecce / dell'ippocampo
- Aggiungere 4 ml della soluzione preparata digestione papaina
- Trasferire tutto il contenuto in una provetta da 50 ml e posizionare il tubo Falcon in un bagno d'acqua a 37 ° C per esattamente 5 minuti
- Rimuovere soluzione papaina con pipetta
- Aggiungere 5 ml di soluzione di inibitori della tripsina, agitare il tubo, e posto in un bagno di acqua a 37 ° C per 2-3 minuti
- Rimuovere soluzione inibitore della tripsina
- Ripetere il punto 13 e 14 tre volte
- Aggiungere 20ml PM caldo
- Triturare fino a quando tutti i grumi sono scomparsi (~ 20-30 volte)
- Centrifugare a 100xg per 7min
- Risospendere il pellet in 10ml PM e lavare due volte per centrifugazione
- Risospendere il pellet in 10ml PM per le culture dei neuroni regolari o in NBB27/DMEM per aggregare culture
- Passaggio delle cellule attraverso un setaccio cellula 70μm
- Contare le cellule vive
- Procedere alle culture aggregato come descritto di seguito o la targa delle celle per le culture dei neuroni regolare
Nota: A questo punto, altamente arricchito culture neurone può essere ottenuto placcatura cellule dissociate sul PDL-rivestimento piastre a densità di 200-640 cellule / mm 2 a seconda dello scopo degli esperimenti. Dopo che le cellule hanno attaccato (~ 2-4h), sostituire medio con PM caldo. Se coltura per lunghi periodi di tempo, il giorno 4, sostituire la metà dei media con CM caldo. Per altamente purificato culture neuronali, inibitore della 5-mitotico FDU (concentrazione finale 10 micron) possono essere aggiunte in DIV2 per inibire la non proliferazione delle cellule neuronali (cioè durante DIV2-3). Dopo il recupero di CM per 2 giorni, le cellule sono impulsi nuovamente trattati con 5-FDU per altri 2 giorni (DIV 6-7) seguito da un cambiamento di terreno completo. In seguito, sostituire la metà della media con fresco, CM calda ogni 3-4 giorni. I neuroni sono vitali per un massimo di 4 settimane.
Aggregati preparazione e placcatura
- Sospendere le cellule dissociate in media NBB27/DMEM contenente 1x Sato, 10ng/ml CNTF e 10μM forskolina ad una densità di 2x10 6 cellule / ml
- Trasferimento 2 ml di sospensione cellulare in ciascun pozzetto di una non rivestito da 6 pozzetti
- Cultura per 3 notti. Ogni giorno, risospendere delicatamente le cellule una volta con un Pipetman P1000
Nota: Le cellule iniziano a formare aggregati (Figura 1). - Il giorno prima della placcatura aggregato, cappotto piastra / coprioggetto con Matrigel:
- Diluire la Matrigel (fattore di crescita ridotta, BD Biosciences 354230) 1:20 con DMEM freddo sul ghiaccio
Nota: aliquote Matrigel devono essere preparati per ogni protocollo del produttore. Tutte le punte, tubi Eppendorf e soluzioni per rendere aliquote dello stock dovrebbe essere fredda per evitare la polimerizzazione Matrigel. Aliquote di Matrigel sono conservati a -80 ° C e scongelato a 4 ° C. - Cappotto in precedenza PDL rivestite coprioggetto con 300μl/well della soluzione diluita Matrigel durante la notte a 37 ° C incubatore
- Lavare con PBS caldo, quindi lavare con piastra calda sterile DDH 2 O e lasciare le piastre in incubatrice.
- Diluire la Matrigel (fattore di crescita ridotta, BD Biosciences 354230) 1:20 con DMEM freddo sul ghiaccio
- 3 giorni dopo la formazione di aggregati, risospendere delicatamente le cellule di nuovo e setaccio la sospensione attraverso una maglia 200μm in un tubo da 50 ml Falcon. Lasciare aggregati di depositarsi sul fondo della provetta per gravità (~ 3-5min)
- Rimuovere con cura surnatante
- Aggiungere mezzo, risospendere delicatamente gli aggregati e lasciarli depositare di nuovo. Ripetere questa operazione più volte per rimuovere le cellule morte, le singole cellule e detriti. Usa microscopio per verificare se il supernatante contengono ancora non aggregata cellule e detritis
- Risospendere delicatamente gli aggregati nel medio NBB27/DMEM stesso (Figura 1) e numero di aggregati
- Regolare la densità di aggregati per circa 25-30 aggreggats/50ul
- Aliquote di trasferimento (500-1000μl) della sospensione aggregato di 2ml provette Eppendorf per la placcatura
Nota: poiché aggregati tendono a stabilirsi sul fondo dei tubi, è fondamentale per rendere più tubi della sospensione aggregato per la placcatura. Risospendere delicatamente gli aggregati spesso prima di loro semina su vetrini rivestiti o piastre di coltura per assicurare numero simile di aggregati placcato su ogni vetrino. - Estrarre la piastra di coltura contenente Matrigel rivestite coprioggetti dai incubatrice. Rimuovere la soluzione da ogni pozzetto, lavare i coprioggetti con caldo PBS e DDH 2 O, e poi brevemente a secco. Essi sono ora pronti per la semina aggregato
- Invertire una provetta contenente sospensione aggregata per consentire loro di essere distribuiti in modo uniforme prima della semina. Carico 50μl di sospensione aggregato al centro di ogni coprioggetto, e gentilmente messo la piastra posteriore per incubatrice senza alcun disturbo per consentire ulteriori aggregazioni di collegare in modo uniforme alla coprioggetto
Nota: La densità degli aggregati è fondamentale. Se aggregati sono seminati troppo vicini gli uni agli altri o se la densità di semina è alta, tendono a fondersi man mano che crescono. - Aggiungi DMEM/NBB27medium aggiuntivi (500 microlitri) in ogni pozzetto 4-6 ore più tardi o la mattina presto
- Per mantenere la cultura aggregato, la metà cambiare mezzo ogni 3-4 giorni. Quando il cambiamento medio, fare attenzione a non disturbare gli aggregati e questo è fatto da dolci aggiungendo medio lungo la parete del pozzo.
Nota: Poche ore dopo aggregati attaccato alla piastra, crescita dei neuriti dagli aggregati possono essere osservati. Assoni crescere rapidamente nelle prime due settimane e formare connessioni abbondante tra gli aggregati (Figura 2). Progenitori gliali migrano radialmente fuori degli aggregati e si differenziano nel tempo in astrociti e oligodendrociti maturi.
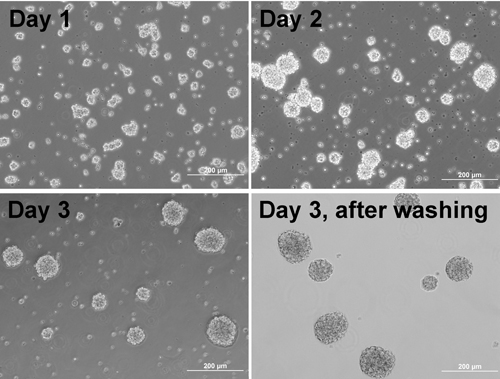
Figura 1. Contrasto di fase immagini di cellule che formano aggregati in giorni diversi e aggregati dopo il lavaggio.

Figura 2. Contrasto di fase le immagini di una cultura aggregato 2 e 12 giorni dopo seminato su Matrigel rivestite coprioggetto.
Access restricted. Please log in or start a trial to view this content.
Discussione
Primi studi riportavano la formazione di sinapsi e mielina maturo in rotazione-mediata culture senza aggregato galleggianti 1. L'aggregato SNC sistema di coltura qui descritto combina senza siero crescita delle cellule progenitrici multipotenti aggregati in tre dimensioni con la comodità di culture tradizionali in 2D per facilitare le analisi dello sviluppo delle cellule, la migrazione e la differenziazione in vitro. Il sistema può essere modificato e utilizzato per precursore neuronali ricerca...
Access restricted. Please log in or start a trial to view this content.
Riconoscimenti
Questo studio è stato finanziato in parte da fondi di start-up della Texas A & M University
Access restricted. Please log in or start a trial to view this content.
Riferimenti
- Matthieu, J. M. Myelination in rat brain aggregating cell cultures. Neuroscience. 3, 565-56 (1978).
- Chen, Y. ing Isolation and culture of rat and mouse oligodendrocyte precursor cells. Nat. Protocols. 2, 1044-10 (2007).
- Watkins, T. A., Emery, B., Mulinyawe, S., Barres, B. A. Distinct stages of myelination regulated by gamma-secretase and astrocytes in a rapidly myelinating CNS coculture system. Neuron. 60, 555-55 (2008).
- Svenningsen, A. F., Shan, W. ei-S. ong, Colman, D. avidR., Pedraza, L. iliana Rapid method for culturing embryonic neuron-glial cell cocultures. Journal of Neuroscience Research. 72, 565-56 (2003).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon