Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Herstellung von Ratten-Gehirn-Aggregate Kulturen für Neuron und Glia Development Studies
In diesem Artikel
Zusammenfassung
A-Protokolle für eine embryonale Rattenhirn Aggregat-Kultur-System beschrieben wird. Multipotente Vorläuferzellen in die Aggregate entwickeln können und differenzieren sich in Neuronen, Astrozyten und Oligodendrozyten.
Zusammenfassung
Eine In-vitro-System, rekapituliert die Entwicklung und Differenzierung von Vorläuferzellen zu reifen Neuronen und Gliazellen im zentralen Nervensystem (ZNS), wäre eine leistungsstarke Plattform für Neurowissenschaftler liefern zu axo-gliale Interaktionen, Eigenschaften und Differenzierung von multipotenten Vorläuferzellen, und das Fortschreiten der oligodendroglialen untersuchen Linie Zellen auf zellulärer und molekularer Ebene. Wir beschreiben hier eine ZNS-Aggregat-Kultur-System aus embryonalen Ratte Vorderhirn, die in einem Serum-freiem Medium gehalten werden können bis zu 3-4 Wochen und ist in unserem Labor als Modell zu Neuron-Glia-Interaktion und ZNS Myelinisierung Studie verwendet. Dieses Video wird gezeigt, wie zu isolieren und zu wachsen diese CNS aggregierten Kulturen aus E16 Rattenhirn. Ferner ist aus dem gleichen Gehirn Dissektion kann hochangereichertes regelmäßigen dissoziierten neuronalen Kulturen leicht erhalten werden und für verschiedene Studien über ZNS-Neuronen oder für Co-Kulturen mit anderen Zellen.
Protokoll
Vorbereitung vor der Dissektion
Chirurgische Instrumente: sterilisieren alle Dissektion Schere und Pinzette von Autoklaven
Deckglas Reinigung:
- Weichen Sie alle Deckgläser (15mm im Durchmesser für 24-Well-Platte) in 1L Gras Becherglas in 33% HCl für mindestens 24 h
- Waschen mit fließendem Wasser für 10 min mit gelegentlichen schütteln, um alle verbleibenden HCl zu entfernen
- Spülen mit Millipore-Wasser
- Ablassen von Wasser aus
- Soak Deckgläser in 95-98% Ethanol
- Transfer Deckgläser zu einem sauberen Tuch auf einem flachen Teller und an der Luft trocknen die Deckgläser
- Transfer Deckgläschen in ein Becherglas, mit Alufolie abdecken und Autoklaven
Hinweis: Deckgläser kann in diesem Stadium gespeichert werden - Legen Sie individuelle Deckglas in die Kultur-Platten. Bereit für die Beschichtung
Deckglas-Beschichtung:
- Verdünnen Sie 100 x Lager von Poly-D-Lysin (PDL, 10 mg / ml in 0,5% Rinderserumalbumin in PBS, als Aliquots bei -20 ° C gelagert) mit PBS und Filter-sterilisiert (0,22 um)
- Coat Deckgläser mit 1 x PDL-Lösung (~ 0,15 ml / cm 2) für 2 h bei 37 ° C im Brutschrank
- Entfernen PDL-Lösung und 3 x waschen mit sterilem ddH 2 O und trocken Deckgläser komplett
Hinweis: Coat genug Deckgläser / Platten für jede Sektion. PDL-beschichtete Deckgläser kann für ein paar Wochen bei 4 ° C gelagert werden
Medien und Lösungen
Dissection (DM): Verwenden Sie sterile eiskalt Hanks Balanced Salt Solution (w / o Ca 2 +, Mg 2 +) (HBSS, Invitrogen 14175) ergänzt mit 10 mM HEPES (Invitrogen 15630).
Aggregate Kulturmedien: Die DMEM/NBB27 Medium enthält DMEM / Neurobasal (1:1 vol: vol), 2% B27, 1 x Sato, 0,5 mM Natriumpyruvat, 0,75 Glutamax, 60μg/ml N-Acetylcystein, 5 ug / ml Insulin, 10nm d-Biotin und 1% Penicillin / Streptomycin. Um 100 ml des Aggregats Kulturmedium mischen 50 ml DMEM (w / o Pyruvat / Glutamin, Invitrogen 11960), 50 ml Neurobasal Medium (Invitrogen 211034), 375 ul Glutamax (100 x, Invitrogen 35.050), 5,5 mg Natrium-Pyruvat (Sigma p2256), 2 ml B27 (Invitrogen 17504), 6,3 mg N-Acetylcystein (Sigma A8199), 1 ml Sato Lager (100 x Lager, siehe unten), 25 ul d-Biotin Lager (4000 x Lager, 40 uM in PBS als Aliquots bei -20 ° C. Sigma B4639), 100 ul von Insulin (1000 x Lager, 5 mg / ml in 0,01 N HCl als Aliquots bei -20 ° C gelagert, Sigma 16634) und 1 ml Penicillin gespeichert / Streptomycin (100 x Lager, Invitrogen 15140), Filter-sterilisiert und bei 4 ° C.
Sato 100 x Stammlösung: Zu 40 ml der zu machen: Mix 40 ml Neurobasal mit 400 mg apo-Transferrin (Sigma T2252), 400 mg BSA (Sigma A9647), 10 ul von Progesteron (25 mg / ml Ethanol, als gespeicherte Aliquots bei -20 ° C. Sigma P8783), 64 mg Putrescin (Sigma P7505) und 40 ul von Natriumselenit (30 nM in PBS, als Aliquots bei -20 ° C gelagert, Sigma S5261). Filter sterilisieren Sato Stammlösung und speichern als Aliquots bei -20 ° C.
Neuron plating Medium (PM): Neurobasalmedium, 2% B27, 2 mM Glutamin (100x Lager, Aliquots bei -20 ° C, Invitrogen 25030 gespeichert), 25 um Glutaminsäure (100 Aktien, bei -20 ° C gelagert) und 1% Penicillin / Streptomycin.
Neuron Kulturmedium (CM): Neurobasalmedium, 2% B27, 2 mM Glutamin (100x Lager, Aliquots bei -20 ° C gelagert) und 1% Penicillin / Streptomycin.
5-FdU Lager: 100x Lager, 1 mM 5-Fluor-2'-desoxyuridin (Sigma F0503) and1mM Uridin (Sigma U3003) in Neurobasalmedium. Filter sterilisiert und gelagert als Aliquots bei -20 ° C.
Papainverdau Lösung (make frisch vor Dissektion):
- Lösen 3,2 mg L-Cystein (Sigma C-7352) in 4ml DM
- Der pH-Wert auf etwa 7,4 mit 1N NaOH (Test auf pH-Teststreifen) und im Wasserbad bei 37 ° C
Hinweis: Führen Sie den nächsten Schritt nach rechts, bevor Gewebe Verdauung (siehe unten). - Add Papain, um eine endgültige Konzentration von 20 Einheiten / ml
- Filter sterilisieren (0,22 mm), und in Wasserbad bei 37 ° C
Trypsin-Inhibitor-Lösung (make frisch vor Dissektion):
- Lösen Sie 0,2 g Trypsin-Inhibitor (Sigma T7295) in 20ml DM
- Überprüfen Sie pH und pH-Wert auf ~ 7,4 mit 1 N NaOH
- Filter sterilisieren und in Wasserbad bei 37 ° C
Brain-Dissection
Setup:
- Sterilisiert Zangen und Scheren
- 70% Ethanol
- Saubere Seidenpapier und DIAPer Pad auf der Bank
- 10cm Petrischalen mit eiskaltem DM für Gebärmutter und Fötus auf der Bank
- Ice Plattform Dissektionsmikroskop
- 2-3 6cm Gerichte mit DM auf Eis
- Warm PM in einem 37 ° C Wasserbad
- Euthanize eine schwangere Sprague-Dawley Ratten (E16) nach einem Verfahren von Ihrem Institutional Animal Care genehmigt und uns Committee (IACUC)
- Legen Sie die Ratte auf die Windel-Pad und spay Alkohol auf die Bauchregion
- Sie mit einer Pinzette auf die Bauchhaut und eine Schere zu halten, um eine V-Form Schnitt schneiden nur die Haut
- Gespreizten der Haut und verwenden Sie ein anderes sterilisiert Pinzette und Schere, um durch die Muskelschicht geschnitten
- Entpacken Sie die Kette der Embryosäcke und überführen sie in eine 10 cm Schüssel mit eiskaltem DM
- Mit einer Mikrodissektion Schere, vorsichtig jedem Embryo aus dem Sack und das Gehirn von jedem Embryo, und legen Sie befreite Gehirn in eine saubere Schüssel mit 10cm DM auf ein Eis-Plattform
- In einem Laminar Kapuze und unter einem Dissektionsmikroskop, entfernen Mittelhirn / Hinterhirn Abschnitte, und verwenden Sie feinen Pinzette Meningen zu entfernen, und übertragen Sie die gereinigt Kortex / Hippocampus, eine neue 6cm Schale mit DM auf einen Eisbeutel
Hinweis: In dieser Phase wird das Gewebe bereit für die Enzym-Verdauung. - Machen Papain und Trypsin-Inhibitor-Lösung und Filter sterilisieren
- Entfernen Sie überschüssiges DM aus Rinden / hippocampi
- Add 4ml der vorbereiteten Papainverdau Lösung
- Übertragen Sie alle Inhalte auf einen 50ml Tube und Ort der Falcon-Röhrchen in ein Wasserbad bei 37 ° C für genau 5 min
- Entfernen Papain-Lösung mit Pipette
- Add 5ml Trypsin-Inhibitor-Lösung, wirbeln die Röhre, und in einem Wasserbad bei 37 ° C für 2-3 min
- Entfernen Trypsin-Inhibitor-Lösung
- Wiederholen Sie Schritt 13 und 14 dreimal
- Fügen Sie 20ml warmen PM
- Verreiben, bis alle Klümpchen verschwunden sind (~ 20-30 mal)
- Zentrifuge bei 100xg für 7min
- Das Pellet in 10ml PM und waschen zweimal durch Zentrifugation
- Das Pellet in 10ml PM für regelmäßige Neuron Kulturen oder in NBB27/DMEM für aggregierte Kulturen
- Pass die Zellen durch ein 70μm-Zelle Siebe
- Graf lebenden Zellen
- Gehen Sie zu aggregieren Kulturen wie unten beschrieben oder Platte die Zellen für die regelmäßige Neuronenkulturen
Hinweis: Bei diesem Schritt, hoch angereichertes Neuron Kulturen können durch Ausplattieren der dissoziierten Zellen auf PDL-Beschichtung Platten bei einer Dichte von 200-640 Zellen / mm 2 je nach Zweck der Experimente erreicht werden. Nachdem die Zellen gebunden haben (~ 2-4h), ersetzen Medium mit warmen Uhr. Wenn Kultivierung für längere Zeit, am Tag 4, ersetzen Sie die Hälfte des Mediums mit warmem CM. Für hochreine neuronalen Kulturen, mitotische Inhibitor 5-FdU (Endkonzentration 10 nM) sind DIV2 hinzugefügt werden, um nicht-neuronalen Zell-Proliferation (dh während DIV2-3) zu hemmen. Nach der Erholung in CM für 2 Tage werden die Zellen Puls wieder mit 5-FdU für weitere 2 Tage (DIV 6-7) durch eine vollständige Mediumwechsel behandelt, gefolgt. Danach ersetzen die Hälfte des Mediums mit frischem, warmen CM alle 3-4 Tage. Neuronen sind für bis zu 4 Wochen lebensfähig.
Aggregates Vorbereitung und Beschichtung
- Suspend dissoziierten Zellen in NBB27/DMEM Medium mit 1x Sato, 10ng/ml CNTF und 10 um Forskolin bei einer Dichte von 2x10 6 Zellen / ml
- Transfer-2ml Zellsuspension in jede Vertiefung einer unbeschichteten 6-Well-Platte
- Kultur für 3 Nächte. Jeder Tag, sanft resuspendieren die Zellen einmal mit einem P1000 Pipetman
Hinweis: Die Zellen beginnen zu Aggregaten (Abbildung 1). - Am Tag vor der gesamten Beschichtung, beschichten Platte / Deckgläser mit Matrigel:
- Verdünnen Lager Matrigel (growth factor reduziert, BD Biosciences 354230) 1:20 mit kaltem DMEM auf Eis
Hinweis: Matrigel Aliquots sollten pro Hersteller-Protokoll vorbereitet werden. Alle Tipps, sollte Eppendorf-Röhrchen und Lösungen für die Herstellung Aliquots der Bestand sich kalt an Matrigel Polymerisation zu vermeiden. Aliquots von Matrigel werden bei -80 ° C gehalten und wieder aufgetaut bei 4 ° C. - Coat zuvor PDL-beschichtete Deckgläser mit 300μl/well der verdünnten Lösung Matrigel über Nacht in einem 37 ° C Inkubator
- Mit warmem PBS, dann waschen Teller mit warmen sterilen ddH 2 O und lassen Sie die Platten in den Inkubator.
- Verdünnen Lager Matrigel (growth factor reduziert, BD Biosciences 354230) 1:20 mit kaltem DMEM auf Eis
- 3 Tage nach der Aggregatbildung, sanft die Zellen wieder und Sieb die Suspension durch ein 200 um Maschenweite in ein 50ml Falcon-Röhrchen. Lassen Aggregate zum Boden des Röhrchens durch die Schwerkraft (~ 3-5min) begleichen
- Entfernen Sie vorsichtig überstehende
- Add Medium vorsichtig resuspendieren der Aggregate und lassen Sie sie wieder absetzen. Wiederholen Sie diesen Vorgang mehrmals, um abgestorbene Zellen, einzelne Zellen und Ablagerungen zu entfernen. Verwenden Mikroskop zu prüfen, ob der Überstand enthalten noch nicht aggregierten Zellen und Fremdkörpergefühls
- Vorsichtig resuspendieren die Aggregate im gleichen NBB27/DMEM Medium (Abbildung 1) und zählen Aggregate
- Passen Sie die Dichte der Aggregate zu etwa 25-30 aggreggats/50ul
- Transfer-Aliquots (500-1000μl) des Aggregats Suspension 2ml Eppendorf-Röhrchen für die Beschichtung
Hinweis: Da Aggregate zu beruhigen, um den Boden der Rohre neigen, ist es wichtig, mehrere Rohre des Aggregats Aufhängung für die Beschichtung zu machen. Vorsichtig resuspendieren die Aggregate häufig vor der Aussaat sie auf beschichtete Deckgläser oder Kultur Platten ähnliche Anzahl von Aggregaten auf jeder Deckglas vernickelt gewährleisten. - Nehmen Sie die Kultur Platte mit Matrigel-beschichteten Deckgläser Inkubator. Remove-Lösung aus jeder Vertiefung, waschen Sie die Deckgläser mit warmem PBS und ddH 2 O, und dann kurz antrocknen. Sie sind nun für insgesamt Aussaat bereit
- Invert ein Röhrchen mit insgesamt Aufhängung, damit sie gleichmäßig vor der Aussaat verteilt werden. Legen Sie 50 ul der aggregierten Suspension in die Mitte jedes Deckglas, und legte sanft die Platte zurück zum Inkubator ohne weitere Störung zu ermöglichen Aggregate gleichmäßig Wert auf das Deckglas
Hinweis: Die Dichte der Aggregate ist von entscheidender Bedeutung. Wenn Aggregate ausgesät sind zu nahe beieinander oder wenn die Aussaatdichte hoch ist, neigen sie dazu, miteinander verschmelzen, wie sie wachsen. - Fügen Sie zusätzliche DMEM/NBB27medium (500 ul) in jede Vertiefung 4-6 h später oder am nächsten Morgen früh
- Um die Aggregat-Kultur, die Hälfte ändern das Medium alle 3-4 Tage. Wenn Veränderungen mittel, darauf achten, nicht zu den Aggregaten zu stören und dies wird durch Zugabe von Medium sanft entlang der Seitenwand des gut gemacht.
Hinweis: Nur wenige Stunden nach der Aggregate an die Platte, Neuritenwachstum von der Aggregate beobachtet werden können. Axone wachsen schnell in den ersten zwei Wochen und bilden reichlich Verbindungen zwischen den Aggregaten (Abbildung 2). Gliazellen Vorfahren radial wandern aus der Aggregate und differenzieren im Laufe der Zeit in Astrozyten und Oligodendrozyten reifen.
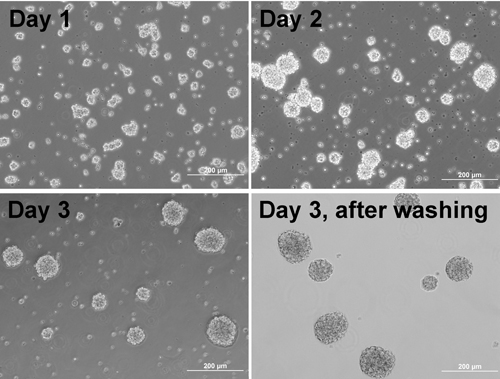
Abbildung 1. Phase kontrastreiche Bilder von Zellen bilden Aggregate an verschiedenen Tagen und Aggregate nach dem Waschen.

Abbildung 2. Phase kontrastreiche Bilder eines Aggregats Kultur 2 und 12 Tage nach ausgesät auf Matrigel-beschichteten Deckgläschen.
Diskussion
Frühe Studien berichteten Bildung von Synapsen und reife Myelin in Rotation vermittelte frei schwebenden aggregierten Kulturen 1. Das ZNS Aggregat-Kultur hier beschriebene System vereint serumfreies Wachstum von multipotenten Vorläuferzellen in dreidimensionalen Aggregaten mit dem Komfort der traditionellen 2D-Kulturen auf Analysen der Zell-Entwicklung, Migration und Differenzierung in vitro zu erleichtern. Das System kann modifiziert und für neurale Vorläuferzellen verwendet werden Stam...
Danksagungen
Diese Studie wurde teilweise durch eine Anschubfinanzierung von der Texas A & M University finanziert
Referenzen
- Matthieu, J. M. Myelination in rat brain aggregating cell cultures. Neuroscience. 3, 565-56 (1978).
- Chen, Y. i. n. g. Isolation and culture of rat and mouse oligodendrocyte precursor cells. Nat. Protocols. 2, 1044-10 (2007).
- Watkins, T. A., Emery, B., Mulinyawe, S., Barres, B. A. Distinct stages of myelination regulated by gamma-secretase and astrocytes in a rapidly myelinating CNS coculture system. Neuron. 60, 555-55 (2008).
- Svenningsen, A. F., Shan, W. e. i. -. S. o. n. g., Colman, D. a. v. i. d. R., Pedraza, L. i. l. i. a. n. a. Rapid method for culturing embryonic neuron-glial cell cocultures. Journal of Neuroscience Research. 72, 565-56 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten