Method Article
蛍光活性化細胞選別(FACS)によって特定の細胞集団の精製
要約
細胞集団の生物学的、化学的分析を必要とする多くの科学的研究のために細胞は純度の高い状態になっている必要があります。蛍光活性化細胞選別(FACS)は、純粋な細胞集団を取得するための優れた方法です。
要約
実験的および臨床研究は、しばしば高度に精製された細胞集団を必要とする。 FACSは、既知の表現型の細胞集団を精製するために最適な手法です。浄化の他の大部分のメソッドは、パン、補体の枯渇と磁気ビーズの分離などがあります。しかし、FACSには他の利用可能なメソッドに比べていくつかの利点があります。 FACSは、標的細胞集団は、差動のマーカーの密度に基づいて分離を必要と識別するマーカーの非常に低いレベルを表現するとき、または細胞集団際に、希望する人口の非常に高い純度が要求される好ましい方法である。さらに、FACSはそのような遺伝子組み換え蛍光タンパク質マーカーとして内部染色や細胞内タンパク質の発現に基づいて細胞を、単離するためにのみ利用可能な浄化技術です。 FACSは、大きさ、粒度及び蛍光に基づいて、個々の細胞の精製が可能になります。目的の細胞を精製するためには、まず、目的の細胞集団(1)上の特定の表面マーカーを認識する蛍光タグ付きモノクローナル抗体(mAb)で染色されています。未染色の細胞の負の選択も可能です。 FACS精製は能力と適切なソフトウェアをソートすると、フローサイトメーターを必要とします。 FACSの場合は、懸濁液中の細胞がレーザーの目の前に単一のセルを含む各液滴のストリームとして渡されます。蛍光検出システムは、細胞の所定蛍光パラメータに基づいて目的の細胞を検出します。楽器は、目的の細胞を含む液滴に電荷を適用し、静電偏向システムは、適切なコレクションチューブ(2)に帯電液滴のコレクションを容易にします。染色し、それによってソートの成功は、識別マーカーとモノクローナル抗体の選択の選択に大きく左右されます。ソートパラメータは、純度および収率の要件に応じて調整することができます。 FACSは、特殊な設備と人材育成を必要としますが、それは非常に細胞集団を精製単離するための最適な方法です。
プロトコル
- プロセスを開始する前に、以下の項目は、収集と準備に注意する必要があります。
- アイス
- 単一のカラーコントロールを染色する染色細胞と12 × 75 mmの流管の15 mlコニカルチューブ。
- バッファを染色:リン酸塩が緩衝生理食塩水(PBS)+ 3%ウシ胎児血清(FCS)
- ピペット
- FCブロック(必要な場合)と染色抗体。抗体は、最適な染色のために滴定する必要があります。
- 補償ビーズ
- サスペンションの緩衝液:ハンクス平衡塩溶液(HBSS)+ 25 mMのHEPES + 3%FCS
- トリパンブルーと血球計数器
- セルストレーナー(40μmのナイロン)
- コレクションチューブ:コレクションチューブの2種類が使用できます)12 × 75 mmのポリスチレンチューブ(300μlのFCSおよび25mM HEPESを含む)またはb)15 mlコニカルチューブ(1ミリリットルFCS + 25mMのHEPESを含む)。高い血中濃度とのリッチな培地は、ソートされた細胞の収集に使用することができます。
- 開始細胞集団の単一細胞懸濁液を生成する。
- オプション:補数の枯渇や磁気ソーティングなどの大量精製法により、目的の細胞集団を濃縮する。濃縮ステップの主な利点は、ソート時間を減らすことです。
- バッファを染色で細胞を1回洗浄する。
- 上清を捨て、効率的な染色のために50 × 10 6に濃度のバッファーを染色で細胞を懸濁します。
- オプション:FcRの高レベルを発現する細胞は、適切なブロッキングメソッドを使用して受容体をブロックする。選択の方法は、氷上で10〜15分間FcγRと結合するモノクローナル抗体の使用である。これらの抗体は市販されている。
- 目的の細胞集団を染色し、染色バッファーで2回洗浄に続いて暗所で氷上で20〜30分、インキュベートするための適切なモノクローナル抗体を(所定の濃度で)を追加します。オプション:このようなヨウ化プロピジウムなどの重要な染料で染色、死細胞を(5)識別に含めることができます。マルチカラー染色を使用する場合は、単一の色のコントロールが必要です。製造業者のプロトコルを使用して、単一のカラーコントロールを準備するために我々は、BDのCompBeadsを使用してください。
- 直接標識抗体を使用していない場合、適切な二次抗体またはストレプトアビジンコンジュゲートを使用して手順7を繰り返します。
- 洗浄後、培養液中に細胞を再懸濁し、トリパンブルーなどの生体染色色素を用いて細胞濃度を決定する。
- 15〜20細胞濃度を調整する× 10 6個 / ml。ソート中に測定器を詰まらせることができるフォームのクラスタ、その細胞集団のために、ストレーナを介して細胞にフィルタをかける。
- 設定し、セルソーターを最適化する。フローサイトメーターのセットアップのプロセスは、製造と適切な訓練を受けた者のみが行うようにニーズに応じて変化する。
一般的な推奨事項は次のとおりです。- ソートされる細胞の種類に応じて、適切なノズルを選択してください。
- 滅菌ソートの場合、楽器を滅菌する。
- レーザーが機能しているかどうかを確認するためにビーズで機器の品質管理を実行し、そしてそれは正確にソートされる。
- 必要なコレクションのデバイスをインストールし、サイドストリームを設定します。
- (私たちのBD FACSアリア三レーザーを持っているし、9色まで検出することができる)使用できる蛍光ラベルを決定するために設定する測定器のレーザーと検出器を見てください。
- 一度蛍光ラベルはセルソーターで使用されるか決定される、報酬は(以下で説明するように)行うことができます。
- 陰性対照サンプルと単一の陽性コントロールを使用して補償を行います。報酬は、2つの検出器間のスペクトルの重複を削除する必要があります。それは、その補償は証拠を欺くされていない注意することは適切であり、逆にどのように鮮やかな特定のマーカー染色、そして暗く、負の集団の間で貧しい人々の解像度につながる可能性が低い自家蛍光を持つ細胞の蛍光による影響を受けます。
最良の結果を得るには、実験的なデザインは、低発現を持っているか、既知の染色パターンを持っていないそのマーカーで明るい蛍光色素を使用して含める必要があります。細胞集団と高度に発現している間に良好な分離を提供するマーカーは、赤色または紫色レーザーで励起されたもののような二量体の蛍光色素で使用する必要があります。- 補償は、マウス、ラット、またはラット/ハムスターからの免疫グロブリンのκ軽鎖に特異的な抗体に結合されているポリスチレン微粒子である補償のビーズ、で行うことができます。ビーズは、染色堅牢な信号を持っているし、実験試料と同じ蛍光体を持っている単一の染色されたコントロールを作成する簡単な方法を提供するのは簡単です。
- のために前方散乱光(FSC)と側方散乱(SSC)、および一つのヒストグラムを表示するには、変量プロットを含むテンプレートを設定する使用されるそれぞれの蛍光色素。
- 陰性コントロールチューブを実行し、規模の利息の人口を配置する前方散乱光(FSC)と側方散乱(SSC)を調整します。
- ヒストグラムの一番左側の部分に負の人口または自己蛍光を配置する蛍光PMTの設定を調整します。
- 陰性コントロールチューブを記録。
- 単一の陽性対照チューブを実行し、各チューブのデータを記録する。
- ヒストグラム上のデータの正の部分と、ヒストグラムの負の部分に別の区間のゲートの周りに間隔のゲートを描きます。
- 手動補正は、それがネガの中央値と等しくなるまで、中央値(中央値は対数スケールで平均よりも中央の傾向のよりよい推定値である)陽性のを調整することによって行われます。これは、実験に用いた蛍光色素のラベルのそれぞれに対して行う必要があります。
- 中央値を調整するには、どちらかの上位または下位の各蛍光パラメータの一致のための中央値になるまでにできる限り近づけることのスペクトルオーバーラップ値を調整します。
- 補償は、解析ソフトウェアで自動的に行うことができます。自動補正は、実験で使用されるすべての蛍光体の代数行列を計算するために補償のコントロールから記録されたデータを使用しています。これらの値は、原色の検出器への出血している非原色の貢献を引くために使用されます。
- ソートする実験的なサンプルを記録し、関心の集団を定義するためにゲートのツールおよびサブセット化メソッドを使用します。
- FSC対SSCを表示し、ゲートに関心の人口をゲーティングツール、多角形、長方形、間隔または象限を使ってドットプロットで実験的なテンプレートを設定します。散布図は、細胞のタイプに区別される細胞の物理的なプロパティが表示されます。
- 蛍光ゲーティングの戦略を決定する最良の方法は、蛍光マイナス1(FMO)コントロールを使用することです。 FMO制御管で実験に使用されるすべての試薬は、関心の一つを除いて含まれています。 FMOはぼんやりとステンド集団と幅広い負の集団を区別するのに役立ちます。
- 実験的なチューブ内にゲートを配置する場所を決定するためにFMOのチューブから記録されたデータを使用してください。
- ゲートが決定したら、ゲートが外部のコレクションチューブにソートを選択することができます。最大4つのゲート(または集団)が利用できる計装に応じて一度に並べ替えることができます。
- 偏向板をオンにし、サンプルを並べ替え、4℃での実験試料チューブを実行します。 5 × 10 5 -1.5 × 10 6細胞を12 × 75 mmのチューブに並べ替えることができますし、1.5 × 10 6 - 4.5 × 10 6細胞を15 mlコニカルに並べ替えることができます。
- セルの必要数を取得したら、手動でソート停止。
- ソートされた細胞集団の純度を決定するために後のソートの解析を行います。
代表的な結果
ここでは、マウス脾臓BおよびCD4 T細胞のソーティング(図1)の結果を示している。脾細胞をPEテキサスレッド標識抗マウスB220、FITC結合抗マウスTCRβおよびB細胞(B220 +TCRβ - )とCD4 T細胞(CD4 +TCRβ+を識別するために、CD4抗マウスAlexafluor - 700 -共役で染色した)。並べ替えは、BD FACS Ariaの楽器を行った。 B細胞の純度をソートした後に> 97%であり、CD4 T細胞の純度は> 98%であった。
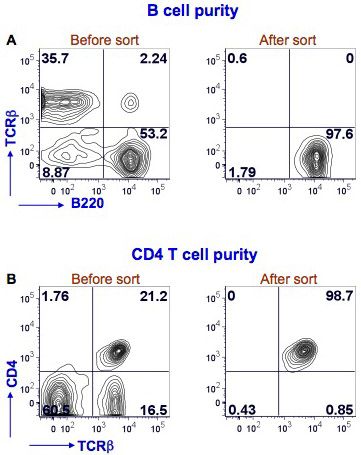
図1。脾臓B細胞とCD4 FACS後のT細胞の純度。マウス脾細胞を抗マウスB220、TCRβおよびCD4抗体で染色した。 B細胞のFACSは、B220 +TCRβ - 細胞(図1A、左のパネル、右下の象限)にゲートでBD FACSのアリアを用いて行った。ポストソートの解析は、B細胞(図1A、右側パネル)の純度を決定するために行われました。 B220染色は、y軸上にx軸とTCRβ染色で示されています。 CD4 T細胞のFACSは、TCRβ+ CD4 +細胞のゲーティングにより、同一のフローサイトメーター(図1B、左のパネル、右上の象限)を用いて行った。ポストソートの解析は、CD4 T細胞(図1B、右のパネル)の純度を決定するために行われました。 TCRβ染色は、x軸とy軸に染色CD4に表示されます。各象限におけるパーセント陽性細胞が示されています。
ディスカッション
FACSは、ソートされた人口の非常に高い純度(95〜100%)を得ることができるの関心の細胞集団を、精製するための高度なテクニックです。したがって、この手法は、高純度の必須要件(例えば、マイクロアレイ解析)ここで、実験のために特に重要です。細胞集団が毎週発現される表面マーカー上またはときに二つ以上の集団が同じ表面マーカーの発現の異なるレベルを持つ精製する必要が基づいて精製する必要があるときにFACSは浄化の他の可能な方法に比べて特に有利である。たとえば、辺縁帯の精製B細胞(B220 + CD21 ハイ CD23 INT /低 )と濾胞性B細胞(B220 + CD21 int型/低 CD23 HI)CD21及びCD23の発現レベルに基づいて。 FACSの別の成長アプリケーションは、個々のセル(3,4)の分析を可能にする単一の細胞選別です。 FACSはまた、一般的に、緑色蛍光タンパク質タグタンパク質(5)のような遺伝的に発現される蛍光タンパク質を発現する細胞を選別するために使用されます。滅菌ソートが実行されている場合は細胞を培養することができます。しかし、細胞の生存率と収率はソート時に損なわれる可能性があります。生存率は、ソートのために細胞依存性、最適温度を使用して、それらが容量に達した直後にコレクションチューブを処理することによって改善することができます。回復は、ポリプロピレンのコレクションチューブを使用して断続的に血清リッチメディアと反転コレクションチューブにソートされた細胞を収集し、最適な温度でコレクションチューブを維持し、〜10分(http://cyto.mednet.ucla.eduために選別された細胞を遠心分離することによって増加することができます/ Protocol.htm)。
超高速選別機の開発は、臨床現場でのソートの流れの応用の可能性を拡張しました。 FACSの潜在的な臨床応用は、人間の精子と病気の早期検出を(6,7)ソート治療目的のヒト血液から血液幹細胞の精製、癌治療への応用、羊水穿刺の交換を、含まれています。
多色の染色に、抗体の選択は重要なステップであり、蛍光色素は、それぞれ特定の楽器のための検出システムに基づいて選択されています。セルソーターを販売し、レーザーの構成は、ユーザーのニーズに応じて変化する企業の数があります。従って1つは、単に互換性を確認せずに発表された研究で使用されているまったく同じ抗体を使用することはできません。最適な抗体の選択のために、一つは検査されているタンパク質の発現レベルを考慮する必要があります。薄暗い蛍光色素を高発現の表面マーカー(8)の染色に使用することができますが、一般的で、明るい可能な蛍光タグ抗体は、ぼんやりと表現される表面マーカーを染色するために使用する必要があります。さらに、抗体は、それらの発光スペクトルの間で重なるように選択されるべき最小限に抑えられます。多色の染色の場合、それはスペクトルの重なりがないことを蛍光色素を選択することは極めて困難である。このような状況では、補償が実行されます。
補償は、数学的に検出器(8-10)によって測定可能である、様々な蛍光色素の排出スペクトルとの間の蛍光の重複を排除する必要があります。つまり、一方の蛍光色素からの蛍光のオーバーラップは、別の蛍光色素の排出スペクトルから減算されます。補償の計算は、多色の染色(9、10)に使用される各蛍光色素のための未染色の制御と単一の陽性コントロールが必要です。補償は、細胞やビーズを用いて行うことができる。ビーズは、染色堅牢な信号を持っているし、実験試料と同じ蛍光物質を持っている単一の染色されたコントロールを作成する簡単な方法を提供するのは簡単です。興味の細胞表面の蛋白質が低レベルで発現され、関心の細胞集団が最初の出発細胞集団に制限された場合に、補償のビーズは、特に有利である。
抗体が選択されると、その活性は滴定分析を行うことによって最適化する必要があります。 FACSのマシンは非常に強力なレーザーを持っている場合、これは特に重要です。染色抗体の準最適濃度の使用は、総細胞集団から目的の細胞集団の貧しい人々に分離されることがあります。高い抗体濃度の使用は、抗原非特異的な染色のための機会を増加させる。したがって、抗体の滴定は、正の人口と最小のバックグラウンド染色(8)の最大の明るさを与える抗体濃度の選択が可能になります。
FACSは細胞の亜集団を精製するための標準技術です。これは、単一の細胞懸濁液が生成され、抗体が目的の細胞集団を同定するために利用できることができる任意のセル型を分離するのに使用できます。 FACSは、選択の方法であるとき、Highly純粋な細胞集団が必要です。
謝辞
我々は、フローサイトメトリーコアの使用の彼のサポートのために博士はビルのCashdollarを感謝したいと思います。
参考文献
- Herzenberg, L. A., De Rosa, S. C. Monoclonal antibodies and the FACS: complementary tools for immunobiology and medicine. Immunol Today. 21, 383-390 (2000).
- Givan, A. L. . Flow cytometry first principles. , 273-273 (2001).
- Hewitt, Z., Forsyth, N. R., Waterfall, M., Wojtacha, D., Thomson, A. J., McWhir, J. Fluorescence-activated single cell sorting of human embryonic stem cells. Cloning Stem Cells. 8, 225-234 (2006).
- Walker, A., Parkhill, J. Single-cell genomics. Nat Rev Microbiol. 6, 176-177 (2008).
- Sorensen, T. U., Gram, G. J., Nielsen, S. D., Hansen, J. E. Safe sorting of GFP-transduced live cells for subsequent culture using a modified FACS vantage. Cytometry. 37, 284-290 (1999).
- Diamond, R. A., DeMaggio, S. . In living color: Protocols in flow cytometry and cell sorting. , 800-800 (2000).
- Karabinus, D. S. Flow cytometric sorting of human sperm: MicroSort clinical trial update. Theriogenology. 71, 74-79 (2009).
- Perfetto, S. P., Chattopadhyay, P. K., Roederer, M. Seventeen-colour flow cytometry: unravelling the immune system. Nat Rev Immunol. 4, 648-655 (2004).
- Herzenberg, L. A., Tung, J., Moore, W. A., Parks, D. R. Interpreting flow cytometry data: a guide for the perplexed. Nat Immunol. 7, 681-685 (2006).
- Tung, J. W., Heydari, K., Tirouvanziam, R., Sahaf, B., Parks, D. R., Herzenberg, L. A. Modern flow cytometry: a practical approach. Clin Lab Med. 27, 453-468 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved