Method Article
Floresan Aktive Hücre Ayırma (FACS) Özgül Hücre Nüfus Arıtma
Özet
Hücrelerin hücre popülasyonlarının bir biyolojik ve kimyasal analiz gerektiren pek çok bilimsel çalışmalar için saflık yüksek bir devlet olmalıdır. Floresan aktive edilmiş hücre sıralama (FACS), saf hücre popülasyonlarının elde etmek için üstün bir yöntemdir.
Özet
Deneysel ve klinik çalışmalarda genellikle hücre popülasyonları son derece saflaştırılmış gerektirir. FACS bilinen fenotip hücre popülasyonlarının arındırmak için tercih edilen bir tekniktir. Arınma diğer dökme yöntemleri kaydırma, tamamlayıcı tükenmesi ve manyetik boncuk ayırma içerir. Ancak, FACS, mevcut diğer yöntemlere göre bazı üstünlükleri vardır. FACS hedef hücre popülasyonu diferansiyel marker yoğunluğuna göre ayırma gerektiren çok düşük bir seviyede tespit marker ifade ya da hücre popülasyonlarının zaman, istenilen nüfusun çok yüksek saflıkta gerekli olan tercih edilen bir yöntemdir. Buna ek olarak, FACS gibi genetiği değiştirilmiş floresan protein marker olarak iç boyama ya da hücre içi protein ifade hücreleri izole etmek için sadece mevcut arıtma tekniğidir. FACS sağlar, tek tek hücrelerin boyutu, taneciklik ve floresan dayalı arıtma. Ilgi hücreleri arındırmak için, ilk, istenen hücre popülasyonu (1) özel yüzey belirteçleri tanır floresan monoklonal antikorlar (mAb) ile boyandı. Lekesiz hücrelerinin Negatif seçim de mümkündür. FACS arıtma kapasitesi ve uygun yazılım sıralama ile bir akış sitometresinin gerektirir. FACS, süspansiyon hücrelerin her biri bir lazer önünde tek bir hücre içeren damlacıklar bir akım olarak aktarılır. Floresan algılama sistemi hücreleri, hücrelerin önceden belirlenmiş floresan parametreler dayalı ilgi algılar. Cihaz ilgi ve elektrostatik saptırma sistemi, uygun toplama tüpleri (2) içine ücret damlacıkları toplama kolaylaştıran bir hücre içeren damlacık bir ücret geçerlidir. Boyama ve böylece sıralama tanımlayıcı belirteçler ve mAb seçim seçim başarısı büyük ölçüde bağlıdır. Saflık ve verim gereksinimine göre sıralama parametreleri ayarlanabilir. FACS, özel ekipman ve personel eğitimi gerektirmesine rağmen, hücre popülasyonlarının yüksek oranda saflaştırılmış izolasyonu için tercih edilen bir yöntemdir.
Protokol
- Işlemine başlamadan önce, aşağıdaki öğeleri toplanmış ve hazırlanmış olması gerekir:
- Buz
- , Tek renk kontrolleri boyanması için boyama hücreleri ve 12 x 75 mm akış tüpler için 15 ml konik tüpler.
- Tampon Boyama: fosfat tamponlu salin (PBS) +% 3 fetal buzağı serumu (FCS)
- Pipetler
- Fc blok (gerekiyorsa) ve boyama antikorlar. Antikorlar optimal boyama titre edilmesi gerekir.
- Tazminat boncuk
- Süspansiyon tamponu: Hank Dengeli Tuz Çözeltisi (HBSS) + 25 mM HEPES +% 3 FCS
- Tripan mavi ve hemasitometre
- Hücre süzgeç (40 mikron naylon)
- Toplama borular: İki tür toplama tüpleri kullanılabilir) 12 x 75 mm polistiren tüpleri (300 ul FCS ve 25 mM HEPES içeren) veya b) 15 ml konik tüpler (1 ml FCS + 25 mM HEPES içeren). Yüksek serum konsantrasyonu ile herhangi bir zengin orta sıralaması hücrelerinin toplanması için kullanılabilir.
- Başlangıç hücre popülasyonu tek bir hücre süspansiyonu oluşturur.
- İsteğe bağlı tamamlayıcı incelmesi ya da manyetik sıralama gibi bir toplu arıtma yöntemi ile istenilen hücre popülasyonu için zenginleştirin. Zenginleştirme adım ana avantajı sıralama süresini kısaltır.
- Hücreleri tampon boyama ile bir kez yıkayın.
- Süpernatantı atın ve verimli boyama için 50 x 10 6 bir konsantrasyon tampon boyama hücrelerin tekrar süspansiyon haline getirin.
- İsteğe bağlı: FCR yüksek düzeylerde ifade hücreleri için uygun bir engelleme yöntemi kullanılarak reseptörlerini bloke. Tercih edilen bir yöntem 10-15 dakika buz üzerinde FcγR bağlanır mAb kullanılmasıdır. Bu antikorlar, ticari olarak mevcuttur.
- Istenilen hücre popülasyonu leke ve boyama tamponu ile iki yıkar takip karanlıkta buz üzerinde 20-30 dakika boyunca inkübe uygun mAb (önceden belirlenmiş konsantrasyon) ekleyin. İsteğe Bağlı: propidium iyodür gibi hayati bir boya, Boyama, ölü hücrelerden ayırt etmek (5) dahil edilebilir. Çok renkli boyama kullanılacak ise, tek renk kontrolleri gereklidir. Biz üretici protokolünü kullanarak tek renk kontrolleri hazırlamak için BD CompBeads kullanın.
- Doğrudan konjuge antikorları kullanarak değilse, uygun ikincil antikor veya Streptavidin konjuge kullanarak 7. adımı tekrarlayın.
- Yıkadıktan sonra, kültür ortamı hücreleri tekrar süspansiyon ve Tripan mavi gibi hayati bir boya kullanarak hücre konsantrasyonunu belirlemek.
- Hücre konsantrasyonu 15-20 ayarlayın x 10 6 / ml. Sıralama sırasında araç yapışmasına neden olabilir form kümeleri, bir süzgeç vasıtasıyla hücrelerin filtre hücre popülasyonlarının.
- Set up ve hücre sıralayıcı optimize. Bir akış sitometresinin kurma süreci üretime bağlı olarak çeşitli ve uygun şekilde eğitilmiş personel tarafından yapılması gerekiyor.
Genel öneriler aşağıdaki gibidir:- Sıralanabilir hücre tipine bağlı olarak uygun nozul seçin.
- Steril türlü enstrüman sterilize edin.
- Lazerler işleyen doğrulamak için boncuk aleti kalite kontrolünü yapmak ve doğru bir sıralama.
- Gerekli toplama cihazı takın ve yan akışları kurmak.
- (BD FACS Aria üç lazerler ve dokuz renk algılayabilir) kullanılabilir floresan etiketleri belirlemek için cihazın lazer ve dedektör bakın.
- Bir kere floresan etiketler hücre sıralayıcı ne olacağı belirlenir, tazminat (aşağıda açıklandığı gibi) yapılabilir.
- Negatif kontrol örneği ve tek pozitif kontroller kullanarak tazminat gerçekleştirin. Tazminat spektrum üst üste iki dedektör arasındaki kaldırmak için gereklidir. Tazminat aptal kanıt değildir ile ilgili ve ne kadar parlak bir belirli belirteçler leke ve loş ve negatif popülasyonları arasındaki zayıf çözünürlüğü neden düşük otofloresans hücrelerin floresans olumsuz etkilenir.
En iyi sonuç için, deneysel tasarım, düşük ifade veya bilinen bir boyanma paterni zorunda değilsiniz işaretleri ile parlak fluorochromes kullanarak içermelidir. Hücre popülasyonlarının ve yüksek olarak ifade edilir arasında iyi bir ayrım sağlayan belirleyicileri olanlar, kırmızı ya da mor lazerler tarafından heyecan gibi dimer fluorochromes kullanılmalıdır.- Kappa ışık fare Ig zinciri, fare, sıçan / bir hamster için özel bir antikor birleştiğinde polistiren mikro tazminat boncuk, telafisi yapılabilir. Boncuklar, leke güçlü bir sinyal var ve deneysel numuneler, aynı fluorofor tek lekeli kontrolleri hazırlanması kolay bir yol sağlamak için kolaydır.
- Forward scatter (FSC) ve yan dağılım (SSC) ve bir histogramı görüntülemek için iki değişkenli bir komplo içeren bir şablon ayarlamaKullanılacak her florokrom.
- Negatif kontrol tüpü çalıştırın ve forward scatter (FSC) ve yan dağılım (SSC) ölçekte ilgi nüfusu yerleştirmek için ayarlayın.
- Histogramın çok sol elini kısmı negatif nüfus veya otofloresans yere floresan PMT ayarlarını ayarlayın.
- Negatif kontrol tüpü kaydedin.
- Tek bir pozitif kontrol tüpleri çalıştırın ve her tüp için veri kaydı.
- Histogram verileri olumlu kısmı, ve histogram negatif kısmını başka bir aralık kapı etrafında bir aralık kapı çizin.
- Manuel tazminat ayarlayarak yapılır medyan medyan negatifleri eşit olana kadar pozitif (medyan ortalama logaritmik ölçekte daha merkezi eğilim daha iyi bir tahmin). Bu deneyde kullanılan florokrom etiket her biri için yapılmalıdır.
- Medyan ayarlamak için, daha düşük veya yüksek her floresan parametre maç için medyan kadar mümkün olduğunca yakından spektral örtüşme değerleri ayarlayın.
- Tazminat analiz yazılımı ile otomatik olarak yapılabilir. Otomatik tazminat deneyde kullanılan tüm fluorophores için cebirsel bir matris hesaplamak için tazminat kontrol kaydedilen verileri kullanır. Bu değerler, bir ana renk dedektör içine kanama olan birincil olmayan renk katkıları ortaya çıkarmak için kullanılır.
- Deneysel örnek sıralanabilir kaydedin ve ilgi nüfusu tanımlamak için yolluk araçları ve subsetting yöntemleri kullanabilirsiniz.
- FSC vs SSC görüntüler ve kapı ilgi nüfusun bir yolluk aracı, çokgen, dikdörtgen, aralık veya kadranda bir nokta arsa ile deneysel şablonu ayarlayın. Scatter plot hücre hücre tipi farklı fiziksel özelliklerini görüntüler.
- Floresan yolluk strateji belirlemenin en iyi yolu, floresan eksi bir (FMO) denetimleri kullanmak. FMO kontrol tüpü deneyde kullanılan tüm reaktifler, faiz biri için hariç dahildir. FMO loş lekeli nüfusları ve geniş negatif popülasyonları arasında ayrımcılık yardımcı olur.
- FMO tüpler kapıları deney tüpü içinde nereye yerleştirileceğini belirlemek için kaydedilen verileri kullanın.
- Kapıları bir kez tespit edilmiştir, kapılar dış toplama tüpleri içine sıralamak için seçilebilir. Dört kapı (ya da popülasyonlar) bir defada mevcut enstrümantasyon göre düzenlenmiş olabilir.
- 4 deneysel örnek tüp çalıştırın ° C, saptırma plakaları açın ve örnek sıralamak. 5 x 10 5 -1.5 x 10 6 hücre, 12 x 75 mm tüp ve 1.5 sıralanabilir x 10 6 - 4,5 x 10 6 hücre, 15 ml konik içine sıralanabilir .
- Gerekli sayıda hücre elde edildikten sonra, elle sıralama durdurmak.
- Sıralanmış hücre popülasyonlarının saflığını belirlemek için bir tür post-analiz gerçekleştirin.
Temsilcisi sonuçları
Biz burada fare dalak B ve CD4 T hücre sıralama (Şekil 1) sonuçları göstermiştir. Splenositlerin PE Texas Red-konjuge anti-fare B220, FITC-konjuge anti-fare TCRβ ve B hücreleri (B220 + TCRβ) ve CD4 T hücreleri (CD4 + TCRβ + tanımlamak için CD4 anti-fare Alexafluor-700-konjuge ile boyandı .) Sıralama BD FACS Aria aleti ile yapıldı. > B hücre saflık sıralama sonra% 97 ve CD4 T hücre saflık>% 98 idi.
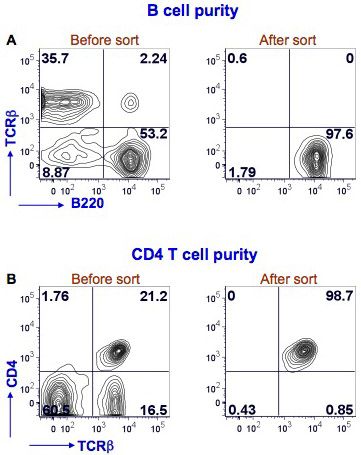
Şekil 1. Saflık dalak B hücreleri ve CD4 FACS sonra hücreler, T Fare splenositlerin anti-fare B220, TCRβ ve CD4 antikorları ile boyandı. B hücreleri için FACS B220 üzerinde yolluk BD FACS Aria kullanılarak gerçekleştirildi + TCRβ hücreleri (Şekil 1A, sol panelindeki, sağ alt kadranda). B hücreleri (Şekil 1A, sağ panel) saflığını belirlemek için bir post tür analizi yapıldı. B220 boyama, y ekseni üzerinde x-ekseni ve TCRβ boyama gösterilir. FACS CD4-T hücreleri üzerinde yolluk aynı akış sitometresi kullanılarak yapıldı TCRβ + CD4 + hücreler (Şekil 1B, sol panelindeki, sağ üst kadranda). Sonrası bir sıralama analizi, CD4 T hücreleri (Şekil 1B, sağ panel) saflığı belirlemek için yapıldı. TCRβ boyama, x-ekseni ve y-ekseni üzerinde boyama CD4 gösterilmiştir. Her çeyrekte yüzde pozitif hücrelerin gösterilmiştir.
Tartışmalar
FACS sıralanmış nüfusun çok yüksek saflıkta (% 95-100) elde edilebilir, hangi faiz hücre popülasyonlarının, arındırıcı için son derece gelişmiş bir tekniktir. Bu nedenle, bu teknik deneyler, yüksek saflıkta için temel bir gereklilik (örneğin mikroarray analizi) için özellikle önemlidir. FACS aynı yüzey marker ifade farklı düzeylerde sahip olduğu iki veya daha fazla nüfus arındırılması gerekir bir hücre haftalık ifade yüzey işaretleyici dayalı nüfus saflaştırılmış gereken veya mevcut diğer arıtma yöntemlerine göre oldukça avantajlı. Örneğin, marjinal bölge arıtma B hücreleri (B220 + CD21 hi CD23 int / düşük) ve foliküler B hücreleri (B220 + CD21 int / düşük CD23 yüksek), CD21 ve CD23 ekspresyon düzeyleri dayalı . FACS büyüyen diğer bir uygulama, tek tek hücrelerin analizi (3, 4) izin veren tek bir hücre sıralama. FACS da yaygın tür hücrelere, gibi yeşil flüoresan protein etiketli proteinleri (5) gibi genetik olarak ifade edilir floresan proteinleri ifade kullanılır. Steril bir sıralama yapılırsa hücrelerin kültür olabilir. Ancak, hücre canlılığı ve verim sıralama sırasında tehlikeye girebilir. Canlılık, sıralama için bir hücre bağımlı optimum sıcaklık ve kapasite ulaştıktan sonra hemen toplama tüpleri işleme geliştirilebilir. Kurtarma, polipropilen toplama tüpleri kullanarak, aralıklı serum zengin medya ve tersini alma tüpleri olarak sıralanır hücreleri toplamak optimal bir sıcaklık toplama tüpleri muhafaza ve ~ 10 dakika (http://cyto.mednet.ucla.edu sıralanmış hücreler santrifüj artabilir / Protocol.htm).
Ultra yüksek hızda sorters klinik ortamlarda akış sıralama uygulama geliştirme imkanı genişletmiştir. FACS potansiyel klinik uygulamalar, insan kanı, insan sperm ve hastalığın erken tespitler (6, 7) sıralama terapötik amaçlarla, kanser tedavisi uygulamaları, amniyosentez değiştirme, kan kök hücre arıtma içerir.
Çok renkli boyama, antikor seçimi kritik bir adımdır ve fluorochromes her bir araç için algılama sistemi olarak seçilmiştir. Kullanıcı ihtiyaçlarına göre hücre sorters ve lazer yapılandırma değişir satan şirketlerin bir dizi vardır. Böylece bir sadece uyumluluğu teyit olmadan Yayınlanan çalışmalarda kullanılan aynı antikorlar kullanamazsınız. Optimum antikor seçimi için, bir muayene olmak protein ekspresyon seviyesi göz önünde bulundurmalısınız. Genel olarak, en parlak florokrom etiketli antikorlar loş fluorochromes yüksek ifade yüzey belirteçleri (8) boyanması için kullanılabilir loş ifade yüzey belirteçleri leke olmalıdır. Buna ek olarak, antikorlar kendi emisyon spektrumları arasında üst üste böyle bir şekilde seçilmelidir minimum düzeydedir. Çok renkli boyama için, spektral örtüşme olduğunu florokrom seçmek için son derece zordur. Bu durumda, tazminat yapılır.
Tazminat floresan dedektörleri (8-10) ölçülebilir çeşitli fluorochromes emisyon spektrumu arasındaki örtüşme matematiksel ortadan kaldırmak için gereklidir. Diğer bir deyişle, bir florokrom floresan örtüşme başka bir florokrom emisyon spektrumu çıkarılır. Tazminat hesaplama, çok renkli boyama (9, 10) için kullanılan her florokrom için lekesiz kontrolü ve tek pozitif kontrol gerektirir. Tazminat hücreleri veya boncuk kullanılarak yapılabilir. Boncuklar, leke güçlü bir sinyal var ve deneysel numuneler, aynı fluorophores tek lekeli kontrolleri hazırlanması kolay bir yol sağlamak için kolaydır. Tazminat boncuk ilgi hücre popülasyonu başlangıç hücre popülasyonunu sınırlayan özellikle ilgi hücre yüzeyinde protein, düşük bir seviyede ifade edildiği zaman, avantajlı ve.
Antikorlar seçilmiştir sonra, kendi faaliyet titrasyon analiz yaparak optimize edilmelidir. FACS makine çok güçlü lazerler varsa bu özellikle önemlidir. Suboptimal boyama antikor konsantrasyonlarının toplam hücre popülasyonunun istenilen hücre popülasyonunun kötü ayrımı neden olabilir. Yüksek antikor konsantrasyonlarının antijen non-spesifik boyanması için şansını artırır. Bu nedenle antikor titrasyon olumlu nüfus ve minimal arka plan boyama (8) maksimum parlaklık verir antikor konsantrasyonu seçimi sağlayacaktır.
FACS hücre alt popülasyonlarının arıtma için standart bir tekniktir. Bu herhangi bir hücre tipi, tek bir hücre süspansiyonu oluşturulur ve istenilen hücre popülasyonunu belirlemek için antikorlar mevcuttur hangi ayırmak için kullanılabilir. FACS tercih edilen bir yöntemdir zaman highly saf hücre popülasyonlarının gereklidir.
Teşekkürler
Dr Bill Cashdollar Sitometrisi Core verdiği destek için teşekkür etmek istiyorum.
Referanslar
- Herzenberg, L. A., De Rosa, S. C. Monoclonal antibodies and the FACS: complementary tools for immunobiology and medicine. Immunol Today. 21, 383-390 (2000).
- Givan, A. L. . Flow cytometry first principles. , 273-273 (2001).
- Hewitt, Z., Forsyth, N. R., Waterfall, M., Wojtacha, D., Thomson, A. J., McWhir, J. Fluorescence-activated single cell sorting of human embryonic stem cells. Cloning Stem Cells. 8, 225-234 (2006).
- Walker, A., Parkhill, J. Single-cell genomics. Nat Rev Microbiol. 6, 176-177 (2008).
- Sorensen, T. U., Gram, G. J., Nielsen, S. D., Hansen, J. E. Safe sorting of GFP-transduced live cells for subsequent culture using a modified FACS vantage. Cytometry. 37, 284-290 (1999).
- Diamond, R. A., DeMaggio, S. . In living color: Protocols in flow cytometry and cell sorting. , 800-800 (2000).
- Karabinus, D. S. Flow cytometric sorting of human sperm: MicroSort clinical trial update. Theriogenology. 71, 74-79 (2009).
- Perfetto, S. P., Chattopadhyay, P. K., Roederer, M. Seventeen-colour flow cytometry: unravelling the immune system. Nat Rev Immunol. 4, 648-655 (2004).
- Herzenberg, L. A., Tung, J., Moore, W. A., Parks, D. R. Interpreting flow cytometry data: a guide for the perplexed. Nat Immunol. 7, 681-685 (2006).
- Tung, J. W., Heydari, K., Tirouvanziam, R., Sahaf, B., Parks, D. R., Herzenberg, L. A. Modern flow cytometry: a practical approach. Clin Lab Med. 27, 453-468 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır