Method Article
Purification de population cellulaire spécifique par le tri cellulaire activé par fluorescence (FACS)
Dans cet article
Résumé
Pour de nombreuses études scientifiques nécessitant une analyse biologique et chimique des populations de cellules, les cellules doivent être dans un état de pureté élevé. Fluorescence tri cellulaire (FACS) est une méthode supérieure dans laquelle d'obtenir des populations de cellules pures.
Résumé
Des études expérimentales et cliniques ont souvent besoin hautement purifiée populations de cellules. FACS est une technique de choix pour purifier les populations de cellules de phénotype connu. Autres méthodes de purification en vrac comprennent panoramique déplétion complément, et séparation magnétique perle. Toutefois, FACS a plusieurs avantages sur les autres méthodes disponibles. FACS est la méthode préférée quand une pureté très élevée de la population désirée est nécessaire, lorsque la population de cellules cibles exprime un niveau très bas du marqueur identifiant ou lorsque les populations de cellules nécessitent une séparation basée sur la densité de marqueur différentiel. En outre, FACS est la seule technique de purification disponibles pour isoler les cellules basées sur la coloration interne ou l'expression des protéines intracellulaires, comme un marqueur fluorescent protein génétiquement modifiés. FACS permet la purification des cellules individuelles basées sur la taille, la granularité et la fluorescence. Afin de purifier les cellules d'intérêt, ils sont d'abord colorées par fluorescence marqués d'anticorps monoclonaux (mAb), qui reconnaissent des marqueurs de surface spécifiques sur la population de cellules désirée (1). La sélection négative des cellules non colorées est également possible. Purification de FACS nécessite un cytomètre en flux avec tri des capacités et le logiciel approprié. Pour FACS, les cellules en suspension sont transmises comme un flux de gouttelettes avec chacun contenant une seule cellule en face d'un laser. Le système de détection par fluorescence détecte les cellules d'intérêt basé sur des paramètres prédéterminés fluorescents des cellules. L'instrument applique une charge à la goutte contenant une cellule d'intérêt et d'un système de déflexion électrostatique facilite la collecte des gouttelettes chargées dans des tubes de collecte approprié (2). Le succès de la coloration et de ce fait le tri dépend largement de la sélection des marqueurs d'identification et le choix du MAB. Paramètres de tri peut être ajusté en fonction de l'exigence de pureté et de rendement. Bien FACS nécessite un équipement spécialisé et la formation du personnel, c'est la méthode de choix pour l'isolement des populations de cellules hautement purifiées.
Protocole
- Avant de commencer le processus, les éléments suivants doivent être recueillis et préparés à:
- Glace
- 15 ml tubes coniques pour les cellules de coloration et de 12 x 75 mm pour les tubes d'écoulement coloration contrôles de couleur unique.
- Coloration tampon: tampon phosphate salin (PBS) + 3% sérum de veau foetal (FCS)
- Pipettes
- Fc bloc (si nécessaire) et d'anticorps coloration. Anticorps besoin d'être titré pour la coloration optimale.
- Indemnisation des perles
- Suspension de tampon: Solution saline équilibrée de Hank (HBSS) + 25 mM HEPES + 3% de FCS
- Bleu Trypan et hémocytomètre
- Cellule crépine (40 um Nylon)
- Tubes de prélèvement: Deux types de tubes de prélèvement peut être utilisé a) 12 x 75 mm tubes en polystyrène (contenant 300 ul de FCS et 25 mM d'HEPES) ou b) tubes de 15 ml conique (contenant 1 ml de FCS + 25 mM HEPES). Toute milieu riche avec une concentration sérique élevé peut être utilisé pour la collecte de cellules triées.
- Générer une suspension cellulaire unique de la population de cellules de départ.
- En option: Enrichir pour la population de cellules désirée par un procédé de purification en vrac telles que l'appauvrissement de compléter ou de tri magnétique. Le principal avantage de l'étape d'enrichissement est que cela réduit le temps de trier.
- Laver les cellules une fois avec coloration tampon.
- Jeter le surnageant et remettre en suspension les cellules dans la coloration de tampon à une concentration allant jusqu'à 50 x 10 6 pour la coloration efficace.
- Facultatif: Pour les cellules exprimant des niveaux élevés de FcR, bloquer les récepteurs utilisant une méthode appropriée de blocage. Une méthode de choix est l'utilisation d'un anticorps monoclonal qui se lie à FcyR sur la glace pendant 10-15 min. Ces anticorps sont disponibles commercialement.
- Ajouter le mAb appropriés (à une concentration prédéterminée) pour colorer la population de cellules désirée et incuber pendant 20-30 min sur la glace dans l'obscurité, suivie de deux lavages avec le tampon de coloration. En option: coloration avec un colorant vital, comme l'iodure de propidium, peuvent être inclus à discerner les cellules mortes (5). Si multi-couleurs coloration doit être utilisée, les contrôles sont nécessaires seule couleur. Nous utilisons CompBeads BD pour préparer les contrôles seule couleur en utilisant le protocole du fabricant.
- Si ce n'est pas l'aide d'anticorps directement conjugués, répétez l'étape 7, en utilisant l'anticorps secondaire approprié ou conjugué streptavidine.
- Après le lavage, remettre les cellules en milieu de culture et de déterminer la concentration de cellules en utilisant un colorant vital comme le bleu trypan.
- Ajuster la concentration de cellules à 15-20 x 10 6 / ml. Pour les populations de cellules qui forment des grappes, qui peut obstruer l'instrument pendant le tri, le filtrage des cellules à travers une passoire.
- Mettre en place et optimiser le trieur de cellules. Le processus de mise en place d'un cytomètre en flux est varié en fonction de la fabrication et doit être effectuée par un personnel correctement formé.
Les recommandations générales sont les suivantes:- Sélectionner la buse appropriée selon le type de cellules à trier.
- Pour sortes stérile, stériliser les instruments.
- Effectuer le contrôle qualité des instruments avec des perles de vérifier les lasers sont fonctionnement, et il est le tri de précision.
- Installer le dispositif de collecte nécessaires et mettre en place les flux secondaires.
- Regardez au laser de l'instrument et le détecteur mis en place pour déterminer les marqueurs fluorescents qui peuvent être utilisés (notre BD FACS Aria a trois lasers et peut détecter jusqu'à neuf couleurs).
- Dès qu'il est déterminé ce que les étiquettes fluorescentes sera utilisé sur le trieur de cellules, la compensation peut être effectuée (comme expliqué ci-dessous).
- Effectuer une indemnisation en utilisant l'échantillon de contrôle négatif et le contrôle positif unique. La rémunération est nécessaire de supprimer le chevauchement du spectre entre deux détecteurs. Il est pertinent de noter que la rémunération n'est pas une panacée et elle est affectée par la manière dont certains marqueurs brillamment tache, et par la fluorescence des cellules qui ont autofluorescence faible, ce qui peut conduire à une faible résolution entre populations faible et négative.
Pour de meilleurs résultats, le modèle expérimental devrait inclure l'aide fluorochromes lumineux avec des marqueurs qui ont une expression faible ou qui n'ont pas un motif de coloration connues. Marqueurs qui fournissent une bonne séparation entre les populations de cellules et sont fortement exprimés doivent être utilisés avec des fluorochromes dimère comme ceux excités par des lasers rouges ou violettes.- La compensation peut être réalisée avec des perles de compensation, qui sont des microparticules de polystyrène qui ont été couplées à un anticorps spécifique de la chaîne légère kappa des Ig de souris, le rat ou rat / hamster. Les perles sont faciles à colorer, avoir un signal robuste et offrent un moyen facile de préparer seul contrôle qui ont teinté le fluorophore même que les échantillons expérimentaux.
- Mettre en place un modèle qui comprend un graphe bivarié à afficher diffusion vers l'avant (FSC) et diffusion latérale (SSC), et un histogramme pourchaque fluorochrome qui sera utilisé.
- Exécutez le tube de contrôle négatif et ajuster la diffusion vers l'avant (FSC) et diffusion latérale (SSC) pour placer la population d'intérêt sur la balance.
- Ajustez les paramètres de fluorescence PMT à placer la population négatif ou autofluorescence dans la partie extrême gauche de l'histogramme.
- Enregistrez le tube de contrôle négatif.
- Exécuter les tubes simples de contrôle positif et d'enregistrer les données de chaque tube.
- Dessinez une porte intervalle autour de la partie positive des données sur l'histogramme, et une autre porte d'intervalle sur la partie négative de l'histogramme.
- Compensation manuelle se fait en ajustant la valeur médiane (médiane est une meilleure estimation de la tendance centrale que la moyenne sur une échelle logarithmique) des points positifs jusqu'à ce qu'elle soit égale à la médiane des négatifs. Cela doit être fait pour chacune des étiquettes fluorochrome utilisé dans l'expérience.
- Pour ajuster la valeur médiane, ajustez les valeurs spectrales de chevauchement soit supérieure ou inférieure jusqu'à ce que la médiane pour chaque match de paramètres fluorescentes aussi étroitement que possible.
- L'indemnisation peut également être fait automatiquement avec le logiciel d'analyse. La compensation automatique utilise les données enregistrées à partir des contrôles de compensation pour calculer une matrice algébrique pour tous les fluorophores utilisés dans l'expérience. Ces valeurs sont utilisées pour soustraire la contribution des non-couleurs primaires qui sont des saignements dans une couleur détecteur de primaire.
- Enregistrement de l'échantillon expérimental pour être triés et utiliser des outils et des méthodes de déclenchement de sous-ensembles pour définir les populations d'intérêt.
- Mettre en place le modèle expérimental avec un dot plot qui affiche FSC vs SSC et l'utilisation d'un outil de déclenchement, polygone, rectangle, intervalle ou quadrant de la porte de la population d'intérêt. Le nuage de points affiche les propriétés physiques de la cellule qui est distinct du type cellulaire.
- La meilleure façon de déterminer la stratégie de gating fluorescence est d'utiliser la fluorescence moins un (FMO) contrôles. Dans un tube de contrôle FMO tous les réactifs qui sont utilisés dans l'expérience sont inclus, sauf pour l'un des intérêts. La FMO permet une discrimination entre les populations faiblement colorés et larges populations négatives.
- Utiliser les données enregistrées à partir des tubes à FMO déterminer où placer les portes dans le tube expérimental.
- Une fois les portes ont été déterminés, les portes peuvent être sélectionnés pour le tri dans les tubes de prélèvement externe. Jusqu'à quatre portes (ou populations) peuvent être triées en une seule fois en fonction de l'instrumentation disponible.
- Exécutez le tube échantillon expérimental à 4 ° C, tournez sur des plaques de déviation, et de trier l'échantillon. 5 x 10 5 -1,5 x 10 6 cellules peuvent être triés dans un tube de 12 x 75 mm et 1,5 x 10 6 - 4,5 x 10 6 cellules peuvent être triés dans un cône de 15 ml.
- Une fois le nombre requis de cellules a été obtenue, arrêter manuellement le tri.
- Effectuer une analyse post-tri pour déterminer la pureté des populations de cellules triées.
Les résultats représentatifs
Nous avons montré ici les résultats pour B spléniques de souris et de tri de lymphocytes T CD4 (figure 1). Les splénocytes ont été colorés avec du PE Texas Red-conjugué anti-souris B220, conjuguée au FITC anti-souris et les TCRβ AlexaFluor-700-anti-souris conjugué CD4 pour identifier les cellules B (B220 + TCRβ-) et les cellules T CD4 (CD4 + TCRβ + ). Le tri a été effectué avec BD FACS Aria instrument. Après le tri de la pureté des cellules B est> 97% et la pureté des cellules T CD4 est> 98%.
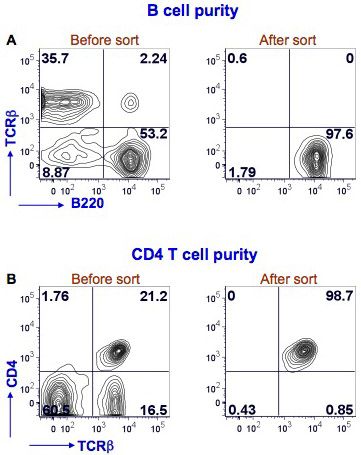
Figure 1. Pureté des cellules B spléniques et lymphocytes T CD4 après FACS. Splénocytes de souris ont été colorés avec anti-souris B220, et les anticorps CD4 TCRβ. FACS des cellules B a été effectuée en utilisant une BD FACS Aria par gating sur le B220 + TCRβ-cellules (Fig. 1A, volet de gauche, quadrant inférieur droit). Une analyse tri message a été effectuée pour déterminer la pureté des cellules B (figure 1A, le panneau de droite). Coloration B220 est indiqué sur l'axe des x et la coloration TCRβ sur l'axe des ordonnées. FACS des cellules T CD4 a été réalisée en utilisant le cytomètre de flux par les mêmes gating sur TCRβ + CD4 + (figure 1B, panneau de gauche, quadrant supérieur droit). Une analyse de tri poste a été effectuée pour déterminer la pureté des cellules T CD4 (Fig. 1B, panneau de droite). Coloration TCRβ est indiqué sur l'axe des x et CD4 taches sur l'axe des y. Les cellules positives pour cent dans chaque quadrant est montré.
Discussion
FACS est une technique très sophistiquée de purification des populations de cellules d'intérêt, dans laquelle une très grande pureté (95-100%) de la population triés peuvent être obtenues. Par conséquent, cette technique est particulièrement important pour des expériences, où une grande pureté est une exigence essentielle (par exemple l'analyse des microréseaux). FACS est particulièrement avantageux par rapport aux autres méthodes disponibles de purification où une population de cellules doit être purifié basé sur un marqueur de surface exprimées par semaine ou lorsque deux ou plusieurs populations ont besoin d'être purifié qui ont différents niveaux d'expression du marqueur de même surface. Par exemple, la purification de la zone marginale cellules B (CD21 + B220 Salut CD23 int / basse) et B folliculaire cellules (B220 + CD21 int / basse CD23 Salut) basé sur les niveaux d'expression de CD21 et CD23. Une autre application croissante de la FACS est tri cellulaire unique permettant l'analyse des cellules individuelles (3, 4). FACS est aussi couramment utilisé pour trier les cellules exprimant des protéines fluorescentes qui sont génétiquement exprimées, telles que le vert protéines protéine fluorescente marqués (5). Si une sorte stériles est effectuée, les cellules peuvent être cultivées. Cependant, la viabilité cellulaire et le rendement peut être compromise lors du tri. La viabilité peut être améliorée en utilisant une température dépendant des cellules optimales pour le tri et le traitement par les tubes de prélèvement immédiatement après avoir atteint la capacité. La récupération peut être augmentée en utilisant des tubes de prélèvement en polypropylène, la collecte de cellules triées dans le sérum rich media et des tubes de prélèvement inversant par intermittence, le maintien des tubes de prélèvement à une température optimale et la centrifugation des cellules triées pour ~ 10 min (http://cyto.mednet.ucla.edu / Protocol.htm).
Le développement de l'ultra haute vitesse trieurs a étendu la possibilité de l'application du tri des flux dans les milieux cliniques. Les applications cliniques potentielles de la FACS comprennent la purification de cellules souches sanguines du sang humain à des fins thérapeutiques, les applications dans le traitement du cancer, le remplacement amniocentèse, tri des spermatozoïdes humains et les détections précoce de la maladie (6, 7).
Pour la coloration multicolore, la sélection d'anticorps est une étape critique et fluorochromes sont choisis en fonction du système de détection pour chaque instrument en particulier. Il ya un certain nombre de compagnies qui vendent des trieurs de cellules et de la configuration du laser varie en fonction des besoins des utilisateurs. Ainsi, on ne peut pas simplement utiliser les anticorps utilisés dans exactement les mêmes études publiées sans confirmer la compatibilité. Pour la sélection d'anticorps optimal, on doit considérer le niveau d'expression de la protéine à l'étude. En général, les plus brillants disponibles anticorps marqués au fluorochrome doit être utilisé pour colorer les marqueurs de surface faiblement exprimés, tandis que fluorochromes DIM peut être utilisée pour la coloration des marqueurs de surface fortement exprimée (8). En outre, les anticorps doivent être choisis de telle manière que les chevauchements entre leurs spectres d'émission est minime. Pour la coloration multicolore, il est extrêmement difficile de choisir un fluorochrome qui n'ont pas de chevauchement spectral. Dans cette situation, la compensation est effectuée.
La rémunération est mathématiquement nécessaire pour éliminer le chevauchement entre le spectre de fluorescence des émissions des fluorochromes différents qui est mesurable par les détecteurs (8-10). En d'autres termes, le chevauchement de fluorescence d'un fluorochrome est soustrait du spectre des émissions d'un autre fluorochrome. Le calcul de la compensation requiert un contrôle sans tache et simple des contrôles positifs pour chaque fluorochrome utilisé pour une coloration multicolore (9, 10). La compensation peut être réalisée en utilisant des cellules ou des perles. Les perles sont faciles à colorer, avoir un signal robuste et offrent un moyen facile de préparer seul contrôle qui ont teinté les fluorophores même que les échantillons expérimentaux. Perles de rémunération sont particulièrement avantageux lorsque la protéine de surface cellulaire d'intérêt est exprimé à un niveau bas et quand la population cellulaire d'intérêt est de limiter dans la population cellulaire initiale de départ.
Une fois que les anticorps ont été choisis, leur activité doit être optimisée en effectuant une analyse de titration. Ceci est particulièrement important si la machine FACS a lasers très puissants. L'utilisation de concentrations suboptimales d'anticorps coloration peut entraîner une mauvaise séparation de la population cellulaire désirée de la population cellulaire totale. L'utilisation de concentrations élevées d'anticorps augmente les chances pour antigène non spécifique coloration. Par conséquent titrage d'anticorps permettant la sélection de la concentration en anticorps qui donne la luminosité maximale de la population positive et une coloration de fond minimal (8).
FACS est maintenant une technique standard pour la purification des sous-populations de cellules. Il peut être utilisé pour séparer n'importe quel type cellulaire dans lequel une suspension cellulaire unique peut être généré et les anticorps sont disponibles pour identifier la population cellulaire désirée. FACS est la méthode de choix quand highly populations de cellules pures sont nécessaires.
Remerciements
Nous tenons à remercier le Dr Bill Cashdollar pour son soutien dans l'utilisation de la cytométrie de flux de base.
Références
- Herzenberg, L. A., De Rosa, S. C. Monoclonal antibodies and the FACS: complementary tools for immunobiology and medicine. Immunol Today. 21, 383-390 (2000).
- Givan, A. L. . Flow cytometry first principles. , 273-273 (2001).
- Hewitt, Z., Forsyth, N. R., Waterfall, M., Wojtacha, D., Thomson, A. J., McWhir, J. Fluorescence-activated single cell sorting of human embryonic stem cells. Cloning Stem Cells. 8, 225-234 (2006).
- Walker, A., Parkhill, J. Single-cell genomics. Nat Rev Microbiol. 6, 176-177 (2008).
- Sorensen, T. U., Gram, G. J., Nielsen, S. D., Hansen, J. E. Safe sorting of GFP-transduced live cells for subsequent culture using a modified FACS vantage. Cytometry. 37, 284-290 (1999).
- Diamond, R. A., DeMaggio, S. . In living color: Protocols in flow cytometry and cell sorting. , 800-800 (2000).
- Karabinus, D. S. Flow cytometric sorting of human sperm: MicroSort clinical trial update. Theriogenology. 71, 74-79 (2009).
- Perfetto, S. P., Chattopadhyay, P. K., Roederer, M. Seventeen-colour flow cytometry: unravelling the immune system. Nat Rev Immunol. 4, 648-655 (2004).
- Herzenberg, L. A., Tung, J., Moore, W. A., Parks, D. R. Interpreting flow cytometry data: a guide for the perplexed. Nat Immunol. 7, 681-685 (2006).
- Tung, J. W., Heydari, K., Tirouvanziam, R., Sahaf, B., Parks, D. R., Herzenberg, L. A. Modern flow cytometry: a practical approach. Clin Lab Med. 27, 453-468 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon