このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
脊髄電気生理学
要約
電気生理学的研究のための新生児マウス脊髄の分離のデモンストレーション。
要約
新生児マウスの脊髄には神経回路をして歩行運動の発展を研究するためのモデルです。我々は、脊髄の解剖と運動研究のために使用される記録のバスの人工脳脊髄液の準備を示しています。一度解剖、脊髄腹側神経根は、腰髄内の回路を生成する中枢パターンの電気生理学的信号を記録する記録電極に接続することができます。
プロトコル
1。人工脳脊髄液(ACSF)1を準備します。まず、マグネシウムやカルシウムなしACSFの10X株式の2Lを用意。試薬はミリモルにリストされています。カタログ番号は、シグマ/アルドリッチを参照してください。
| 2リットル10倍ACSF(マグネシウムまたはカルシウムなし) | |||
| 試薬 | mMの | g/2L | カタログ |
| 塩化カリウム | 40 | 5.96 | P - 9333 |
| NaClの | 1280 | 149.61 | S - 7653 |
| NaHCO 3の | 210 | 35.28 | S - 6297 |
| のNaH 2 PO 4 | 5 | 1.38 | S - 9638 |
| グルコース | 300 | 108.12 | D - 9434 |
| 2Lに蒸留水を追加します。 | |||
我々はまた、実験間のモル濃度の調整を可能にするために50mLの水にし、MgSO 4とCaCl 2の1M溶液を調製し、カルシウムの溶液中に残っている保証する。
| 1Mカルシウムとマグネシウムの株式 | |||
| 試薬 | M | g/50mL | カタログ |
| CaCl 2の | 1 | 7.35 | C - 5080 |
| MgSO 4を | 1 | 12.33 | M - 5921 |
ACSF液が沈殿するカルシウムやカルシウムを加える前にpHを下げるためにcarbogen(95%O2 / 5%CO2)でガス処刑されている必要があります。
| 1リットルのACSF | |
| 試薬 | ボリューム |
| 10X ACSF | 100mLの |
| 1MのCaCl 2 | 1 mLの(解剖)2mLの(記録) |
| 1M MgSO 4を | 1 mLの |
| カルシウムを添加する前に2分間carbogenと〜800 mLの蒸留水、ガスを追加 | |
| 1Lに蒸留水を追加。 | |
ポンプとチューブと解剖皿は使用前と使用後に洗い流してください。
解剖
解剖しながら、1mMのカルシウムACSFを連続してcarbogenでガス処刑されるべきである。 ACSFは、ボトルから解剖皿にサイフォンと解剖皿からボトルにポンプまたは無駄に送ることができます。我々は、エラストマー(Sylgard、ダウコーニング)解剖を行うためにコートしたディッシュを使用してください。
新生児マウスは、急速に鋭いはさみと腹側胸部と腹部を介してはさみで作られた切開で斬首されています。動物は、その後evisceratedている。 evisceratedマウスは、ACSFでリンスする。動物は、前肢を通って尾の基部に挿入された昆虫ピンと解剖皿に固定されます。
脊柱は、腹側椎弓切除を行うことにより除去される。脊柱は、小型の鉗子で保持され、小さなハサミの一方のブレードは骨性脊柱にすぐに背側に挿入されます。そっと骨脊柱を持ち上げながら、ラミナは、片側と他にカットされます。これは、脊柱の長さのために行われている。
脊髄は、脊髄神経根を切断し、脊髄を取り巻く髄膜をカットする脊髄の両側に沿って切断により除去される。私たちは、左右両側にカットし、我々はそれを解放するために脊髄の背側に接続されている髄膜をカット。分離されたコードは、追加の動物が解剖されていなくても、適切な酸素化を確実にするACSFの入口近くに皿に固定されます。
分離された脊髄は、小さなスプーンやヘラを使って録音皿に移している。ここでは、酸素2mMのカルシウムACSFで準備を灌流。脊髄は、エラストマーコーティングされた皿や根の近くで細胞外、全ルートの吸引電極を移動するために使用されるマイクロマニピュレータに固定されます。電極の先端がフリールートの終わり近くになると、穏やかな吸引は吸引電極にルートを描画に適用されます。このプロセスは、同時にいくつかの根を記録するために繰り返すことができます。
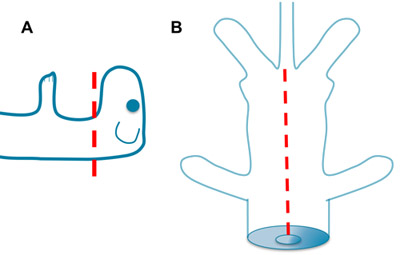
図1。断頭と内臓摘出。A.急速に鋭いはさみでマウスを斬る。脳幹から多かれ少なかれ貢献カットのレベルに応じて達成することができます。断頭によって作成された胸腔の開口部にはさみのB.プレイスつのブレード。尾の付け根に腹胸部と腹部を開きます。内臓を取り出して、ACSFで洗い流してください。

図2。脊柱の除去。A.コードに腹産卵の骨を介して脊髄やカットの右に脊柱と脊髄の間の空間にはさみの左のブレードを挿入します。その後、脊髄とカットの左に脊柱と脊髄の間の空間にはさみの右ブレードを挿入します。脊柱に穏やかなトラクションをかけながらB.はこのプロセスを繰り返します。低い角度でハサミを保持することによって穿刺脊髄にしないように注意してください。

図3。脊髄の除去。A.脊髄と脊髄への横方向敷設脊髄根と髄膜を介して脊髄やカットの右にある骨の間の空間にはさみの左のブレードを挿入します。その後、脊髄や脊髄への横方向敷設脊髄根と髄膜を介して脊髄やカットの左にある骨の間の空間にはさみの右のブレードを挿入します。 B.最後に、優しく吻側コードを持ち上げて、ラミナに背コードを接続する髄膜をカット。再び低角度でハサミを保持することによってではない穿刺に脊髄を注意してください。脊髄に近づきすぎて根を切断しないでください。
ディスカッション
孤立した新生児脊髄は神経系のdevelopment1、2を勉強の扱いやすい方法が用意されています。新生児げっ歯類の腰部脊髄の中で、中枢パターン発生回路は、神経伝達物質の存在下で虚構の歩行運動を生成することができます。この架空の運動は、0.2から0.5 Hzで生成される活動のリズムが増加する、バースト、で構成されています。これらのバーストは、コードと屈筋 - 伸交替(同側のL2 L5からの?...
開示事項
実験はAIACUCソーク生物学研究所が定めたガイドラインと規則に従って行った。
謝辞
サミュエルL. Pfaffさんは、ソーク生物学研究所での遺伝子発現の研究室の教授、ハワードヒューズ医学研究所の研究者でもある。この作品は、クリフトファーリーブ麻痺財団によってサポートされていました。ジョーBelcovson、ソーク研究所のマルチメディアリソースのケントSchnoekerとマイクサリバンは写真撮影と編集との支援を行いました。
資料
| Name | Company | Catalog Number | Comments |
| KCl | P-9333 | ||
| NaCl | S-7653 | ||
| NaHCO3 | S-6297 | ||
| NaH2PO4 | S-9638 | ||
| Glucose | D-9434 | ||
| CaCl2 | C-5080 | ||
| MgSO4 | M-5921 | ||
| Large Scissors | Fine Science Tools | 14070-12 | |
| Forceps | Fine Science Tools | 11050-10 | |
| Fine Scissors | Fine Science Tools | 15000-10 | |
| Insect pins | Fine Science Tools | 26002-10 | |
| Sylgard 184 (Dow-Corning) | |||
| 1L volumetric flask | |||
| 100mL volumetric flask |
参考文献
- Myers, C. P. Cholinergic input is required during embryonic development to mediate proper assembly of spinal locomotor circuits. Neuron. 46, 37-49 (2005).
- Goulding, M., Pfaff, S. L. Development of circuits that generate simple rhythmic behaviors in vertebrates. Curr Opin Neurobiol. 15 (1), 14-20 (2005).
- Gallarda, B. Segregation of axial motor and sensory pathways via heterotypic trans-axonal signaling. Science. 320, (2008).
- Gosgnach, S. V1 spinal neurons regulate the speed of vertebrate locomotor outputs. Nature. 440 (7081), 215-219 (2006).
- Lanuza, G. M., Gosgnach, S., Pierani, A., Jessell, T. M., Goulding, M. Genetic identification of spinal interneurons that coordinate left-right locomotor activity necessary for walking movements. Neuron. 42 (3), 375-386 (2004).
- Jiang, Z., Carlin, K. P., Brownstone, R. M. An in vitro functionally mature mouse spinal cord preparation for the study of spinal motor networks. Brain Res. 816 (2), 493-499 (1999).
- Ziskind-Conhaim, L., Gao, B. X., Hinckley, C. Ethanol dual modulatory actions on spontaneous postsynaptic currents in spinal motoneurons. J Neurophysiol. 89 (2), 806-813 (2003).
- Tabak, J., Rinzel, J., O'Donovan, M. J. The role of activity-dependent network depression in the expression and self-regulation of spontaneous activity in the developing spinal cord. J Neurosci. 21 (22), 8966-8978 (2001).
- Chub, N., Mentis, G. Z., O'Donovan, M. J. Chloride-sensitive MEQ fluorescence in chick embryo motoneurons following manipulations of chloride and during spontaneous network activity. J Neurophysiol. 95 (1), 323-330 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved