Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Spinal Cord Elektrophysiologie
In diesem Artikel
Zusammenfassung
Eine Demonstration der Isolierung von Neugeborenen Maus Rückenmark für elektrophysiologische Untersuchungen.
Zusammenfassung
Das Neugeborenen-Maus Rückenmark ist ein Modell für die Untersuchung der Entwicklung von neuronalen Schaltungen und Fortbewegung. Wir zeigen das Rückenmark Dissektion und Vorbereitung der Aufnahme Bad künstlichen Liquor des Bewegungsapparates Studien verwendet. Nachdem seziert, kann das Rückenmark ventral Nervenwurzeln, um eine Aufnahme Elektrode angebracht werden, um die elektrophysiologische Signale des zentralen Muster erzeugen Schaltung innerhalb Lendenmark aufzunehmen.
Protokoll
1. Bereiten künstlichen Liquor (aCSF) 1. Wir bereiten Sie zunächst einen 2 l einer 10-fach Bestand aCSF ohne Magnesium oder Calcium. Reagenzien in millimolaren aufgeführt. Katalog-Nummern beziehen sich auf Sigma / Aldrich.
| 2 Liter 10X aCSF (ohne Mg oder Ca) | |||
| Reagens | mM | g/2L | Katalog |
| KCl | 40 | 5,96 | P-9333 |
| NaCl | 1280 | 149,61 | S-7653 |
| NaHCO 3 | 210 | 35,28 | S-6297 |
| NaH 2 PO 4 | 5 | 1,38 | S-9638 |
| Glucose | 300 | 108,12 | D-9434 |
| Destilliertem Wasser auf 2L | |||
Außerdem bereiten wir 1M Lösungen von MgSO 4 und CaCl 2 in 50 mL Wasser, um Anpassungen in Molarität von Experiment zu Experiment zu ermöglichen und zu gewährleisten, das Kalzium in Lösung bleibt.
| 1M Calcium und Magnesium Stocks | |||
| Reagens | M | g/50mL | Katalog |
| CaCl 2 | 1 | 7,35 | C-5080 |
| MgSO 4 | 1 | 12,33 | M-5921 |
Die aCSF Lösung muss mit Carbogen (95% O2 / 5% CO2) vergast werden, um den pH-Wert vor Zugabe von Calcium oder Calcium wird Niederschlag geringer.
| 1 Liter aCSF | |
| Reagens | Volumen |
| 10X aCSF | 100ml |
| 1M CaCl 2 | 1 mL (Sezieren) 2 ml (Aufnahme) |
| 1M MgSO 4 | 1 mL |
| Fügen Sie ~ 800 ml destilliertem Wasser, Gas mit Carbogen für 2 Minuten, bevor die Zugabe von Calcium | |
| Add destilliertem Wasser auf 1L. | |
Die Pumpen und Schläuche und seziert Gerichte sollten vor und nach Gebrauch abgespült werden.
Zergliederung
Während sezieren sollte 1mM Calcium aCSF kontinuierlich mit Carbogen begast werden. Die aCSF kann aus einer Flasche, die sezieren Gericht abgeschöpft werden und pumpte aus dem Sezieren Gericht auf die Flasche oder in den Abfall. Wir verwenden ein Elastomer (Sylgard, Dow Corning) beschichtet Gericht die Dissektion durchzuführen.
Das Neugeborenen-Maus ist schnell mit einer scharfen Schere und einen Schnitt mit der Schere durch den ventralen Thorax und Abdomen gemacht enthauptet. Das Tier wird dann ausgeweidet. Die ausgenommene Maus ist mit aCSF gespült. Das Tier wird dann mit dem Sezieren Gericht mit Insekten Stifte durch die Vorderbeine und an der Basis des Schwanzes eingefügt merken.
Die Wirbelsäule wird durch Ausführen einer ventralen Laminektomie entfernt. Die Wirbelsäule ist mit kleinen Zange gehalten und eine Klinge von kleinen Schere eingeführt wird unmittelbar dorsal der knöchernen Wirbelsäule. Die Lamina ist auf der einen Seite und dann die andere schneiden, während leichtes Anheben der knöchernen Wirbelsäule. Dies wird für die Länge der Wirbelsäule durchgeführt.
Das Rückenmark wird durch Schneiden auf beiden Seiten entlang des Rückenmarks auf die Nervenwurzeln zu trennen und schneiden den Hirnhäuten umgeben das Rückenmark entfernt. Wir schneiden auf der linken und rechten Seite, dann schneiden wir die Meningen an der Rückenseite des Rückenmarks um sie zu befreien. Die isolierte Kabel wird dann an das Gericht in der Nähe des aCSF Einlass gute Sauerstoffversorgung zu gewährleisten, wenn zusätzliche Tiere seziert werden merken.
Die isolierte Rückenmark ist dann eine Aufnahme Teller mit einem kleinen Löffel oder Spatel übertragen. Hier haben wir versorgen die Vorbereitung mit sauerstoffreichem 2mM Calcium aCSF. Das Rückenmark ist mit dem Elastomer beschichtet Schüssel und Mikromanipulatoren verwendet werden, um extrazelluläre, ganze Wurzel Saugelektroden in der Nähe der Wurzeln zu bewegen merken. Wenn die Spitze der Elektrode in der Nähe des freien root Ende ist, ist sanfte Saugwirkung angewendet an der Wurzel in die Saugelektrode ziehen. Dieser Vorgang kann wiederholt werden, um mehrere Wurzeln gleichzeitig aufgezeichnet werden.
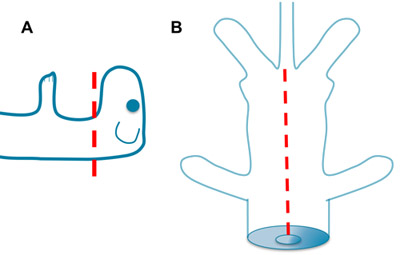
Abbildung 1. Enthauptung und Ausweiden. A. Schnell enthaupten der Maus mit einer scharfen Schere. Mehr oder weniger Beiträge aus dem Hirnstamm erreicht in Abhängigkeit von der Höhe der geschnitten werden. B. Legen Sie ein Blatt der Schere in die Öffnung der Brusthöhle von der Enthauptung erstellt. Öffnen Sie das ventrale Thorax und Abdomen an der Basis des Schwanzes. Entfernen Sie die Eingeweide und gründlich mit aCSF.

Abbildung 2. Die Entfernung der Wirbelsäule. A. Setzen Sie die linke Blatt der Schere in den Raum zwischen der Wirbelsäule und des Rückenmarks auf der rechten Seite des Rückenmarks und Durchtrennung der Knochen über ventral am Kabel. Dann legen Sie die richtige Klinge der Schere in den Raum zwischen der Wirbelsäule und des Rückenmarks auf der linken Seite des Rückenmarks und geschnitten. B. Wiederholen Sie diesen Vorgang unter sanftem Zug auf die Wirbelsäule. Achten Sie darauf, Punktion des Rückenmarks, indem Sie die Schere in einem flachen Winkel.

Abbildung 3. Die Entfernung der Spinal Cord. A. Setzen Sie die linke Blatt der Schere in den Raum zwischen dem Rückenmark und die Knochen auf der rechten Seite des Rückenmarks und Durchtrennung der Wirbelsäule Wurzeln und Meningen über seitlich am Kabel. Dann legen Sie die richtige Klinge der Schere in den Raum zwischen dem Rückenmark und die Knochen auf der linken Seite des Rückenmarks und Durchtrennung der Wirbelsäule Wurzeln und Meningen Verlegung seitlich am Kabel. B. Schließlich heben die rostral Kabel und schneiden den Hirnhäuten Anschluss der Dorsalmark der Lamellen. Auch darauf achten, nicht zu durchstechen das Rückenmark, indem Sie die Schere in einem flachen Winkel. Schneiden Sie nicht die Wurzeln zu nahe an das Rückenmark.
Diskussion
Die isolierten neonatalen Rückenmark stellt eine gefügig Methode zur Untersuchung des Nervensystems Entwicklung1, 2. Im Lumbalmark der Neugeborenen-Nagetiere, kann central pattern Erzeugung Schaltung fiktiven Fortbewegung in Gegenwart von Neurotransmittern zu produzieren. Diese fiktive Lokomotion besteht aus rhythmischen Anstieg der Aktivität, Bursts, dass bei 0,2 bis 0,5 Hz erzeugt werden. Diese Ausbrüche sind so organisiert, links-rechts abwechselnd entlang der Länge des Kabels und der Beuger-Strecker Wechsel (ip...
Offenlegungen
Experimente an Tieren wurden in Übereinstimmung mit den Richtlinien und Vorschriften her von The Salk Institute for Biological Studies AIACUC gesetzt durchgeführt.
Danksagungen
Samuel L. Pfaff ist ein Professor in der Genexpression Laboratories am Salk Institute for Biological Studies und ein Investigator in der Howard Hughes Medical Institute. Diese Arbeit wurde von der Christopher and Dana Reeve Foundation unterstützt. Joe Belcovson, Kent Schnoeker und Mike Sullivan in Multimedia-Ressourcen am Salk Institute unterstützte mit der Fotografie und Bearbeitung.
Materialien
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| KCl | P-9333 | |||
| NaCl | S-7653 | |||
| NaHCO3 | S-6297 | |||
| NaH2PO4 | S-9638 | |||
| Glucose | D-9434 | |||
| CaCl2 | C-5080 | |||
| MgSO4 | M-5921 | |||
| Large Scissors | Fine Science Tools | 14070-12 | ||
| Forceps | Fine Science Tools | 11050-10 | ||
| Fine Scissors | Fine Science Tools | 15000-10 | ||
| Insect pins | Fine Science Tools | 26002-10 | ||
| Sylgard 184 (Dow-Corning) | ||||
| 1L volumetric flask | ||||
| 100mL volumetric flask |
Referenzen
- Myers, C. P. Cholinergic input is required during embryonic development to mediate proper assembly of spinal locomotor circuits. Neuron. 46, 37-49 (2005).
- Goulding, M., Pfaff, S. L. Development of circuits that generate simple rhythmic behaviors in vertebrates. Curr Opin Neurobiol. 15 (1), 14-20 (2005).
- Gallarda, B. Segregation of axial motor and sensory pathways via heterotypic trans-axonal signaling. Science. 320, (2008).
- Gosgnach, S. V1 spinal neurons regulate the speed of vertebrate locomotor outputs. Nature. 440 (7081), 215-219 (2006).
- Lanuza, G. M., Gosgnach, S., Pierani, A., Jessell, T. M., Goulding, M. Genetic identification of spinal interneurons that coordinate left-right locomotor activity necessary for walking movements. Neuron. 42 (3), 375-386 (2004).
- Jiang, Z., Carlin, K. P., Brownstone, R. M. An in vitro functionally mature mouse spinal cord preparation for the study of spinal motor networks. Brain Res. 816 (2), 493-499 (1999).
- Ziskind-Conhaim, L., Gao, B. X., Hinckley, C. Ethanol dual modulatory actions on spontaneous postsynaptic currents in spinal motoneurons. J Neurophysiol. 89 (2), 806-813 (2003).
- Tabak, J., Rinzel, J., O'Donovan, M. J. The role of activity-dependent network depression in the expression and self-regulation of spontaneous activity in the developing spinal cord. J Neurosci. 21 (22), 8966-8978 (2001).
- Chub, N., Mentis, G. Z., O'Donovan, M. J. Chloride-sensitive MEQ fluorescence in chick embryo motoneurons following manipulations of chloride and during spontaneous network activity. J Neurophysiol. 95 (1), 323-330 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten