Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La médula espinal de Electrofisiología
En este artículo
Resumen
Una demostración del aislamiento de la médula espinal de ratón neonatal para los estudios electrofisiológicos.
Resumen
El cordón espinal de ratón recién nacido es un modelo para estudiar el desarrollo de circuitos neuronales y el movimiento del aparato locomotor. Nos demuestran que la disección de la médula espinal y la preparación del baño de grabación de líquido cefalorraquídeo artificial utilizado para estudios del aparato locomotor. Una vez disecado, las raíces nerviosas de la médula espinal ventral puede ser conectado a un electrodo de registro para registrar las señales electrofisiológicas de los circuitos generadores de patrones centrales dentro de la médula lumbar.
Protocolo
1. Prepare líquido cefalorraquídeo artificial (ACSF) 1. En primer lugar, preparar un 2 litros de un depósito de 10 veces LCRa sin magnesio o calcio. Reactivos enumerados en milimolar. Los números de catálogo se refieren a Sigma / Aldrich.
| 2 Litros 10X LCRa (sin Mg o Ca) | |||
| Reactivo | mM | g/2L | Catálogo |
| KCl | 40 | 5.96 | P-9333 |
| NaCl | 1280 | 149,61 | S-7653 |
| NaHCO3 | 210 | 35.28 | S-6297 |
| NaH 2 PO 4 | 5 | 1.38 | S-9638 |
| Glucosa | 300 | 108,12 | D-9434 |
| Agregue el agua destilada a 2L | |||
También vamos a preparar las soluciones 1M de MgSO 4 y CaCl 2 en 50 ml de agua para permitir ajustes en molaridad de experimento a experimento y para asegurar que el calcio se mantiene en solución.
| Calcio 1M y las poblaciones de magnesio | |||
| Reactivo | M | g/50mL | Catálogo |
| CaCl2 | 1 | 7.35 | C-5080 |
| MgSO4 | 1 | 12.33 | M-5921 |
La solución debe ser gaseados LCRa con carbogen (95% O2 / CO2 al 5%) para reducir el pH antes de la adición de calcio o calcio se precipitan.
| 1 Litro LCRa | |
| Reactivo | Volumen |
| 10X LCRa | 100 ml |
| 1M CaCl2 | 1 ml (disección) 2 ml (de grabación) |
| 1M MgSO4 | 1 mL |
| Añadir ~ 800 ml de agua destilada, con carbogen gas durante 2 minutos antes de la adición de calcio | |
| Añadir agua destilada hasta 1 litro. | |
Las bombas y tubos y platos de disección debe enjuagarse antes y después de su uso.
Disección
Mientras que la disección, 1 mM de calcio LCRa debe ser continuamente gaseados con carbogen. El LCRa puede ser desviada de una botella a la placa de disección y se bombea desde el plato de disección a la botella o enviados a los residuos. Nosotros usamos un elastómero (Sylgard, Dow Corning) plato recubierto de realizar la disección.
El ratón neonatal es rápidamente decapitado con tijeras y se hace una incisión con tijeras por el tórax y el abdomen ventral. El animal es entonces eviscerado. El ratón eviscerado se enjuaga con LCRa. El animal es luego depositado en el plato de disección con alfileres de insectos inserta a través de las extremidades anteriores y en la base de la cola.
La columna vertebral se elimina mediante la realización de una laminectomía ventral. La columna vertebral se mantiene con pequeñas pinzas y una hoja de tijera pequeña se inserta inmediatamente dorsal a la columna vertebral ósea. La lámina se corta en un lado y luego el otro, mientras que levantar suavemente la columna vertebral ósea. Esto se lleva a cabo para la longitud de la columna vertebral.
La médula espinal es eliminado por el corte a lo largo de ambos lados de la médula espinal para cortar las raíces del nervio espinal y las meninges corte que rodea la médula espinal. Cortamos en los lados izquierdo y derecho, y luego cortamos las meninges atado a la parte dorsal de la médula espinal para liberarlo. El cable aislado es entonces clavada en el plato cerca de la entrada LCRa para asegurar una buena oxigenación si otros animales, se disecan.
La médula espinal aislado se transfiere a un plato de grabación con una cuchara o una espátula. Aquí perfundir la preparación con oxigenada de calcio 2 mM LCRa. La médula espinal se fija en el plato recubierto de elastómero y micromanipulador utiliza para mover los electrodos extracelulares, toda aspiración de raíz cerca de las raíces. Cuando la punta del electrodo se encuentra cerca del extremo de la raíz libre, suave succión se aplica a sacar la raíz en el electrodo de succión. Este proceso se puede repetir para grabar varias raíces al mismo tiempo.
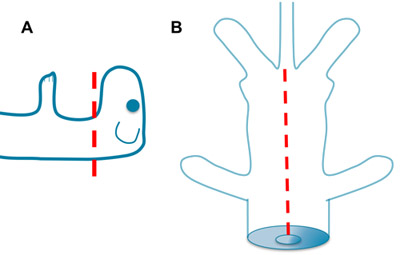
Figura 1. Decapitación y extracción de las vísceras. A. Rápidamente decapitar al ratón con unas tijeras afiladas. Contribuciones más o menos desde el tronco cerebral se puede lograr en función del nivel de corte. B. Coloque una hoja de la tijera en la abertura de la cavidad torácica creada por la decapitación. Abrir el tórax y el abdomen ventral a la base de la cola. Retire las vísceras y enjuague con LCRa.

Figura 2. La eliminación de la columna vertebral. A. Inserte la hoja izquierda de las tijeras en el espacio entre la columna vertebral y la médula espinal a la derecha de la médula espinal y cortar a través de los huesos por la que se ventral de la médula. A continuación, introduzca el extremo derecho de la tijera en el espacio entre la columna vertebral y la médula espinal a la izquierda de la médula espinal y se corta. B. Repita este proceso mientras se aplica una tracción suave de la columna vertebral. Tenga cuidado de no pinchar la médula espinal mediante la celebración de las tijeras en un ángulo bajo.

Figura 3. La eliminación de la médula espinal. A. Inserte la hoja izquierda de las tijeras en el espacio entre la médula espinal y los huesos a la derecha de la médula espinal y cortar a través de las raíces espinal y las meninges por la que se laterales a la médula. A continuación, introduzca el extremo derecho de la tijera en el espacio entre la médula espinal y los huesos a la izquierda de la médula espinal y cortar a través de las raíces espinal y las meninges por la que se laterales a la médula. B. Por último, levante suavemente el cable rostral y cortar las meninges de conectar el cable a la lámina dorsal. Una vez más tener cuidado de no pinchar la médula espinal mediante la celebración de las tijeras en un ángulo bajo. No corte las raíces demasiado cerca de la médula espinal.
Discusión
El aislado de la médula espinal neonatal proporciona un método manejable de estudiar el sistema nervioso desarrollo1, 2. Dentro de la médula lumbar espinal de roedores recién nacidos, los circuitos centrales de generación de patrones puede producir locomoción ficticia en la presencia de neurotransmisores. Esta locomoción ficticia consiste en aumentos de ritmo en la actividad, las explosiones, que se producen en el 0,2 a 0,5 Hz. Estas explosiones se organizan para producir la alternancia izquierda-derecha a lo lar...
Divulgaciones
Los experimentos en animales se realizaron de acuerdo con las directrices y normas establecidas por el Instituto Salk para Estudios Biológicos AIACUC.
Agradecimientos
Samuel L. Pfaff es profesor en el Laboratorio de Expresión Génica en el Instituto Salk de Estudios Biológicos y un investigador en el Instituto Médico Howard Hughes. Este trabajo fue apoyado por el Christopher y Dana Reeve Foundation. Joe Belcovson, Schnoeker Kent y Mike Sullivan en Recursos Multimedia en el Instituto Salk proporcionó asistencia con la fotografía y la edición.
Materiales
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| KCl | P-9333 | |||
| NaCl | S-7653 | |||
| NaHCO3 | S-6297 | |||
| NaH2PO4 | S-9638 | |||
| Glucose | D-9434 | |||
| CaCl2 | C-5080 | |||
| MgSO4 | M-5921 | |||
| Large Scissors | Fine Science Tools | 14070-12 | ||
| Forceps | Fine Science Tools | 11050-10 | ||
| Fine Scissors | Fine Science Tools | 15000-10 | ||
| Insect pins | Fine Science Tools | 26002-10 | ||
| Sylgard 184 (Dow-Corning) | ||||
| 1L volumetric flask | ||||
| 100mL volumetric flask |
Referencias
- Myers, C. P. Cholinergic input is required during embryonic development to mediate proper assembly of spinal locomotor circuits. Neuron. 46, 37-49 (2005).
- Goulding, M., Pfaff, S. L. Development of circuits that generate simple rhythmic behaviors in vertebrates. Curr Opin Neurobiol. 15 (1), 14-20 (2005).
- Gallarda, B. Segregation of axial motor and sensory pathways via heterotypic trans-axonal signaling. Science. 320, (2008).
- Gosgnach, S. V1 spinal neurons regulate the speed of vertebrate locomotor outputs. Nature. 440 (7081), 215-219 (2006).
- Lanuza, G. M., Gosgnach, S., Pierani, A., Jessell, T. M., Goulding, M. Genetic identification of spinal interneurons that coordinate left-right locomotor activity necessary for walking movements. Neuron. 42 (3), 375-386 (2004).
- Jiang, Z., Carlin, K. P., Brownstone, R. M. An in vitro functionally mature mouse spinal cord preparation for the study of spinal motor networks. Brain Res. 816 (2), 493-499 (1999).
- Ziskind-Conhaim, L., Gao, B. X., Hinckley, C. Ethanol dual modulatory actions on spontaneous postsynaptic currents in spinal motoneurons. J Neurophysiol. 89 (2), 806-813 (2003).
- Tabak, J., Rinzel, J., O'Donovan, M. J. The role of activity-dependent network depression in the expression and self-regulation of spontaneous activity in the developing spinal cord. J Neurosci. 21 (22), 8966-8978 (2001).
- Chub, N., Mentis, G. Z., O'Donovan, M. J. Chloride-sensitive MEQ fluorescence in chick embryo motoneurons following manipulations of chloride and during spontaneous network activity. J Neurophysiol. 95 (1), 323-330 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados