このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
リバーシブルビオチン化によって原形質膜タンパク質エンドサイトーシス率を測定
要約
規制エンドサイトーシスは、膜タンパク質の大部分の細胞表面発現レベルを制御します。ここでは、ドーパミントランスポーター(DAT)、ポリトープ膜タンパク質のエンドサイトーシス率を測定するために還元、膜非透過性ビオチン化試薬を利用する。メソッドは、ほとんどの細胞膜タンパク質のエンドサイトーシス率を測定するための直接的なアプローチを促進する。
要約
細胞膜タンパク質は、受容体、イオンチャネル、トランスポーターとポンプで構成されるタンパク質の大規模、多様なグループです。これらのタンパク質の活性は栄養デリバリー、細胞の興奮、および化学的シグナル伝達を含む主要な携帯電話のイベント、様々な責任があります。多くの細胞膜タンパク質は、動的にタンパク質の表面発現を変化させることによってタンパク質の機能を調節するエンドサイトーシスの人身売買、によって規制されている。タンパク質のエンドサイトーシスを促進するメカニズムは複雑であり、完全に多くの膜蛋白質のために理解されていません。完全に与えられたタンパク質のエンドサイトーシス売買を制御するメカニズムを理解するためには、それはタンパク質のエンドサイトーシスの速度を正確に測定することが重要です。多くの受容体の場合は、直接エンドサイトーシスの速度の測定は、頻繁に標識された受容体リガンドを利用して実現されています。しかし、そのようなトランスポーター、ポンプ、イオンチャネルなど膜タンパク質の多くのクラスに対して、エンドサイトーシス速度を測定するために使用できる便利なリガンドはありません。本報告では、我々はドーパミントランスポーター(DAT)エンドサイトーシス率を測定するために採用することを可逆的ビオチン化の方法を説明します。このメソッドは、内在化率を測定するための直接的なアプローチを提供し、容易にほとんどの膜タンパク質の人身売買の研究に用いることができる。
プロトコル
手順の概要:
このアプローチを使用して、細胞表面のタンパク質が共有結合膜の透過性を使用して、使用可能な外リジン残基上のビオチンで標識され、人身売買制限された条件下でのジスルフィド結合のビオチン化試薬(スルホ- NHS - SS -ビオチン)(すなわち、低温)(図1参照説明のため)。細胞の1つのセットが人身売買許容条件にシフトし(37℃)とビオチン化タンパク質は、内面化される。細胞の他のセットは、時間= 0で1)の総表面タンパク質、および2)ストリッピングコントロールのコントロールとして、低温で保持されます。内在化の短い期間の後、細胞が内在化を停止するために低温へシフトされ、任意の残留表面のビオチンは、ジスルフィド結合のビオチンを切断する還元剤、細胞を処理することによって取り除かれる。細胞表面から生じたと内面化されたビオチン化タンパク質は、ストリッピング工程から保護されており、残る唯一のビオチン化タンパク質となります。細胞溶解後、ビオチン化タンパク質は、ストレプトアビジンアフィニティークロマトグラフィーによって分離されていると、目的のタンパク質を定量的イムノブロットによって検出されます。エンドサイトーシス率を決定するために、内部化されたタンパク質の量は、時間= 0で標識の総表面の制御と比較されます。我々は、正常に神経ノルエピネフリン1とドーパミン1月4日トランスポーターの内在化の速度を測定するためにこのアプローチを使用している。
詳細なプロトコル:
1日目:
- 彼らは2日目〜80%コンフルエントになるように、6ウェルプレートに細胞をプレート。また、トランスフェクトされた細胞が使用されている場合、それらが内在化の速度が測定される時点で〜80%コンフルエントになるような密度でトランスフェクト。細胞は強く付着していない場合、組織培養のウェアは、広範な洗浄ステップの間に細胞の損失を防ぐために、細胞接着基質(例えば、ポリ- D -リジン)で治療されるべきである。
- それぞれのタンパク質はテストされているため、1枚のプレートにプレート2ウェルを全表面のタンパク質(T = 0)とストリッピングコントロールとして使用される。第二の板上に、テスト対象の各内面化の条件のためのウェルプレート1つ(すなわち基礎エンドサイトーシスのレートと薬剤処理された)。
- 2日目に使用するために指示された温度で、以下のソリューションとストアを準備します。
- PBS 2 +:リン酸1.5mMのMgCl 2、0.2mMのCaCl 2で 、(4℃)を添加した液(pH7.4)緩衝生理食塩水
- ビオチン化は解決策をクエンチ :PBS 2 + 100 mMグリシン、(4℃)で補足
- NTバッファー :150mMのNaCl、1.0mMのEDTA、0.2%BSA、20 mMトリス、pH 8.6、(4 ° C)
- RIPAバッファー :10 mMトリス、pH 7.4、150mMのNaCl、1.0mMのEDTA、0.1%SDS、1.0%トリトンX 100、1.0%デオキシコール酸ナトリウム、(4℃)
- スルホ- NHS - SS -ビオチンの原液 :200 mg / mlの、(-20℃)に(DMSO)ジメチルスルホキシドに溶解
- トリス(2 -カルボキシエチル)ホスフィン塩酸塩(TCEP)ストック溶液:H 2 O中の500mM、(-20 ° C、光を遮断するために箔で覆われて)
2日目:
- PBS 2 + 0.18g/mlグルコースを補充した、0.2%のIgG /(PBS 2 + / G / BSA)プロテアーゼフリーウシ血清アルブミンを準備します。 ℃の水浴中で37に予熱するこのソリューション。
- DMSOを溶かすためにベンチの上にスルホ- NHS - SS -ビオチンの原液を解凍。使用直前に、新鮮なスルホ- NHS - SS -ビオチン溶液(0.75ミリリットル/ウェルのに十分な氷冷PBS 2で2.5 mg / mlの+を 、)準備。 DMSOを可溶化するために激しくボルテックスするソリューション。 NHS -ビオチン試薬が水溶液中で容易に加水分解されることに注意してください。したがって、すべてのソリューションは、使用直前に準備する必要があります。
- ビオチン化:低温室で氷浴上に置いてプレートと氷冷PBS 2 +と3 × 2 mlをすすいでください。プレートをわずかに完全な排水及び緩衝液の除去を可能にするために角度していることを確認して。 /ウェルの各ウェルに新鮮スルホ- NHS - SS -ビオチン溶液0.75 mlを加え。インキュベート× 15"、4℃激しく振盪と氷浴上でC。インキュベーションが完了したら、別の新鮮なスルホ- NHS - SS -ビオチン溶液を調製。新鮮な溶液とインキュベート× 15"、4℃で古いソリューションを置き換える
- 焼入れ:彼らはと反応し、細胞が溶解されると細胞内タンパク質のビオチニル化することのないよう、すべての非反応NHS -ビオチン分子が消光されていることが重要です。焼き入れ液で細胞を3 × 2 mlを洗浄し、2mlのクエンチの解x 15'、4℃穏やかに振盪しながらCで二回インキュベートする。
- 内部化:薬物治療がテストされている場合は、PBS 2 + / G / BSAに適切な薬物濃度を追加。 4℃で制御プレートを保持し、内在化プレートを低温室から引き出す。予め温めておいたPBS 2で3 × 2 mlを洗う+ / G / BSA(+ / - DRUGS)と同じ解(2ミリリットル/ウェル)に残す。プレート全体に均一な温度を確保するために予め温めておいたソリューションを持つ空の井戸を埋める。 10'、37℃のインキュベーターにセルを転送する。 37℃のインキュベーションを終了する直前に、氷の上でストリッピング工程とストアに使用するNTのバッファで新鮮なの50mM TCEP溶液を調製。 1.0ミリリットル/ウェルのために十分な量を準備します。
- ストリップ:氷浴と低温室へ復帰にすぐ転送プレート(S)。迅速にエンドサイトーシスを停止するために、氷冷NT緩衝液で3 × 2 mlを細胞を洗浄。また、NTバッファーでストリップコントロールウェルを3 × 2 mlを洗う。各ウェルに1.0 mlの新鮮な剥離液を追加。静かに振とうしながら、氷上で15'、4℃インキュベートする。新鮮な剥離液で井戸を交換し、氷上でさらに15'、4℃でインキュベートする。
- 溶解:剥離液、3 × 2ミリリットルNTバッファにさらされたすべてのウェルを洗う。その後、3 × 2 mlのPBS 2 +との(合計コントロールを含む)すべてのウェルを洗う。新鮮なプロテアーゼ阻害剤(1.0mMのPMSF、1.0μg/ mlの各ロイペプチン、アプロチニン及びペプスタチン)を含む300μl/wellRIPA緩衝液(または関心のあるタンパク質のための互換性のあるその他の溶解バッファー)に溶解する。 × 20"、4℃で振とうすることにより溶解18000 × gで、10'、4℃で遠心分離することによってマイクロチューブと明確な細胞の破片に転送する
- タンパク質濃度測定:標準BSAの曲線と比較して溶解物のタンパク質濃度を決定するために溶解条件(例:DCプロテインアッセイ、Bio - Rad社)と互換性のあるタンパク質アッセイを使用してください。
- ストレプトアビジンアフィニティークロマトグラフィー :各サンプルのタンパク質に相当する量のマイクロチューブを準備します。 200μlの各サンプルの最終容量を持って来るために溶解バッファーを追加します。激しくボルテックスストレプトアビジンアガロースビーズをさらに懸濁液に持参する。先端で200μlのピペットを使用すると、各チューブに、ピペットのビーズを切断。 20μlのbeads/50μgのライセートをお勧めします。チューブローテーターで一晩、4℃でインキュベートする。
3日目:
- ビーズの洗浄:遠心分離機のサンプルを、18,000 × gで、2'ビーズを収集する。アスピレーターでビーズペレットに接近しないように注意しながら、ライセートをオフに吸引除去する。よりよいコントロールのための吸引器の端にあるプラスチック製のピペットチップを使用してください。各試験管に0.75 mlの溶解バッファーを追加し、ビーズを洗浄する渦。遠心サンプル、18,000 × gで、2'ビーズと繰り返し吸引を収集し、(合計で3回洗浄)回洗浄する。最終洗浄後、ビーズペレットを乱すことなく、できるだけバッファをできるだけ多く吸引除去する。アスピレーターに向かってチューブを傾けることは、このステップを支援します。
- サンプルの溶出:各チューブに20 -25μlの2 × Laemmliサンプル緩衝液(還元)を追加。還元剤を切断するには、溶液中に単離されたタンパク質を放出、NHS - SS -ビオチンのジスルフィド結合なります。ほとんどの膜タンパク質は、沸騰時に凝集に対して非常に脆弱であり、SDS - PAGE用ゲルにロードする前に加熱してはいけません。これらの実験を実行する前に目的のタンパク質の熱感度を決定する。タンパク質が/沸騰加熱に耐えられない場合、SDS - PAGEによって分析する前にローテータ、30'、室温でインキュベートする。これは、開裂するジスルフィド結合に十分であるとタンパク質を溶出させる。
- SDS - PAGEとイムノブロッティング:SDS - PAGEにより分離タンパク質。各サンプルについて、次の順序でサンプルを実行するのが最も簡単です:あなたの蛋白質のための適切な抗体との合計面(時間= 0)、ストリップ、内在化の条件#1、状態#2、などイムノブロッティング用メンブレンに移しブロット興味のある。は飽和ピクセルが存在しないことが確実であること、CCDカメラのゲルドキュメンテーションシステムを使って免疫反応性バンドをキャプチャします。ゲル分析/デンシトメトリーのソフトウェアを使用して各バンドの密度を定量化する。
代表的な結果:
代表的なイムノブロットの結果は、図2Aに示されています。最も強い信号は、前のインターナリゼーションに表面のタンパク質の総量である"合計"レーン(T)、になります。 "ストリップ"制御(S)は、理想的にストリップが実験のために効率的であることを示す空白、に近い必要があります。ストリップの効率は、"合計"車線のように、"ストリップ"車線の密度を比較して算出されます(ストリップと平行してビオチン化された例えば、タンパク質が、どちらも37℃に加温しされず、剥離液にさらされていた)。次の式が使用されます。
[1 - (ストリップ/合計)] * 100%
この式を用いて、図2のストリップは、効率的な99.8%であった。最後に、内在化の車線の合計(秒)(I)よりも低い強度のバンドが表示されます。例(図2)においては、処理された細胞は、10時の最初のインターナリゼーションの時代"内在化し、ドーパミントランスポーターの内在化率は10で測定された"車両または1μMホルボールミリステートアセテート(PMA)のどちらかで処理した。内部化率は次のように計算されます次のとおりです。
合計/内部化* 100
図2Bに示すように、10.4%表面DATは、溶媒投与の条件下で10'を介して内面化。 PMA治療は、全表面のDATの23.2%にDATの内在化率を増加させた。
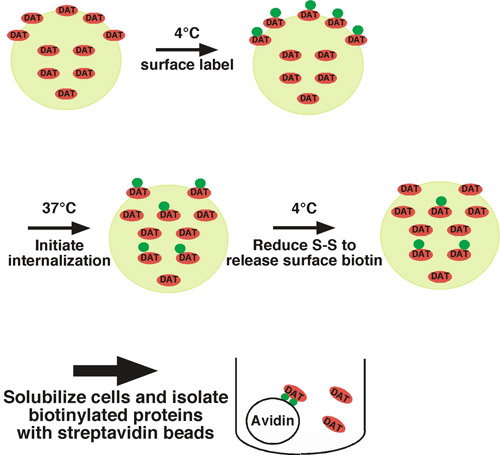
図1。プロトコルのイラスト。細胞は° Cが独占的に表面の人口にラベルを付けるために4でビオチン化されている、と℃の内部移行を開始するために37にシフトされます。内在化に続いて、細胞が急速にエンドサイトーシスプロセスを停止するには、冷却され、残りの表面のビオチンは、還元剤で細胞を処理することにより除去されます。残っている唯一のビオチン化タンパク質は、このようにストリッピング治療からそれらを保護し、t = 0で表面から生じたと内面化されたものです。ビオチン化タンパク質は、ストレプトアビジンビーズを使用してバッチアフィニティークロマトグラフィーによって分離されていると、目的のタンパク質は、イムノブロッティングにより検出される。
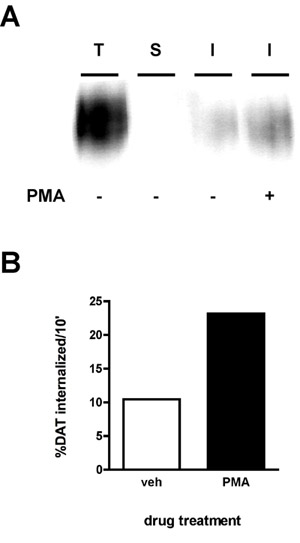
図2。 PKC活性化はDATエンドサイトーシスの速度。内在化アッセイを増加させる 。安定的にDATの発現PC12細胞をビオチン化し、4℃などの"詳細なプロトコル"で説明されている。れました細胞は急速に37加温した℃± 1μMPMAとインキュベートさ10'、37℃残留ビオチンが低減することにより除去された、細胞を溶解し、ビオチン化タンパク質は、ストレプトアビジンアフィニティークロマトグラフィーにより単離した。 (A)代表のイムノブロットは、全体の表面のDATを示す時刻t = 0(T)、ストリップコントロール(S)、および指定された条件の下で内部化されたDAT(I)。 (B)バンドは、CCDカメラで捕捉し、数量データソフトウェア(Bio - Rad)を定量した。データは、%の合計DAT internalized/10の分として表現されています。
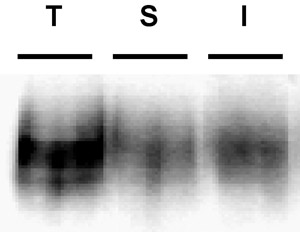
図3。例の免疫ブロット法は、貧しい人々ビオチンのストリップ。内在化アッセイを描いた 。安定的にDATの発現PC12細胞をビオチン化し、4℃などの" 詳細なプロトコル "で説明されている。れました細胞は急速に℃、インキュベーション10'、37℃37℃に温めていた残留ビオチンが低減することにより除去された、細胞を溶解し、ビオチン化タンパク質は、ストレプトアビジンアフィニティークロマトグラフィーにより単離した。免疫ブロットは、t = 0(T)、ストリップコントロール(S)、および内部化DAT(I)における総表面積DATを示しています。貧しいストリップの効率を示す、ストリップコントロールのレーンに表示されるバンドに注目してください。
ディスカッション
一般的な問題 :これらの実験で発生する最も一般的な問題は、貧しいストリップ効率です。ストリップの効率は、結果を解釈できることに非常に重要です。ストリップは非常に効率的でない限り、それは内面化の車線内の任意のビオチン化タンパク質は、実際には、表面から内部化されたと結論することはできません。ストリップ≥90%の効率が最適であり、そしてストリップがこの?...
謝辞
この作品は、#DA15169 HEMにNIHの助成金によって賄われていた
参考文献
- Holton, K. L., Loder, M. K., Melikian, H. E. Nonclassical distinct endocytic signals dictate constitutive and PKC-regulated neurotransmitter transporter internalization. Nat Neurosci. 8, 881-888 (2005).
- Boudanova, E., Navaroli, D. M., Melikian, H. E. Amphetamine-induced decreases in dopamine transporter surface expression are protein kinase C-independent. Neuropharmacology. 54, 605-612 (2008).
- Boudanova, E., Navaroli, D. M., Stevens, Z., Melikian, H. E. Dopamine transporter endocytic determinants: carboxy terminal residues critical for basal and PKC-stimulated internalization. Mol Cell Neurosci. 39, 211-217 (2008).
- Loder, M. K., Melikian, H. E. The dopamine transporter constitutively internalizes and recycles in a protein kinase C-regulated manner in stably transfected PC12 cell lines. J Biol Chem. 278, 22168-22174 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved