È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Misurazione delle proteine plasmatiche Tariffe endocitico membrana da biotinilazione reversibile
In questo articolo
Riepilogo
Endocitosi regolata regola i livelli di superficie cellulare espressione della maggior parte delle proteine di membrana. Qui utilizziamo riducibili, reagenti biotinilazione impermeant membrana per misurare la velocità endocitico del trasportatore della dopamina (DAT), una proteina di membrana politopica. Il metodo favorisce un approccio diretto per misurare il tasso endocitico della maggior parte delle proteine di membrana plasmatica.
Abstract
Proteine di membrana plasmatica sono un grande gruppo eterogeneo di proteine comprende recettori, canali ionici, trasportatori e pompe. Attività di queste proteine è responsabile di una serie di eventi cellulari fondamentali, inclusa la consegna dei nutrienti, l'eccitabilità cellulare, e la segnalazione chimica. Molte proteine di membrana plasmatica sono dinamicamente regolato da traffico endocitico, che modula la funzione delle proteine di superficie, modificando l'espressione della proteina. I meccanismi che facilitano endocitosi di proteine sono complesse e non sono pienamente compresi per molte proteine di membrana. Al fine di comprendere appieno i meccanismi che controllano il traffico endocitico di una certa proteina, è fondamentale che il tasso di endocitico la proteina s essere misurato con precisione. Per molti recettori, misurazioni dirette tasso endocitico sono spesso raggiunto utilizzando ligandi dei recettori etichettati. Tuttavia, per molte classi di proteine di membrana, come trasportatori, pompe e canali ionici, non c'è ligando conveniente che può essere utilizzato per misurare la velocità endocitico. Nella presente relazione, si descrive un metodo reversibile biotinilazione che impieghiamo per misurare il trasportatore della dopamina (DAT) tasso endocitico. Questo metodo fornisce un approccio diretto per misurare i tassi di interiorizzazione, e possono essere facilmente utilizzati per gli studi di traffico di proteine di membrana più.
Protocollo
Panoramica della procedura:
Usando questo approccio, le proteine della superficie cellulare sono covalentemente etichettati con biotina disponibili su residui di lisina extracellulare con un impermeant membrana, disolfuro ad accoppiamento reattivo biotinilazione (solfo-NHS-SS-biotina) con il traffico di condizioni restrittive (temperatura bassa) (vedi Fig. 1. per l'illustrazione). Un set di cellule è spostato al traffico di condizioni permissive (37 ° C) e le proteine biotinilato interiorizzare. L'altra serie di cellule sono conservate a bassa temperatura come controlli per 1) la proteina superficie totale al tempo = 0, e 2) il controllo stripping. A seguito di un breve periodo di interiorizzazione, le cellule si spostano di nuovo a bassa temperatura per fermare l'interiorizzazione, la biotina e qualsiasi superficie residua viene eliminata trattando le cellule con un agente riducente, che spacca il disolfuro accoppiamento biotina. Proteine biotinilato che nasce dalla superficie cellulare e sono stati interiorizzati sono protetti dalla fase di stripping, e sarà l'unica proteine biotinilato che rimangono. A seguito di lisi cellulare, le proteine biotinilato sono isolati da streptavidina cromatografia di affinità e la proteina di interesse viene rilevato da immunoblotting quantitativi. Per determinare il tasso di endocitica, la quantità di proteine internalizzate viene confrontato con il controllo della superficie totale etichettati al tempo = 0. Abbiamo utilizzato con successo questo approccio per misurare il tasso di interiorizzazione della noradrenalina neuronale 1 e 1-4 trasportatori della dopamina.
Protocollo dettagliato:
1 ° giorno:
- Cellule piastra in 6 piastre in modo che essi saranno confluenti ~ 80% nel Day 2. In alternativa, se le cellule trasfettate sono in uso, trasfettare ad una densità tale che siano confluenti ~ 80% al momento il tasso di internalizzazione sarà misurato. Se le cellule non sono fortemente aderente, la cultura ware tessuto devono essere trattati con un substrato di adesione cellulare (ad esempio poli-D-lisina) per prevenire la perdita delle cellule durante le fasi di lavaggio estesa.
- Per ogni proteina in fase di test, piastra 2 pozzi su un piatto da utilizzare come la proteina di superficie totale (t = 0) e controlli stripping. Su un secondo piatto, piatto un pozzo per ogni condizione di internalizzazione in fase di sperimentazione (cioè basale endocitico vs farmaco-trattati).
- Preparare le seguenti soluzioni e conservarlo a temperature indicate per l'uso su Giorno 2:
- PBS 2 +: una soluzione salina tampone fosfato (pH 7,4) integrato con 1,5 mM MgCl2, 0,2 mM CaCl 2, (4 ° C)
- Biotinilazione Quench Soluzione: PBS 2 + integrato con 100 mM glicina, (4 ° C)
- NT tampone: 150 mM NaCl, 1,0 mM EDTA, 0,2% di BSA, 20 mM Tris, pH 8,6, (4 ° C)
- RIPA buffer: 10 mM Tris, pH 7,4, 150 mM NaCl, 1,0 mM EDTA, 0.1% SDS, 1.0% Triton X 100, sodio desossicolato 1,0%, (4 ° C)
- Solfo-NHS-SS-biotina soluzione madre: sciogliere in dimetilsolfossido (DMSO) a 200 mg / ml, (-20 ° C)
- Tris (2-carbossietil) fosfina cloridrato (TCEP) soluzione madre: 500 mm H 2 O, (-20 ° C, coperto di pellicola per bloccare la luce)
2 ° giorno:
- Preparare PBS 2 + integrato con glucosio 0.18g/ml, 0,2% IgG / proteasi senza albumina di siero bovino (PBS 2 + / g / BSA). Pre-riscaldare la soluzione a 37 ° C a bagnomaria.
- Scongelare il solfo-NHS-SS-biotina soluzione madre sul banco per sciogliere il DMSO. Immediatamente prima dell'uso, preparare fresca solfo-NHS-SS-biotina soluzione (2,5 mg / ml in PBS freddo ghiaccio 2 +, sufficiente per 0,75 ml / pozzetto). Vortex vigorosamente la soluzione per solubilizzare il DMSO. Si noti che il NHS-biotina reagente viene facilmente idrolizzato in soluzione acquosa. Pertanto, tutte le soluzioni devono essere preparate immediatamente prima dell'uso.
- Biotinilazione: piatti Mettere su un bagno di ghiaccio nella stanza fredda e lavare 3 x 2 ml con PBS freddo ghiaccio 2 +. Assicurarsi che le piastre sono leggermente angolati per consentire il drenaggio e la rimozione completa della soluzione tampone. Aggiungere 0,75 ml / pozzetto di fresco solfo-NHS-SS-biotina soluzione in ogni pozzetto. Incubare x 15 ', 4 ° C sul bagno di ghiaccio con agitazione vigorosa. Dopo l'incubazione è completa, preparare un altro dolce solfo-NHS-SS-biotina soluzione. Sostituire la vecchia soluzione con la soluzione fresca e incubare x 15 ', 4 ° C.
- Tempra: è fondamentale che tutti i non-reazione NHS-biotina molecole sono temprati, in modo che non reagiscono con le proteine intracellulari e biotinylate una volta che le cellule sono lisate. Lavare le cellule 3 x 2 ml di soluzione di tempra e incubare due volte in 2 ml di soluzione spegnere x 15 ', 4 ° C agitando delicatamente.
- Interiorizzazione: se trattamenti farmacologici sono in fase di test, aggiungere giusta concentrazione di farmaco PBS 2 + / g / BSA. Mantenere piastra di controllo a 4 ° C e portare piastra interiorizzazione fuori dalla stanza fredda. Lavare 3 x 2 ml con PBS preriscaldata 2 + / g / BSA (+ / - drUGS) e lasciare in stesse soluzioni (2 ml / pozzetto). Riempire qualsiasi vuoto con pozzi pre-riscaldato soluzione per garantire la temperatura uniforme in tutto il piatto. Trasferire le cellule a 37 ° C in incubatore per 10 '. Immediatamente prima della fine della 37 ° C di incubazione, preparare una soluzione fresca TCEP 50 mM in tampone di NT da utilizzare per passo stripping e memorizzare sul ghiaccio. Preparare la quantità sufficiente per 1,0 ml / pozzetto.
- Spogliarello: Immediatamente piastra di trasferimento (s) a bagno di ghiaccio e di tornare a camera fredda. Lavare rapidamente le celle con ghiaccio freddo NT tampone, 3 x 2 ml di fermare endocitosi. Anche lavare striscia dei pozzetti di controllo 3 x 2 ml con tampone NT. Aggiungere 1,0 ml di soluzione fresca stripping in ciascun pozzetto. Incubare in ghiaccio, 15 ', 4 ° C agitando delicatamente. Sostituire pozzetti con soluzione fresca stripping e incubare un ulteriore 15 ', 4 ° C il ghiaccio.
- Lisi: lavare tutti i pozzetti che sono stati esposti a soluzione stripping, 3 x 2 ml NT buffer. Quindi lavare tutti i pozzetti (compresi i controlli totali) con 3 x 2 ml di PBS 2 +. Lyse in 300μl/well RIPA buffer (tampone di lisi o altro compatibile per la proteina di interesse) contenenti gli inibitori della proteasi fresca (1,0 mM PMSF, 1,0 mg / ml ogni leupeptina, aprotinina e pepstatina). Lyse agitando x 20 ', 4 ° C. Trasferimento a tubi microcentrifuga e chiaro detriti cellulari mediante centrifugazione 18.000 xg, 10 ', 4 ° C.
- Concentrazione determinazione delle proteine: utilizzare un dosaggio di proteine compatibile con le vostre condizioni di lisi (es. proteina DC test, Bio-Rad) per determinare la concentrazione proteica del lisato rispetto ad una curva standard di BSA.
- Streptavidina cromatografia di affinità: Preparare tubi microcentrifuga con quantità equivalenti di proteine per ogni campione. Aggiungi tampone di lisi per portare il volume finale di ogni campione di 200μl. Vortex la streptavidina perline agarosio vigorosamente per portare a una sospensione anche. Utilizzando una pipetta 200μl con la punta tagliata, perline pipetta in ciascuna provetta. Consigliato 20μl beads/50 lisato mcg. Incubare per una notte, 4 ° C su un rotatore tubo.
Giorno 3:
- Lavaggio tallone: Centrifugare i campioni, 18.000 xg, 2 'per raccogliere perle. Aspirare off lisato, facendo attenzione a non avvicinarsi tallone pellet con aspiratore. Utilizzare una punta di plastica pipetta sulla fine della aspiratore per un migliore controllo. Aggiungere 0,75 ml di tampone di lisi a ciascuna provetta e miscelare per lavare perline. Campioni centrifuga, 18.000 xg, 2 'per raccogliere perline e ripetere l'aspirazione e lavaggio due volte (tre lavaggi in totale). Dopo l'ultimo lavaggio, aspirare la maggior quantità di buffer come possibile senza disturbare il pellet tallone. Ribaltamento del tubo verso l'aspiratore assiste con questo passaggio.
- Eluizione del campione: Aggiungere 20-25μl di buffer 2x campione Laemmli (riduzione) in ciascuna provetta. L'agente riducente si unirà il SSN-SS-biotina legame disolfuro, rilasciando le proteine isolate in soluzione. La maggior parte delle proteine di membrana sono estremamente vulnerabili quando aggregazione bollito, e non deve essere riscaldato prima del caricamento su gel per SDS-PAGE. Determinare la sensibilità al calore della vostra proteina di interesse prima di effettuare questi esperimenti. Se la proteina non può tollerare il riscaldamento bollente /, incubare su un rotatore, 30 ', temperatura ambiente prima analisi mediante SDS-PAGE. Questo è sufficiente a fendere il legame disolfuro ed eluire le proteine.
- SDS-PAGE e immunoblotting: proteine separate mediante SDS-PAGE. Per ogni campione, è più facile eseguire gli esempi nel seguente ordine: superficie totale (tempo = 0), nastri, condizione interiorizzazione # 1, Condizione # 2, ecc Trasferimento a membrana per immunoblotting e macchia con l'anticorpo appropriato per la propria proteina di interesse. Cattura le bande immunoreattive utilizzando una telecamera CCD-sistema di documentazione del gel, essendo certi che non ci siano pixel saturi. Quantificare ogni densità banda utilizzando gel di analisi / densitometria software.
Rappresentante dei risultati:
Un risultato di immunoblot rappresentante è mostrato nella Figura 2A. Il segnale più forte è nella corsia "totale" (T), che è quantità totale di proteina di superficie prima di internalizzazione. Il comando "strip" (S) dovrebbe essere idealmente vicino a vuoto, il che dimostra che la striscia era efficiente per l'esperimento. L'efficienza striscia è calcolato confrontando la densità della corsia "striscia" a quella della corsia "totale" (es. proteina che è stata biotinilati in parallelo con la striscia, ma non era né riscaldato a 37 ° C, né esposti a soluzione stripping). La formula viene utilizzata la seguente:
[1 - (striscia / totale)] * 100%
Usando questa formula, la striscia in Figura 2 è stata del 99,8% efficiente. Infine, si vedrà fasce di minore intensità rispetto al totale nella corsia di internalizzazione (s) (I). Nell'esempio (Figura 2), le cellule trattate sono stati trattati con veicolo o 1μM acetato forbolo miristato (PMA) nel corso di un 10 'i tassi di internalizzazione trasportatore della dopamina e internazionalizzazione sono stati misurati per un 10' internalizzazione periodo iniziale. Il tasso di internalizzazione è calcolato comesegue:
interiorizzato / totale * 100
Come si vede nella figura 2B, 10,4% della superficie DAT interiorizzato oltre 10 'sotto di veicoli trattati con condizioni. PMA trattamento aumento dei tassi di interiorizzazione DAT al 23,2% della superficie totale DAT.
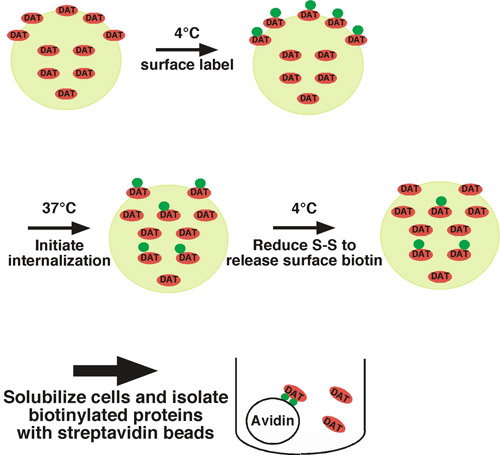
Figura 1. Cellule illustrazione del protocollo. Biotinilato sono a 4 ° C per etichettare esclusivamente la popolazione di superficie, e sono spostati a 37 ° C per avviare internalizzazione. A seguito di internazionalizzazione, le cellule sono rapidamente raffreddata per fermare i processi endocitico e biotina superficie residua è spogliato trattando le cellule con un agente riducente. L'unico proteine biotinilato che rimangono sono quelle verificatesi dalla superficie al tempo t = 0 e sono stati interiorizzati, così li protegge dal trattamento stripping. Biotinilato proteine sono isolati dal lotto cromatografia di affinità con perline streptavidina e la proteina di interesse viene rilevato da immunoblotting.
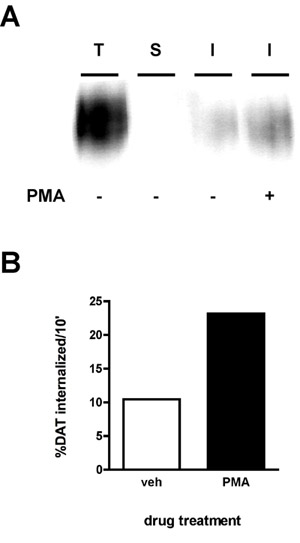
Figura 2. Attivazione PKC aumenta il tasso endocitico DAT. Test internalizzazione. PC12 cellule che esprimono stabilmente DAT sono stati biotinilato, 4 ° C, come descritto nel "Protocollo dettagliate". Le cellule sono state rapidamente portato a 37 ° C ± 1 microM PMA e incubate 10 ', 37 ° C. Biotina residuo è stato spogliato, riducendo, le cellule sono state lisate e le proteine biotinilati sono stati isolati da streptavidina cromatografia di affinità. (A) immunoblot Rappresentante mostrando DAT superficie totale al tempo t = 0 (T), striscia di controllo (S), e interiorizzato DAT (I), alle condizioni indicate. (B) Bande sono stati catturati con una telecamera CCD e quantificati con quantità di dati software (Bio-Rad). I dati sono espressi come minimo totale% DAT internalized/10.
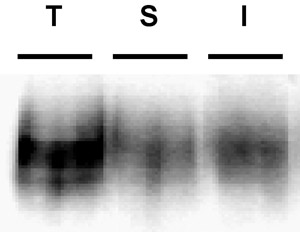
Figura 3. Immunoblot esempio raffigurante una striscia povero biotina. Internalizzazione test. PC12 cellule che esprimono stabilmente DAT sono stati biotinilato, 4 ° C, come descritto nel "Protocollo dettagliate". Le cellule sono state rapidamente riscaldato a 37 ° C e incubare 10 ', 37 ° C. Biotina residuo è stato spogliato, riducendo, le cellule sono state lisate e le proteine biotinilati sono stati isolati da streptavidina cromatografia di affinità. La mostra immunoblot DAT superficie totale al tempo t = 0 (T), striscia di controllo (S), e interiorizzato DAT (I). Si noti la banda visibile nella corsia striscia di controllo, indicativo di efficienza striscia poveri.
Discussione
I problemi più comuni: Il problema più comune che si pone in questi esperimenti è l'efficienza striscia poveri. L'efficienza della striscia è fondamentale essere in grado di interpretare i risultati. A meno che la striscia è stata molto efficiente, non è possibile concludere che qualsiasi proteine biotinilati nelle corsie internalizzazione erano, infatti, interiorizzati dalla superficie. Strisce di efficienza ≥ 90% sono ottimali, e noi scartare alcun risultato se la striscia scende al di sot...
Riconoscimenti
Questo lavoro è stato finanziato dal NIH concedere # DA15169 di HEM
Riferimenti
- Holton, K. L., Loder, M. K., Melikian, H. E. Nonclassical distinct endocytic signals dictate constitutive and PKC-regulated neurotransmitter transporter internalization. Nat Neurosci. 8, 881-888 (2005).
- Boudanova, E., Navaroli, D. M., Melikian, H. E. Amphetamine-induced decreases in dopamine transporter surface expression are protein kinase C-independent. Neuropharmacology. 54, 605-612 (2008).
- Boudanova, E., Navaroli, D. M., Stevens, Z., Melikian, H. E. Dopamine transporter endocytic determinants: carboxy terminal residues critical for basal and PKC-stimulated internalization. Mol Cell Neurosci. 39, 211-217 (2008).
- Loder, M. K., Melikian, H. E. The dopamine transporter constitutively internalizes and recycles in a protein kinase C-regulated manner in stably transfected PC12 cell lines. J Biol Chem. 278, 22168-22174 (2003).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon