Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mess-Plasmamembranprotein endocytischen Preise von Reversible Biotinylierung
In diesem Artikel
Zusammenfassung
Regulierte Endozytose regelt die Zelloberflächenexpression Ebenen der Mehrheit der Membranproteinen. Hier nutzen wir reduzierbar, Membran impermeante Biotinylierungsreagenzien die endocytischen Rate der Dopamin-Transporter (DAT), ein polytoper Membranprotein zu messen. Das Verfahren ermöglicht eine einfache Methode zur Messung der Endozytose von den meisten Plasmamembranproteinen.
Zusammenfassung
Plasma-Membran-Proteine sind eine große, heterogene Gruppe von Proteinen, Rezeptoren, Ionenkanäle, Transporter und Pumpen umfasst. Die Aktivität dieser Proteine ist verantwortlich für eine Vielzahl von Schlüsselbegriffen zellulären Ereignissen, einschließlich Nährstoffzufuhr, zelluläre Erregbarkeit und chemische Signalisierung. Viele Plasmamembranproteinen werden dynamisch von endocytischen Menschenhandel, die Funktion von Proteinen moduliert durch die Veränderung Proteinoberfläche Ausdruck geregelt. Die Mechanismen, die Protein Endocytose zu erleichtern, sind komplex und nicht vollständig für viele Membranproteine verstanden. Um das Verständnis der Mechanismen, die die endocytischen Handel mit einem bestimmten Protein-Steuerung, ist es entscheidend, dass das Protein s endocytischen Rate präzise gemessen werden. Für viele Rezeptoren, sind direkte endocytischen Rate-Messungen häufig erreicht Verwendung markierter Rezeptor-Liganden. Doch für viele Klassen von Membranproteinen, wie etwa Transporter, Pumpen und Ionenkanäle, gibt es keine passende Ligand, mit dem die endocytischen Rate gemessen werden kann. In dem vorliegenden Bericht beschreiben wir eine reversible Biotinylierung Methode, die wir einsetzen, um die Dopamin-Transporter (DAT) endocytischen zu messen. Diese Methode stellt eine einfache Methode zur Messung von Internalisierung Raten und kann leicht für den Handel mit Studien der meisten Membranproteine eingesetzt werden.
Protokoll
Vorgehensweise im Überblick:
Mit diesem Ansatz sind Zelloberfläche Proteine kovalent mit Biotin auf den verfügbaren extrazellulären Lysin-Reste mit einer Membran impermeante, Disulfid-gekoppelten Biotinylierungsreagenz (Sulfo-NHS-SS-Biotin) unter Menschenhandel restriktiven Bedingungen (zB bei niedriger Temperatur) bezeichnet (siehe Abb.. 1 zur Illustration). Eine Gruppe von Zellen zur Bekämpfung permissiven Bedingungen verschoben (37 ° C) und biotinylierte Proteine zu verinnerlichen. Die andere Gruppe von Zellen bei niedriger Temperatur als Kontrollen für 1) die gesamte Oberfläche Protein zur Zeit = 0, und 2) stripping Kontrolle gehalten. Nach einer kurzen Periode der Internalisierung werden die Zellen wieder auf niedriger Temperatur, um die Internalisierung stoppen verschoben, und alle restlichen Oberfläche Biotin wird durch Behandlung von Zellen mit einem Reduktionsmittel, die Disulfid-gekoppelte Biotin spaltet beraubt. Biotinylierter Proteine, die von der Zelloberfläche entstanden und wurden verinnerlicht werden aus der Strippung geschützt, und die einzige biotinylierten Proteinen, die bleiben werden. Nach Zelllyse sind biotinylierten Proteinen durch Streptavidin-Affinitätschromatographie isoliert und das Protein von Interesse wird durch quantitative Immunoblot erkannt. Zur Bestimmung der endocytischen Rate, ist der Betrag, der verinnerlicht Protein auf die gesamte Oberfläche zu steuern zur Zeit = 0 gekennzeichnet verglichen. Wir haben erfolgreich dieser Ansatz verwendet, um die Internalisierung von der neuronalen Noradrenalin-1 und Dopamin-Transporter 1-4 messen.
Detaillierte Protokoll:
Tag 1:
- Platte Zellen in 6-Well-Platten, so dass sie ca. 80% konfluent am Tag 2 werden. Alternativ, wenn transfizierte Zellen genutzt werden, in einer solchen Dichte, dass sie ca. 80% konfluent werden zum Zeitpunkt der Internalisierung Rate gemessen werden transfizieren. Wenn Zellen nicht stark haftende, sollte Gewebekultur ware mit einer Zelladhäsion Substrat (z. B. Poly-D-Lysin) zu Zellverlust während der umfangreichen Waschschritte zu verhindern behandelt werden.
- Für jedes Protein getestet, um Platte 2 Brunnen auf einer Platte, wie die gesamte Oberfläche Protein (t = 0) und Strippen Kontrollen verwendet werden. Auf einer zweiten Platte, Platte eine Vertiefung für jedes Internalisierung Zustand getestet (dh basalen endocytischen Rate vs Medikament behandelt).
- Bereiten Sie die folgenden Lösungen und speichern bei den angegebenen Temperaturen für den Einsatz am Tag 2:
- PBS 2 +: Phosphat gepufferter Kochsalzlösung (pH 7,4) mit 1,5 mM MgCl 2, 0,2 mM CaCl 2, (4 ° C)
- Biotinylierung Quench Lösung: PBS 2 + ergänzt mit 100 mM Glycin, (4 ° C)
- NT-Puffer: 150 mM NaCl, 1,0 mM EDTA, 0,2% BSA, 20 mM Tris, pH 8,6, (4 ° C)
- RIPA Puffer: 10 mM Tris, pH 7,4, 150 mM NaCl, 1,0 mM EDTA, 0,1% SDS, 1,0% Triton X 100, 1,0% Natriumdeoxycholat, (4 ° C)
- Sulfo-NHS-SS-Biotin-Stammlösung: Lösen Sie in Dimethylsulfoxid (DMSO) und 200 mg / ml, (-20 ° C)
- Tris (2-Carboxyethyl) phosphin-Hydrochlorid (TCEP) Stammlösung: 500 mM in H 2 O, (-20 ° C, bedeckt mit Folie um Licht zu blockieren)
Tag 2:
- Bereiten PBS 2 + mit 0.18g/ml Glucose, 0,2% IgG / Protease-Rinderserumalbumin (PBS 2 + / g / BSA). Pre-warm diese Lösung auf 37 ° C im Wasserbad.
- Tauen Sie das Sulfo-NHS-SS-Biotin-Stammlösung auf der Tischplatte, um das DMSO zu schmelzen. Unmittelbar vor der Verwendung, bereiten Sie frisches Sulfo-NHS-SS-Biotin-Lösung (2,5 mg / ml in eiskaltem PBS 2 +, ausreichend für 0,75 ml / well). Vortex die Lösung kräftig auf die DMSO löslich. Beachten Sie, dass der NHS-Biotin-Reagenz leicht hydrolysiert in wässriger Lösung. Daher sollten alle Lösungen unmittelbar vor bereit, zu verwenden.
- Biotinylierung: Place Platten auf einem Eisbad im Kühlraum und spülen Sie 3 x 2 ml mit eiskaltem PBS 2 +. Seien Sie sicher, dass die Platten leicht angewinkelt sind, um für die komplette Entwässerung und Entfernung der Pufferlösung zu ermöglichen. Add 0,75 ml / Vertiefung der frischen Sulfo-NHS-SS-Biotin-Lösung in jede Vertiefung. Inkubieren x 15 ', 4 ° C auf dem Eisbad unter kräftigem Schütteln. Nach der Inkubation abgeschlossen ist, bereiten anderen frischen Sulfo-NHS-SS-Biotin-Lösung. Ersetzen Sie die alte Lösung mit der frischen Lösung, Inkubation x 15 ', 4 ° C.
- Abschrecken: Es ist wichtig, dass alle nicht-reagierende NHS-Biotin-Moleküle abgeschreckt werden, so dass sie nicht mit zu reagieren und Biotinylierung intrazellulären Proteinen, sobald die Zellen lysiert sind. Wash-Zellen 3 x 2 ml mit Abschrecken Lösung, Inkubation zweimal in 2 ml Quenchlösung x 15 ', 4 ° C unter leichtem Schütteln.
- Internalisierung: Wenn die medikamentöse Behandlungen getestet werden, fügen Sie geeignete Wirkstoffkonzentration zu PBS 2 + / g / BSA. Behalten Sie die Kontrolle Platte bei 4 ° C und bringen Internalisierung Platte aus dem kalten Raum. Wash 3 x 2 ml mit vorgewärmter PBS 2 + / g / BSA (+ / - drugs) und in dieselben Lösungen (2 ml / well) zu verlassen. Füllen Sie alle leeren Brunnen mit vorgewärmten Lösung für eine gleichmäßige Temperaturverteilung über die Platte zu gewährleisten. Übertragen Sie die Zellen in ein 37 ° C Inkubator für 10 '. Unmittelbar vor dem Ende von 37 ° C inkubiert, bereiten Sie frisches 50 mM TCEP-Lösung in NT-Puffer für Strippen und speichern auf Eis verwendet werden. Bereiten Sie ausreichend für 1,0 ml / well.
- Stripping: Sofortüberweisung Platte (n) zu Eisbad und zum kalten Raum. Schnell waschen Sie die Zellen mit eiskaltem NT-Puffer, 3 x 2 ml bis Endozytose zu stoppen. Auch waschen Streifen Kontrollvertiefungen 3 x 2 ml mit NT-Puffer. Fügen Sie 1,0 ml frisches Stripping Lösung in jede Vertiefung. Inkubieren auf Eis, 15 ', 4 ° C unter leichtem Schütteln. Ersetzen Brunnen mit frischem Stripping Lösung, Inkubation weitere 15 ', 4 ° C auf Eis.
- Lysis: Waschen Sie alle Vertiefungen, die Strippen-Lösung, 3 x 2 ml NT-Puffer ausgesetzt waren. Dann waschen alle Vertiefungen (einschließlich der gesamten Controls) mit 3 x 2 ml PBS 2 +. Lyse in 300μl/well RIPA Puffer (oder andere Lysepuffer kompatibel für das Protein von Interesse) mit frischem Protease-Inhibitoren (1,0 mM PMSF, 1,0 pg / ml Leupeptin, Aprotinin und Pepstatin). Lyse durch Schütteln x 20 ', 4 ° C. Transfer zum Mikrozentrifugenröhrchen und klare Zelltrümmer durch Zentrifugation 18.000 xg, 10 ', 4 ° C.
- Protein Konzentrationsbestimmung: Verwenden Sie ein Protein-Assays kompatibel mit Ihrem Lyse Bedingungen (z. B. DC Protein Assay, Bio-Rad), um den Proteingehalt der Lysate zu bestimmen, wie ein Standard-BSA-Kurve verglichen.
- Streptavidin-Affinitätschromatographie: Bereiten Mikrozentrifugenröhrchen mit äquivalenten Mengen an Protein für jede Probe. Add Lysepuffer Endvolumen jeder Probe zu 200 ul zu bringen. Vortex die Streptavidin Agarose-Beads kräftig auf eine gleichmäßige Suspension zu bringen. Mit einem 200 ul Pipette mit der Spitze abgeschnitten, Pipette Perlen in jedes Röhrchen. Empfehlenswerte 20 &mgr; l beads/50 pg Lysat. Inkubieren über Nacht bei 4 ° C auf einem Rohr Rotator.
Tag 3:
- Bead Waschen: Centrifuge Proben, 18.000 xg, 2 ', um Perlen zu sammeln. Absaugen Lysat man aufpassen, nicht zu Wulst Pellet mit Aspirator Ansatz. Verwenden Sie einen Kunststoff-Pipettenspitze am Ende des Saugers für eine bessere Kontrolle. Add 0,75 ml Lysepuffer in jedes Röhrchen und Wirbel um Perlen zu waschen. Centrifuge Proben, 18.000 xg, 2 ', um Perlen und wiederholen Anspruch erheben und zweimaligem Waschen (drei Wäschen in Summe). Nach dem letzten Waschen, saugen so viel von der Puffer wie möglich, ohne die Perlen Pellets. Tipping the tube zum Aspirator hilft bei diesem Schritt.
- Beispiel Elution: In 20-25 &mgr; l 2x Laemmli-Probenpuffer (reduzierend) in jedes Röhrchen. Das Reduktionsmittel wird spalten die NHS-SS-Biotin Disulfidbindung, die Freigabe der isolierten Proteine in Lösung. Die meisten Membranproteine sind sehr anfällig für Aggregation, wenn gekocht, und sollte nicht vor dem auf Gelen Belastung für SDS-PAGE beheizt werden. Bestimmen Sie Wärmeempfindlichkeit Ihrer Protein von Interesse vor der Durchführung dieser Experimente. Wenn Protein nicht tolerieren können kochendem / Heizung, auf einem Rotator, 30 ', Raumtemperatur vor inkubieren durch SDS-PAGE Analyse. Dies ist ausreichend zur Spaltung der Disulfidbrücke und eluieren die Proteine.
- SDS-PAGE und Immunoblot: Separate Proteine durch SDS-PAGE. Für jede Probe ist es am einfachsten, die Proben in der folgenden Reihenfolge ausführen: Gesamtfläche (Zeit = 0), Streifen, Internalisierung Bedingung Nr. 1, Bedingung 2, etc. Transfer zum Membran für Immunoblotting und Blot mit entsprechenden Antikörper für Ihr Protein von Interesse. Erfassen immunreaktiven Banden mit einer CCD-Kamera Geldokumentationssystem, dass bestimmte, dass es keine gesättigten Pixel. Quantifizierung jedes Band Dichte mit Gel-Analyse / Densitometrie-Software.
Repräsentative Ergebnisse:
Ein Vertreter Immunoblot Ergebnis ist in Abbildung 2a dargestellt. Das stärkste Signal ist in die "totale" lane (T), die Gesamtmenge an Oberflächenprotein ist vor Verinnerlichung. Der "Strip"-Regelung (S) sollte idealerweise in der Nähe von leer, was bedeutet, dass der Streifen effizient war für das Experiment demonstriert. Der Streifen Effizienz wird durch den Vergleich der Dichte des "Strip" lane, dass der "total" Spur berechnet werden (zB Protein, das parallel zu den Streifen biotinylierten wurde, war aber weder auf 37 ° C erwärmt, noch ausgesetzt Stripping-Lösung). Die folgende Formel verwendet:
[1 - (Band / total)] * 100%
Mit dieser Formel wurde der Streifen in Abbildung 2 99,8% effizienter. Schließlich werden Sie Banden geringerer Intensität als die Summe in die Internalisierung lane (s) (I) zu sehen. Im Beispiel (Abbildung 2), Zellen behandelt wurden entweder mit Fahrzeug oder 1 &mgr; Phorbolmyristatacetat (PMA) während einer 10 behandelten ersten Internalisierung Zeitraum "Internalisierung und Dopamin-Transporter Internalisierung Raten wurden für eine 10 'gemessen. Die Internalisierung Rate wird wie folgt berechnetfolgt:
verinnerlicht / insgesamt * 100
Wie in Abbildung 2B zu sehen, 10,4% der Fläche DAT über 10 'unter Vehikel-behandelten Bedingungen verinnerlicht. PMA-Behandlung erhöhte DAT Internalisierung Preise auf 23,2% der Gesamtfläche DAT.
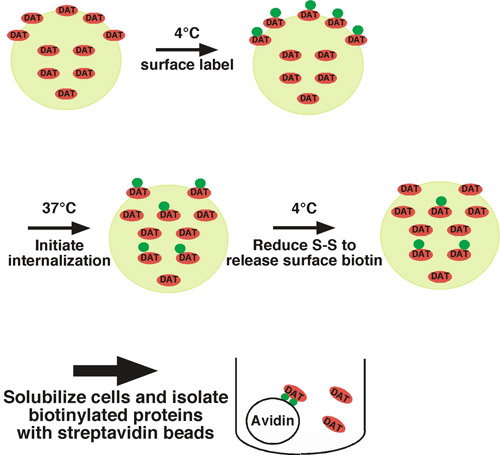
Abbildung 1. Protokoll Illustration. Cells sind bei 4 ° C biotinylierten ausschließlich Etikett der Oberfläche der Bevölkerung und sind bis 37 ° C verschoben, um die Internalisierung zu initiieren. Nach Internalisierung Zellen werden schnell gekühlt, um endocytischen Prozesse und Restfläche Biotin Anschlag wird durch Behandlung von Zellen mit einem Reduktionsmittel befreit. Die einzige biotinylierten Proteine, die bleiben, sind jene, die von der Oberfläche bei t = 0 entstanden und wurden verinnerlicht, damit sie vor dem Abstreifen der Behandlung. Biotinylierter Proteine werden durch Batch-Affinitätschromatographie mit Streptavidin-Beads isoliert und das Protein von Interesse ist durch Immunoblot nachgewiesen werden.
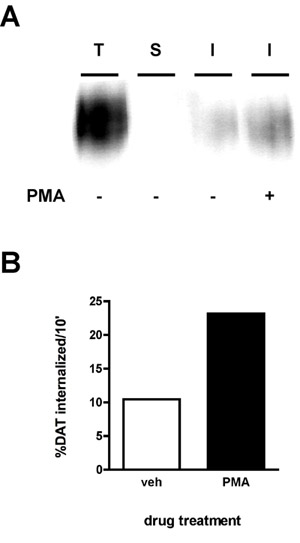
Abbildung 2. PKC-Aktivierung erhöht sich die DAT endocytischen Rate. Internalisierung Assay. PC12-Zellen stabil exprimiert DAT wurden biotinylierte, 4 ° C, wie in "Detaillierte Protocol" beschrieben. Die Zellen wurden schnell auf 37 ° C erwärmt ± 1 nM PMA und inkubiert 10 ', 37 ° C. Residual Biotin, indem ausgezogen war, wurden die Zellen lysiert und biotinylierten Proteine wurden isoliert durch Streptavidin-Affinitätschromatographie. (A) Repräsentative Immunoblots zeigen Gesamtfläche DAT bei t = 0 (T), Streifen-Regelung (S), und verinnerlicht DAT (I) unter den angegebenen Bedingungen. (B) Bands wurden mit einer CCD-Kamera erfasst und quantifiziert Menge Data Software (Bio-Rad). Die Daten werden als% insgesamt DAT internalized/10 min ausgedrückt.
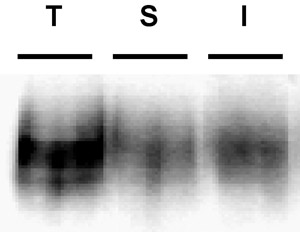
Abbildung 3. Beispiel Immunoblot Darstellung eines armen Biotin Streifen. Internalisierung Assay. PC12-Zellen stabil exprimiert DAT wurden biotinylierte, 4 ° C, wie in "Detaillierte Protocol" beschrieben. Die Zellen wurden schnell auf 37 ° C erwärmt und inkubiert 10 ', 37 ° C. Residual Biotin, indem ausgezogen war, wurden die Zellen lysiert und biotinylierten Proteine wurden isoliert durch Streptavidin-Affinitätschromatographie. Der Immunoblot zeigt Gesamtfläche DAT bei t = 0 (T), Streifen-Regelung (S), und verinnerlicht DAT (I). Beachten Sie die sichtbare Bande in dem Streifen Kontrolle Spur, Anzeichen für schlechte Streifen Effizienz.
Diskussion
Häufige Probleme: Das häufigste Problem, dass bei diesen Versuchen ergibt sich ist schlecht Streifen Effizienz. Die Effizienz des Streifens ist von entscheidender Bedeutung in der Lage, die Ergebnisse zu interpretieren. Sofern der Streifen wurde hocheffiziente, ist es nicht möglich festzustellen, dass jeder biotinylierten Proteinen in die Internalisierung Gassen, waren in der Tat, verinnerlicht von der Oberfläche. Strips ≥ 90% Wirkungsgrad sind optimal, und wir verwerfen Ergebnisse, wenn die Streifen unter ...
Danksagungen
Diese Arbeit wurde vom NIH geförderten # DA15169 zu HEM
Referenzen
- Holton, K. L., Loder, M. K., Melikian, H. E. Nonclassical distinct endocytic signals dictate constitutive and PKC-regulated neurotransmitter transporter internalization. Nat Neurosci. 8, 881-888 (2005).
- Boudanova, E., Navaroli, D. M., Melikian, H. E. Amphetamine-induced decreases in dopamine transporter surface expression are protein kinase C-independent. Neuropharmacology. 54, 605-612 (2008).
- Boudanova, E., Navaroli, D. M., Stevens, Z., Melikian, H. E. Dopamine transporter endocytic determinants: carboxy terminal residues critical for basal and PKC-stimulated internalization. Mol Cell Neurosci. 39, 211-217 (2008).
- Loder, M. K., Melikian, H. E. The dopamine transporter constitutively internalizes and recycles in a protein kinase C-regulated manner in stably transfected PC12 cell lines. J Biol Chem. 278, 22168-22174 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten