Method Article
ロボット工学と植物組織における遺伝子発現の研究のための動的画像解析
要約
我々は、導入、トラッキングおよび植物細胞におけるGFP発現の定量分析法を報告する。このメソッドは、時間の経過とともに、大量のサンプルから半連続画像コレクションのためにカスタム設計されたロボットのシステムを利用しています。我々はまた、画像系列の分析のためのImageJのとImageReadyの使用方法を示しています。
要約
植物組織における遺伝子発現は、通常のための植物組織からの化合物の破壊的な抽出によって研究されている
プロトコル
以下の方法論は、自動画像収集システムを使用して遺伝子発現の画像解析のためのプロトコルの概要を説明します。説明を簡単にするために、全体的なアプローチは、4つのステップに分けるれました:1)種子の準備、2)遺伝子導入をパーティクルガン法、3)ロボットのイメージのコレクション、および4)画像解析を用いた。この一般的な方法論が他のアプリケーションの広い範囲で使用できますが、プロトコルの現在のセットは、同じ部分で遺伝子発現を追跡するための有用なレポーター遺伝子である緑色蛍光タンパク質(GFP)遺伝子、の使用に基づいています。時間をかけて生きている組織。
I.種子の準備
- リマ豆(。 インゲンlunatus CVヘンダーソン-ブッシュ)の種子を購入、または理想的に成長チャンバー内で生育した植物(相対湿度50%、16 / 8時間ライト:暗い、23分の25 ° C昼/夜)から収穫することができます。収穫後の種子の品質は、-20℃で保存する種子を維持することができる
- 種子の発芽のためにマゼンタGA7容器を準備します。マゼンタボックスの底部に収まるようにろ紙またはペーパータオルを折りたたみます。ペーパータオルを湿らせて、各コンテナに〜25 mLの脱イオン水を追加し、オフ吸収されない水を注ぐ。オートクレーブは、20分の用紙を含むボックスを湿らせた。
- 60rpmで旋回シェーカーで振とうしながら20分間(20〜40ミリリットルで20種)10%市販の漂白液に種子を殺菌、50 mlのディスポーザブル遠沈管を使用する。
注:以降の手順はすべて、層流フードで実行する必要があります。 - 各洗浄中に30秒間穏やかに撹拌しながら滅菌脱イオン水で種子を4-7回すすいでください。
- 各滅菌マゼンタボックス内にある折り畳まれた紙の層の間に5〜6滅菌種子を置きます。
- 25 ° C、16 / 8時間ライト::ダーク、40μEm-2 s -1と 、以下の条件で4日間のシーズをインキュベートする。
II。粒子衝突を利用した遺伝子導入
- 生体組織で監視することができるレポーター遺伝子と、お気に入りの発現ベクターを用いた遺伝子構築物を構築する。我々は、プロモーターとプロモーター要素解析のための高コピー数の発現ベクターが有用設計した。このベクターは、プロモーター/変換された組織におけるプロモーター要素の機能を視覚化するために使用されるGFP遺伝子が含まれています。
- 発芽苗から砲撃、消費税リママメの子葉の前にhを1月2日前後と種皮を取り除く。砲撃に適した子葉は、緑の平らな、さらに画像解析の妨げとなる被害の自由な光を黄色にする必要があります。
- すぐに摘出した後、MS塩1、B5ビタミン2、3%スクロースおよび0.2%ゲルライトを液(pH 5.7)を含むOMSの培地上での場所は子葉。
- DNAは、M10タングステン粒子(シルバニア、トワンダ、ペンシルバニア州、米国)の上に構築沈殿する。 0.6ミリリットルのマイクロ遠心チューブに、25μlのタングステン粒子(粒 子が右使用前に、滅菌水、100mgのml -1の中に再懸濁している)、5μlのDNA(1μgの液-1)、25μlの2.5 Mの塩化カルシウム(シグマを追加アルドリッチの猫。C3881 - 500G)と10μlの100mMのスペルミジン(SigmaカタログS - 2626)。徹底的にすべてのコンポーネントを混在させる簡単に渦。
- 5分間氷上でDNA調製をインキュベートする。その後、50μlの上清を除去して捨てる。
- ボルテックスでDNA被覆粒子を再懸濁し、すぐに2μlのアリコートを削除します。このボルテックスステップのアリコートをチューブから削除されるたびに繰り返します。被覆粒子が氷に保持され、15分以内に使用する必要があります。
- シリンジフィルターの上部を通じ、場所、フィルタ画面の中央に2μlのコーティングされた粒子。パーティクルガンチャンバー内のフィルタ保持部に被覆された粒子を含むフィルタユニットを置きます。
- バッフルにリママメ子葉葉の表側を上にし、パーティクルガンチャンバー内にバッフルを置きます。ビーカーの底に溶け画面で構成されてバッフルは、、爆撃の間に組織をサポートするためのプラットフォームとして使用されます。
- 攻め、次のようにパーティクルガン(この方法論では、我々は単純で安価な粒子の流入ガン3を使用する 、私たちの研究室で設計された豚を、)を使用して組織;)B、チャンバーを排気するように真空につながるバルブを開いて)後に真空は、粒子衝突の後、真空ラインのバルブを閉じ、排気バルブを使用して真空を解除760ミリメートル(30)水銀、ソレノイドをアクティブにし、粒子を推進するためにヘリウムを放出、C)に達する。粒子を加速するために使用するヘリウムの圧力が50 PSIです。
- 真空が解放された後、砲撃子葉を取得し、OMSの培地に、子葉、葉の表側を返すようにチャンバーの扉を開きます。
注:定量化と発現プロファイリングのため、我々は通常、すべてのDNA構築物の3つの子葉の最小値を攻め。通常はDNAであるポジティブコントロール、よく研究された遺伝子発現プロファイルを得、その構造、参照用として用意されています。
III。自動化された画像コレクション
- 水銀ランプの電源を入れ、ウォームアップするためにランプのために30分間待ちます。
- スポット- RT CCDカメラ(診断インスツル株式会社、スターリングハイツ、ミシガン州、米国)とロボットプラットフォームの運動を駆動するロボットプラットフォームモータコントローラ、のために電源をオンにします。
- MZFLIII解剖顕微鏡(ライカ、Heerbrugg、スイス)で、(例40分の480 nmの、エム510 LP。。GFP2フィルターセット)GFP検出用フィルターセットを設定します。
- 70%エタノールを噴霧して厚くポリカーボネートペトリ皿の蓋を滅菌する。ペトリ皿のベースをカバーするために使用される特殊なふたは、画像のコレクション4の間に結露を防ぐ。
- 自動画像収集システムのロボティクスのプラットフォーム(Arrickロボット、ハースト、テキサス州、米国)に砲撃子葉を含むプレートを置きます。ロボティクスプラットフォームは、ステッピングモータのセットで駆動し、8のペトリ皿の添付ファイルのためにテーブルで構成されています。プラットフォームは、ポリカーボネート、ポリプロピレンとアルミで構成されている。プレートは、横方向のプラスチック製の固定ネジを締めて、位置に固定されている。
- ロボティクスのプラットフォームと画像取得の両方を制御するカスタムソフトウェアアプリケーションを開きます。また、ソフトウェア白色光のコントローラのスイッチを開きます。
- "モーターの動き"タブで、"モーターオン"と"モーターホーム"をクリックしてください。ソフトウェアは、ホームポジションへのプラットフォームの向きがした後、我々はすべての子葉のための位置の入力を開始する準備が整いました。
- "モーターの動き"タブでは、最初のプレートを選択します。プラットフォームは、顕微鏡の対物下でペトリ皿の中央に配置します。移動距離のボタンを使用して、正確に画像のコレクションの最初の子葉を置きます。上に白色光コントローラと、ターゲット領域は、"ライブモード"機能をオンにすることでコンピュータのモニターを通して観察することができます。
- 第一子葉の場合は、解剖顕微鏡で手動ノブを使用してフォーカスし、倍率(1.6倍倍率が優先される)を設定します。同じプレート上の残りの子葉のための焦点調整がロボットのプラットフォーム上で、それぞれのプレートの下にある3つのレベリングのネジを使用して作られています。
- 関心領域が設定されると、"この位置に追加"ボタンをクリックしてください。ソフトウェアは、位置のスケジュールファイルにこの領域の座標を追加し、プラットフォームは、プレートの中央に戻ります。
- 位置を設定し、移動距離のボタンとマニュアルレベリングのネジを使用して、プレート上に残っているすべての子葉のために焦点を当てる。すべての子葉のすべての座標を入力したら、位置のスケジュールの座標を保存します。
- 画像コレクションのパラメータを入力します。 "画像設定"タブでは、光、希望の種類を選択し、白または青。 GFPの検出のために、唯一の青い光を使用する必要があります。また、露出設定を入力します。我々は赤、青と緑の色のために独立して露出の時間を変更できますが、我々は通常、私たちが直接確認できるようにGFPの写真 - ドキュメント(それぞれ赤の場合は20、14と14秒、緑と青のチャンネル、)のために同じ設定を使用して、異なるDNA構築物間で一貫性の比較。
- 同じ"画像設定"タブでは、イメージを保存する空のフォルダを指定します。画像の各シリーズは、子葉に入力された位置の順序に従って順次番号、独立したフォルダ内のこのマスターのフォルダ内に保存されます。
- "キャプチャ時間のコントロール"タブに移動し、画像取得の時間間隔と画像のコレクションのサイクル数の合計を設定します。画像は、一般的に、明確に定義された遺伝子発現プロファイルを生成し、100時間のために時間ごとに収集されます。
- をクリックして画像取り込みを開始"実行スケジュール!" "位置のスケジュール"タブにあるボタン。
- 100時間の映像コレクションの最後に、さらに画像解析のためのあらゆる大容量のハードドライブまたはコンピュータにロボットを制御するコンピュータからのすべての画像を転送。高解像度の画像は(1600 × 1200ピクセル)〜5 MBそれぞれを測定するTIFファイルとして収集されます。
IV。画像解析
- Adobe ImageReadyを使用して、各フォルダから100連続した画像を組み立てる。
- ImageReadyを開き、フレームなどのシリーズを構成するすべての連続した画像をインポートします。
- 800 × 600ピクセルのオリジナル画像のサイズを変更します。収集された画像は、画像処理が遅くなることが大きなファイルを生成する高解像度、です。
- 画像をスクロールして、ほとんどの画像に表示されるスポット(s)を見つける。
- 選択されたスポット(複数可)に300%までズームできます。高倍率を用いて画像の位置合わせは、より正確に登録することができます。
- すべての画像の上に層を挿入し、すべてのフレームに表示されていることを確認してください。 "ペイントブラシ"ツールを使用してスポット(複数可)の位置をマークします。
- "移動"ツールを使用してすべてのフレームを合わせ、基準としてレイヤーにマークを取り始める。
- アライメントが完了すると、参照として使用されるレイヤーを削除し、単一の"PSD"ファイルとして画像を保存。また、最高の解像度を使用して単一の"mov"ファイルとしてすべてのフレームをエクスポートします。各画像のシリーズのマニュアルアライメントは〜10分かかります。
- ImageJを用いて遺伝子発現の定量化を行います。
- オープンImageJはソフトウェアとImageReadyで以前に保存されたの"mov"ファイルを開きます。
- 選択ツールを使用して、400 × 300ピクセルの面積と作物のイメージを選択してください。この新しいファイルは"AVI"ファイルとして保存する必要があります。
- "画像"、"色"と、ImageJの"RGBの分割"をクリックして、赤、青、緑のチャンネルに新しい"AVI"ファイルにある連続した画像を、で区切ります。
- 緑と赤のチャネル内のすべての画像からのバックグラウンド蛍光を引きます。グリーンチャンネルの画像のシリーズを使用して、非発現細胞と地域から、20 × 20ピクセルの領域を選択し、同じ領域が両方のチャネルで選択されるように、"ROIマネージャ"ツールでその場所を記録。緑のチャネルでアクティブな20 × 20ピクセルの正方形で、ImageJのタスクバーにある"プラグイン"コマンドに移動して、プラグイン、ツール"スライスごとに減算測定ROI"をクリックしてください。
- ImageJのでは、その後、GFPを発現しているピクセルを定義したり、セグメントに"閾値"を"調整"、"イメージ"をクリックして。 20から30ピクセルの平均スポットサイズを取得するためのしきい値ウィンドウでバーをドラッグしてしきい値レベルを調整します。
- 我々は平均値は、ピクセルあたりの値との合計数GFPを発現しているピクセルをグレースケールに測定するために設計されたというプラグインを使用してGFPの発現を決定する。
- 平均出力をコピーするには、Microsoft Office ExcelにImageJと貼り付けで値をグレースケール。平均値を乗じて各チャンネルのGFPの発現(赤と緑)を計算すると、各チャンネルのGFP発現のピクセルの合計数でピクセルあたりの値をグレースケール。両方のチャネルの式の値の合計は、GFPの発現が得られます。値は、遺伝子発現プロファイルを例示し、直接比較を行うために使用することができます。時間経過のアニメーションは、遺伝子発現プロファイルのユニークで明確な可視化を提供する、"MOV"または"AVI"ファイルを使用して生成することができます。
V.代表の結果
ロボットの画像の収集と分析の手順(図1)ここで報告短い期間での遺伝子発現に関する定量的な大量のデータの取得が可能です。 GFP遺伝子を用いた植物プロモーターの特徴付けのために、この方法論は、唯一の一過性発現プロファイルを作成する(図2)だけでなく、一過性および安定に形質転換植物の組織5,6の詳細-方法のGFPの発現で追跡するために有用ではない。収集された連続画像で生成された短い時間経過のアニメーションは、植物組織の経時遺伝子発現の詳細な分析のための貴重なツールです。この方法論は、直接遺伝子発現に影響を与える要因を評価するための優れたアプリケーションを持っています。例えば、ウイルスの起源のサイレンシングの異なるサプレッサーの存在下で一時的なGFPの発現が正常に私たちの自動画像収集と分析のシステム7,8を用いて研究されてきた。
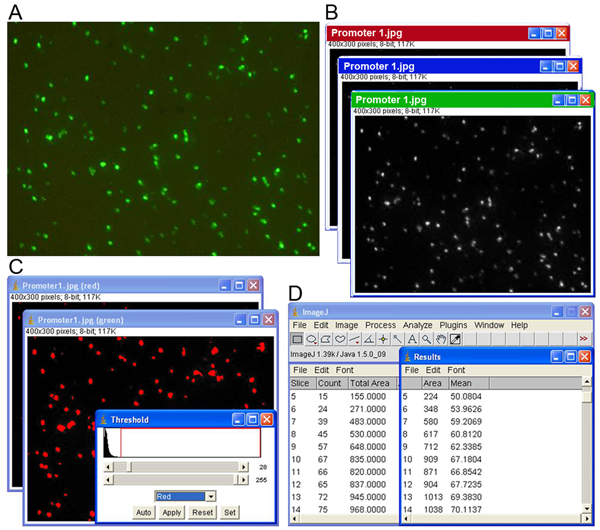
図1画像解析の手順は、次の4つの主要ステップで構成されています。ロボットの画像収集システムを使用して、イメージのシリーズの(A)の取得、画像の(B)分離、赤、青、緑のチャンネルに、しきい値レベルを調整することによって表現するピクセルの(C)セグメンテーション、及び(D)の出力結果を得を含む値とGFP発現フォーカスカウントをグレースケール。
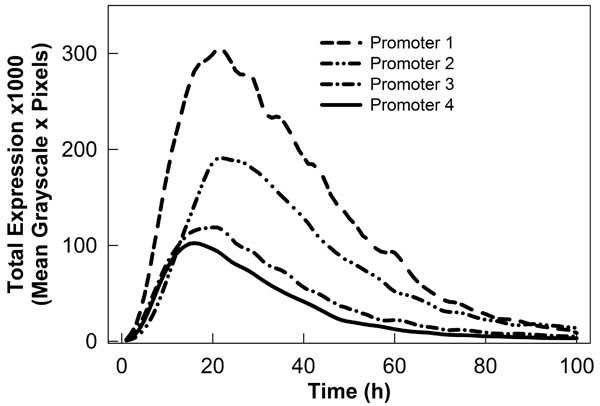
図2。GFPに融合した植物プロモーターによって駆動される別の一時的な発現プロファイルを示すグラフ。データは、当社のロボットの画像収集システムを用いて採取とImageReadyとImageJのソフトで分析した。
ディスカッション
ロボットの使用は、人間の生活のさまざまな側面で巨大なアプリケーションがあり、特に、ロボットが効率的に退屈で複雑なアクティビティを自動化するために、そしてより正確な方法でタスクを遂行するために、危険な環境でのアクティビティを実行するために使用されている。分子生物学、特に遺伝子発現解析では、ロボットは遺伝子だけでなく、機能だけでなく、時間をかけて組織の成長と発展を追跡するのに役立ちます。多くの生命現象は、単一の時点の観測値を使用して従うことが困難になる可能性がある、動的に発生。
発現研究のためのGFP遺伝子の使用は、組織の反応と成長を観察するための付加的な利点をもたらします。我々の実験手順については、GFPはGFPの検出は非破壊的であるとして、私たちは時間の経過とともに組織の同じ部分で遺伝子発現をたどることができます。さらに、GFPタンパク質の私たちのバージョンでは、検出を可能にするために十分に安定であるだけでなく、私たちは遺伝子発現の立ち上がりと立ち下がりの両方を追うことのできる、植物組織での蓄積を最小限に抑えるために、いくつかの売上高を示しています。
我々は、すでに幅広い用途で私たちのロボットの画像の収集と分析のシステムを利用してきた。我々は、現象の動的な理解が望まれる多くの生物学的用途のための高いポテンシャルを予測する。例えば、植物組織の成長と発展は、貴重な洞察/これらのプロセスに関する情報を提供する私たちのシステムを使用して追跡することができます。また、GFPなどのレポーター遺伝子を用いたタンパク質輸送のダイナミクスは、タイムラプスアニメーションを使用して容易に視覚化することができます。このレポートで説明される方法は技術的に複雑ですが、概念的には簡単です。我々の結果は強固であり、新しいアプリケーションが絶えず発見されている。
謝辞
給与や研究支援は、米国大豆ボードによって提供され、州と連邦資金でオハイオ州立大学/オハイオ農業研究開発センターに充当された。この研究はまた、部分的にCONACYT、メキシコ、からCMHGへのフェローシップによってサポートされていました。商標または所有者の製品に関する記述は、OSU / OARDCにより、製品の保証または保証するものではありませんし、またも適当かもしれない他の製品の除外に承認を意味するものではありません。ジャーナル813827 HCS 9月17日。
資料
| Name | Company | Catalog Number | Comments | |
| ImageJ | Software | National Institutes of Health | http://rsbweb.nih.gov/ij/ |
参考文献
- Murashige, T., Skoog, F. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant. 15, 473-497 (1962).
- Gamborg, O. L., Miller, R. A., Ojima, K. Nutrient requirements of suspension cultures of soybean root cells. Exp Cell Res. 50, 150-158 (1968).
- Finer, J. J., Vain, P., Jones, M. W., McMullen, M. D. Development of the particle inflow gun for DNA delivery to plant cells. Plant Cell Rep. 11, 232-238 (1992).
- Finer, J. E., Finer, J. J. A simple method for reducing moisture condensation on Petri dish lids. Plant Cell Tiss Org. 91, 299-304 (2007).
- Buenrostro-Nava, M. T., Ling, P. P., Finer, J. J. Comparative analysis of 35S and Lectin promoters in transgenic soybean tissue using an automated image acquisition system and image analysis. Plant Cell Rep. 25, 290-296 (2006).
- Chiera, J. M., Bouchard, R. A., Dorsey, S. L., Park, E. H., Buenrostro-Nava, M. T., Ling, P. P., Finer, J. J. Isolation of two highly active soybean (Glycine max (L.) Merr.) promoters and their characterization using a new automated image collection and analysis system. Plant Cell Rep. 26, 1501-1509 (2007).
- Chiera, J. M., Lindbo, J. A., Finer, J. J. Quantification and extension of transient GFP expression by the co-introduction of a suppressor of silencing. Transgenic Res. 17, 1143-1154 (2008).
- Dhillon, T., Chiera, J. M., Lindbo, J. A., Finer, J. J. Quantitative evaluation of six different viral suppressors of silencing using image analysis of transient GFP expression. Plant Cell Rep. 28, 639-647 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved