Method Article
Robotique et d'analyse d'images dynamiques pour les études d'expression génique dans les tissus végétaux
Dans cet article
Résumé
Nous rapportons une méthode pour l'introduction, le suivi et l'analyse quantitative de l'expression de GFP dans les cellules végétales. Cette méthode utilise un système conçu sur mesure pour la robotique collection d'images en semi-continu d'un grand nombre d'échantillons, au fil du temps. Nous démontrons également l'utilisation d'ImageJ et ImageReady pour l'analyse des séries d'images.
Résumé
L'expression des gènes dans les tissus végétaux est généralement étudiée par extraction des composés destructeurs de tissus végétaux pour le
Protocole
La méthodologie suivante décrit un protocole pour l'analyse de l'image de l'expression génique utilisant un système automatisé de l'image de collecte. Pour faciliter l'explication, l'approche globale a été décomposé en quatre étapes: la préparation des semences 1), 2) l'introduction du gène par bombardement de particules, 3) la collecte d'images robotiques et d'analyse d'image 4). Bien que cette méthodologie générale peut être utilisée pour une large gamme de d'autres applications, les jeux présents sur les protocoles sont basés sur l'utilisation de la protéine verte (GFP) fluorescentes gène, qui est un gène rapporteur utiles pour l'expression du gène de suivi dans la même pièce des tissus vivants dans le temps.
Préparation semences I.
- Haricot de Lima (. Phaseolus lunatus cv Henderson-Bush) les graines peuvent être achetées ou, idéalement récolté à partir de plantes cultivées dans une chambre de croissance (50% d'humidité relative, 16 / 8 h de lumière: obscurité, 25/23 ° C jour / nuit). La qualité des semences après la récolte peut être maintenu par des graines de stockage à -20 ° C.
- Préparer Magenta GA7 conteneurs pour faire germer les graines. Pliez le papier filtre ou de serviettes en papier pour entrer dans le fond des boîtes Magenta. Ajouter ~ 25 ml d'eau déminéralisée pour chaque conteneur pour humidifier des serviettes en papier, et versez de l'eau non absorbée off. Autoclave papier humidifié contenant les boîtes pendant 20 min.
- En utilisant 50 ml microtubes jetables, stériliser les graines dans une solution de javel commerciale à 10% (20 graines de 20-40 ml) pendant 20 min avec agitation sur un agitateur giratoire à 60 rpm.
Remarque: Toutes les étapes ultérieures doivent être effectuées dans une hotte à flux laminaire. - Rincer les graines 4-7 fois à l'eau déminéralisée stérile avec agitation douce pendant 30 sec lors de chaque rinçage.
- Placer 5-6 graines stériles entre les couches de papier plié situé dans chaque boîte Magenta stérile.
- Incuber les graines pendant 4 jours dans les conditions suivantes: 25 ° C, 16 / 8 h de lumière: obscurité et 40 μEm -2 s -1.
II. L'introduction du gène par bombardement de particules
- Construire des constructions de gènes en utilisant votre vecteur d'expression favori avec un gène rapporteur qui peuvent être surveillés dans les tissus vivants. Nous avons conçu un vecteur copie haute nombre d'expression utile pour le promoteur et les analyses élément promoteur. Ce vecteur contient le gène de la GFP, qui est utilisé pour visualiser promoteur / fonction élément promoteur dans les tissus transformés.
- Autour de 1-2 h avant le bombardement, les cotylédons accise haricot de Lima de germer les semis et enlever les téguments. Cotylédons adaptée pour le bombardement devrait être jaune à vert pâle, plat et exempt de tout dommage qui pourrait interférer avec l'analyse d'images supplémentaires.
- Cotylédons Placer sur un milieu de culture contenant des sels de SGD MS 1, 2 vitamines B5, 3% de saccharose et de Gelrite 0,2% (pH 5,7) immédiatement après avoir été excisée.
- Précipiter la construction d'ADN sur des particules de tungstène M10 (Sylvania, Towanda, PA, USA). Dans un tube de 0,6 ml de microcentrifugation, ajouter 25 ul particules de tungstène (particules sont remises en suspension dans l'eau stérile, 100 mg ml -1, juste avant l'utilisation), 5 ul d'ADN (1 pl g -1), 25 ul de chlorure de calcium 2,5 M (Sigma Cat-Aldrich. C3881-500G) et 10 pl 100 mM (Sigma Cat. S-2626) spermidine. Vortex brièvement pour bien mélanger tous les composants.
- Incuber la préparation de l'ADN sur la glace pendant 5 min. Ensuite, retirer et jeter le surnageant 50 pi.
- Resuspendre les particules enrobées d'ADN par des vortex et de retirer immédiatement une aliquote de 2 pl. Répétez cette étape de vortex à chaque fois une aliquote est retiré du tube. Particules enrobées doivent être conservés dans la glace et utilisé dans les 15 min.
- Grâce à la partie supérieure d'un filtre à seringue, placer 2 ul particules enrobées dans le milieu de l'écran filtrant. Placez l'unité de filtration contenant des particules enrobées dans l'unité de détention filtre à l'intérieur de la chambre de canon à particules.
- Placer un haricot de Lima cotylédons côté adaxiale sur un baffle et le lieu de la chicane dans la chambre de canon à particules. La chicane, qui se compose d'un écran de fondre au fond d'un bécher, est utilisé comme une plate-forme pour soutenir les tissus pendant le bombardement.
- Bombardez les tissus en utilisant un canon à particules (dans cette méthodologie, nous utilisons un canon à particules simple et peu coûteux d'apports 3, PIG, conçu dans notre laboratoire) comme suit: a) ouvrir la vanne menant à la dépression pour évacuer la chambre, b) après le vide atteint 760 mm (30 po) Hg, activer le solénoïde et la libération de l'hélium pour propulser les particules, c) après le bombardement de particules, fermer le robinet ligne de vide et de relâcher le vide à l'aide de la soupape d'échappement. La pression d'hélium utilisé pour accélérer des particules est de 50 psi.
- Après le vide est libéré, ouvrez la porte de la chambre pour récupérer les cotylédons bombardés et retourner le cotylédon, côté adaxiale place, au milieu de culture SGD.
Note: Pour la quantification et le profilage d'expression, nous avons l'habitude bombardent un minimum de trois cotylédons pour chaque construction d'ADN. Un contrôle positif, qui est habituellement un ADNconstruction qui donne un profil bien étudié l'expression des gènes, est compris comme une référence.
III. Collection d'images automatique
- Allumez la lampe au mercure et d'attendre 30 min pour la lampe pour se réchauffer.
- Tournez sur les sources d'alimentation pour la caméra CCD Spot-RT (Diagnostic Instruments Inc, Sterling Heights, Michigan, USA) et la plate-forme robotique contrôleur de moteur, qui entraîne le mouvement de la plate-forme robotique.
- Régler le jeu de filtres pour la GFP détection (GFP2 ensemble de filtres;.. Ex nm 480/40, Em 510 LP) sur un microscope disséquant MZFLIII (Leica, Heerbrugg, Suisse).
- Stériliser les couvercles en polycarbonate épaissi boîte de Petri par pulvérisation avec de l'éthanol à 70%. Les couvercles spécialisé, utilisé pour couvrir la base de boîte de Pétri éviter la condensation pendant 4 collection d'images.
- Placez les plaques contenant cotylédons bombardés sur la plateforme robotique (Arrick Robotique, Hurst, TX, USA) du système de collecte automatisée d'images. La plate-forme robotique est piloté par un ensemble moteur pas à pas et se compose d'une table pour la fixation des boîtes de Pétri 8. La plateforme est construite en polycarbonate, polypropylène et aluminium. Les plaques sont fixées en position par serrage en plastique latéraux de vis de fixation.
- Ouvrez l'application logicielle personnalisée qui contrôle à la fois la plate-forme de robotique et d'acquisition d'image. Aussi, ouvrez le logiciel switch blanche contrôleur de la lumière.
- Dans le «mouvement du moteur", cliquez sur "moteur sur» et «camping». Une fois le logiciel oriente la plate-forme à la position de la maison, nous sommes prêts à commencer à entrer des positions pour chaque cotylédon.
- Dans le «mouvement du moteur", sélectionnez la première plaque. La plate-forme sera la position du centre de la boîte de Pétri sous l'objectif du microscope. En utilisant les boutons de distance de déplacement, de positionner précisément le cotylédon première collection d'images. Avec le contrôleur de lumière blanche sur la région cible peut être observée à travers l'écran d'ordinateur en activant le mode "live" caractéristique.
- Pour le premier cotylédon, mis l'accent et le grossissement (grossissement 1.6x est préférable) en utilisant les boutons de manuel sur le microscope à dissection. Accent ajustements pour les cotylédons restant sur la même plaque sont faites au moyen de trois vis de réglage située sous chaque assiette, sur la plateforme robotique.
- Une fois la région d'intérêt a été fixé, cliquez sur le lien "ajouter cette position" bouton. Le logiciel va ajouter les coordonnées de cette région à un fichier de planification position et la plate-forme sera de retour au centre de la plaque.
- Régler les positions et se concentrer pour tous les cotylédons restant sur des plaques en utilisant les boutons distance de déplacement et de vis de réglage manuel. Après toutes les coordonnées de tous les cotylédons ont été inscrits, enregistrer les coordonnées calendrier de position.
- Entrez les paramètres de collecte d'images. Dans le "réglage de l'image", sélectionnez le type de lumière désiré; blanc ou bleu. Pour la détection GFP, seule la lumière bleue devrait être utilisé. Aussi, entrez le paramètre d'exposition. Bien que nous ne pouvons modifier le temps d'exposition indépendamment de la couleur rouge, bleu et vert, nous utilisons habituellement les mêmes paramètres pour la GFP photo-documentation (20, 14 et 14 sec pour le canal rouge, vert et bleu, respectivement) nous permettant de faire des directs et comparaisons cohérentes entre les constructions d'ADN différentes.
- Dans la même «mise en image" onglet, spécifiez un dossier vide dans lequel les images seront stockées. Chaque série d'images seront sauvegardées dans ce dossier principal dans des dossiers indépendants, numérotés séquentiellement selon l'ordre des positions entré pour cotylédons.
- Allez à la "commande en temps de capture" onglet et définissez l'intervalle de temps d'acquisition d'image et le nombre total de cycles de collecte de l'image. Les images sont généralement recueillies toutes les heures pendant 100 h, générant bien définis des profils d'expression génique.
- Démarrer l'acquisition d'images en cliquant sur le "calendrier de courir!" bouton situé dans le «calendrier de la position" onglet.
- A la fin de la collection de 100 images h, le transfert de toutes les images de l'ordinateur contrôlant le robot à tout lecteur dur de grande capacité ou un ordinateur pour l'analyse d'images supplémentaires. Des images haute résolution (1600 x 1200 pixels) sont recueillies dans les fichiers TIF mesure ~ 5 Mo chacune.
IV. Image Analysis
- Assemblez les 100 images séquentielles de chaque dossier à l'aide d'Adobe ImageReady.
- Ouvrez ImageReady et importer toutes les images séquentielles de composer une série de cadres.
- Redimensionner des images originales à 800 x 600 pixels. Images recueillies sont en haute résolution, ce qui génère des fichiers de grande taille qui peut rendre le traitement d'image lente.
- Faites défiler les images et trouver un endroit (s) visible dans la plupart des images.
- Zoom jusqu'à 300% sur l'endroit sélectionné (s). Alignement des images en utilisant un plus fort grossissement permet un enregistrement plus précis.
- Insérez un calque au-dessus de toutes les images et vérifiez si est visible dans tous les cadres. Marquez l'endroit (s) emplacement à l'aide du «pinceau» de l'outil.
- Commencer à aligner toutes les trames utilisant l'outil «Déplacement» et en prenant les notes sur la couche comme une référence.
- Lorsque l'alignement est terminé, supprimer le calque utilisé comme référence et enregistrer des images en une seule "PSD" fichier. En outre, d'exporter toutes les fenêtres comme une seule "mov" fichier en utilisant la plus haute résolution. Alignement manuel de chaque série d'image prend environ 10 minutes.
- Effectuer la quantification de l'expression génique utilisant ImageJ.
- Ouvrez le logiciel ImageJ et ouvrez le "mov" fichier enregistré précédemment dans ImageReady.
- Utilisation de l'outil de sélection, choisissez une zone de 400 x 300 pixels et recadrer l'image. Ce nouveau fichier doit être enregistré en tant que "avi" de fichiers.
- Séparez les images séquentielles, situé dans le nouveau "avi" de fichiers dans les canaux rouge, vert et bleu en cliquant sur «image», «couleur» et «split RVB" dans ImageJ.
- Soustraire la fluorescence de fond de toutes les images dans les canaux vert et rouge. En utilisant la série d'images de canal vert, sélectionnez une zone de 20 x 20 pixels d'une région avec des non-cellules exprimant et enregistrer son emplacement dans le "Gestionnaire de ROI" outil, de sorte que la même zone seront sélectionnés dans les deux canaux. Avec le carré 20 x 20 pixels actifs dans le canal vert, allez à la "plugins" de commande situé dans la barre des tâches de ImageJ et cliquez ensuite sur le "ROI soustrayez mesurée pour chaque tranche de" plugin-outil.
- En ImageJ, cliquez sur "Image", "ajuster" puis "seuil" de définir ou d'un segment du exprimant la GFP pixels. Ajuster les niveaux de seuil en faisant glisser la barre dans la fenêtre de seuil pour obtenir une taille de spot moyen de 20-30 pixels.
- Déterminer expression de la GFP en utilisant un plugin que nous avons conçu pour mesurer la valeur de la moyenne en niveaux de gris par pixel et le nombre total de pixels exprimant la GFP.
- Copiez le gris de sortie moyenne des valeurs dans ImageJ et collez-le dans Microsoft Office Excel. Calculer l'expression de GFP pour chaque canal (rouge et vert) en multipliant la moyenne en niveaux de gris par pixel de valeur par le nombre total de pixels exprimant la GFP pour chaque canal. La somme des valeurs d'expression pour les deux canaux donne l'expression de GFP. Les valeurs peuvent être utilisées pour illustrer les profils d'expression génique et de faire des comparaisons directes. Time-lapse animations peuvent aussi être générés en utilisant "mov" ou "AVI" fichiers, offrant une visualisation unique et claire du profil d'expression génique.
Résultats Représentant V.
La collecte et l'analyse d'image robotisée procédure (Fig. 1) rapportés ici permet l'acquisition d'une grande quantité de données quantitatives sur l'expression génique dans un court laps de temps. Pour la caractérisation promoteur végétal en utilisant le gène de la GFP, cette méthodologie n'est pas seulement utile pour créer des profils d'expression transitoire (Fig. 2), mais aussi de suivre dans une expression de la GFP-détaillée manière transitoire et les tissus végétaux stablement transformées 5,6. Court time-lapse animations générées avec les images recueillies séquentielle sont un outil précieux pour une analyse en profondeur de l'expression génique au cours du temps dans les tissus végétaux. Cette méthodologie a aussi une grande application pour évaluer les facteurs qui affectent directement l'expression des gènes. Par exemple, expression de la GFP transitoires sous la présence de différents suppresseurs de faire taire d'origine virale a été correctement étudiés à l'aide de notre collection d'images automatisée et 7,8 système d'analyse.
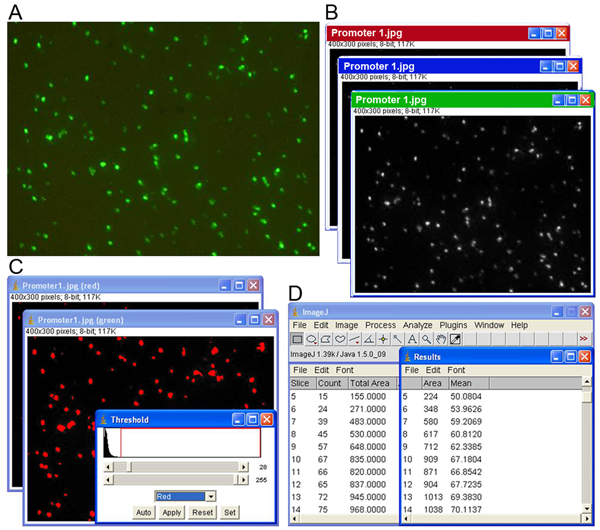
Figure 1. Procédure d'analyse d'image se compose de quatre étapes principales. (A) Acquisition de séries d'images en utilisant le système robotique d'image de collecte, (B) la séparation des images dans les canaux rouge, vert et bleu, (C) la segmentation des pixels exprimer en ajustant les niveaux de seuil, et (D) l'obtention des résultats de sortie contenant les valeurs de gris et les exprimant la GFP compter de discussion.
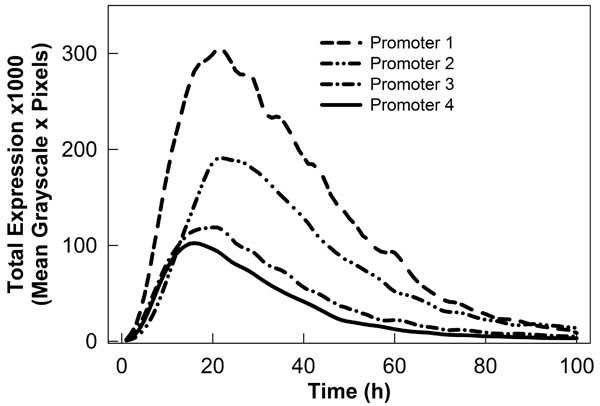
Figure 2. Graphique montrant différents profils d'expression transitoire tirée par les promoteurs végétaux fusionnée à la GFP. Les données ont été recueillies à l'aide de notre système robotique collection d'images et analysées avec le logiciel ImageReady et ImageJ.
Discussion
L'utilisation de la robotique a des applications considérables dans différents aspects de la vie humaine, plus précisément, les robots ont été effectivement utilisés pour effectuer des activités dans des environnements dangereux, à automatiser les activités fastidieuses et complexes, et pour effectuer des tâches d'une manière plus précise. En biologie moléculaire, et en particulier des analyses d'expression génique, les robots peuvent aider à suivre non seulement les caractéristiques des gènes, mais aussi la croissance des tissus et le développement au fil du temps. De nombreux phénomènes biologiques se produisent de façon dynamique, ce qui peut être difficile à suivre à l'aide seule des observations ponctuelles temps.
L'utilisation du gène de la GFP pour les études d'expression apporte des avantages supplémentaires pour l'observation de la réponse des tissus et la croissance. Pour nos procédures expérimentales, la GFP permet de suivre l'expression des gènes dans le même morceau de tissu au fil du temps que la détection de la GFP est une méthode non destructive. En outre, notre version de la protéine GFP est suffisamment stable pour permettre la détection, mais montre aussi une certaine rotation afin de minimiser l'accumulation dans les tissus végétaux, nous permettant de suivre à la fois la montée et la chute de l'expression génique.
Nous avons déjà utilisé notre collection d'images de robotique et système d'analyse d'un large éventail d'applications. Nous prévoyons un fort potentiel pour de nombreuses applications biologiques où une compréhension dynamique d'un phénomène est souhaitée. Par exemple, la croissance et le développement des tissus de la plante peuvent être suivis en utilisant notre système donnant de précieux renseignements / informations sur ces processus. En outre, la dynamique du transport des protéines en utilisant des gènes rapporteurs comme la GFP, peuvent être facilement visualisés à l'aide time-lapse animations. La méthodologie décrite dans le présent rapport est techniquement complexe, mais conceptuellement simple. Nos résultats sont robustes et de nouvelles applications sont continuellement découvertes.
Remerciements
Salaires et soutien à la recherche ont été fournis par le Conseil de soja-Unis, et par des fonds d'État et fédéraux affectés à la Ohio State University / Ohio recherche agricole et le Centre de Développement. Cette recherche a également été partiellement financé par une bourse du CONACYT, au Mexique, au PHMC. La mention de marques ou de produits exclusifs ne constitue pas une garantie de qualité ou du produit par l'OSU / OARDC et n'implique pas non plus l'approbation à l'exclusion des autres produits qui peuvent également être adaptés. Journal l'article Pas de HCS 09-17.
matériels
| Name | Company | Catalog Number | Comments | |
| ImageJ | Software | National Institutes of Health | http://rsbweb.nih.gov/ij/ |
Références
- Murashige, T., Skoog, F. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant. 15, 473-497 (1962).
- Gamborg, O. L., Miller, R. A., Ojima, K. Nutrient requirements of suspension cultures of soybean root cells. Exp Cell Res. 50, 150-158 (1968).
- Finer, J. J., Vain, P., Jones, M. W., McMullen, M. D. Development of the particle inflow gun for DNA delivery to plant cells. Plant Cell Rep. 11, 232-238 (1992).
- Finer, J. E., Finer, J. J. A simple method for reducing moisture condensation on Petri dish lids. Plant Cell Tiss Org. 91, 299-304 (2007).
- Buenrostro-Nava, M. T., Ling, P. P., Finer, J. J. Comparative analysis of 35S and Lectin promoters in transgenic soybean tissue using an automated image acquisition system and image analysis. Plant Cell Rep. 25, 290-296 (2006).
- Chiera, J. M., Bouchard, R. A., Dorsey, S. L., Park, E. H., Buenrostro-Nava, M. T., Ling, P. P., Finer, J. J. Isolation of two highly active soybean (Glycine max (L.) Merr.) promoters and their characterization using a new automated image collection and analysis system. Plant Cell Rep. 26, 1501-1509 (2007).
- Chiera, J. M., Lindbo, J. A., Finer, J. J. Quantification and extension of transient GFP expression by the co-introduction of a suppressor of silencing. Transgenic Res. 17, 1143-1154 (2008).
- Dhillon, T., Chiera, J. M., Lindbo, J. A., Finer, J. J. Quantitative evaluation of six different viral suppressors of silencing using image analysis of transient GFP expression. Plant Cell Rep. 28, 639-647 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon