このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
電子線結晶学による構造生物学研究用小型膜タンパク質の二次元結晶化トライアルの評価
* これらの著者は同等に貢献しました
要約
注文した膜タンパク質アレイの形成のために2次元(2D)の結晶化試験を評価すると、電子線結晶学における非常に重要かつ困難な作業です。 90kDa - ここでは、のためにスクリーニングし、15の範囲で主に小型の膜タンパク質の2次元結晶の同定に我々のアプローチを説明します。
要約
電子線結晶学は、どちらかあるいは、または構造と機能膜タンパク質の質問だけでなく、可溶性タンパク質を研究するために三次元結晶化とX線結晶構造解析と組み合わせて使用することができる手法として発展してきた。透過型電子顕微鏡による二次元(2D)の結晶のスクリーニングは、(EM)を最適化し、低温電子顕微鏡による高分解能のデータ収集のためのサンプルを選択し、見つけるのに重要なステップです。ここでは、潜在的に結晶化条件の最適化に重要な情報を供給できるよう、大規模および順序だけでなく、小規模な2次元配列の両方を識別するための基本的な手順を説明します。
EMで異なる倍率で作業することによって、重要なパラメータの範囲のデータが得られる。低倍率では、形態や膜サイズで貴重なデータを提供しています。より高い倍率で、可能な限り順番と二次元結晶の寸法が決定されます。この文脈では、CCDカメラとオンライン - フーリエ変換は、順序とサイズのためのプロテオリポソームを評価するために高倍率で使用されているか説明しています。
膜タンパク質の2次元結晶は、最も一般的に透析して再構成によって栽培されているが、スクリーニングの手法は、単層、ネイティブの2Dクリスタルの助けを借りて生産結晶の等しく適用可能である、と可溶性タンパク質の配列を命じた。さらに、ここで説明する方法は、さらに小さいの2D結晶だけでなく、私たちの例と大規模なタンパク質の格子がより容易に識別できる可能性があるとしても小さい蛋白質が同定におけるケアの同じ量を必要とする大規模な膜タンパク質のスクリーニングに適用可能である審査の早い段階で。
プロトコル
1。二次元結晶化トライアルのグリッドの準備
- 炭素でコーティングされた400メッシュ銅EMグリッドは負染色することによって調製される。酢酸ウラニルは、頻繁に使用され、長期的なグリッドの長期保存のための使用だけでなく、適合性の前に数ヶ月のためのソリューションのストレージの条件で染色を提供しています。対照的に、このようなウラニルギなどの他の負の汚れ、優れた染色を提供している間は、新鮮な1を行う必要がある。二次元結晶化試験のスクリーニングに使用されるグリッドの多数の高速な準備作業については、ネガティブ染色を変更したバージョンが使用されます。サンプル2μLの体積は、炭素で覆われたEMのグリッド上にピペットで、60秒間インキュベートする再び30の後、グリッドの端からブロットされ、直ちに適用され、その後、1%酢酸ウラニルの2μL、これをWhatman#4ろ紙(ビデオ図1)の破れた部分とエッジからブロッティングが続きます。 S.ろ紙の破れたエッジとリム上のグリッドに触れると、プロテオリポソームを除去することなく液体の最適な除去を保証します。さらに、グリッドの端に乾燥には炭素膜の改良維持を保証。繊細な炭素膜の破損がサンプルの付着を防止し、サンプルの不正確な表現につながることができるようにケアは、準備とグリッドの取扱いに注意する必要があります。 5μLの伝統的に大規模なサンプルの量があったと日常的にグリッドの準備のために使用されていますが、貴重なサンプルを2μLまたは2以下にボリュームを削減することで保存することができます。
- 可能な限り最大の膜を生成するために、我々のサンプルのいくつかは、グリセロールまたはショ糖の高濃度(10-20%)が透析緩衝液中に存在する必要があります。グリセリンまたはスクロースが高粘度であり、適切にバッファを貫通するから酢酸ウラニルを防ぐため、不完全膜を染色するので、これは、グリッドの準備にマイナスの影響を持つことができます。したがって可能な格子が不明瞭になります。バッファーはグリセロール/ショ糖を含まないバッファ(図示せず)によってサンプルと交換の遠心分離によって交換することができる、またはグリッドが似てネガティブ染色の前に数サイクルに1つのバッファまたはグリセロール/ショ糖を含まない緩衝液で洗浄することができるのどちらかクライオEMは3,4で使用される手法。
2。 EMによる二次元結晶化トライアルの評価
- 試料ホルダーのタイプに応じて、いずれかまたは複数のグリッドがロードされます。中間倍率としてここに呼ばれる2 - 10K、の倍率は、実験ノート5の中のメモを取られている膜、形態、サイズ、の分散の平均の分布と程度の第一印象が可能になります。 CCDカメラはフィルムで、利用できない場合、適切な領域は、CCDカメラの助けを借りて、代表的な概要として記録またはされています。
- 約400 - 800 ×の範囲の低倍率は、全体のサンプルの概要/グリッドが望まれる時間に使用されます。両方否定的染色およびカーボン膜、グリッド上のサンプルの濃度、および場合によっては不均一なプロテオリポソーム分布の潜在的な部分的な破損:すべてのグリッドで採用されていないが、低倍率では、いくつかの側面の面でグリッドの準備の評価の助けの貴重な情報を提供します。個々のグリッドの四角形は、双眼鏡やCCDカメラで表示される場合があります。一部のEMSとは、より高い倍率で、後で検査のためにリコールすることができる特定の興味のあるポジションを、保存することが可能です。
- 興味のグリッド領域が低いか中間倍率で識別されると、倍率は約50K - 60Kに変更されます。膜、水晶とユニットセルのサイズに応じて、既知の場合、として30Kと低いと80Kという高倍率が使用されている。 30 - 80Kの倍率の範囲は、2次元結晶のスクリーニングの目的のために高倍率と呼ぶことにする。焦点は、低用量のセットアップ、画像/写真の設定に続いてスイッチ付き、または関心のある領域の近傍でのフォーカスの設定のいずれかで発生します。
- 関心の領域が実際に膜であるかどうかのあいまいさのケースでは、サンプルはプロテオリポソームの大きさの炭素フィルム、マイカ、またはその他の成果物のために検査されます。この目的のために、エッジは典型的な折りたたみや形態を明らかにする。
- 今関心の領域がCCDカメラで検査されます。 CCDイメージは30K - 80K膜のサイズに応じて倍率、、タンパク質または単位セルサイズ、または既知の結晶性の領域で収集されます。小規模および/または主に疎水性の膜タンパク質の格子は、CCDの画像自体の視覚的評価では必ずしも表示されません。どちらかの全体像は、オンラインフーリエ変換(FT、または高速のFT - FFT)に使用されます。順序付き配列が小さい場合は、このFTは、しかし、ノイズのかなりの量が含まれます。このように、縮小箱入り画像サイズはSmaIでの改善された信号対雑音比が可能になりますLER結晶と容易に識別。この目的のために、ボックスは画像の上に移動され、ライブFTが評価されます。
ビームの強度/輝度は低用量サンプルの条件だけでなく、心のCCDカメラの設定を維持する調整されます。使用されるCCDカメラによっては、ライブFTのガンマは、順序付けられた配列の最適な識別のために調整されます。過度に高い値は、ノイズの寄与に起因するスポットを隠蔽したりすることができます、そして過度に低いガンマ値が識別されるから弱いスポットを防止します。これらの弱い点はほとんどノイズレベルよりFTの斑点のある小さな結晶配列が原因である可能性があります。
より高い分解能でデータをサンプル6の少数の収集されているが、一般的にネガティブ染色2D結晶の分解能に制限されたり、およそ15Aの解像度よりも優れていると想定してはいけません。約-400 nmのデフォーカスで、斑点のない以上の1から3までの注文が簡単に識別できることが期待されています。サンプルは一般的に低温電子顕微鏡データの収集が達成可能な最高解像度の適切な指示を与えるとして、解決のために評価されません。スポットと可能mosaicityのシャープネスはも記載されています。
- 異なる膜だけでなく、膜の形態は、高倍率での順序のために評価されます。小さいのではなく、大きなプロテオリポソームまたは膜のパッチが最も有望な分野を含むことができるので、これは、最初または2次元結晶化試験の中間段階では特に重要です。 2次元結晶の非常に低い割合では、順序付けられた配列の最初の同定以来、多数の画像の画像取得とFT、または光学回折は、頻繁にサイズと品質2,4,7の急速な向上につながることが必要になります。
3。代表的な結果
理想的に順序付けられたプロテオリポソームは容易に認識可能な、シャープなスポットを表示する。大と規則正しい結晶は容易にCCDの画像や顕微鏡写真の光学回折のオンライン- FTによって識別されます。
例のサイズは数ミクロンまでである18kDaの小さな膜タンパク質の2次元結晶を示しています。 FT上のスポットを簡単に識別し、シャープされています。ライブ- FTのボックスの動きは、格子がmosaicityなしで連続であることを示しています。より広範な可溶性ドメインを持つ大規模タンパク質の格子は、EMの小さな画面上で識別することができます。 CCDイメージコレクションとFTは、より良い評価の手段を提供すると、例えば、可能な限りmosaicity(ショーFT)の情報を得ることが必要である。順序付けされていないプロテオリポソームのFTを計算する場合、ノイズは、最初のスポットと誤解することができます。ライブ- FT用のボックスが移動させながら、しかし、斑点が表示されなくなります。一方、小規模のアレイは、不審な結晶で、ライブFTが画像領域上にもわずかに移動するときに静止して、残りの自分の斑点を持つことになります。さらに、これらの小さな結晶は、通常、同一のユニットセルサイズを持つことによって認識することができる、と別のFTSでスポット間の距離は、特定の大きさの円を持つなど、様々な方法で測定することができます。脂質の結晶は、異なる格子の形態とFTが表示されます。
それは初期の試験で降水量が発生することも珍しくありません。ここに再構成せずにタンパク質沈殿はいえ、小さな脂質凝集体と区別する必要があります。低倍率で析出されているように見えるサンプルは、頻繁に高い倍率で見た場合の脂質凝集体であることが判明する。 30 50Kでの検査時には、これらの暗い構造のエッジは、それらが蛋白質の無降水量を有する膜で構成することが明らかに。脂質凝集体は、以下の実験で大規模な膜にサイズを大きくする可能性があるので、これらは重要な観察である。
サンプル評価の悪い結果は、しばしば適切かつ高速なスクリーニングを防ぐ低膜濃縮に接続されています。これは、頻繁に透析の2次元結晶化のための高タンパク質濃度を使用することで克服することができる。また、膜は、貯蔵中のエッペンドルフチューブの下部に数日間のために解決するために残すことができます。いくつかのケースでは膜の急速な、またはほとんどインスタントセトリングが発生し、チューブの底からペッティングすれば、グリッド上でより高い膜密度になります。別のはるかに高速のオプションは、チューブの底からの後続のサンプリングとサンプルの遠心分離(1〜3分間3000から8000 rpmで)です。
最適な条件下でのサンプルは、2次元結晶の大部分が含まれます。それは最も大きく、最もよく秩序2D結晶がデータ収集のために視覚的に選択されているように、膜の均質な外観を目指す必要はありません。サンプルはのために使用されている場合、結晶化試験は同様に繰り返されている場合、サンプルのこれらのタイプは簡単に認識されます。高解像度の画像の最大数は、結果として低温電子顕微鏡データの収集、。
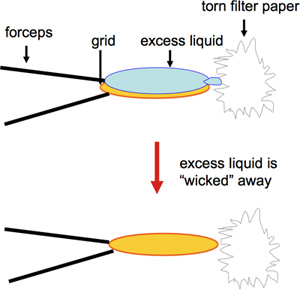
図1この図は、ワットマンの破れた部分第4濾紙でグリッドの端をブロッティングを示しています。
ディスカッション
サンプルの適切な評価は、膜の十分な数の慎重な評価が必要です。例えば、180以上の画像化されたプロテオリポソームの外のような低%2などの結晶配列を持つ試料は二次元結晶化の条件7の迅速な最適化のための重要な情報を与えた。
タンパク質の時折部分的沈殿が発生したものの、タンパク質の沈殿が発生すると、グリッドは、低倍率での検査の後、さらにス?...
謝辞
我々は我々の方法に関連する経験と観察のいくつかに貢献し、貴重なタンパク質サンプルを、提供するための私達の協力者に感謝する。ギュンターSchmalzingは親切にこのプロジェクトに参加するFRする機会を提供した。バーバラArmbruster氏、ヤコブブリンクとデリックミルズは、その卓越したヘルプや機器の入力のために感謝されています。資金は、NIHの助成金HL090630によって提供されていました。
資料
| Name | Company | Catalog Number | Comments |
| 400-mesh copper TEM grids coated with carbon film | |||
| forceps: regular and anti-capillary | Dumont #5 and Dumont N5AC or similar | ||
| Micropipette and pipette tips | |||
| Whatman #4 filter paper | |||
| 1% uranyl acetate | |||
| Dialysis sample to be screened for 2D crystals | |||
| Glycerol/sucrose-free dialysis buffer | Optional | ||
| JEOL-1400 transmission electron microscope (TEM) | similar 80 – 120kV TEM equipped with an Lab6 or tungsten filament and film and/or CCD cameras (Gatan Orius SC1000 and/or UltraScan1000 CCD cameras and Gatan Digitial Micrograph software package or Tietz cameras (TVIPS)) |
参考文献
- Johansen, B. V. Bright field electron microscopy of biological specimens V. A low dose pre-irradiation procedure reducing beam damage. Micron. 7, 145-156 (1976).
- Schmidt-Krey, I. Electron crystallography of membrane proteins: Two-dimensional crystallization and screening by electron microscopy. Methods. 41, 417-426 (2007).
- Wang, D. N., Kühlbrandt, W. High-resolution electron crystallography of light-harvesting chlorophyll a/b-protein complex in three different media. J Mol Biol. 217, 691-699 (1991).
- Schmidt-Krey, I., Rubinstein, J. L. Electron cryomicroscopy of membrane proteins: specimen preparation for two-dimensional crystals and single particles. Micron. , (2010).
- Schmidt-Krey, I., Mutucumarana, V., Haase, W., Stafford, D. W., Kühlbrandt, W. Two-dimensional crystallization of human vitamin K-dependent γ-glutamyl carboxylase. J Struct Biol. 157, 437-442 (2007).
- Trachtenberg, S., DeRosier, D. J., Zemlin, F., Beckmann, E. Non-helical perturbations of the flagellar filament: Salmonella typhimurium SJW117 at 9.6 Å resolution. J Mol Biol. 276, 759-773 (1998).
- Zhao, G., Johnson, M. C., Schnell, J. R., Kanaoka, Y., Irikura, D., Lam, B. K., Austen, K. F., Schmidt-Krey, I. Two-dimensional crystallization conditions of human leukotriene C4 synthase requiring a particularly large combination of specific parameters. J Struct Biol. 169, 450-454 (2010).
- Cheng, A., Leung, A., Fellmann, D., Quispe, J., Suloway, C., Pulokas, J., Abeyrathne, P. D., Lam, J. S., Carragher, B., Potter, C. S. Towards automated screening of two-dimensional crystals. J Struct Biol. 160, 324-331 (2007).
- Vink, M., Derr, K. D., Love, J., Stokes, D. L., Ubarretxena-Belandia, I. A high-throughput strategy to screen 2D crystallization trials of membrane proteins. J Struct Biol. 160, 295-304 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved