Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
L'évaluation des essais de cristallisation bidimensionnelle de protéines membranaires petites pour les études en biologie structurale par cristallographie électronique
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Évaluer bidimensionnelles (2D essais de cristallisation) pour la formation de réseaux classés protéine membranaire est une tâche difficile et très critique dans cristallographie électronique. Ici, nous décrivons notre approche dans le dépistage et l'identification des cristaux 2D de protéines membranaires principalement des petites de l'ordre de 15 - 90kDa.
Résumé
Cristallographie électronique a évolué comme une méthode qui peut être utilisée alternativement ou en combinaison avec trois dimensions cristallisation et cristallographie aux rayons X pour étudier la structure-fonction des questions de protéines membranaires, ainsi que des protéines solubles. Dépistage des cristaux bidimensionnels (2D) par microscopie électronique à transmission (EM) est l'étape cruciale dans la recherche, l'optimisation et la sélection des échantillons de haute résolution collecte de données par cryo-EM. Nous décrivons ici les étapes fondamentales de l'identification à la fois vaste et ordonné, ainsi que de petits tableaux 2D, qui peut potentiellement fournir des informations essentielles pour l'optimisation des conditions de cristallisation.
En travaillant avec différents grossissements les EM, les données sur une gamme de paramètres critiques est obtenue. Faible grossissement fournit de précieuses données sur la morphologie et la taille de la membrane. À forts grossissements, une éventuelle dimension de cristal de commande et 2D sont déterminés. Dans ce context, il est décrit comment caméras CCD et en ligne des transformées de Fourier sont utilisés à forts grossissements pour évaluer protéoliposomes pour l'ordre et la taille.
Tandis que les cristaux 2D de protéines membranaires sont le plus souvent augmenté par reconstitution par dialyse, la technique de criblage est également applicable pour les cristaux produits à l'aide de cristaux natifs monocouches, 2D, et des matrices ordonnées de protéines solubles. En outre, les méthodes décrites ici sont applicables à la projection de cristaux 2D de même plus petit ainsi que des protéines membranaires plus grandes, où les petites protéines nécessitent la même quantité de soins dans l'identification que nos exemples et le treillis de grandes protéines pourraient être plus facilement identifiable aux premiers stades de la projection.
Protocole
1. Préparation Grille des essais de cristallisation 2D
- Revêtues de carbone de 400 mailles de cuivre EM grilles sont préparés par coloration négative. L'acétate d'uranyle est fréquemment utilisé et fournit une tache de longue durée en termes de stockage de la solution pendant plusieurs mois avant de les utiliser, ainsi que l'aptitude à l'entreposage à long terme des réseaux. En revanche, d'autres taches négatifs tels que le formiate d'uranyle, tout en offrant une excellente coloration, doivent être fraîchement préparé 1. Pour la préparation rapide d'un grand nombre de réseaux qui seront utilisés pour le dépistage des essais de cristallisation 2D, une version modifiée de coloration négative est utilisée. Un volume de 2 pl de l'échantillon est pipeté sur une grille recouverte de carbone-EM et incubées pendant 60 s. Elle est suivie par buvard à partir du bord avec un morceau déchiré de papier Whatman n ° 4 filtre (Figure 1; vidéo), puis 2 ul d'acétate d'uranyle 1% sont appliquées immédiatement, qui sont de nouveau effacés à partir du bord de la grille après le 30 s. Touchant la grille sur la jante avecle bord déchiré du papier filtre assure une élimination optimale de liquide sans enlèvement de protéoliposomes. En outre, le séchage sur le bord de la grille permet une meilleure conservation de la couche de carbone. Des précautions doivent être prises dans la préparation et la manipulation des grilles, comme la rupture de la couche de carbone délicate empêche l'adhérence de l'échantillon et peut se traduire par une représentation inexacte de l'échantillon. Bien que les volumes d'échantillon traditionnellement une version agrandie de 5 ul ont été et sont couramment utilisées pour la préparation de la grille, précieux échantillons peuvent être sauvegardées en réduisant le volume à 2 pi ou moins 2.
- Pour produire les plus grands possibles membranes, certains de nos échantillons nécessitent de fortes concentrations de glycérol ou le saccharose (10-20%) d'être présent dans le tampon de dialyse. Cela peut avoir un effet négatif sur la préparation grille, comme le glycérol ou le saccharose est très visqueux et empêche l'acétate d'uranyle de bien pénétrer dans la mémoire tampon, et donc incomplète coloration des membranes. Par conséquent, un treillis sera possible obsguérie. Supporte le tampon peut être remplacé par centrifugation des échantillons et le remplacement de glycérol / sucrose sans tampon (non représenté), ou les grilles peuvent être lavés avec un tampon ou du glycérol / sucrose dans un tampon sans une à plusieurs cycles avant coloration négative semblables à une technique utilisée pour cryo-EM 3,4.
2. L'évaluation des essais de cristallisation 2D par EM
- En fonction du type de support d'échantillon, soit une ou plusieurs grilles sont chargés. Un grossissement de 2-10K, qui sera appelée ici grossissement intermédiaire, permet une première impression de la distribution moyenne et l'étendue de la dispersion des membranes, la morphologie et la taille, ce qui est pris note de la notebook 5 laboratoire. Zones appropriées sont comptabilisés comme des aperçus représentatifs à l'aide d'une caméra CCD ou, si une caméra CCD n'est pas disponible, le film.
- Faible grossissement dans la gamme d'environ 400-800x est utilisé à des moments où un aperçu de l'ensemble duéchantillon / grille est souhaitée. Même s'il n'est pas utilisé avec tous les réseaux, à faible grossissement donne des renseignements précieux d'aide à l'évaluation de la préparation du réseau en termes de plusieurs aspects: à la fois coloration négative et le potentiel de rupture partielle du film de carbone, concentration de l'échantillon sur la grille, et peut-être inégale répartition protéoliposome. Cases de la grille individuelles peuvent être visualisés avec des jumelles ou une caméra CCD. Avec un peu d'EM, il est possible d'enregistrer les positions d'un intérêt particulier, qui peuvent être rappelés pour une inspection subséquente à forts grossissements.
- Une fois qu'une zone de la grille d'intérêt a été identifié à chaque grossissement faible ou intermédiaire, le grossissement est changé à environ 50K-60K. Selon la taille de la membrane cellulaire, le cristal et l'unité, si elle est connue, grossissements aussi bas que 30K et 80K le plus haut sont utilisés. La plage de grossissement de 30-80K seront appelés à fort grossissement pour des fins de dépistage des cristaux 2D. Mise au point se fait soit dans la mise au point setttion de la faible dose set-up, avec interrupteur suite à image / photo de réglage, ou dans le voisinage de la zone d'intérêt.
- En cas d'ambiguïté de savoir si la zone d'intérêt est en effet une membrane, l'échantillon est inspecté pour le carbone-film dans la taille des protéoliposomes, le mica, ou d'autres objets. À cette fin, les bords révéler pliage et la morphologie.
- Maintenant, la zone d'intérêt est inspecté avec une caméra CCD. Une image CCD est recueilli à 30K-80K grossissement, selon la taille de la membrane, de protéines ou taille de cellule unitaire, ou connus zone cristalline. Le treillis d'une protéine de la membrane plus petite et / ou en grande partie hydrophobe n'est pas forcément visible par l'évaluation visuelle de l'image CCD lui-même. Soit la totalité de l'image est utilisée pour une transformation de Fourier en ligne (FT, ou rapide FT-FFT). Cette FT contient une quantité importante de bruit, cependant, si le tableau commandé est faible. Ainsi, une taille de l'image réduite en carton permettra un meilleur rapport signal-sur-bruit d'un smaller cristal et une identification plus facile. A cet effet, la boîte est déplacée au-dessus de l'image en temps réel et une FT est évaluée.
L'intensité / luminosité du faisceau est ajusté en gardant à faible dose conditions de l'échantillon, ainsi que les réglages caméra CCD à l'esprit. En fonction de la caméra CCD utilisée, le gamma de la FT est ajusté en temps réel pour l'identification optimale des réseaux ordonnés. Une valeur trop élevée peut masquer les taches dues à des contributions de bruit, et une valeur de gamma trop faible empêche les plus faibles de points étant identifiés. Ces points faibles pourrait être due à de plus petits réseaux cristallins avec des taches dans le FT peine au-dessus du niveau de bruit.
Bien que les données à plus haute résolution ont été recueillies sur un petit nombre d'échantillons 6, communément la résolution de coloration négative cristaux 2D est limité ou ne devraient pas s'attendre à être meilleure que la résolution 15 Å environ. Avec une défocalisation d'environ -400 nm, pas plus de 1-3 ordres de taches devraient être easily identifié. Les échantillons sont généralement pas évalués pour la résolution, comme cryo-EM collecte de données donnera une bonne indication de la résolution la plus élevée possible. Netteté des taches et mosaïcité possible sont cependant de noter.
- Différentes membranes, ainsi que des morphologies membranaires, sont évalués à la commande à fort grossissement. Ceci est particulièrement important au début ou à des stades intermédiaires des essais de cristallisation 2D, comme protéoliposomes plus petits plutôt que de gros ou des correctifs membrane peut contenir des domaines les plus prometteurs. Un pourcentage très faible de cristaux 2D, il faudra acquisition de l'image et du FT, ou de la diffraction optique, d'un grand nombre d'images depuis l'identification initiale des tableaux commandés seront souvent mener à une amélioration rapide de la taille et de la qualité 2,4,7.
3. Les résultats représentatifs
Protéoliposomes idéalement ordonnés afficher facilement identifiables, des points tranchants. Gros cristaux et ordonné unre facilement identifié par ligne-FT d'images CCD ou de diffraction optique de microscope.
L'exemple montre des cristaux 2D d'une petite protéine membranaire de 18kDa qui sont jusqu'à plusieurs microns. Des taches sur le FT sont facilement identifiés et pointu. Le mouvement de la live box-FT montre que le réseau est continu, sans mosaïcité. Le treillis d'une plus grosse protéine avec un domaine plus vaste soluble peut être identifié sur le petit écran des EM. Collection d'images CCD et FT est nécessaire de prévoir un moyen de mieux évaluer et d'obtenir des informations sur, par exemple, mosaïcité possible (Afficher FT). Lors du calcul d'un FT d'un protéoliposome qui n'est pas imposée, le bruit peut d'abord être confondu avec des taches. Alors que la boîte pour le live-FT est déplacé, cependant, les taches disparaissent. D'autre part, les tableaux, avec de petites cristallinité discutable, auront leurs places restantes stationnaire quand la live-FT est déplacé voire légèrement au-dessus de la zone d'image. En outre, thescristaux e petits peuvent être reconnus par ayant généralement les mêmes tailles de maille, et les distances entre les points dans les tables de tir différents peut être mesurée de différentes façons, comme avec un cercle d'une taille spécifique. Cristaux de lipides présentent une morphologie distincte et treillis FT.
Il n'est pas rare de rencontrer des précipitations dans les essais initiaux. Voici la précipitation des protéines sans reconstitution doit être distinguée de petits agrégats lipidiques cependant. Les échantillons qui semblent être précipités à faible grossissement se révèlent souvent être des agrégats lipidiques lors du visionnage à plus fort grossissement. Lors de l'inspection à 30-50K, les bords de ces structures sombres révèlent qu'ils se compose de membranes sans précipitation de la protéine. Ces observations sont importantes car les agrégats lipidiques pourrait être augmenté en taille à de grandes membranes dans les expériences suivantes.
Mauvais résultats dans l'évaluation des échantillons sont parfois liés à une membrane de faible concenion qui empêche un dépistage adéquat et rapide. Cela peut souvent être surmontés par l'utilisation d'une concentration plus élevée en protéines de cristallisation 2D par dialyse. Alternativement, les membranes peuvent être laissés au repos pendant quelques jours au fond du tube Eppendorf pendant le stockage. Dans certains cas, décantation rapide, ou presque instantanée des membranes se produit et le pipetage du fond du tube se traduira par une forte densité de membrane sur la grille. Une autre solution est beaucoup plus rapide de centrifugation (à 3000-8000 rpm pendant minutes 1-3) d'échantillons avec un échantillonnage subséquent de la partie inférieure du tube.
Échantillons dans des conditions optimales contiendra un grand pourcentage de cristaux 2D. Il n'est pas nécessaire de viser un aspect homogène des membranes, comme le plus grand et le mieux ordonné des cristaux 2D sont sélectionnées visuellement pour la collecte des données. Ces types d'échantillons sera facilement reconnaissable lorsque les essais de cristallisation sont répétées ainsi que lorsque les échantillons sont utilisés pourcryo-EM collecte de données, résultant en un nombre maximum d'images de haute résolution.
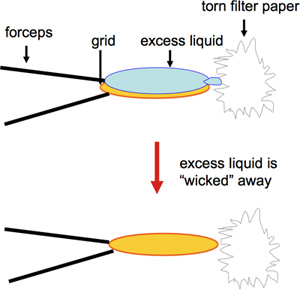
Figure 1. Cette figure montre buvard le bord de la grille avec un morceau déchiré de papier Whatman n ° 4 filtre.
Discussion
Évaluation appropriée des échantillons requiert un examen minutieux d'un nombre suffisant de membranes. Par exemple, des échantillons avec aussi peu que 2% de réseaux cristallins sur plus de 180 protéoliposomes imagés ont donné des informations essentielles pour l'optimisation rapide des conditions de cristallisation 2D 7.
Lorsque la précipitation de la protéine se produit, une grille pourrait être abandonné d'un dépistage supplémentaire après l'insp...
Remerciements
Nous remercions nos collaborateurs pour fournir des échantillons de protéines précieuses, qui ont contribué à certaines de nos méthodes relatives expérience et les observations. Günther Schmalzing aimablement fourni l'occasion de FR à rejoindre ce projet. Barbara Armbruster, Jacob Brink et Mills Deryck sont remerciés pour leur aide exceptionnelle et d'entrée sur l'équipement. Le financement a été fourni par NIH HL090630.
matériels
| Nom du produit | Type | Entreprise | Numéro de catalogue | Commenter |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| 400-maille des grilles de cuivre recouvertes de TEM film de carbone | ||||
| pince: régulière et anti-capillaire | Dumont # 5 et Dumont N5AC ou similaire | |||
| Micropipette et pointes de pipette | ||||
| Whatman n ° 4 papier filtre | ||||
| 1% d'acétate d'uranyle | ||||
| Dialyse samsonnes à subir un dépistage de cristaux 2D | ||||
| Glycérol / saccharose sans tampon de dialyse | En option | |||
| JEOL-1400 microscope électronique à transmission (MET) | semblable 80 - 120 kV TEM équipé d'un filament de tungstène ou de LaB6 et le film et / ou des caméras CCD (Gatan Orius SC1000 et / ou UltraScan1000 caméras CCD et Gatan Digitial progiciel Micrograph ou caméras Tietz (TVIPS)) |
Références
- Johansen, B. V. Bright field electron microscopy of biological specimens V. A low dose pre-irradiation procedure reducing beam damage. Micron. 7, 145-156 (1976).
- Schmidt-Krey, I. Electron crystallography of membrane proteins: Two-dimensional crystallization and screening by electron microscopy. Methods. 41, 417-426 (2007).
- Wang, D. N., Kühlbrandt, W. High-resolution electron crystallography of light-harvesting chlorophyll a/b-protein complex in three different media. J Mol Biol. 217, 691-699 (1991).
- Schmidt-Krey, I., Rubinstein, J. L. Electron cryomicroscopy of membrane proteins: specimen preparation for two-dimensional crystals and single particles. Micron. , (2010).
- Schmidt-Krey, I., Mutucumarana, V., Haase, W., Stafford, D. W., Kühlbrandt, W. Two-dimensional crystallization of human vitamin K-dependent γ-glutamyl carboxylase. J Struct Biol. 157, 437-442 (2007).
- Trachtenberg, S., DeRosier, D. J., Zemlin, F., Beckmann, E. Non-helical perturbations of the flagellar filament: Salmonella typhimurium SJW117 at 9.6 Å resolution. J Mol Biol. 276, 759-773 (1998).
- Zhao, G., Johnson, M. C., Schnell, J. R., Kanaoka, Y., Irikura, D., Lam, B. K., Austen, K. F., Schmidt-Krey, I. Two-dimensional crystallization conditions of human leukotriene C4 synthase requiring a particularly large combination of specific parameters. J Struct Biol. 169, 450-454 (2010).
- Cheng, A., Leung, A., Fellmann, D., Quispe, J., Suloway, C., Pulokas, J., Abeyrathne, P. D., Lam, J. S., Carragher, B., Potter, C. S. Towards automated screening of two-dimensional crystals. J Struct Biol. 160, 324-331 (2007).
- Vink, M., Derr, K. D., Love, J., Stokes, D. L., Ubarretxena-Belandia, I. A high-throughput strategy to screen 2D crystallization trials of membrane proteins. J Struct Biol. 160, 295-304 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon