このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
部分的ライゲーションによるマウス頸動脈における乱流誘発アテローム性動脈硬化症と頸動脈内皮からのRNA単離の方法における簡便な方法のモデル
要約
これは、マウスの総頚動脈のintraplaque新血管形成(4週間)と(二週間で)乱流の条件とその後のアテローム性動脈硬化症の発展の原因となる部分的な頸動脈結紮術を、説明します。我々はまた、高純度内皮RNAを提供する、頸動脈内膜からのRNA分離の新しい方法を説明します。
要約
よく知られている密接な関係にもかかわらず、アテローム発生する乱流を結ぶ直接的な証拠が欠けていた。我々は最近、急性マウス頸動脈に、、乱流の2つの重要な特性を低くし、振動流の条件を誘導することを示すために頸動脈部分的ライゲーション法[1,2]の修正版を使用している。このモデルを使用して、我々は、乱流が実際にアポEノックアウトマウスで迅速かつ堅牢なアテローム性動脈硬化症の開発[3]を導くことを示す直接的な証拠を提供している。我々はまた、マウス頸動脈内膜からの高純度を持つ内皮RNA調製の方法[3]を開発した。このマウスモデルと方法を使用して、我々は、その部分的なライゲーションが4週間でこのようなintraplaque血管新生などの複雑病変形成の機能と共に高脂血症のマウスモデルでの二週間で、堅牢かつ迅速なアテローム形成に続いて、週に内皮機能障害を引き起こすが見つかりました。この急速な
プロトコル
1。左頸動脈の部分結紮
- マウスは、生後〜8週で使用されています。マウスの体重は少なくとも18グラムであることが推奨されます。
- ビーズ機器滅菌器で30秒のための器具を滅菌し、冷却することができます
- ケタミン(80mg/kg)とキシラジン(10mg/kgより少ない)IACUCによって承認された腹腔内(ip)注射または別の麻酔と麻酔を誘発する。腹腔内注射の場合は、腹部の左側の低い象限にマウスを注入する。
- 完全に麻酔までの温暖化チャンバ内の場所のマウス。つま先のピンチに反応して麻酔の深さを確認してください。
- 仰臥位(腹側の上向き)の位置に外科的ステージの上に置いてマウス、。上下のステージへの唯一の後肢足テープフォア足の手のひらを。
- 下顎と胸骨の間に首に脱毛剤のリベラルな量(例えばNairさんを)適用する。優しくマッサージすべての毛が除去されるまで。
- 脱毛剤を拭き取ってdepilatedエリアにBetadineの適当な量を塗布します。
- ライゲーションのための6から0絹縫合糸の1インチの長さの切片を作製します。各マウスは、縫合糸の2つが必要になります。
- 鋭い小さなはさみを使って、首の中央に4〜6ミリメートル縦切開を行います。皮膚および基礎となる筋膜の両方をカットする必要があります。
- 正中線から左へ、左耳下腺を移動し、露骨にちょうど気管の解剖を開始。あなたは簡単に脈動左総頸動脈を識別することができるはずです。
- もし分岐が見つかるまで尾側に総頸動脈に従ってください。
- 外頸動脈、内頸動脈、後頭動脈と上甲状腺動脈:単刀直入に左総頸動脈から次の4つの遠位枝を露出させる分岐を細かく分析。これらの血管、特に優れた甲状腺は、壊れやすいことができます。あなたの郭清を伴う非常に注意してください。
- 6から0絹縫合糸を使用して優れた甲状腺上記外頸動脈を結紮する。これを行うには、動脈の下one鉗子を渡すと、他の鉗子の助けを借りて、プレカット縫合糸の一部をつかむ。ゆっくりと動脈の下渡す縫合糸を引く。結び目に巻き込まれて周囲の組織を避けてしっかりと結びます。あなたが効果的に、実質的に異なるモデルである完全なライゲーションを行うことになりますプロシージャの最後で、上甲状腺動脈を脱いで下にはネクタイ場合。
- 同じテクニックを使用して1つの結び目で内頚動脈と後頭動脈を結紮する。
- 縫合糸と上甲状腺動脈の開存の位置を確認してください。
- ティッシュメンドの少量を使用しておおよその皮膚と密接な肌。
- 回復するまで、温暖化のチャンバー内にマウスを置きます。回復は通常30〜60分かかります。
- 動物は、最初の24時間以内に苦痛になっている場合に使用される麻酔は、長引く痛みの軽減(すなわち、吸入イソフルラン)を提供しない場合やブプレノルフィン(0.1mg/kg)の単回投与は、ポスト手術直後に投与する必要があります。我々の経験では、麻酔のために投与ケタミン投与量は手術が経験豊富な外科医によって実行され、それ以上の鎮痛が必要とされていない十分な鎮痛を提供します。
2。頸動脈超音波検査
- 部分的なライゲーションが乱流を誘発したかどうかを検証するには、頸動脈の流れは、1日後にライゲーションを検討すべきである
- イソフルランで麻酔を誘導する - 必要に応じて麻酔インダクションボックスを使用することができる
- 上の画像の段階、腹側で麻酔したマウスを置きます
- イメージング段階で心電図センサーにテープの腕や脚
- Nairさんのリベラルなアプリケーションで首を落葉させる(すでにライゲーションの手続きのために行われていない場合は、この手順にのみ必要です)
- 温度を記録するために直腸の温度計を挿入する
- 首にゲルエコー適用されます。
- B -モードで起動します。
- 結像面は90度(プローブ上のノブは、マウスの鼻に向かって指していなければなりません)でなければなりません
- 画像が得られるまで、マウスの首へのプローブを下げます。
- ステージは左と右気管まで(ミッドライン構造)識別された操作
- 左総頸動脈を識別する
- チルトイメージング段階ので角度が撮像面と頸動脈の間に作成されていること。この角度より大きい、強いドップラー信号になります。
- 左総頸動脈の中央にあるパルス波ドップラーを置きます。
- 必要に応じて角度補正を使用してください。
- 右総頸動脈の測定を繰り返します。
- 成功した部分的な頸動脈結紮では拡張期大動脈入口に向かって流れの逆転と、右側に比べて左総頸動脈の流れの全体的な減少(〜80〜90%)になります。
- いったん良好な画像が得られている、テープの解像度からマウスやフリーマウスオフジェルをエコーワイプ、麻酔をオフにするtraints。温めた回復室でマウスを置きます。
3。頸動脈から内膜のRNA分離
- 制度的IACUCプロトコルに従ってCO 2吸入によりマウスを犠牲にする
- ペーパータオルにテープ足を。
- 腹部から胸部の上部にマウスの皮膚を切り取ります。
- ハサミで胸郭下腹壁を開きます。
- 鉗子で胸骨を持ち上げ、横隔膜をカットして、心臓を露出させる胸郭を切り取る。
- はさみで大静脈をカット。
- 肺と肝臓が蒼白になるまで、左心室を通して10単位/ mLのヘパリンを含む生理食塩水で2〜3分間圧力を浸み込ませる(120 mmHgの)。
- 首の皮膚をカットし、頸動脈が露出されるまで、すべての脂肪、筋肉、および結合組織を取り除く。
- 解剖顕微鏡下でマウスを置きます。
- 穿刺右第二灌流のための左頚動脈の結紮部位以下の穴。
- 圧力は、左頸動脈がよくperusedていることを確認し、左心室を通して10単位/ mLのヘパリンを含む生理食塩水で〜1分間再灌流。
- 微細な先端の鉗子と小さな春のはさみを使用して、慎重にcarotidsを取り巻く周囲の外膜の組織を削除します。この洗浄ステップ中にcarotidsを圧迫やストレッチをしないように注意してください。
- 大動脈弓と頸動脈分岐部上記のライゲーションの点の間の左頸動脈を切断。
- 右鎖骨下動脈の分岐点と頸動脈分岐部の間に右頸動脈を切断。
- 氷冷HBSSを含む、35mmの培養皿にcarotidsを転送する。必要に応じて、慎重に残りの周囲の外膜組織を除去する。
- 各頸動脈あたり150μlのQIAsolの溶解バッファー(Qiagen社)を充填して29グラム針とインスリンの注射器(3 / 10 mlの注射器)を準備する。
- 慎重に頸動脈の一端に針の先端を挿入する。
- すぐに、頸動脈やピンセットで針の先端を保持している間(〜1秒)1.5mlチューブ(内膜の溶出液)にQIAsol溶解バッファー(150μl)をフラッシュする。
- 頸動脈残り(メディア+外膜)一度HBSSで、1.5 mlチューブに入れ、そして液体窒素中でスナップ凍結をすすぐ。
- 内膜の溶出液と凍結残ったが、製造元の指示に従ってmiRNeasyミニキット(QIAGEN)を用いて内膜またはメディア+外膜RNAの分離に使用されます。
4。代表的な結果:
我々は部分的に結紮マウス左頸動脈超音波検査は、手順に従って一日行った。図1に示すように、成功した部分的なライゲーションは、血流速度を低減し、心拡張期に左総頸動脈の流れ(乱流)を逆にします。高脂肪食を伴うアポEノックアウト(KO)マウスの部分的なライゲーションは、2週間(図2)で、左総頸動脈の動脈(LCA)ではなく、反対側の右の頸動脈で堅牢なアテローム性動脈硬化症を誘発する。 - SMA(図3)などの中膜平滑筋細胞マーカー遺伝子のフリーながら頸動脈内膜から採取したRNAは、そのようなPECAM - 1などの内皮マーカー遺伝子が含まれています。
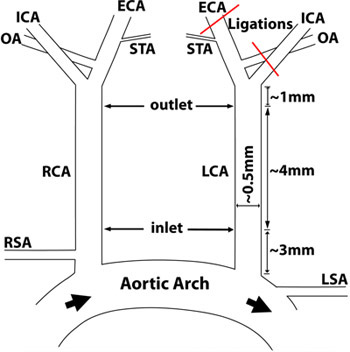
図1:頸動脈解剖学とライゲーションの回路図: 上甲状腺動脈(STA)が開いたままで左総頸動脈の三枝(LCA)[外頸動脈(ECA)、内頸動脈(ICA)、および後頭動脈(OA)]は、連結した。
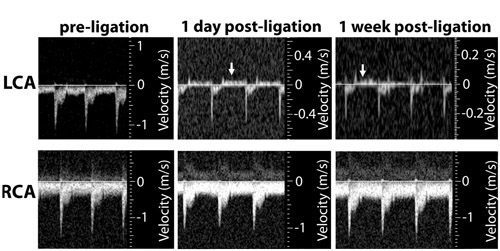
図2:超音波画像は、流れの速度プロファイルを示し、拡張期の間にLCAに(矢印で示される)部分的なライゲーションが流れの反転を引き起こすことが明らかになった。 RCAの流れは、ライゲーションした後も変更されずに残る。
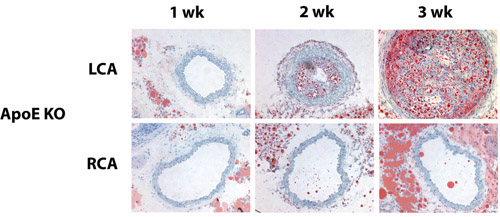
図3:部分的ライゲーションと高脂肪食は急速にアポKOマウスのLCAでアテローム性動脈硬化症を誘発アポKOマウスでは、部分的に連結し、1〜3週間の高脂肪食を与えられた。 LCAから凍結切片をオイルレッドOで染色した。

図4内膜RNA調製の方法。内膜RNAと内側+外膜(mは+ A)RNAをC57BL / 6マウスに偽手術RCAとLCAから得られた。 RNAはPECAM - 1とα- SMAは、内部コントロールとして18秒を使用するための半定量的RT - PCR(A)と定量PCR(B、C)により分析した。バーグラフは± SEM、n = 3の平均値です。
ディスカッション
この手順では、外頸動脈、内頸動脈、後頭動脈と上甲状腺動脈を含む、総頸動脈のすべての支店の適切な識別が不可欠です。示すように超音波を使用してフローのパターンを検証することも重要です。当社の経験豊富な手で、500以上のマウスの超音波の研究に基づいて部分的な結紮手術の私達の成功率は90%よりも優れています。頸動脈内膜RNA調製には、まず血流のステップの後に頸動脈の?...
謝辞
この作品は、科学、技術と韓国の教育省からのNIH助成HL87012(HJ)、HL75209(HJ)、UO1HL80711(DH、DG、HJ)とワールドクラスの大学プロジェクト(HJ)からの資金によって支えられている。
資料
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| Normal Saline (0.9% sodium chloride) | Baxter | 2B1323 | ||
| Insulin syringe (3/10 ml 29g syringe) | Tyco Health care | 8881600145 | ||
| HBSS | Cellgro, Mediatech, Inc. | 21-023 | ||
| miRNeasy mini kit (including, QIAzol) | QIAGEN | 217004 | ||
| Vevo 770 High-Resolution Micro-Imaging System | Visualsonics | a.Visualsonics 770 system b.Imaging stage c.Vevo integrated rail system d.RMV scan head for mice | or similar system | |
| 6-0 Silk Suture, sterile | Covidien | s-1172 c2 | ||
| Small scissors | Roboz | RS-5675 | or similar | |
| Dissecting Forceps | Roboz | RS-5005 | or similar | |
| Tissue Mend II | Webster Vet Supply | 07-856-7946 |
参考文献
- Korshunov, V. A., Berk, B. C. Flow-induced vascular remodeling in the mouse: a model for carotid intima-media thickening. Arterioscler Thromb Vasc Biol. 23 (12), 2185-2191 (2003).
- Sullivan, C. J., Hoying, J. B. Flow-dependent remodeling in the carotid artery of fibroblast growth factor-2 knockout mice. Arterioscler Thromb Vasc Biol. 22 (7), 1100-1105 (2002).
- Nam, D. Partial carotid ligation is a model of acutely induced disturbed flow, leading to rapid endothelial dysfunction and atherosclerosis. Am J Physiol Heart Circ Physiol. 297 (4), H1535-H1543 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved