Method Article
大腸癌への進行中に視野欠損欠損PMS2、ERCC1、Ku86、CcOI
要約
PMS2及び/または全体の陰窩におけるERCC1の減少/不在の式はおそらく結腸腺癌、高い可変性と癌への進行による視野欠損の基礎の各辺が10 cm以内頻繁にイベントです。 Ku86またはCcOIの欠乏はあまり頻繁にこれらの視野欠損のです。
要約
発がんでは、"視野欠損は、"多くの場合近くの場所で、これは、同じ組織型の他の悪性腫瘍を開発するために、特定の癌の生存者の高い傾向が臨床的に認識されています。そのような視野欠損は、大腸癌で指摘されている。コロンの視野欠損を担当している分子異常は、結腸腺癌の周囲または高度な腫瘍(よく大腸癌への道上)と腺腫周囲の組織学的に正常組織で高頻度で検出可能になるはずですが、低周波数で大腸腫瘍のない患者からの結腸粘膜インチ
免疫組織化学を用いて、結腸腺がんまたは進行結腸腫瘍形成の各辺が10 cm以内全体陰窩は、2つのDNA修復タンパク質、PMS2および/またはERCC1のため頻繁に減少または式の中で不在であることがわかった。 PMS2は、過剰なDNA損傷による細胞のアポトーシスに必要なだけでなく、DNAミスマッチ修復に積極的に二重の役割蛋白質、である。 ERCC1はDNAヌクレオチド除去修復に積極的です。 ERCC1とPMS2両方の減少または欠如式が生き残るために増加する能力(アポトーシス抵抗性)と可変性の増加レベルの両方で細胞を作成します。 ERCC1とPMS2両方の減少または欠如の発現は、おそらく大腸癌への進行の初期段階です。
DNA修復遺伝子Ku86(DNAに積極的に非相同末端結合)とチトクロームcオキシダーゼサブユニットは、私は(アポトーシスに関与する)各結腸癌に近い粘膜の分野における表現に減少することが報告されていた。しかし、発現のそれらのレベルの免疫組織化学的評価は、大腸癌の周囲や高度な結腸腫瘍を周囲の視野欠損にその発現を欠くように陰窩のささやかな周波数にのみ低示した。
我々は、ここで、ERCC1、PMS2、Ku86とCcOIの発現のための陰窩の評価の手法を示す。我々は、陰窩の2%と頻度の中央値を持っているの頻度はKu86欠損陰窩ながら、PMS2とERCC1のための欠損全体陰窩のその頻度は、しばしば結腸腫瘍を周囲20センチの分野で70%〜95%と大きいであることを示すCcOIの欠損は、これらの分野で16%の中央値を持っています。全体のコロンは長さ150 cmです(約5フィート)とその粘膜層で約1,000万地下室を持っています。 PMS2ため、大腸癌を取り巻くERCC1の欠陥は、100万陰窩を含めることができます。それは、大腸癌が発生するという欠陥のある地下室からです。
プロトコル
スライドで見られるように準備組織
- 大腸は、直腸から結腸に渡すことができます。大腸は、結腸のよりよい視覚化を可能にするために長い風船のようにそれを爆破するために大腸に空気を通過する能力照明とヘッドでビデオカメラを持っている長い管である、と缶生検鉗子のための通路を有する私たちの生検標本を与えるために内面"皮膚"や大腸の粘膜層の3〜5ミリメートル領域をピンチオフするビデオカメラを越えて。生検鉗子は、潜在的に大腸に見られる前癌ポリープを除去するために使用することができます。
- 私たちは、インフォームドコンセントで、患者から正常な結腸粘膜組織の生検を取得。これらの患者は胃腸クリニックでのスクリーニング大腸内視鏡検査を受けていた。私たちの生検は、ホルマリンの瓶に入れた。 4時間後、ホルマリンを70%アルコールに置き換えられました。
- 組織の同様のサンプルを、高度な腫瘍と大腸癌や腺腫から1 cmおよび10 cm離れていた手術中に除去大腸の切除、、の地域から採取した。これらの組織サンプルは、ホルマリンに入れ、組織サンプルのサイズが大きい場合、いくつかは70%アルコールに配置される前に長い期間、ホルマリンに格納されていました。
- 組織サンプルを処理し、パラフィンブロック内に配置されるための組織学の研究室に運ばれている。
- パラフィンブロックは、それらをより容易にミクロトームで切断するために冷蔵庫で冷却されています。
- 4ミクロンの厚さの組織切片をミクロトームを用いて、組織ブロックから切り出し、そして水に浮いています。
- 2枚の画像それぞれに、3つの組織切片がなくなるまで2つのタンパク質の発現を比較するため、インスタンスERCC1とPMS2のために、別の組織切片は、二つのスライドにピックアップすることができます。例えば、セクション1、3、および5は、ERCC1とセクション2、4、6はPMS2というラベルのスライド上に配置することができるというラベルのスライド上に配置することができます。 three組織切片では、単一のスライドに一つのタンパク質に対して免疫あるとアーティファクトはスライド上の複数の組織切片で繰り返すことはないので、地下の異常な染色パターンは、アーティファクトであるか実数どうかを確認できるようにすることができます。結腸陰窩は、約15組織切片が1つの地下室を切って進むことができる、と同じ地下室は、スライドごとに複数の組織切片上で閲覧することができるように、、直径約60ミクロンです。
組織切片を免疫染色
- スライドはその後、免疫組織化学的標識法を介して配置されます。これは、8時間の手続きであり、ほぼ標準的なものです。標準ではない我々が使用している手順の一部は、染色用Sequenza容器の使用、および"スナイパー"と呼ばれるバックグラウンド染色を低減するためのソリューションを使用しています。 "スナイパー"のソリューションは、バイオメディカル、コンコードCAによって独自の計算式として販売されています。
- 私たちの手続きのステップのいくつかがここに表示されます。
- 例として、PMS2免疫組織化学のために、スライドは、95%エタノールで2つの変更(2分に続いて100%エタノールで2つの変更(2分)、続いてキシレンの3変化(3分)、で配置することにより、第一脱パラフィンです。それぞれ)、蒸留水を2回交換(2分ごと)に続く。実験者が蒸気に暴露されないようにこれらの手順は、負の空気の圧力と化学ボンネットの下に行われている。
- 最初に組織を固定するために使用されたときにホルマリン、組織サンプル中のタンパク質の部分は、架橋となった。今我々は、抗体が目的のタンパク質を認識できるように、クロスリンクを解除する必要があります。スライドは、電子レンジで沸騰に持って来られている緩衝液に配置されます。これは、氷上で20分間冷却し、培地の設定に10分が続きます。このステップでは、良好な結果が得られるまで、さまざまな電子レンジをテストして調整する必要があります。 CcOIまたはKu86を免疫染色のために私達が9mLクエン酸+ 41mLのクエン酸ナトリウム、約6.0のpHを持っていたERCC1のために私達が作ったクエン酸緩衝液を使用する+ 450mL H 2 O(ナトリウムイオンを含む緩衝液)で作られたクエン酸ナトリウム緩衝液を使用することに注意してください2.1グラムのクエン酸+ 1リットルで6.1(最小限の付加ナトリウムイオンとバッファー)、pHをもたらすためにH 2 O +〜5mLの水酸化ナトリウム、およびPMS2のために我々は(VECTORで)5mLを抗原のアンマスキングのソリューションで作成されたソリューションを使用する+ 533mL H 2 O別のバッファは、特定のタンパク質のエピトープと抗体の相互作用を高めるために必要とされる。
- スライドはその後3分間蒸留水ですすぎ、そして5分間(PBSと呼ばれる)リン酸緩衝生理食塩水で洗浄し、続いて20分間、3%過酸化水素(メタノールで希釈した)に入れられます。
- スライドはその後Sequenza(サーモフィッシャーサイエンティからシャンドンSequenzaの免疫染色システム)と呼ばれる平らな狭い染色ラックに入れ、PBSで洗浄されています。
- ERCC1またはPMS2のために免疫染色されているスライドを、10分にさらされているバックグラウンドのタンパク質の非特異的染色を減少させる作用"スナイパー"と呼ばれるバイオケアから得られた独自のソリューション、、の3滴の追加治療への曝露はユート。
- スライドを1 mlのTween + 100ミリリットル10倍トリス+ 900 mlの蒸留水である[10倍トリスは24.2グラムTrizma + 80グラムのNaCl + 1,000 mlの蒸留及び脱イオン水+濃塩酸(ここでバッファ"TBST"で洗浄されている約15 ml)をpHが7.6〜解決策をもたらすために]。
- スライドはその後(2%ウシ血清アルブミンは、バッファTBSTで構成される)バッファーで3回洗浄し、DAKOの100マイクロリットルは1:100希釈で二次抗体をビオチン化しスライドに加え、室温で30分間インキュベートされています。
- この時点では、ベクタステインABC(アビジンビオチン複合体)(ベクターラボラトリーズから)試薬を2.5 mlのPBS、1滴のソリューション、1滴の溶液Bを使用して、用意され、そして溶液を30分間放置する。
- スライドをTBST緩衝液で3回洗浄されています。
- 次にベクタステインABC試薬を3滴を添加し、スライドをTBSTで2回リンスし、次いで、室温で30分間インキュベートする。
- スライドはその後約5分間DAB(ジアミノ-ベンズアミド)(2.9ミリリットルDAB + 400マイクロリットルのPBS + 250マイクロリットルの過酸化水素)に浸漬されています。
- スライドを蒸留、脱イオン水で2回リンスしています。
- 対比は、10秒間ヘマトキシリンの希薄溶液を使用して行われます。スライドは、脱イオン水に続いて水道水で十分にすすぎ洗いされています。
- スライドはその後、キシレンで2分間95%エタノールで2分間脱水2回、100%エタノールで2分間と2回の2倍です。
- Cytoseal XYL(リチャード - アラン科学)の滴のカップルは、スライドに追加し、カバースリップが適用されます。
- ERCC1、Ku86とCcOIの免疫組織化学的評価はPMS2と同じプロトコルを使用して実行しますが、ERCC1、Ku86とCcOI用抗体でPMS2抗体を置き換える、次の表に記載されています。
ERCC1の発現を欠く陰窩、PMS2、Ku86とCcOIのための組織切片の評価
- 我々は、大腸粘膜の陰窩のPMS2とERCC1の発現のためにMotic(DM - BA300)顕微鏡写真機の下の組織切片で最初に見ていきます。
- PMS2とERCC1の両方のDNA修復酵素であり、DNAがどこにあるので、それらは陰窩の細胞の核に、配置されています。これは、ERCC1の染色を表す茶色のコロンは、陰窩の細胞の核で発生した図1に示されています。我々は顕微鏡で最初に表示する通常の地下室は、ERCC1のために染色し、そして茶色の変色は、ERCC1の位置を示していた。我々は、"杯細胞が"地下室の外側のエッジにある細胞の基部に小さな領域での原子核と、多少のワイングラスのような形している地下室、そして熱気球セクション外での細胞のタイプを指摘する地下室の内側の細胞の一部に白い粘液顆粒で満たされ。細胞の他の2つのタイプが私たちの染色切片で多少〜に似ている、と彼らは腸と腸内分泌細胞であり、その核は細胞の基底で、地下室の外側のエッジにもなります。ここに示されているように結腸腫瘍を持っていなかった患者から、または生検ではるかに大腸癌の任意のサイトから採取生検では、ほぼすべてのすべての陰窩における原子核のは、ERCC1の発現の正常な高いレベルを示しています。
- オリエントにない大腸腫瘍患者の生検から得られた我々の観察、組織切片を通常の結腸粘膜におけるPMS2の発現のレベルは、ERCC1、CcOIまたはKu86が観察されています。我々は徐々に陰窩、間質細胞、スライド上の任意のリンパ結節、および筋層に全組織切片と点を通過するように我々は(、40倍対物レンズで、正常組織のセクション内のすべての陰窩を観察することができます(存在する場合)生検で)。
- 我々はまた、幹細胞である陰窩の基部にあるだけでいくつかの細胞があることを指摘している。これらの幹細胞は、完全な地下室の約2,000細胞のすべてを生成します。突然変異またはepimutation持つ幹細胞は、全体の幹細胞のニッチを引き継ぐことができます。その後、全体のcryptは我々がCcOIの高発現している地下室の隣にCcOIため欠乏全体の陰窩を参照してくださいどこに我々はこの新しいスライドに示すように、目的の酵素(クリプトの変換)のために染色変更した可能性があります。
- その後、我々は、大腸癌患者からスライドまたは高度な腫瘍と腺腫を示しています。このスライドでは、一部の陰窩は、ERCC1のために、式の通常の高レベルを持っているといくつかの発現の低レベルを持っている。組織切片内の陰窩のすべては、10倍対物レンズで低解像度で撮影され、画像は全体の組織切片が1つの画像に見られるように順に配置されます。陰窩は、その後に番号が付けられています。
- 今まであちこちに、酵素の高発現と生検で陰窩の典型的な陰窩メートルすべての癌は、レベル"4"染色と呼ばれています。式がある場合、他のレベルは"0"であり、かろうじて検出可能な発現が明らかであれば、"1"検出されない表現、"2"がない場合、式の存在があるかどうかが、レベル4よりもはるかに低いレベルで、そして"3" 4よりも低いレベルで存在するが、かなり強い。我々は、2の黄、3緑1オレンジと0は赤、4の低解像度の画像の青の各スライドが点在しています。ここでは、40倍対物レンズを使用して生検からセクションを通過して示す。我々は、低解像度の画像に地下室が点在しています。

図1。陰窩細胞の核にERCC1の高い発現を示す結腸陰窩。この画像のすべての色が均等にPaint Shop Proの5を使用して、コントラストと彩度に拡張されました。
代表的な結果
- 別々のスライド上で別の組織切片では、私たちは免疫組織化学によって示される二つの異なるタンパク質の発現と、同じ結腸陰窩を見ることができます。 ERCC1用のPMS2のための地下室のステンドグラスと同じ地下室のステンドグラスのイメージは、隣接するコンピュータのモニタと隣接顕微鏡で示されています。これは、私たちは共同の欠乏は、それぞれが頻繁にある間、独立して発生する、2つのタンパク質またはタンパク質の各々の欠陥かどうかがあるかどうかを判断することができます。我々は蛋白質の発現のいずれかの明らかな欠陥が複数のセクション上で欠損として確認され、アーティファクトによるものではないことができるように、スライドごとに3つの組織切片を持っている。癌を生じさせる視野欠損がある大腸癌を、周囲の組織では、ERCC1とPMS2のための欠損陰窩の高周波があります。
- 我々はまた、Ku86とCcOIのために欠損陰窩の周波数を見つけるために免疫組織化学を使用している。このスライドでは、我々は全体の組織切片を通過40倍対物レンズを使用して、Ku86を免疫染色し、我々はいくつかの陰窩は、この組織切片にKu86のために欠乏していることがわかります。
- 同様に、このスライドで、我々は、全体の組織切片40倍対物レンズを使用して、CcOIのために免疫染色を通過、そして我々は、陰窩の中程度の数がCcOIために欠乏していることがわかります。
ディスカッション
- それは、スライドごとに3組織切片を持っていることは非常に重要です。気泡は、気泡が組織切片と反応する抗体を防ぐという理由だけで陰窩のある陰窩または一部が適切に染色されないことがありますように、抗体を運ぶメディアを適用する際に発生する可能性があります。陰窩は、直径約60ミクロンであり、および組織切片は厚さ4ミクロンですので、同じ地下室を通じて、多くの15組織切片がある可能性があります。それは、スライド上に配置、複数の組織切片に、ガイドとして地下室の形態を使用して、同じ地下室を見つけることは通常可能です。
- 私たちの最近の研究では、大規模な組織サンプルのため、Sequenzaでの染色は組織に適切な抗体のカバレッジを提供できない場合があります。これらのケースでは、一つは抗体を含有する培地のドロップは各組織サンプル上の手で置かれている組織の手の染色を、使用することをお勧めします。
- 明らかに免疫染色タンパク質の発現を示す茶色の染色、およびコンピュータのモニタ上で核DNAを示す青色の染色を確認するには、Motic顕微鏡写真機ソフトウェアは次のように調整される。オフセット0、ゲイン0、、、、ガンマ1.00、0を0、255を強化シャープネス1、色補正7、R、G、Bゲイン1.00、R、G、Bの明るさ0。解像度は1024 × 768に設定されており、ホワイトバランスが有効になっています。
- 我々の方法は、任意のタンパク質は、高度な腫瘍で、大腸癌や腺腫周囲の視野欠損では、過剰発現の可能性欠乏の彼らの頻度を評価するために、大腸癌への進行に重要であると考え、または一緒に使用することができます。
- 視野欠損は、癌への進行の一部です。
用語"領域癌化は、"最初のスローターらによって使用された1953年1癌の開発に向けてそれをやすくなるように大部分は未知のプロセス(当時)を前提条件されている上皮の面積または"フィールド"を記述する。初期の使用は、口腔癌の文脈にあった。それ以来、用語"領域癌化"と"視野欠損は、"新たながんが発生する可能性が高くなる、プレ悪性組織を記述するために、より広く使用されており、臨床腫瘍学の領域癌化の概念が注目2を受けている。我々は最近、消化器癌3の視野欠損の証拠日。このレビューに含まれるコロンの視野欠損の証拠を提供する多くの研究の結果であった。
結腸粘膜の視野欠損は、おそらく1つの幹細胞がニッチの連続4を存続するような陰窩の幹細胞の間で変異細胞や後成的に改変細胞の自然淘汰によって起こる。遺伝的不安定性やDNAヌクレオチド除去修復やDNAミスマッチ修復の減少に起因するかもしれないミューテーター表現型は、、このプロセスを加速する(とPMS2の頻繁な欠陥は、以前は大腸癌5、周辺地域で報告されている)。 、結腸粘膜の幹細胞の正常な個体群で、細胞が突然変異またはepimutationを通じて選択的優位性を取得した場合、それは、隣接する幹細胞を犠牲にしてクローン的に拡大する傾向がある。結腸粘膜では、幹細胞のニッチは、地下室のすべて(約2,000)の細胞を生じさせる≤5セル6で占められている。 "地下室の転換"7の変異体や後成的に変化した細胞の種類の結果によって幹細胞のニッチの-を引き継ぐ。
大腸上皮における変異クローンの広がり(変換後の陰窩)が最も頻繁にはcrypt核分裂8で発生する可能性があります。 cryptの分裂の例を図2に示されています。このようにして異常組織のパッチが生じる。このようなパッチの中で、第二このような変異は、指定された地下室はパッチ内の他の陰窩に比べて優位性を獲得し、この地下室は、元のパッチ内での二次のパッチを形成するクローン的に拡大するように発生する可能性があります。悪性幹細胞がクローナルに癌に展開されて発生するまでこの新しいパッチ内で、プロセスは、おそらく数十年にわたって、いくつかのより多くの時間を繰り返すことができる。これは散発的結腸腺癌が発生する一般的プロセスの場合、結腸腺癌は一般的に関連付けられている必要があります、と異常のフィールドを付けなければ。したがって、変換後の陰窩のパッチは、高度な腫瘍と腺腫の周囲、または大腸癌の周囲で検出可能な欠陥を持っていることが予想される場合があります。
事前に腫瘍の進行のこのモデルから、1つは、がんに進行する可能性がある大腸の腫瘍性病変の周辺地域における非腫瘍性の大腸粘膜から採取した組織サンプルの間で事前に腫瘍の進行に関連する遺伝子やエピジェネティックな変化を見つけることを期待。特に、DNA修復酵素で、またはアポトーシスのために必要なタンパク質の欠陥は、ゲノムの不安定性を高めることにより、進行に寄与するであろう、そして欠陥のあるフィールドで発見されることが期待されることがあります。 - 細胞がdであるPMS2の欠乏のための選択ERCC1用eficientとDNA損傷剤にさらさ
奈良ら 9はすべてのDNA修復遺伝子ERCC1を不活化変異を有するチャイニーズハムスター卵巣細胞43 - 3B、25の文化を成長し、MNNG、DNA損傷剤と文化を扱う。 DNA損傷の治療を生存細胞の中でも、単一のセルがそれぞれの培養液から単離され、クローンを形成させた。分離されたすべてのクローンは、親株よりも、MNNGによる殺害への約10倍以上の耐性であった。単離されたクローンのうち、22は、DNAミスマッチ修復(MMR)に欠陥であることが証明された。これらの22クローンのうち5つはシークエンシングによってテストされ、そして5人の3人がPMS2のための欠損であった。 PMS2の欠陥のためのこの選択は、PMS2欠乏がアポトーシスに抵抗性の原因となったのでおそらくであり、したがって、ERCC1が欠落していた時に細胞内に残っている追加されたDNA損傷に耐える能力。 (通常は、PMS2感覚のDNA損傷のレベル、およびDNA損傷が過剰になるとアポトーシスを細胞の原因となる。)よって、PMS2の欠乏は、ERCC1 -欠損細胞はDNA損傷を受けたときに選択されます。親細胞よりもUVを照射したときのERCC1とPMS2両方の欠陥のクローンは、500〜1000倍以上の突然変異率について持っていることが示された。 - 胆汁酸は、酸化ストレスを引き起こすDNA損傷物質であり、大腸癌への進行に重要です。
デオキシコール酸、胆汁酸は、ミトコンドリア10の損傷を含む、複数のプロセスによる活性酸素種(ROS)の生成により酸化ストレスを増加させる。 ROSは、エピジェネティックな変化11を引き起こす、と少なくとも15の研究は、胆汁酸は、高脂肪食に伴う増加濃度で、DNA損傷12を引き起こすことが示されているという最近の証拠がある。バーンスタインらによる審査として12は 、食事脂肪の摂取と大腸癌の発生率の間に正の相関関係がある。胆汁酸は、食事中の脂肪に反応して腸管内に分泌され、胆汁酸は、脂肪の消化を助けるために洗剤として機能している。従って、高脂肪食は増加胆汁酸の分泌に関連付けられています。糞便中胆汁酸濃度は大腸癌の発生率が高いと集団で上昇している、と胆汁酸への過剰な暴露は、大腸癌13の主要な危険因子とみなされている。胆汁酸は大腸の視野欠損の原因である可能性があります。
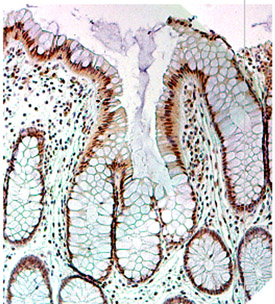
図2 3陰窩に結腸陰窩の核分裂。
結論
我々は、大腸がんを取り巻く大きな視野欠損におけるDNA修復遺伝子ERCC1とPMS2(PMS2はまた、アポトーシスに必要とされる)の欠損陰窩の高い周波数を発見した。 ERCC1とPMS2(エピジェネティックな変化や変異に起因する)の欠乏は大腸癌への進行までの中央の遺伝的不安定性の初期段階かもしれません。
謝辞
アリゾナ州南部の退役軍人ヘルスケアシステムVAメリットレビュー助成金0142とアリゾナ州バイオメディカル研究会助成金0803で提供される資金。
資料
| Name | Company | Catalog Number | Comments |
| PMS2 antibody | BD Biosciences | 556415 | |
| ERCC1 antibody | Thermo Fisher Scientific, Inc. | MS-671-P1 | |
| Ku86 antibody | Santa Cruz Biotechnology, Inc. | SC-9034 | |
| CcO1 antibody | Invitrogen | 459600 | |
| Biotinylated secondary | Dako | E0413 | |
| 22% BSA | Informagen, Inc. | 2327 | |
| Sniper | Biocare Medical | BS966 | |
| Vectastain ABC | Vector Laboratories | PK-6100 | |
| DAB | Thermo Fisher Scientific, Inc. | 34001 | |
| Tween 20 | USB Corp., Affymetrix | 20605 | |
| Cytoseal XYL | VWR international | 48212-196 | |
| Trizma | Sigma-Aldrich | T1503 |
参考文献
- Slaughter, D. P., Southwick, H. W., Smejkal, W. Field cancerization in oral stratified squamous epithelium; clinical implications of multicentric origin. Cancer. 6, 963-968 (1953).
- Vauthey, J. N. Importance of field cancerisation in clinical oncology. Lancet Oncol. 1, 15-16 (2000).
- Bernstein, C. Field defects in progression to gastrointestinal tract cancers. Cancer Lett. 260, 1-10 (2008).
- Calabrese, P. Colorectal pretumor progression before and after loss of DNA mismatch repair. Am J Pathol. 164, 1447-1453 (2004).
- Bernstein, H. Reduced Pms2 expression in non-neoplastic flat mucosa from patients with colon cancer correlates with reduced apoptosis competence. Appl Immunohistochem Mol Morphol. 14, 166-172 (2006).
- Huang, E. H. Aldehyde dehydrogenase 1 is a marker for normal and malignant human colonic stem cells (SC) and tracks SC overpopulation during colon tumorigenesis. Cancer Res. 69, 3382-3389 (2009).
- Kim, K. M., Shibata, D. Methylation reveals a niche: stem cell succession in human colon crypts. Oncogene. 21, 5441-5449 (2002).
- Greaves, L. C. Mitochondrial DNA mutations are established in human colonic stem cells, and mutated clones expand by crypt fission. Proc Natl Acad Sci USA. 103, 714-719 (2006).
- Nara, K., Nagashima, F., Yasui, A. Highly elevated ultraviolet-induced mutation frequency in isolated Chinese hamster cell lines defective in nucleotide excision repair and mismatch repair proteins. Cancer Res. 61, 50-52 (2001).
- Payne, C. M. Deoxycholate induces mitochondrial oxidative stress and activates NF-kB through multiple mechanisms in HCT-116 colon epithelial cells. Carcinogenesis. 28, 215-222 (2007).
- Lim, S. O. Epigenetic changes induced by reactive oxygen species in hepatocellular carcinoma: methylation of the E-cadherin promoter. Gastroenterology. 135, 2128-2140 (2008).
- Bernstein, H. Bile acids as carcinogens in human gastrointestinal cancers. Mutat Res. 589, 47-65 (2005).
- Payne, C. M. hydrophobic bile acids, genomic instability, Darwinian selection, and colon carcinogenesis. Clinical and Experimental Gastroenterology. 1, 19-47 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved