このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ラベルフリーその場でイメージング
要約
共焦点ラマン顕微鏡法に基づく方法は、ラベルフリー植物細胞壁中のリグニンの可視化と異なる組織、試料や種の木質化の比較に支払うよう提示される。
要約
会議増大するエネルギーを安全に要求し、効率的に地球規模の課題です。そのため、費用対効果の高い、持続可能な解決策を見つけるように努めるバイオ燃料生産の研究は、局所および重要な課題となっています。リグノセルロース系バイオマスは、液体バイオ燃料〜1-6の変換のためのバイオマスの主な情報源になろうとしています。しかし、費用対効果的かつ効率的にこれらの植物細胞壁の材料の反抗劣化はバイオ燃料や化学物質4の生産で使用するための大きな障害となって提示。特に、リグニン、複雑で不規則なポリフェニルプロパノイドヘテロポリマーは、リグノセルロース系バイオマスの収穫後の脱構築に問題となる。バイオ燃料用のバイオマスの変換の例では、それは発酵7の単糖を生成することを目的とプロセスの糖化を抑制する。工業用の植物バイオマスの有効利用は、実際には植物の細胞壁がlignifiedされる範囲に大きく依存している。リグニンの除去はコストがかかり、制限因子8、リグニンは、したがって、細胞壁の変換を改善するために重要な植物の品種改良と遺伝子工学の対象となっている。
植物細胞壁の木質化の正確な急速な特性評価を可能にする分析ツールは、繁殖集団の多数を評価するためにますます重要になる。このようなリグニンなどのネイティブコンポーネントの分離のための抽出手順は、重要な化学的および構造的な変更が9月11日をもたらし、必然的に破壊的です。 現場の方法で分析化学は、このようにリグノセルロース系材料の組成および構造解析のための非常に貴重なツールです。ラマン顕微鏡は、レーザー光子のエネルギーのシフトは分子振動に関連しているレーザー、からそのように、単色光の非弾性またはラマン散乱に依存し、試料の固有のラベルフリーの分子"フィンガープリント"を提示する手法である。ラマン顕微鏡は、天然状態に近いの化学組成と分子構造についての洞察を与えて、最小限のサンプル調製で非破壊で比較的安価な測定値を手に入れることができます。共焦点ラマン顕微鏡による化学イメージングは、以前は木材の細胞壁12-14にセルロースとリグニンの空間分布の可視化のために使用されています。これらの以前の結果に基づいて、我々は最近、野生型およびリグニン欠損トランスジェニックポプラtrichocarpa(ブラックコットンウッド)の幹木材15に木質化を比較するためにこの方式を採用している。 1600、1,700 cm -1に 、リグニンの信号強度と局在との間のスペクトル領域でのリグニンのラマンバンドが16,17の分析は、 その場でマッピングした。我々のアプローチは、リグニン含有量の違い、ローカライズ、および化学組成を可視化。最近では、我々は18のサブμmである横方向の解像度を持つシロイヌナズナの細胞壁ポリマーのラマンイメージングを示した。ここでは、この方法は、染色や組織の標識せずに植物細胞壁中のリグニンの可視化と異なる組織、試料や種の木質化の比較を得た提示されます。
プロトコル
1。サンプル準備
- ミクロトームで、和の植物試料、例えばポプラの幹木材やシロイヌナズナの茎をマウントします。
- ネイティブ組織から薄片を(通常は厚さ20μm)カット。
- ガラスの顕微鏡スライド上に植物のセクションを転送します。
- D 2 O中の植物のセクションを浸し、D 2 Oの蒸発を防ぐために顕微鏡スライド上にシールされているガラスのカバースリップでカバー植物のセクションでは、現在のイメージングのための準備ですか、それは将来使用するために格納することができます。
2。サンプルの測定
- 顕微鏡対物および/またはカバーガラスにイマージョンオイルを適用します。
- 顕微鏡対物が直面しているカバースリップで、顕微鏡の圧電走査ステージ上の顕微鏡スライドを置き、固定します。
- 高開口数の液浸顕微鏡の対物レンズを用いてカバースリップ(100倍、NA = 1.40)を介してサンプルを表示し、関心のサンプル領域を探します。
- 他のすべての実験室、顕微鏡の光源をオフにした後、位置分解顕微測定は、10から30 mWの典型的なパワー(と試料にCWレーザーからバンドパスフィルタ処理された単色緑色の光を(λ= 532nm)を焦点を当てて行われる)セットアップの概略については、図1を参照してください。自家蛍光は、長い波長のレーザー光で励起が賢明かもしれない、その場合に有用な測定値を、禁止する可能性があるいくつかのサンプルで発生する可能性があります。
- 後方散乱ストークスシフトしたラマン光は顕微鏡対物レンズによって収集され、共焦点セットアップの空間フィルタとして機能するダイクロイックミラー、ピンホール、、とロングパスフィルタを通過し、回折格子のスリットに集光され光をスペクトルに分散し、ラマンスペクトルを与え、冷却CCDカメラによって検出される分光計、。ポプラ材のラマンスペクトルは1,600、1,700 cm -1の間のスペクトル領域での特徴的なリグニンのバンドで、図2に示します。
- 化学イメージングと空間的なリグニンの分布の可視化のため、二次元スペクトルのマップは、ラスタが圧電スキャンステージとレーザーの焦点を介してサンプルをスキャンし、各サンプル位置のためにラマンスペクトルを記録することによって取得されます。三次元スペクトルマップはレーザーの焦点がz軸方向に沿って連続して踏まれたために2次元の地図を積み重ねることにより生成されることがあります。
3。データ解析
- 化学イメージングとリグニンの可視化のため、収集されたデータは、MATLAB(MathWorks社、バージョン7.7)を用いて分析される。データは2つの空間次元とスペクトル信号の三次元で構成されている三次元のハイパーキューブ、に配置されている。
- リグニンの分析のために、1550、1,700 cm -1の間のスペクトル領域(図2を参照)とみなされます。リグニンの空間分布は(図3を参照)ベースライン補正スペクトルの1550 1700 cm -1にから強度を統合することにより可視化される。ベースラインの補正に代わるものとして、二次微分スペクトルを計算し、二次微分のピークは、分析に使用することができます。
- 。特にconiferaldehydeとコニアルコールの部分に関してはリグニンの局在と化学は、、さらに(図2、文献15のイラストを参照1600、1,700 cm -1の間にある三つのバンドの嵌合のガウスピーク下の面積を評価することによって分析することができる- 17)。
- 異なるスペクトルマップ間の強度の正規化を参照クラスタリングの分類を、kは、手段で得られる平均的なルーメンのスペクトル、の2,500 cm -1の外因性のOD伸縮バンドのピーク高さとして使用して実行されます。これは非常に重要であり、一つ異なる測定、組織、サンプルおよび種間のリグニンのシグナル強度を比較することができます。
4。代表的な結果
ポプラ( ポプラangustifolia)の幹木材の代表的なラマンスペクトルを図2に示されています。特徴的なリグニンのバンドは1,600、1,700 cm -1の間のスペクトルの領域で発見されています。例として、ポプラ材の断面におけるリグニンの空間分布を図3に示す。可視画像と比較すると、形態学的に異なる細胞壁領域が原因で別のリグニンの信号強度に明確に区別さとなる。高リグニンの信号強度は、化合物の中間ラメラの細胞の隅(CC)と、やや少ない、(CML)で観察される。実体のない低い、まだ、リグニンの量は、繊維のS2壁層内で観察される。リグニンの信号強度の変動は、特に繊維の繊維から、CC、CMLおよびS2内である程度まで見られる。我々の測定における横方向の空間分解能は〜300 nmである。データの品質の間木質化を比較するためによく適していますサンプルとさらにリグニン化学15を解剖する。
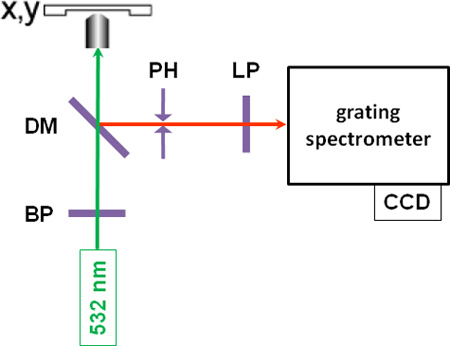
図1:楽器のセットアップの概略図BP:バンドパスフィルター、DM:ダイクロイックミラー、PH:ピンホール、LP:ロングパスフィルター。
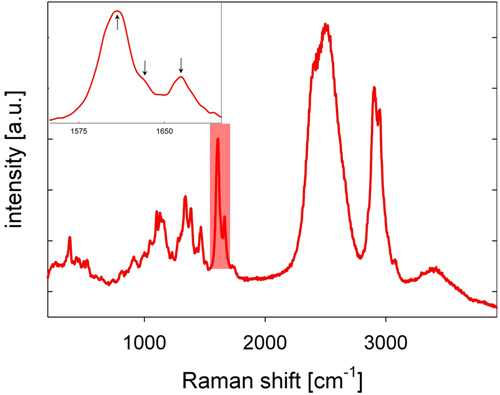
図2:D 2 Oに記録されたポプラ( ポプラangustifolia)の幹木材の代表的なラマンスペクトル 。強調表示されたスペクトルの面積は(また、挿入図を参照)リグニンと特異的に起因する3つの山を有するスペクトル領域をマークします。

図3:1550 1700 cm -1のからラマン信号強度を積分して得られる、:ポプラ材の断面のラマンリグニンの画像(下)(可視画像上)。
ディスカッション
リグノセルロース系材料は、階層と構造と組成の両方に関して不均一である。詳細な特性評価のために化学物質過敏症を持っている分析ツール、空間分解能、およびネイティブのコンテキストでこれらの材料についての洞察を与えることが望ましいです。記載された方法は、リグニンと天然状態の近くでサンプルを染色またはラベリングすることなくサブミクロンである空間分解能を持つリ?...
開示事項
謝辞
我々は、実りのコラボレーションと有用な議論をアンドリューキャロル、ブライトChaibang、Purbashaサルカール(エネルギーバイオサイエンス研究所、バークレー校)、Bahramパービン(ローレンスバークレー国立研究所)とヴィンセントL.チェンマイ(ノースカロライナ州立大学)を感謝。この作品は、エネルギーバイオサイエンス研究所によってサポートされていました。分子ファウンドリーで仕事は契約番号DE - AC02 - 05CH1123下で、米国エネルギー省の科学局、基礎エネルギー科学局によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| microscope slides | |||
| cover slips | |||
| D2O | |||
| nail polish | |||
| immersion oil | |||
| tweezers | |||
| pointed brush | |||
| microtome | |||
| confocal Raman microscope |
参考文献
- Herrera, S. Bonkers about biofuels. Nat Biotechnol. 24, 755-760 (2006).
- Himmel, M. E. Biomass recalcitrance: Engineering plants and enzymes for biofuels production. Science. 315, 804-807 (2007).
- Pauly, M., Keegstra, K. Cell-wall carbohydrates and their modification as a resource for biofuels. Plant J. 54, 559-568 (2008).
- Pauly, M., Keegstra, K. Physiology and metabolism 'Tear down this wall. Curr Opin Plant Biol. 11, 233-235 (2008).
- Ragauskas, A. J. The path forward for biofuels and biomaterials. Science. 311, 484-489 (2006).
- Somerville, C. Biofuels. Curr Biol. 17, R115-R119 (2007).
- Ralph, J., Brunow, G., Boerjan, W. . Lignins in Encyclopedia of Life Sciences. , (2007).
- Chiang, V. L. From rags to riches. Nat Biotechnol. 20, 557-558 (2002).
- Atalla, R. H., Agarwal, U. P. Raman microprobe evidence for lignin orientation in the cell walls of native woody tissue. Science. 227, 636-638 (1985).
- Atalla, R. H., Agarwal, U. P. Recording Raman spectra from plant cell walls. J Raman Spectrosc. 17, 229-231 (1986).
- Fukushima, K. Regulation of syringyl to guaiacyl ratio in lignin biosynthesis. J Plant Res. 114, 499-508 (2001).
- Agarwal, U. P. Raman imaging to investigate ultrastructure and composition of plant cell walls: distribution of lignin and cellulose in black spruce wood (Picea mariana). Planta. 224, 1141-1153 (2006).
- Gierlinger, N., Schwanninger, M. Chemical imaging of poplar wood cell walls by confocal Raman microscopy. Plant Physiol. 140, 1246-1254 (2006).
- Gierlinger, N., Schwanninger, M. The potential of Raman microscopy and Raman imaging in plant research. Spectrosc Int J. 21, 69-89 (2007).
- Schmidt, M. Label-free in situ imaging of lignification in the cell wall of low lignin transgenic Populus trichocarpa. Planta. 230, 589-597 (2009).
- Agarwal, U. P., Argyropoulos, D. S. An Overview of Raman Spectroscopy as Applied to Lignocellulosic Materials. Advances in Lignocellulosics Characterization. , 201-225 (1999).
- Agarwal, U. P., Ralph, S. A. Determination of ethylenic residues in wood and TMP of spruce by FT-Raman spectroscopy. Holzforschung. 62, 667-675 (2008).
- Schmidt, M. Raman imaging of cell wall polymers in Arabidopsis thaliana. Biochem Biophys Res Comm. 395, 521-523 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved