Method Article
動脈組織工学におけるエラストマーのPGSの足場
要約
拍動流のバイオリアクターで培養した血管平滑筋細胞とエラストマーPGSの足場は比較的短い培養期間でネイティブECM生産との有望な小口径動脈の構造につながる可能性があります。
要約
心血管疾患は、米国における死亡の主要原因の一つであり、特に、冠動脈疾患は、人口の高齢化や増加する肥満1増加する。現在、自家血管、同種移植片、および合成グラフトを使用してバイパス手術一般的に動脈代替2に使用するとして知られています。しかし、これらの移植片は動脈の内径が低い可用性、血栓性合併症、コンプライアンスの不整合、および後期内膜過形成3,4による6 mmより小さい場合の用途は限られています。これらの制限を克服するために、組織工学が正常にnonthrombogenic、堅牢、そして準拠している小口径動脈の構造を開発するための有望な代替手段として適用されている。いくつかの先行研究では、トライラメラ構造を持つ小口径動脈の構造、ネイティブ動脈5,6に匹敵する優れた機械的特性および破裂圧力を開発しました。高い引張強度と剛性材料または細胞シート足場からのコラーゲン産生を増加させることにより破壊圧力は、これらの構造はまだ移植後グラフト不全を引き起こすことが大きな問題である低エラスチンの生産とコンプライアンスを、有していた。これらの問題を考慮して、機械的なコンディショニングを組み合わせたelastometric生体材料は弾力性を提供し、細胞外マトリックスの産生を増加させ、細胞の向きをサポートする血管細胞、により効率的に機械的なシグナルを実施するという仮説を立てた。
このレポートの目的は、多孔質管状の足場の製造技術と動脈組織工学への適用のための動的な機械的な空調を導入することである。我々は、塩の溶融法で多孔質管状の足場を製造する生分解性エラストマー、ポリ(グリセロールのセバシン酸)(PGS)7を使用していました 。成人原発ヒヒ平滑筋細胞(平滑筋細胞)が3週間のための私達の設計された拍動流のバイオリアクターで培養足場の内腔に播種した。 PGSの足場は、一貫性のある厚さを有し、ランダムに分布し、マクロとミクロの孔。 SMCの向きと足場の強化されたECMの産生をサポートしている拍動流のバイオリアクターからの機械的な調整。これらの結果は、エラストマーの足場とバイオリアクターの文化の機械的な調整が動脈組織工学のための有望な方法であることを示唆している。
プロトコル
1。管状足場製作
- 足場のための鋳型として、ガラス管(小さな部品、ミラマー、フロリダ州の長さ= 70 mmの外径は= 9.0ミリメートル、肉厚= 1.0 mm)を準備する。
- 脱イオン水10mlにHAの100 mgを溶解して1.0重量/容量%ヒアルロン酸(HA)(Sigma - Aldrich社、セントルイス、MO)を準備する。溶液中に気泡がなくなるまで、一晩ローテータを使用して混ぜる。
- ガラス管の上部に1.0%のHAソリューションを注ぐ。それは金型の内壁に沿ってゆっくりと流れてみましょう。解決策は、ローテータを用いて金型の底に達したときにチューブを介して反転し、金型の内壁を均等にソリューションにより被覆されるまで、この手順を繰り返します。
- 塗布後、24時間、37℃の真空オーブンCにすべてのガラスチューブを乾燥させる
- グラインドとポロゲンとして使用するふるい塩粒子(サイズ= 25〜32ミクロン)。
- 前述の8記載のガラスチューブ(1.0%HAソリューションの内側でコーティングされた)、マンドレル(ステンレス鋼は、PTFEチューブで包まれて)、熱収縮(HS)スリーブ、及びPTFEリングを組み立てます。
- シリコンゴム製の漏斗を通してスパチュラを用いてガラスモールドに所望の大きさの塩の粒子を追加。塩粒子の均一な分布を確保するために穏やかに金型をタップします。ヘラの側面を使用して鋳型の上部に過剰な塩分の粒子を削り取る。
- 塩パックのモールドを転送する前に30分間ハイブリダイゼーションインキュベーターに入れます。ハイブリダイゼーションインキュベーターの電源をオフにし、塩の融合のためのハイブリダイゼーションインキュベーターに塩詰められた金型を置きます。
- ハイブリダイゼーションインキュベーターから金型を外し、37℃の真空オーブンにそれらを乾燥℃で24時間
- 真空オーブンから塩パックの金型を取り外し、それらを、室温で冷ましてください。 PTFEリングを押しながらそれを押し下げることによってステンレス鋼のマンドレルを削除します。マンドレルは、金型にきつすぎる場合、それを引き出すためにニードルペンチを使用してください。モールドの底部からPTFEリングを取り外します。
- ℃で5分間HSのスリーブを収縮さ120でオーブンに型を置きます。 HSのスリーブを圧縮されているか確認してください。塩いっぱいの金型からHSのスリーブを取り外し、それらを、室温で冷ましてください。実際に使用されるまでデシケーター中に金型を保管してください。
- 20重量/容量%溶液を形成するためにテトラヒドロフラン15ml(THF)(Sigma - Aldrich社、セントルイス、MO)にPGSの3gを溶解してPGS溶液を調製します。
- ヒュームフード内でspoidを使用して、それをドロップして塩、パックされた金型の内腔にPGSソリューションを追加。 45 °約ガラスモールドに傾くと徐々に金型を回転させると内側の内腔にPGSソリューションをドロップします。 PGSのソリューションは、金型の壁面に沿って流下するかどうかを確認します。ドライスポットが観察されている場合は、より多くのソリューションを追加します。
- PGSのソリューションを追加した後、THFを蒸発させるための少なくとも30分間ヒュームフード内で金型を置きます。
- 100ミリトル、150℃で硬化PGSために予め定められた硬化時間の真空オーブン(例:24 / 36 / 48時間)に金を入れてください。
- 硬化後、型を取り出し、冷却するため室温に置いてください。ゆっくりと垂直位置で脱イオン水にそれぞれの金型をつけます。気泡が足場を引き裂く原因となる可能性があるため、水の高速にそれらを浸してはいけません。
- 慎重に水浴に金型を転送し、簡単にHAを溶解するためにシリコンチューブを使用して1時間の角度で配置してください。 HAは、金型から溶解されているか確認。はHAが金型から放出されていない場合は、金型からそれを解放するためにスパチュラを用いてゆっくりと足場の一端を押してください。足場のもう一方の端でこの手順を繰り返し、水浴でゆっくり前後に金型を振る。足場が金型内に移動されているか確認。
- 慎重に攪拌機を持つ別の水浴に足場を移す。足場を割る可能性がしっかりと足場を、つかむしないでください。塩粒子を浸出する水を変更することで、少なくとも3日間の水浴中で足場を置きます。
- 塩粒子から浸出した後、脱イオン水で満たされた15 ml遠心チューブにそれぞれの足場を転送するとフリーズして1時間ドライアイスボックスの中に置いてください。凍結乾燥機(すべてのチューブのタクシーが開かれている必要があります)に遠心管を入れて、2日間、それらを凍結乾燥。
- 実際に使用されるまで前デシケーター中にすべての足場を置く。
2。細胞播種のための足場の準備
- デシケーターから足場を取り出し、長さの25〜30ミリメートルとして、それらをカット。
- twoシリコーンゴム栓(直径= 20 mmの壁の厚さ= 6.35ミリメートル、中央の穴の直径= 3 mm)を準備し、2枚のPTFEのチューブを(外径= 3.97ミリメートル、内径= 2.38ミリメートル、肉厚= 0.79 mm、長さ=接続各栓の中央の穴を通して60ミリメートルと40ミリメートル)。
- 長さ1.5 mmとHSのリングをカットし、足場の一端の上にそれを置く。できるだけ小さな重なり部分として足場の一端に1つのPTFEチューブ(接続されているシリコーンゴム栓)を押してください。
- ℃で10分間HSリングを縮小するために120℃オーブンに足場とPTFEチューブを置く。 HSのリングを縮めて、足場がしっかりとPTFEのチューブに接続されているか確認してください。
- 足場とPTFEチューブを取り出し、冷却するため室温に置いてください。バイオリアクターチャンバーとしてポリカーボネートの管(外径= 15.5ミリメートル、内径= 9 mm、長さ= 50 mm)に足場- PTFEチューブアセンブリを置きます。
- ステップ2.3)と2.4)のように足場にPTFEチューブの他端を接続します。
- ポリカーボネートの管の両端に彼らの内面を添付するには、2つのシリコーンゴムのストッパーを調整します。 2つのアルミニウム合金板(;幅= 20 mm、長さ= 70 mm、厚さ= 6.35ミリメートル上部と下部)にシリコーンゴム栓の両方の外側面に取り付けます。プレートの側面の穴に2つのネジ棒を入れて、プレート上に親指のナットのネジを締めてプレートにポリカーボネートの管を(足場の内側に含まれる)を修正。
- 各足場のseedable長さ(二HSリング間の長さ)を測定し、細胞播種のための各足場の内面の面積(πX内径X seedable長さ)を計算する。
- 包むバイオリアクターチャンバーのアルミ箔付きユニットと℃で30分間120℃でオートクレーブして、それを滅菌する。 30分間120℃でオートクレーブしてバイオリアクターの各部分を(メディアタンク、ポンプチューブ、ガス交換、マニホールド、およびニードル弁)滅菌し、細胞培養フードの内部にそれらを組み立てる。
- 事前に扱い、perfusionsのシリーズ(70、50、および25%エタノールで1時間、生理食塩水(PBSリン酸緩衝で足場を洗い流し、使用して24時間Mediatech、ハーンドン、バージニア州)2のH、およびSMC培地流回路で1.0 ml /分で、蠕動ポンプ。
3。細胞播種と文化
- 若年男性のヒヒ(パピオアヌビス)の頸動脈からの主な動脈平滑筋細胞(平滑筋細胞)分離して継代し、以前に9に記載のように播種前に、2次元(2D)文化の中でそれらを特徴づける。
- ウシ胎児血清(ロンザ、ウォーカー、MD)、1%L -グルタミン(Mediatech)、50μg/ mlのアスコルビン酸(フィッシャーサイエンティフィック、フェアローン、10%MCDB 131培地(Mediatech、ハーンドン、バージニア州)を用いて平滑筋細胞を拡大するNJ)、および抗生物質 - 抗真菌剤溶液(10,000 IU / mlのペニシリン、10,000μg/ mlのストレプトマイシン、および25μg/ mlのアンホテリシンB、Mediatech)。
- バイオリアクター内の流れの回路から各バイオリアクターチャンバーを切り離します。 (入口)反管腔側および管腔(コンセント)フローの両方を切断後の足場の内腔に5mlの注射器で、懸濁液を注入することにより、2 × 10 6細胞/ cm 2の密度と足場にシードの平滑筋細胞(継代4-6)。
- 37℃でハイブリダイゼーションインキュベーターにすべてのバイオリアクターチャンバーを入れ、細胞が均一に足場に広がるようにする4時間の2回転でそれらを回転させる。
- フード内でバイオリアクターの回路を流れるようにそれらを再接続ブリダイゼーションインキュベーターからバイオリアクターチャンバーを取り出します。細胞培養インキュベーター中にすべてのバイオリアクターシステムを転送します。
- ペリスタルティックポンプとタンクの負荷新鮮な培養液の軟骨にポンプチューブ(内径= 1.6 mm)を接続します。唯一の内腔の流れに続いて15分間1.0 ml /分でスルー壁の血流を(反管腔側に内腔)を起動します。
- それぞれ、一日1〜14.2ミリリットル/分(15.3ダイン/ cm 2)と21日目に120 mmHgの上の20 mmHgの1.0 ml /分(1.1ダイン/ cm 2内腔のせん断応力)から徐々に流量と圧力を上げます。 4日目でポンプチューブ(内径= 3.2 mm)と培地毎週一回に変更します。
4。組織の収穫と分析のための試料調製
- 21日間培養後、培地タンクのポンプとクランプ管(入口と出口を)停止する。フードにペリスタルティックポンプと搬送バイオリアクターシステムの軟骨からポンプチューブを切り離します。
- 各バイオリアクターチャンバーの入口および出口のチューブをクランプし、フローループから切り離す。インレットチューブを開いて、ポリカーボネートの管の内部に培地を収集するアウトレットチューブでシャーレを準備。ゆっくりアウトレットチューブを開き、チャンバーから培地を取り除く。
- チャンバーから反管腔側ゲージの針および管腔シリコンチューブを外し、ネジを放出することによってアルミ板を切り離します。ポリカーボネートの管を外し、PTFEチューブから組織の構造の一端を外してください。
- 10mlのPBSで満たされたシャーレを準備し、PTFEチューブから構成体のもう一方の端を切り離します。 PBSに構築し、三回すすぎ置く。
- 長さ5 mmのようなカミソリの刃を持つ構造をカット。 -80生化学的アッセイのための° Cのフリーザーでそれをフリーズまたは組織- Tek社最適な切削温度の化合物(サクラファインテック(株)、トーランス、カリフォルニア州への機械的なテストまたはスナップ凍結のために新鮮な培地5 mlを充填した15 ml遠心チューブに移す)のための組織学/ immunofluorescence染色。
5。代表的な結果:
管状PGSの足場は、塩の溶融法(図1A)で生分解性エラストマーを用いて作製した。各バイオリアクターチャンバーには、内腔および反管腔側両方のフローでの足場を提供し、メインフローのループ(図1B)とは別のユニットとして切り離すことができる。バイオリアクターシステムは、フローだけでなく、圧力( 図1C&D)を制御し、監視することにより、一度に培養するための4つの足場を設計されました。
バイオリアクターの培養の概略を図に示した。 2。平滑筋細胞を播種した後、各バイオリアクターチャンバーは37で回転させた° C足場の内腔に均一に細胞を分散するために4時間。とし、拍動流が徐々に増加する流量( 図2A)と圧力( 図2B)と14日目までの足場に適用した。 14日後は、流量と圧力は、文化の終わり(21日目)まで一定に保った。
PGS足場の表面形態を走査電子顕微鏡(SEM)により調べた。走査型電子顕微鏡写真は、足場が一貫性のある壁が(539 ± 18μm)を厚さがあったことを示した( 図3A)とランダムに腔表面( 図3B)をマクロとミクロの孔を配布。足場の形態学的パラメータはmicrocomputed断層撮影(マイクロCT)およびイメージング解析から測定した。平均細孔径は23.3 ± 3.9μmであり、細孔の相互接続性は99.4である± 0.62パーセント、すべての毛穴が完全に足場で相互接続されることを意味です。エタノールの変位で測定した気孔率は75.6 ± 2.7%です。
PGSコンストラクトの細胞形態をSEM( 図4)によって調べた。多層平滑筋細胞は完全に管腔の表面をカバーし、彼らは流れ方向に垂直に配向した。これらの結果は、拍動流のバイオリアクターからの機械的な空調が足場でSMCの向きをサポートしていることを示している。
細胞外マトリックス(ECM)と弾性線維の存在は、H&E染色とエラスチンの自己蛍光(図5)により調べた。 H&E染色は、細胞とECMタンパク質が完全に構築PGSの内腔を覆っていたことを示した。エラスチン自家蛍光はまた、構造の管腔表面に周方向に組織化弾性繊維を示した。 PGS構造のECMタンパク質の産生は、生化学的アッセイから測定した。不溶性エラスチンとコラーゲンの内容はそれぞれ、20.2 ± 9.1組織のμgの/ mg及び6.3 ±組織の1.9μgの/ミリグラムだった。

図1。足場製作とバイオリアクターシステム。管状足場製作の(A)の回路図。 (B)バイオリアクターチャンバー。足場は、PTFEのチューブに接続してポリカーボネートチューブに入れ、シリコーンゴム栓及びアルミ合金板で固定した。 (ゲージの針で)内腔(シリコンチューブによる)と反管腔側フロー:各チャンバーは2つの流路を持っています。インキュベーター内に配置された(C)バイオリアクターシステム。それはメディアタンク、蠕動ポンプモジュール、ガス交換、圧力トランスデューサ、二つの多様体(上部と下部)、及びニードル弁が含まれています。 (D)バイオリアクターシステムは、インキュベーターの外に配置。それは、圧力モニター、流量制御ユニット、データ収集システム、およびコンピュータが含まれています。
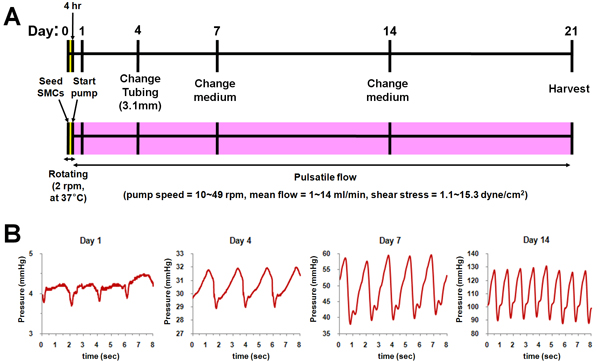
図2バイオリアクターの培養の模式図。 (A)文化プロトコル。 (B)の各時点(1日目、4、7、および14)で圧力プロファイルを適用。
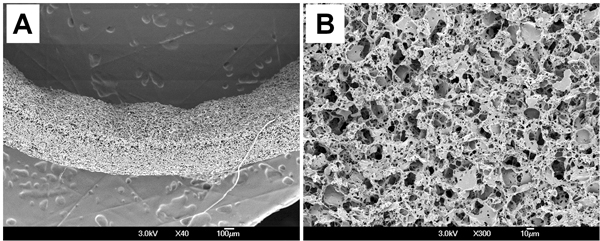
図3。PGS足場の表面形態。 (A)断面図。 (B)ルーメン。
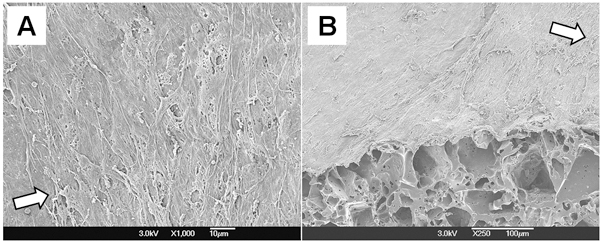
図4。PGSの細胞形態を構築する。 (A)ルーメン。 45 °カットの(B)断面図。両方の図中の矢印は流れの方向を表しています。
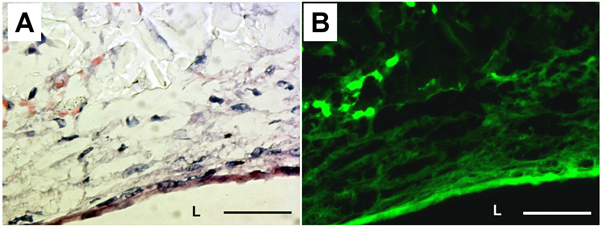
図5組織学とPGSのエラスチン自家蛍光が構築。 (A)H&E染色。 (B)対応するエラスチンの自家蛍光。 L:ルーメン。倍率:40X。スケールバー:50μmである。
ディスカッション
ここで説明する生分解性エラストマーを使用して製造技術はいくつかの機能を備えています。 (1)我々は、離型剤としてヒアルロン酸(HA)を使用。 HAは水溶性なので、足場は簡単に水の中への浸漬した後、ガラスモールドからリリースされました。ソリューションの低濃度(<0.5重量/容量%)は粘性がないと我々はガラス管の上にそれを注ぐときにダウンするため、高速に流れるので、この報告書では、我々はHAソリューションの1.0重量/容量%を使用。解決策は、チューブの底を下に飛び、このステップを繰り返すと、コートのHAソリューションに一様に、我々は、ガラス管を介して反転。このHAコーティングは、最終的な足場を解放するための私達の製造手順が重要です。 (2)我々は、ガラス管に塩を保持するために熱収縮(HS)スリーブを使用していました。塩が密にガラス管とHSのスリーブの内壁との間の空間に充填されているので、HSスリーブがチューブの底部にマンドレルとPTFEリングを削除した後に塩を保持。我々は、℃で5分間120℃オーブンに型を置くことによって容易にHSのスリーブを削除して、管状塩のテンプレートを得ることができる。 (3)我々は塩溶融法を使用。それはよく塩溶融法は、核融合の時間10を変化させて細孔の相互接続性および機械的特性を改善できることが知られている。我々はPGSを使用するので、微細孔がおそらく我々は以前に11を説明するように硬化PGS中に形成されるグリセリンの水蒸気によって生成された一方さらに、、マクロ細孔は、浸出プロセス中に塩の粒子によって製造された。したがって、この方法では、塩の粒子だけでなく、条件を硬化PGSを変更することでさまざまなマクロとミクロ構造と多孔質管状の足場を製作する可能性を秘めています。
バイオリアクターからの機械的な空調は、拍動流の血流を提供しています(最大流量を意味する= 14 ml /分、最大せん断応力= 15.3ダイン/ cm 2、周波数= 0.5〜1.7 Hz)とにつながったPGS足場、と生理的に関連する圧力SMCの成長と方向( 図4)。これらの結果は、以前の研究では、この周波数でその周期的なストレッチを報告と一致しており、せん断応力は、SMCの増殖12、およびECMタンパク質の生産13,14を増加させる。 SMCの成長と方向に加えて、PGSは、バイオリアクター内で3週間の文化の中で特に円周方向に編成弾性繊維( 図5)、サポートされているECMタンパク質の生産を構築する。は弾性繊維は、これらの構文で検出されなかった一方、小径動脈の構造としてエラストマー足場を使用していくつかの研究では、ネイティブ動脈15、スピナーフラスコ16,17を使用して準拠した足場の急速なSMCの統合に匹敵する機械的強度と破裂圧力を示している。我々の結果は、バイオリアクターからの周期的な半径方向の膨張は、可能性エラスチンの合成と組織に貢献PGS足場、の平滑筋細胞に、より効果的に機械的なシグナル伝達を改善することをお勧めします。
血管平滑筋細胞は我々のアプローチ、静止内皮でのECMタンパク質を生産し、臨床的に成功した小口径動脈の構造を開発するために必要な機械的強度を向上させる細胞のみであったため。我々は、内皮細胞が私たちの培養条件と機械的なコンディショニング9歳コンフルエントな単層およびサポートされている表現型のタンパク質の発現を生成した平滑筋細胞と共培養したと報告している。したがって、ここで説明する我々のアプローチに基づいて、共培養の実験条件の変更は、堅牢な結果構文の機能を改善し、nonthrombogenic生成するために次のステップになる、と動脈準拠のネイティブ動脈に似て構築する。
開示事項
謝辞
著者は、PGSの合成、バイオリアクターのセットアップ、博士のための洞察力に富んだ議論のためのピータークラポのための博士ジンガオに感謝。ヒヒ頚動脈をexplantingためのモハメドEzzelarabと魏呉。この研究は国立衛生研究所(R01 HL089658)からの助成金によって支えられて。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | |
|---|---|---|---|
| ヒアルロン酸のナトリウム塩 | シグマアルドリッチ | H7630 | |
| テトラヒドロフラン | シグマアルドリッチ | 401757 | |
| MCDB 131 | Mediatech | 15から100 - CV | |
| ウシ胎仔血清 | ロンザ | BW14 - 502F | |
| L -グルタミン | Mediatech | 25から005 - CV | |
| アスコルビン酸 | フィッシャーサイエンティフィック | A62 - 500 | |
| 抗生物質、抗真菌ソリューション | Mediatech | 30から004 - CI | |
| リン酸緩衝生理食塩水(PBS) | Mediatech | 21から031 - CV | |
| 組織- Tek社最適な切削温度の化合物、4583 | サクラファインテック | 25608-930 |
参考文献
- The American Heart Association Statistics Committee Stroke Statistics Subcommittee. American Heart Association: Heart disease and stroke statistics-2009 update. Circulation. 119, 480-486 (2009).
- Isenberg, B. C., Williams, C., Tranquillo, R. T. Small-diameter artificial arteries engineered in vitro. Circ Res. 98, 25-35 (2006).
- Conte, M. S. The ideal small arterial substitute: a search for the Holy Grail. FASEB J. 12, 43-45 (1998).
- Wang, X., Lin, P., Yao, Q., Chen, C. Development of small-diameter vascular grafts. World J Surg. 31, 682-689 (2007).
- L'Heureux, N., Paquet, S., Labbe, R., Germain, L., Auger, F. A. A completely biological tissue-engineered human blood vessel. FASEB J. 12, 47-56 (1998).
- Niklason, L. E., Gao, J., Abbott, W. M., Hirschi, K. K., Houser, S., Marini, R., Langer, R. Functional arteries grown in vitro. Science. 284, 489-493 (1999).
- Wang, Y., Ameer, G. A., Sheppard, B. J., Langer, R. A tough biodegradable elastomer. Nat Biotechnol. 20, 602-606 (2002).
- Crapo, P. M., Gao, J., Wang, Y. Seamless tubular poly(glycerol sebacate) scaffolds: high-yield fabrication and potential applications. J Biomed Mater Res A. 86, 354-363 (2008).
- Gao, J., Ensley, A. E., Nerem, R. M., Wang, Y. Poly(glycerol sebacate) supports the proliferation and phenotypic protein expression of primary baboon vascular cells. J Biomed Mater Res A. 83, 1070-1075 (2007).
- Murphy, W. L., Dennis, R. G., Kileny, J. L., Mooney, D. J. Salt fusion: an approach to improve pore interconnectivity within tissue engineering scaffolds. Tissue Eng. 8, 43-52 (2002).
- Gao, J., Crapo, P. M., Wang, Y. Macroporous elastomeric scaffolds with extensive micropores for soft tissue engineering. Tissue Eng. 12, 917-925 (2006).
- Wilson, E., Mai, Q., Sudhir, K., Weiss, R. H., Ives, H. E. Mechanical strain induces growth of vascular smooth muscle cells via autocrine action of PDGF. J Cell Biol. 123, 741-747 (1993).
- Leung, D. Y., Glagov, S., Mathews, M. B. Cyclic stretching stimulates synthesis of matrix components by arterial smooth muscle cells in vitro. Science. 191, 475-477 (1976).
- Kim, B. S., Nikolovski, J., Bonadio, J., Mooney, D. J. Cyclic mechanical strain regulates the development of engineered smooth muscle tissue. Nat Biotechnol. 17, 979-983 (1999).
- Yang, J., Motlagh, D., Webb, A. R., Ameer, G. A. Novel biphasic elastomeric scaffold for small-diameter blood vessel tissue engineering. Tissue Eng. 11, 1876-1886 (2005).
- Stankus, J. J., Soletti, L., Fujimoto, K., Hong, Y., Vorp, D. A., Wagner, W. R. Fabrication of cell microintegrated blood vessel constructs through electrohydrodynamic atomization. Biomaterials. 28, 2738-2746 (2007).
- Nieponice, A., Soletti, L., Guan, J., Deasy, B. M., Huard, J., Wagner, W. R., Vorp, D. A. Development of a tissue-engineered vascular graft combining a biodegradable scaffold, muscle-derived stem cells and a rotational vacuum seeding technique. Biomaterials. 29, 825-833 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved