Method Article
PGS élastomère échafaudages en génie tissulaire artérielle
Dans cet article
Résumé
PGS élastomère échafaudages avec des cellules musculaires lisses vasculaires en culture dans un bioréacteur flux pulsatile peut conduire à prometteurs de petit diamètre artériel construit avec une production ECM natif dans une période relativement courte de la culture.
Résumé
Les maladies cardiovasculaires sont l'une des principales causes de mortalité aux Etats-Unis et surtout, de maladie coronarienne augmente avec une population vieillissante et une augmentation de l'obésité. Actuellement, un pontage utilisant des navires autologues, des allogreffes, et greffons synthétiques sont connus en tant que couramment utilisé pour des substituts artériels 2. Toutefois, ces greffes ont des applications limitées lors d'un diamètre intérieur des artères est inférieure à 6 mm en raison de la faible disponibilité, des complications thrombotiques, l'inadéquation de conformité, et la fin de l'hyperplasie intimale 3,4. Pour surmonter ces limitations, l'ingénierie tissulaire a été appliquée avec succès comme une alternative prometteuse pour développer les constructions de petit diamètre qui sont des artères non thrombogène, robuste et conforme. Plusieurs études antérieures ont développé des constructions de faible diamètre artériel avec tri-lamellaire structure, d'excellentes propriétés mécaniques et de la pression d'éclatement comparables à 5,6 artères natives. Bien résistance à la traction élevée et une pression d'éclatement en augmentant la production de collagène à partir d'un matériau rigide ou une feuille de cellules échafaudage, ces constructions avaient encore la production d'élastine et de faible conformité, qui est un problème majeur pour provoquer échec de la greffe après l'implantation. Compte tenu de ces enjeux, nous avons supposé que l'élastomère biomatériau combiné avec climatisation mécanique serait de fournir l'élasticité et la conduite des signaux mécaniques plus efficacement aux cellules vasculaires, qui augmentent la production de matrice extracellulaire et de soutenir l'orientation cellulaire.
L'objectif de ce rapport est de présenter une technique de fabrication d'échafaudages poreux tubulaire et d'une climatisation mécanique dynamique pour les appliquer à l'ingénierie des tissus artériels. Nous avons utilisé un élastomère biodégradable, le poly (sébaçate de glycérol) (PGS) 7 pour la fabrication d'échafaudages tubulaires poreuses de la méthode de fusion du sel. Adulte cellules primaires babouin musculaires lisses (SMC) ont été ensemencées sur la lumière d'échafaudages, qui en culture dans notre bioréacteur de flux pulsatile conçus pour 3 semaines. Échafaudages PGS a une épaisseur uniforme et répartis au hasard macro-et micro-pores. Climatisation mécanique de bioréacteur flux pulsatile soutenue SMC orientation et améliorée ECM de production dans des échafaudages. Ces résultats suggèrent que des échafaudages en élastomère et le conditionnement mécanique de la culture bioréacteur peut être une méthode prometteuse pour l'ingénierie tissulaire artérielle.
Protocole
1. Tubulaire d'échafaudage de fabrication
- Préparer un tube de verre (longueur = 70 mm, diamètre extérieur = 9,0 mm, épaisseur = 1,0 mm; petites pièces, Miramar, Floride) comme un moule pour échafaud.
- Préparer 1,0 pds / vol% d'acide hyaluronique (HA) (Sigma-Aldrich, St. Louis, MO) en dissolvant 100 mg de HA dans 10 ml d'eau déminéralisée. Mélanger à l'aide d'un rotateur nuit jusqu'à ce qu'il n'y ait pas de bulles d'air dans la solution.
- Verser la solution HA 1,0% dans le haut du tube de verre. Laissez couler lentement le long de la paroi intérieure du moule. Retourner sur le tube lorsque la solution atteint le fond du moule en utilisant le rotateur et répétez cette étape jusqu'à ce que la paroi intérieure du moule est uniformément recouvert par la solution.
- Après le revêtement, sec tous les tubes de verre dans l'étuve sous vide à 37 ° C pendant 24 h.
- Broyer et des particules de sel tamis (taille = 25 à 32 um), utilisé comme porogènes.
- Réunir un tube de verre (couché avec à l'intérieur HA solution à 1,0%), un mandrin (en acier inoxydable recouvert par un tube en PTFE), thermorétractable (SH) manche, et l'anneau de PTFE comme décrit précédemment 8.
- Ajouter particules de sel de la taille souhaitée pour le moule en verre à l'aide d'une spatule à travers l'entonnoir en caoutchouc de silicium. Appuyez sur le moule doucement pour assurer une distribution uniforme des particules de sel. Gratter les particules excès de sel sur le dessus du moule en utilisant le côté de la spatule.
- Allumez l'incubateur d'hybridation pour 30 min avant de transférer le moule sel emballé. Éteignez l'incubateur d'hybridation et le sel Mettez-emballés moule dans l'incubateur d'hybridation pour la fusion du sel.
- Retirer les moules de l'incubateur d'hybridation et les sécher dans le four sous vide à 37 ° C pendant 24 h.
- Retirer les moules sel emballé du four sous vide et laissez-les refroidir à température ambiante. Retirez le mandrin en acier inoxydable en le poussant vers le bas avec la tenue de l'anneau en PTFE. Si le mandrin est trop serré pour le moule, utilisez la pince à aiguille pour la retirer. Retirer la bague PTFE du fond du moule.
- Mettez les moules dans le four à 120 ° C pendant 5 min à rétrécir manches SH. Vérifiez si le manchon HS est rétréci. Retirer le manchon HS à partir des moules sel emballé et les laisser refroidir à température ambiante. Gardez les moules dans le dessiccateur jusqu'à ce qu'ils soient utilisés.
- Préparer la solution PGS en dissolvant 3 g de PGS dans 15 ml de tétrahydrofurane (THF) (Sigma-Aldrich, St. Louis, MO) pour former une masse 20 / solution% vol.
- Ajouter la solution PGS dans la lumière de sel-emballés moules en les déposant en utilisant un spoid dans la hotte Hume. Lean le moule en verre d'environ 45 ° et chute de la solution PGS dans la lumière intérieure avec rotation du moule lentement. Vérifier si la solution PGS descend le long du mur de moisissure. Si endroit sec est observé, ajouter plus de solution.
- Après avoir ajouté la solution PGS, placer les moules dans la hotte Hume pendant au moins 30 min pour l'évaporation du THF.
- Mettez les moules dans le four à vide pour temps de cuisson pré-déterminé (ex. 24 / 36 / 48 h) à 100 mTorr et 150 ° C pour PGS durcissement.
- Après durcissement, enlever les moules et les placer à température ambiante pour refroidir. Tremper chaque moule dans l'eau déminéralisée avec la position verticale lentement. Ne pas les plonger dans l'eau rapidement, car les bulles d'air peut causer la déchirure de l'échafaud.
- Transférer les moules au bain d'eau soigneusement et les placer à un angle de 1 h en utilisant le tube de silicone pour dissoudre HA facilement. Vérifiez si HA est dissous à partir du moule. Si aucun HA est libéré à partir du moule, poussez la fin l'un des échafaudages lentement en utilisant une spatule pour le démoulage. Répétez cette étape à l'autre bout de l'échafaud et secouer le moule avant et en arrière lentement dans l'eau du bain. Vérifiez si l'échafaudage est déplacé à l'intérieur du moule.
- Transfert l'échafaud pour un autre bain d'eau avec agitateur attentivement. Ne pas saisir fermement l'échafaud, qui peut-être craquer l'échafaud. Placez l'échafaud dans le bain d'eau pendant au moins 3 jours à l'évolution de l'eau pour lessiver les particules de sel.
- Après le lessivage des particules de sel, le transfert de chaque échafaudage pour le tube à centrifuger de 15 ml remplie de l'eau désionisée et placez-les dans la boîte de glace sèche pendant 1 h à geler. Mettez des tubes à centrifuger dans le lyophilisateur (toutes les cabines tube doit être ouvert) et de les lyophiliser pendant 2 jours.
- Mettez tous les échafaudages dans le dessicateur avant jusqu'à ce qu'ils soient utilisés.
2. Préparation d'échafaudage pour l'ensemencement cellulaire
- Sortez échafaudages du dessiccateur et les couper en 25-30mm de longueur.
- Préparer deux bouchons en caoutchouc de silicone (diamètre = 20 mm, épaisseur = 6,35 mm, diamètre du trou du milieu = 3 mm) et de connecter deux tubes en PTFE (diamètre extérieur = 3,97 mm, diamètre intérieur = 2,38 mm, épaisseur = 0,79 mm, longueur = 60 mm et 40 mm) à travers les trous au milieu de chaque bouchon.
- Couper un anneau SH comme 1,5 mm de longueur et de le mettre sur le dessus d'une extrémité de l'échafaud. Poussez une tube PTFE (connecté bouchon de caoutchouc de silicone) dans l'une des extrémités de l'échafaudage comme portion qui se chevauchent plus petit possible.
- Mettez les tubes d'échafaudage et de PTFE dans le four à 120 ° C pendant 10 min à rétrécir anneau de SH. Vérifiez si anneau de HS est rétréci et les échafaudages sont reliés à un tuyau en PTFE fermement.
- Sortez les tubes d'échafaudage et le PTFE et les placer à température ambiante pour refroidir. Mettez l'assemblage tube échafaudage PTFE dans le tube en polycarbonate (diamètre extérieur = 15,5 mm, diamètre intérieur = 9 mm, longueur = 50 mm) comme une chambre de bioréacteur.
- Connectez l'autre extrémité du tube PTFE à l'échafaud comme des étapes 2.3) et 2.4).
- Ajuster deux bouchons en caoutchouc de silicone pour attacher leurs surfaces intérieures aux deux extrémités du tube en polycarbonate. Attachez les deux surfaces extérieures des bouchons en caoutchouc de silicone à deux plaques en alliage d'aluminium (haut et bas, largeur = 20 mm, longueur = 70 mm, épaisseur = 6,35 mm). Mettez deux tiges filetées dans les trous côté de la plaque et fixer le tube en polycarbonate (inclus à l'intérieur d'échafaudage) pour les plaques en serrant la vis écrou de pouce sur la plaque.
- Mesurez la longueur de chaque seedable échafaudage (une longueur entre les anneaux SH deux) et de calculer la surface intérieure (π x diamètre interne x longueur seedable) de chaque échafaudage pour l'ensemencement des cellules.
- Enroulez une unité de chambre bioréacteur avec feuille d'aluminium et stériliser à l'autoclave à 120 ° C pendant 30 min. Stériliser chaque partie (réservoir moyennes, les tubes de la pompe, l'échangeur de gaz, collecteurs, et le pointeau) du bioréacteur à l'autoclave à 120 ° C pendant 30 min et les assembler à l'intérieur du capot de la culture cellulaire.
- Pré-traiter et rincer échafaudages avec une série de perfusions (70, 50 et 25% d'éthanol pendant 1 h, un tampon phosphate salin (PBS; Mediatech, Herndon, VA) pendant 2 h, et un milieu de culture pendant 24 h SMC en utilisant une pompe péristaltique à 1,0 ml / min dans le circuit d'écoulement.
3. Ensemencement de cellules et de la Culture
- Isoler primaires cellules musculaires lisses artérielles (SMC) de l'artère carotide de juvéniles mâles babouins (Papio anubis) et les caractériser en deux dimensions (2D) et de la culture avant repiquage de semis, comme décrit précédemment 9.
- Développer SMC utilisant le milieu MCDB 131 (Mediatech, Herndon, VA) avec 10% sérum de veau fœtal (Lonza, Walkersville, MD), 1% de L-glutamine (Mediatech), 50 pg / ml d'acide ascorbique (Fisher Scientific, Fair Lawn, NJ), et une solution antibiotique-antimycosique (10 000 UI / ml de pénicilline, 10.000 pg / ml de streptomycine, et 25 pg / ml d'amphotéricine B; Mediatech).
- Détachez chaque chambre bioréacteur à partir du circuit d'écoulement dans le bioréacteur. SMC semences (passage 4-6) à l'échafaud avec une densité de 2x10 6 cellules / cm 2 par l'injection de suspension avec seringue de 5 ml dans la lumière d'échafaudages après avoir coupé deux abluminal (entrée) et luminales (sortie) des flux.
- Mettez toutes les chambres de bioréacteur dans l'incubateur d'hybridation à 37 ° C et les faire tourner à 2 tours pendant 4 h pour permettre aux cellules de manière uniforme se répandre dans l'échafaudage.
- Sortez chambres bioréacteur de l'hybridation incubateur rattacher leur départ du circuit du bioréacteur dans la hotte. Transférez tous les système de bioréacteur en incubateur de culture cellulaire.
- Raccordez le tuyau de la pompe (diamètre intérieur = 1,6 mm) pour le cartilage de la pompe péristaltique et charger milieu de culture frais dans le réservoir. Démarrer la perfusion à travers les murs (luminal au abluminal) à 1,0 ml / min pendant 15 min suivi par le flux luminal seulement.
- Augmenter le débit et la pression graduellement de 1,0 ml / min (stress de cisaillement luminal: 1,1 dynes / cm 2) et 20 mmHg du jour 1 au 14,2 ml / min (15,3 dynes / cm 2) et 120 mmHg à 21 jours, respectivement. Changer le tuyau de la pompe (diamètre intérieur = 3,2 mm) au jour 4 et le support une fois par semaine.
4. La récolte de tissus et de préparation des échantillons pour l'analyse de
- Après culture de 21 jours, arrêter la pompe et les tuyaux de serrage (entrée et sortie) du réservoir à moyen terme. Détachez le tuyau de la pompe à partir du cartilage de pompe péristaltique et système de bioréacteur de transfert dans le capot.
- Pince d'entrée et de sortie de tuyaux de chaque chambre bioréacteur et le détacher de la boucle d'écoulement. Ouvrez la tubulure d'entrée et de préparer une boîte de Petri à la tubulure de sortie pour recueillir milieu de culture à l'intérieur du tube en polycarbonate. Ouvrez le tube de sortie lentement et éliminer le milieu de la chambre.
- Détachez une aiguille de calibre abluminal et silicone luminale de la chambre et détacher les plaques d'aluminium en libérant vis de pouce. Retirer le tube de polycarbonate et de détacher un bout de tissu construire à partir de la tubulure de PTFE.
- Préparez une boîte de Petri remplie de 10 ml de PBS et de détacher l'autre extrémité de la construction du tube PTFE. Mettez de construire dans le PBS et rincer trois fois.
- Couper le construire avec une lame de rasoir que de 5 mm de longueur. Congelez au congélateur à -80 ° C pour le dosage biochimique ou le transférer à 15 tube de centrifugeuse ml remplie avec 5 ml de milieu frais pour les tests mécaniques ou congeler s'enclenchent dans le Tissue-Tek composé température optimale de coupe (Sakura Finetek Inc, Torrance, CA ) pour l'histologie / immunoflucoloration orescence.
5. Les résultats représentatifs:
Les échafaudages tubulaires PGS ont été fabriqués en utilisant des élastomères biodégradables selon la méthode de fusion du sel (Fig. 1A). Chaque chambre de bioréacteur à condition d'échafaudages avec des flux à la fois luminale et abluminal et pourrait être détaché comme une unité distincte d'une boucle d'écoulement principal (Fig. 1B). Bioréacteur système a été conçu pour la culture des échafaudages quatre à la fois par le contrôle et la surveillance des flux ainsi que la pression (Fig. 1C et D).
Schéma de la culture a été bioréacteur Fig. 2. Après le semis SMC, chaque chambre bioréacteur a été tourné à 37 ° C pendant 4 h pour distribuer des cellules de manière uniforme dans le lumen de l'échafaudage. Et puis, le flux pulsatile a été appliquée à des échafaudages jusqu'au jour 14 avec le débit en augmentant progressivement (figure 2A) et de pression (figure 2B). Après 14 jours, débit et la pression reste constante jusqu'à la fin de la culture (jour 21).
Morphologie de la surface de l'échafaud PGS a été examinée par microscopie électronique à balayage (MEB). Microscopie électronique à balayage a montré que échafaudage avait murale compatibles épaisseurs (539 ± 18 um) (Fig. 3A) et répartis au hasard macro-et micro-pores sur la surface luminale (figure 3B). Paramètres morphométriques de l'échafaud a été mesuré à partir de microtomographie (micro-CT) et l'analyse d'imagerie. Taille moyenne des pores est de 23,3 ± 3,9 um et l'interconnectivité des pores est de 99,4 ± 0,62%, ce qui signifie que tous les pores sont totalement interconnectés dans échafaud. Porosité mesurée par le déplacement d'éthanol est de 75,6 ± 2,7%.
La morphologie cellulaire de la construction PGS a été examinée par MEB (Fig. 4). SMC multicouches complètement recouvert la surface luminale et ils ont été orienté perpendiculairement à la direction du flux. Ces résultats montrent que le conditionnement mécanique de bioréacteur flux pulsatile soutient l'orientation SMC dans l'échafaud.
La présence de la matrice extracellulaire (ECM) et de fibres élastiques ont été examinés par coloration H & E et d'élastine autofluorescence (fig. 5). Coloration H & E a démontré que les cellules et les protéines ECM complètement couvert de la lumière du PGS construire. L'élastine autofluorescence ont également montré circonférentiellement organisée fibres élastiques à la surface luminale de la construction. Production de protéines ECM dans les constructions PGS ont été mesurés à partir des dosages biochimiques. L'élastine insoluble et le contenu de collagène ont été de 20,2 ± 9,1 pg / mg de tissu et de 6,3 ± 1,9 pg / mg de tissu, respectivement.

Figure 1. Échafaudage de fabrication et système de bioréacteur. (A) Schéma d'échafaudage tubulaire fabrication. (B) chambre de bioréacteur. Les échafaudages ont été connectés au tube PTFE, placé dans le tube en polycarbonate, et fixés par des bouchons en caoutchouc de silicone et des plaques en alliage d'aluminium. Chaque chambre dispose de deux voies d'écoulement: flux luminal (par un tube de silicone) et abluminal (par aiguille de la jauge). Système de bioréacteur (C) placé à l'intérieur de l'incubateur. Il comprend réservoir moyennes, le module de pompe péristaltique, l'échangeur de gaz, des capteurs de pression, deux collecteurs (haut et bas), et le pointeau. (D) système de bioréacteur placé à l'extérieur de l'incubateur. Il inclut de surveiller la pression, l'unité de contrôle de flux, système d'acquisition de données, et l'ordinateur.
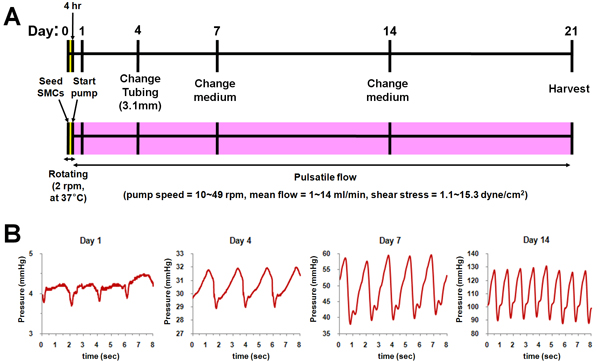
Figure 2. Schéma de la culture bioréacteur. (A) du protocole de la Culture. (B) appliquée profils de pression à chaque point de temps (jour 1, 4, 7 et 14).
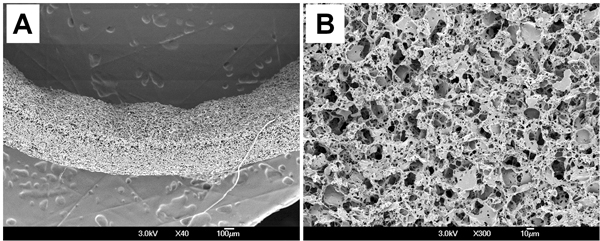
Figure 3. Morphologie de la surface de l'échafaud PGS. (A) de la Croix-section. (B) Lumen.
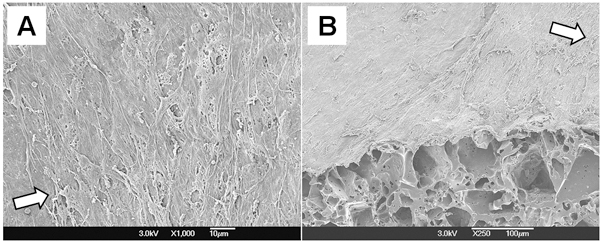
Figure 4. La morphologie cellulaire de l'ES construire. (A) Lumen. (B) Coupe transversale de 45 coupés °. Les flèches dans les deux chiffres représentent le sens d'écoulement.
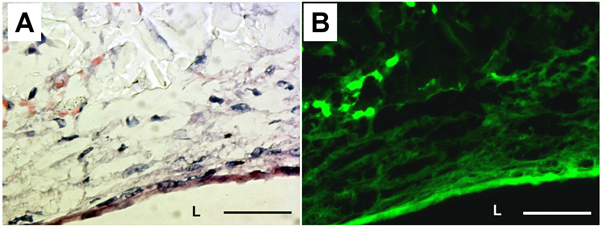
Figure 5. Histologie et d'élastine autofluorescence des PGS construire. (A) coloration H & E. (B) autofluorescence élastine correspondant. L: lumière. Grossissement: 40X. Barre d'échelle: 50 um.
Discussion
La technique de fabrication en utilisant un élastomère biodégradable décrit ici a plusieurs caractéristiques. (1) Nous avons utilisé l'acide hyaluronique (HA) comme un agent de démoulage. Depuis HA est soluble dans l'eau, un échafaudage a été facilement libérée du moule en verre après le trempage dans l'eau. Dans ce rapport, nous avons utilisé 1,0 pds / vol% de la solution HA parce que la concentration est faible (<0,5 pds / vol%) de la solution n'est pas visqueux et s'écoule si vite quand nous la verser sur le dessus du tube de verre. Pour solution HA robe uniformément, nous avons renversé sur le tube de verre lorsque la solution a volé bas au fond du tube et répété cette étape. Ce revêtement HA est un essentiel à notre procédé de fabrication pour la libération des échafaudages finale. (2) Nous avons utilisé thermorétractable (SH) douille pour le maintien des sels dans les tubes de verre. Depuis sels ont été denses dans l'espace entre la paroi interne du tube et le manchon de verre SH, SH manches conservé après le retrait des sels mandrin et anneau de PTFE dans le fond du tube. Nous pourrions supprimer manches HS facilement en mettant le moule dans un four à 120 ° C pendant 5 min, puis obtenir des modèles de sel tubulaire. (3) Nous avons utilisé la méthode de fusion du sel. Il est bien connu que la méthode de fusion du sel peut améliorer l'interconnectivité des pores et les propriétés mécaniques en faisant varier le temps de fusion 10. Par ailleurs, depuis que nous avons utilisé PGS, les macro-pores ont été produits par les particules de sel pendant le processus de lixiviation, tandis que les micro-pores étaient probablement généré par la vapeur du glycérol formé lors de PGS guérir comme nous l'avons décrit précédemment 11. Ainsi, cette méthode a un potentiel pour fabriquer des échafaudages tubulaires poreuses avec des macro-et micro-structures différentes en faisant varier des particules de sel ainsi que PGS guérir condition.
Le conditionnement mécanique du bioréacteur a fourni perfusion flux pulsatile (moyenne maximale de débit = 14 ml / min, la contrainte de cisaillement maximale = 15,3 dynes / cm 2, fréquence = 0,5 à 1,7 Hz) et physiologiquement pertinents de pression avec l'échafaudage PGS, qui a conduit à la croissance de SMC et de l'orientation (Fig. 4). Ces résultats sont cohérents avec les études antérieures des rapports cycliques qui s'étendent à cette fréquence et la contrainte de cisaillement augmente la prolifération SMC 12, et la production de protéines ECM 13,14. En plus de la croissance de SMC et de l'orientation, de construire PGS a appuyé la production de protéines ECM, surtout circonférentiellement organisée fibres élastiques (fig. 5) dans les 3 semaines de culture dans le bioréacteur. Certaines études utilisant un échafaudage en élastomère comme une construction de faible diamètre artériel ont démontré une résistance mécanique et la pression d'éclatement comparable à artères natives 15, et l'intégration rapide de SMC dans les échafaudages conformes à l'aide de spinner flacon 16,17, tandis qu'aucune fibres élastiques ont été trouvés dans ces constructions. Nos résultats suggèrent que la distension radiale cyclique du bioréacteur améliorée transduction du signal mécanique plus efficacement à SMC de PGS échafaudage, qui a probablement contribué à l'élastine synthèse et d'organisation.
Depuis SMC vasculaires ont été les seules cellules qui produit des protéines ECM dans notre approche, l'endothélium quiescent et d'améliorer la résistance mécanique sont nécessaires pour développer une clinique réussie de petit diamètre construit artérielle. Nous avons signalé que les cellules endothéliales co-cultivées avec SMC a généré une monocouche confluente et soutenu l'expression des protéines phénotype dans nos conditions de culture et le conditionnement mécanique 9. Par conséquent, la base de notre approche décrite ici, la modification des conditions d'expérimentation de co-culture serait une prochaine étape pour améliorer les fonctions de constructions et de générer résultante non thrombogène, robuste et conforme artérielle similaire à construire des artères natives.
Déclarations de divulgation
Remerciements
L'auteur remercie le Dr Gao Jin pour la synthèse des PGS, le Dr Peter Crapo pour la discussion fructueuse pour l'installation bioréacteur, les Drs. Mohamed Ezzelarab et Wei Wu pour explantation babouin artères carotides. Cette étude a été soutenue par une subvention des National Institutes of Health (R01 HL089658).
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | |
|---|---|---|---|
| Le sel de sodium d'acide hyaluronique | Sigma-Aldrich | H7630 | |
| Tétrahydrofurane | Sigma-Aldrich | 401757 | |
| MCDB 131 | Mediatech | 15 à 100-CV | |
| Sérum fœtal bovin | Lonza | BW14-502F | |
| L-glutamine | Mediatech | 25 à 005-CV | |
| L'acide ascorbique | Fisher Scientific | A62-500 | |
| Antibiotiques antimycosiques solution | Mediatech | 30 à 004-CI | |
| Tampon phosphate salin (PBS) | Mediatech | 21 à 031-CV | |
| Tissue-Tek composé température optimale de coupe, 4583 | Sakura Finetek | 25608-930 |
Références
- The American Heart Association Statistics Committee Stroke Statistics Subcommittee. American Heart Association: Heart disease and stroke statistics-2009 update. Circulation. 119, 480-486 (2009).
- Isenberg, B. C., Williams, C., Tranquillo, R. T. Small-diameter artificial arteries engineered in vitro. Circ Res. 98, 25-35 (2006).
- Conte, M. S. The ideal small arterial substitute: a search for the Holy Grail. FASEB J. 12, 43-45 (1998).
- Wang, X., Lin, P., Yao, Q., Chen, C. Development of small-diameter vascular grafts. World J Surg. 31, 682-689 (2007).
- L'Heureux, N., Paquet, S., Labbe, R., Germain, L., Auger, F. A. A completely biological tissue-engineered human blood vessel. FASEB J. 12, 47-56 (1998).
- Niklason, L. E., Gao, J., Abbott, W. M., Hirschi, K. K., Houser, S., Marini, R., Langer, R. Functional arteries grown in vitro. Science. 284, 489-493 (1999).
- Wang, Y., Ameer, G. A., Sheppard, B. J., Langer, R. A tough biodegradable elastomer. Nat Biotechnol. 20, 602-606 (2002).
- Crapo, P. M., Gao, J., Wang, Y. Seamless tubular poly(glycerol sebacate) scaffolds: high-yield fabrication and potential applications. J Biomed Mater Res A. 86, 354-363 (2008).
- Gao, J., Ensley, A. E., Nerem, R. M., Wang, Y. Poly(glycerol sebacate) supports the proliferation and phenotypic protein expression of primary baboon vascular cells. J Biomed Mater Res A. 83, 1070-1075 (2007).
- Murphy, W. L., Dennis, R. G., Kileny, J. L., Mooney, D. J. Salt fusion: an approach to improve pore interconnectivity within tissue engineering scaffolds. Tissue Eng. 8, 43-52 (2002).
- Gao, J., Crapo, P. M., Wang, Y. Macroporous elastomeric scaffolds with extensive micropores for soft tissue engineering. Tissue Eng. 12, 917-925 (2006).
- Wilson, E., Mai, Q., Sudhir, K., Weiss, R. H., Ives, H. E. Mechanical strain induces growth of vascular smooth muscle cells via autocrine action of PDGF. J Cell Biol. 123, 741-747 (1993).
- Leung, D. Y., Glagov, S., Mathews, M. B. Cyclic stretching stimulates synthesis of matrix components by arterial smooth muscle cells in vitro. Science. 191, 475-477 (1976).
- Kim, B. S., Nikolovski, J., Bonadio, J., Mooney, D. J. Cyclic mechanical strain regulates the development of engineered smooth muscle tissue. Nat Biotechnol. 17, 979-983 (1999).
- Yang, J., Motlagh, D., Webb, A. R., Ameer, G. A. Novel biphasic elastomeric scaffold for small-diameter blood vessel tissue engineering. Tissue Eng. 11, 1876-1886 (2005).
- Stankus, J. J., Soletti, L., Fujimoto, K., Hong, Y., Vorp, D. A., Wagner, W. R. Fabrication of cell microintegrated blood vessel constructs through electrohydrodynamic atomization. Biomaterials. 28, 2738-2746 (2007).
- Nieponice, A., Soletti, L., Guan, J., Deasy, B. M., Huard, J., Wagner, W. R., Vorp, D. A. Development of a tissue-engineered vascular graft combining a biodegradable scaffold, muscle-derived stem cells and a rotational vacuum seeding technique. Biomaterials. 29, 825-833 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon