このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
すべてのインフルエンザA型の定量的な分析シンプルなスロットブロットアッセイでユニバーサル抗体を用いたウイルスHemagglutininsとノイラミニダーゼ
* これらの著者は同等に貢献しました
Erratum Notice
要約
シンプルなスロットブロット法は、バイオインフォマティクス解析によって同定された彼らの最も保存された配列を標的とする普遍的な抗体を用いてインフルエンザウイルスのヘマグルチニンとノイラミニダーゼの定量化のために開発されました。この革新的なアプローチは、すべてのウイルスのヘマグルチニンとノイラミニダーゼの定量に有用な代替手段を提供することがあります。
要約
ヘマグルチニン(HA)とノイラミニダーゼ(NA)はウイルスのライフサイクルと防御免疫反応の1,2の誘導に重要な役割を果たすことが知られているインフルエンザウイルスの2つの表面蛋白質である。中和抗体の主要なターゲットとして、HAは現在、インフルエンザワクチンの効力のマーカーとして使用され、一元放射免疫拡散(SRID)3によって測定されます。しかし、対応するサブタイプ特異的抗血清の可用性にSRIDの依存性はすべての新しいワクチンのリリースのための2-3ヶ月の遅延の最小値になります。また、NAにも防御免疫4を誘発するという証拠にもかかわらず、インフルエンザワクチンのNAの量がまだのために適切な試薬や分析法5の欠如に標準化されていません。このように、HAとNA抗原を定量することができるシンプルな代替方法は、Rapid Releaseとインフルエンザワクチンのよりよい品質管理のための望ましいです。
すべての利用可能なインフルエンザのHAとNAの配列における普遍的に保存された領域は、6月7日バイオインフォマティクス解析により同定した。つの保存配列はノイラミニダーゼ、一酵素活性部位に近い(HCA - 2として指定)とで識別されたうちの一方のシーケンスは、(ユニ- 1として指定)、HA、融合ペプチド6の唯一の普遍的に保存さエピトープが同定されたN -末端に他の近くに(HCA - 3として指定)7。これらのアミノ酸配列を有するペプチドを合成し、抗体の産生のためにウサギを免疫するために使用された。 HAのユニ- 1エピトープに対する抗体は、HCA - 2とNAのHCA - 3の領域に対する抗体は、全9 NA亜型を結合することが可能であった間にインフルエンザHA(H1 - H13)の13サブタイプに結合することができた。尿膜タンパク質との交差反応性が検出されなかったことを観察によって証明されるようにすべての抗体は、ウイルス配列に対して顕著な特異性を示した。これらの普遍的な抗体は、特異的抗血清7,8がなくてもインフルエンザワクチンのHAとNAを定量化するためにスロットブロットアッセイを開発するために使用されていました。ワクチンのサンプルは、種々の濃度に希釈した標準品と一緒にスロットブロット装置を用いてPVDF膜に適用した。 HAの検出のために、サンプルと標準は、最初に希釈したトリス緩衝NAの測定のために彼らはこれらの条件としてZwittergent 0.01%を含むTBSで希釈しながら、4M尿素を含有する生理食塩水(TBS)が有意に検出感度を向上した。それぞれの普遍的な抗体でイムノブロットすることによって、HAとNAの抗原の検出に続いて、信号強度はデンシトメトリーにより定量した。ワクチンのHAとNAの量は、使用される参照の種々の濃度の信号強度と確立された標準曲線を用いて計算した。
これらの抗体は、HAまたはNAのユニバーサルエピトープに結合することを考えると、関心のある研究者は、スロットブロット以外のイムノアッセイで研究ツールとしてそれらを使用することができます。
プロトコル
1。試薬と機器の準備
- スロットブロットの手順を開始する前に、トリス緩衝生理食塩水(20 mMトリス、137 mMのNaCl、pH7.6)で(TBS)0.01%の赤血球凝集素、またはHA、スロットブロット、または20_mlsためには、Zwittergentで4M尿素溶液の20_mlsを準備ノイラミニダーゼのためのTBS、またはNA、スロットブロットのソリューション。 4M尿素、毎回新鮮に準備されるべきである一方、のdH 2 Oで10%Zwittergentストック溶液は、室温で少なくとも6ヶ月間安定であり、したがって、各アッセイ前にTBSで0.01%に希釈することができる。
- 最終濃度0.1%にTBS溶液にTween - 20を追加することにより、洗浄バッファーの2000 MLSを準備します。洗浄バッファーで5%w / vの中の最終濃度に脱脂粉乳を(グレード脱脂粉乳をブロッティング)溶解することによりブロッキングバッファー80 MLSを準備します。
- のddH 2 Oですすぎ2分に続いて15秒のためのメタノールでPVDF膜(9 × 12 cmの大きさにあらかじめカットして)、アクティブに使用するまでTBSで膜を浸す。 TBSのバイオドットSFろ紙のプレウェット3枚使用するまで。
2。 HAスロットブロット用のインフルエンザワクチンのサンプルとリファレンススタンダードの調製
テストされるワクチン株に対応する予め定められたHAのコンテンツとインフルエンザワクチンの標準品は生物学的標準および制御のための生物製剤評価研究センター(CBER / FDA、米国)や国立研究所のためのセンターから入手した(NIBSC、英国)とスロットブロットによるHAの定量に使用されています。捜査官はまた、文献9および10に記載されて確立された手順を使用して独自の抗原の基準を作成することができる。
- HA基準抗原とテストワクチンのサンプルの場合:0、0.0938、0.1875、0.375、0.75、1.5、3と6μgのHA / mlの次の濃度に4M尿素/ TBSのHAの基準抗原の株式を希釈する。よく混ぜる。その後、4M尿素/ TBSで科学的な研究目的のためにワクチンの生産者から得られたか、社内で作られた人間が使用するためのテストワクチンのサンプルを希釈し、よく混ぜる。リファレンスの抗原とワクチンのサンプルの重複は実行できますが、三連が好ましい。サンプル濃度が標準曲線範囲内にできるように、各サンプルの3希釈(2倍の差)を準備する。重複を実行するには、各参照抗原またはテストワクチンのサンプルの希釈の450μlのまたは650μlを準備したり、それぞれ三連。一価インフルエンザワクチンは、このスロットブロット法を用いてテストすることができます。参照抗原のHA含有量は、以前にインフルエンザワクチンの準備のために現在使用されている標準テストであるSRIDを使用して決定した。 SRIDによって決定されるHAのコンテンツは、スロットブロット標準曲線用希釈液の調製のための最初の基準抗原の株式のHAの濃度として使用されました。
3。 NAスロットブロット用のインフルエンザワクチンのサンプルとリファレンススタンダードの調製
テストされるワクチン株は生物学的標準および制御のための生物製剤評価研究センター(CBER / FDA、米国)や国立研究所のためのセンター(NIBSC、英国)から得られた結果であり、NAの定量に使用されているに対応するインフルエンザワクチンの参照標準スロットブロットによる。これらの標準試料のNAの内容は、若干の修正10で、9前述した。、デンシトメトリ走査型分析と組み合わせることで、脱グリコシル化試料のSDS - PAGE分析により決定した簡単に言えば、脱グリコシル化ワクチンの基準試料(5μg)をサンプルバッファーと混合し、ゲル上にロードされます。追跡用色素はちょうどSYPRO染色に続いて、ゲルを使い果たすまで、ゲルを約90分間、20 mAで実行されました。タンパク質のデンシトメトリーの定量は、Fluorchemゲルドキュメンテーションシステム(アルファイノテック)を用いて行った。 NAの量は、ローリーアッセイによって決定される全タンパク質のNA蛋白質の比率に基づいて決定されました。この方法を用いて調製した標準試料は、ワクチンメーカーからのワクチンサンプル中のNAの内容の定量化のためにスロットブロットで使用することができます。
- NA基準抗原とテストワクチンのサンプルの場合:0、0.039、0.078、0.1562、0.3125、0.625、1.25、2.5、5および10μgNA / mlの:TBS / Zwittergent以下の濃度を0.01%でNAの基準抗原の株式を希釈する。よく混ぜる。その後、ワクチンの生産者から得られた0.01%Zwittergent / TBSで科学的な研究目的のために社内で行われた人間の使用のためのテストワクチンのサンプルを希釈し、よく混ぜる。リファレンスの抗原とワクチンのサンプルの重複は実行できますが、三連が好ましい。サンプル濃度が標準曲線範囲内にできるように、各サンプルの3希釈(2倍の差)を準備する。重複を実行するには、各参照抗原またはテストワクチンのサンプルの希釈の450μlのまたは650μlを準備したり、それぞれ三連。一価インフルエンザワクチンは、ウィットをテストすることができますHこのスロットブロット法。
4。 PVDF膜上に試料のバイオドットSFの精密ろ過装置及びブロッティングの組立
- 以前掃除して乾燥させたバイオドットSFの精密ろ過装置を組み立てます。真空マニホールドにガスケットサポートプレートを配置し、3はガスケット上のバイオドットSFフィルターの紙のシートを湿らtop.Placeのシールガスケットを配置し、事前に浸したPVDF膜が続きます。膜表面への圧力を均一にアプリケーションを確実にするために斜め交差パターンを用いて膜と指で締めます4本のネジの上にサンプルのテンプレートを置きます。
- 3方弁のみポンプをオンにし、真空を接続する前に、真空源に真空マニホールドを公開するために設定されていることを確認します。
- ポンプの電源を入れ、バイオドット装置に接続します。フローバルブは、次の手順でサンプルの迅速かつ適切に排水するためのサンプルウェルより下のレベルに配置されていることを確認します。
- 斜めの交差パターンを使用してねじ締めの手順を繰り返します。真空が適用されている間ネジを締めると、タイトなシールを保証し、ウェル間のクロスコンタミネーションを防ぎます。
- 空気に吸引マニホールドを公開し、ポンプをオフにするフローバルブを変更してください。
- したがって、抗原の均一な結合を確実に膜を水和するためにマルチチャンネルピペッターを使用して、すべてのウェルにTBSを100μlを適用します。ケアは、均等にスロットをカバーするために、可能な限り底の近くに、気泡の形成を回避するために、十分の途中で解決策を適用するために注意しなければなりません。誤っピペッターチップで導入された空気の気泡が破裂。
- 、空気と真空の両方にマニホールドを公開するポンプをオンにし、軽く真空の量を調節するために空気にさらされたポート上で指を入れて井戸からバッファの内容を排出するために、フローバルブを変更してください。
- とすぐにバッファが完全にすべてのウェルから排水しているとして大気中にマニホールドを公開するために、フローバルブを変更します。ポンプの電源を切ったり、真空を外してください。
- ウェル当たりそれぞれ標準またはワクチンのサンプルの希釈液200μLを適用します。ピペットでサンプルを各ウェルの中央に一度は、、のような気泡を導入しないように注意しながら、できるだけ底部に近い。誤っピペッターチップで導入された空気の気泡が破裂。使用中のウェルに適切な真空を確保するために未使用のウェルにサンプル希釈緩衝液(4M尿素/ TBSまたは0.01%Zwittergent / TBS)の200μlを置く。
- 空気と真空の両方にマニホールドを公開するために、フローバルブを調整します。ポンプ(または真空を再接続)をオンにして、静かにサンプルが完全に空気にさらされたポート上の1つ指で真空の量を制御することにより、井戸から流出させる。とすぐにすべてのサンプルは、排水しているとして、真空を解放するためにポートから指を離します。
- すぐにもマルチチャンネルピペッターを使用して、それぞれにTBSの200μlを加える。空気にさらされたポート上の1つ指で真空の量を制御することで井戸を排出し、洗浄するために穏やかな真空を適用する。
- ステップ4.11で説明した洗浄ステップを繰り返します。井戸は完全に排出しているとすぐに、サンプルテンプレートのネジを緩め、井戸を乾燥を避けるために真空をオフにする。メンブレンを直ちに削除するに進みます。
- ブロッキングバッファーにメンブレンを置き、4℃で一晩インキュベート℃で、穏やかな振盪した。メンブレンを完全にカバーするのに十分なブロッキングバッファーを使用してください。
5。 HAとNA抗原のイムノブロット
- をブロッキングバッファーで一晩インキュベートした後、TBS/0.1%Tween - 20を洗浄バッファーで5分間メンブレンを2回洗浄する。すべての洗浄及びインキュベーションのために、膜が完全に溶液で覆われていることを確認します。
- 穏やかで、室温で1時間のために洗浄バッファーで5%(w / v)のBSAで希釈したHA(そのようなユニ- 1など)またはNA(そのようなHCA - 2またはHCA - 3など)に対する普遍的なウサギ抗体で膜をインキュベートロッキング。最適な抗体濃度は、それぞれの抗体ストックのために決定する必要があります。ウサギ抗血清の1:4000の希釈液は、上記の抗体のための最適な結果を与えた。
- 結合していない一次抗体を除去するために、毎回15分間穏やかに振盪しながら室温で、膜を3回洗浄する。
- HRP結合抗ウサギ二次抗体で膜をインキュベートする。穏やかな振盪し、室温で30分間バッファとインキュベートしてブロッキングサーモImmunoPureヤギ抗ウサギIgG、ペルオキシダーゼ標識抗体の1:50000希釈を使用してください。
- すべての非結合二次抗体を除去する洗浄緩衝液で室温、15分間ごとに時間を揺らし、膜を3回洗浄する。
- 残留Tween - 20を膜表面からの界面活性剤を除去するために穏やかなロッキングで5分間、TBSで膜を洗浄してください。
- 各R 3mlで基板を準備するサーモサイエンティフィックからSupersignal西デュラエース拡張期間の基板キットからeagent、よく混ぜる。
- 優しく余分TBSバッファーを削除するには、乾いたティッシュペーパー上に膜を置きます。
- ドライコンテナに膜を移し、膜全体をカバーするために基板を追加します。室温で、穏やかなロッキングで5分間インキュベートする。
- そっとティッシュペーパーにメンブレンをブロット法により余分な基板を取り外します。
- 化学発光のフィルムに膜をさらす。暴露の長さは信号の飽和を避けるために最適化する必要がありますが、通常10秒から10分の範囲である。
- メーカーの指示に従ってFluorchemゲルドキュメンテーションシステム(アルファイノテック)のようなゲルイメージング装置を使用して開発されたフィルムのデンシトメトリー分析を行います。参照抗原とテストワクチンのサンプルの複製のセットごとに密度の値は、平均化されます。抗原の基準とワクチンのサンプルは重複で実行することができますが、三連が好ましい。複製のための密度の値は非常に似ている必要があります。間に有意差は手順の実行中に可能性の技術的問題を示している複製します。濃度依存標準曲線は、基準の標準から、それぞれのスロットに入れHAまたはNA抗原の量(ngの中の)対平均密度の値をプロットすることによって確立されます。イムノアッセイで適切なキャリブレーションカーブフィッティングを使用すると、正確に、HAとNAを定量化するための非常に重要です。反応曲線の直線部分(y = mx + bの)を使用して、濃度対レスポンス(Y)(x)をプロットして得られた線形回帰は、分析物の定量のための最も簡単な方法です。分析物のより広い範囲が濃度計算のために考慮されている場合は、現在受け入れられているイムノアッセイのための4つのパラメータロジスティック(4PL)モデルを使用する必要があります。ソフトウェアの様々な検討に関心のある研究者のために利用可能です。に記載のスロットブロットアッセイの場合には、x軸の値がログスケールに変換すると、カーブは4 - PLモデルとHAとNAのブロット量を計算するために可変スロープ非線形回帰の使用に合わせすることができますテストワクチンのサンプルが可能である。そこで、日常的に我々の分析のためにこのモデルを使用してください。テストワクチンのサンプルがTBS / Zwittergent前膜にブロットされているの4M尿素/ TBSまたは0.01%のいずれかで希釈されたように、各サンプルの希釈係数は、元のテストのHAとNAの内容を決定するために考慮する必要がありますワクチンのサンプル。それは、各テストのワクチンのサンプルは標準曲線の範囲内に密度の値のいずれかのセットのための順序で3つの様々な希釈(2倍の差)で実行されることが示唆されている。ワクチンのサンプルのすべてのテストされた希釈するための標準曲線の範囲よりも高い密度の値はさらに正確なHAまたはNAの定量に希釈する必要があります。密度の値が曲線の最下端の下にある場合は、試験サンプルは、下の希釈率で希釈してください。
6。代表的な結果:
使用可能なすべてのインフルエンザHAシーケンスのバイオインフォマティクス解析は、HAの唯一の保存領域としてHA2サブユニットのN末端を(融合ペプチド)を確認した。図1は、識別されたコンセンサス配列の各アミノ酸の位置のための省エネルギー率を示しています。つのバリエーションは、HA2の14 N -末端アミノ酸の位置2(L -> I)と12(G -> N)で同定されたが、そのような変動は抗体とペプチド変異体6の間の結合に影響を与えないように発見された。ユニ- 1エピトープ(GLFGAIAGFIEGGW)は、HAに対するユニバーサル抗体を開発するために選ばれました。この抗体は、ウイルス配列のための顕著な特異性を明らかにし、インフルエンザHA(H1 - H13)(図2)の13種類のサブタイプに結合可能です。
同様のアプローチを使用して、二つの普遍保存された配列は、すべてのインフルエンザNAの、N末端(HCA - 3)一つの酵素活性部位(HCA - 2)に近い(図3A)と他の(図3B)で同定された。これらのアミノ酸配列を有するペプチドは、NAに対する普遍的な抗体を生成するための抗原として使用した。両方のエピトープに対する抗体は、NAの全9サブタイプに結合することができたため、ウイルスのNAのシーケンス(図4)に対して高い特異性を示す、尿膜または細胞タンパク質にはほとんど交差反応性を示した。
図5は、インフルエンザHAとNAの定量化のためのスロットブロット法の概要を示しています。
HAとNAの抗原スロットブロット分析の例は図6と図7に示す。図6Aと6Cに示すようにそれぞれのインフルエンザワクチンの参照標準とワクチンのサンプル中のHAの抗原の検出後の代表的な結果。各サンプル(標準またはワクチン)は、隣接する井戸で、二重に実行されました。重複はsimilaを表示する必要があります検出以下のR強度。抗体希釈液、インキュベーションと露光時間の最適化が使用される抗体に応じて必要となる場合があります。
ワクチンのリファレンス標準試料からのHAの種々の濃度の検出後に得られた典型的な検量線の例を図6Bに示されています。 HAの抗原の濃度は、スロットブロットの化学発光検出後の信号強度に比例し、この濃度範囲(0.0938から6μgのHA / ml)のために4 - PLカーブフィッティングモデルに適合します。
図7は、インフルエンザワクチンの参照標準のとワクチンのサンプル中のNAの抗原の検出の代表的な結果を示しています。密度の解析には、スロットブロットによるワクチンの参照標準の種々の希釈でNAの抗原を検出することによって得られる信号の強度がNAの濃度(図7A)に比例することを示した。結果として得られる標準曲線は、図7Bに示すように、この濃度範囲(0.039〜10μgとNA / ml)を、4 - PLモデルに適合。図7cは、インフルエンザワクチンのサンプル中のNAのコンテンツのスロットブロット分析の例を示しています。各サンプルは、隣接するウェル内で、重複してアッセイした。

図1インフルエンザHAの融合ペプチド領域におけるユニ- 1エピトープの保全率。
すべての利用可能なインフルエンザの融合ペプチドは、(HA2サブユニットのN -末端に位置する)HAの唯一の普遍的に保存された領域であることを確認したHAシーケンスのバイオインフォマティクス解析。ポジション2(L -> I)と12(G -> N)二つのバリエーションが6抗体結合に影響を与えないように発見されたことに注意してください。インフルエンザHA(H1 - H13)の結合13の異なるサブタイプに対応できるユニバーサル抗体をUni - 1エピトープ(GLFGAIAGFIEGGW)を使用して開発されました。
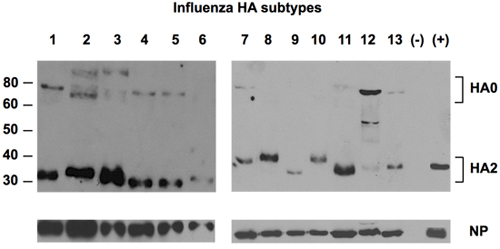
図2。HAに対するユニバーサル抗体によるHAの13亜型の検出。
インフルエンザウイルスは孵化卵の伝播の13のサブタイプの尿液は、HAのユニ- 1エピトープに対するユニバーサル抗体を使用して、HAタンパク質の検出に続いて、SDS - PAGEで分画した。 NPタンパク質は、ポリクローナルウサギNP -特異的抗体を使用してコントロールをロードとして検出されました。ネガティブコントロール( - )は、感染していない卵から尿膜液だった。ポジティブコントロールは、(+)NIBSC、英国からH1の基準の標準でした
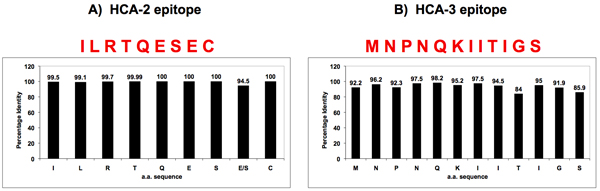
図3。インフルエンザNAの酵素活性部位とN末端 付近の配列相同性。
二つの普遍的に保存された配列は、インフルエンザNAのバイオインフォマティクスによって、酵素活性部位(HCA - 2)の近くに位置する1つ(パネル)、N末端(HCA - 3)(パネルB)で、他に同定された。これらの保存アミノ酸配列を有するペプチドを合成およびNAに対する普遍的な抗体を生成するために使用された。

図4のNA抗体によるNAの9亜型の検出。
インフルエンザウイルスの9つのNA亜型の尿液孵化卵の伝播は、HCA - 2(パネルA)とHCA - 3(パネルB)抗体を使用して、NA蛋白質の検出に続いて、SDS - PAGEで分画した。 NPタンパク質はウサギポリクローナルNP -特異的抗体(パネルC)を使用してコントロールをロードするように検出された。ネガティブコントロール( - )は、感染していない卵から尿膜液だった。ポジティブコントロールは、(+)尿膜液/新Caledonia/20/99のrNA1でスパイクと対応する抗血清でプローブした。

図5。インフルエンザワクチンのHAとNA抗原の定量のためのスロットブロットの手順のフローチャート。
サンプルの希釈のためだけでなく、スロットブロット膜を洗浄し、ブロッキングのために必要なバッファの最初に準備されており、バイオドットSFの精密ろ過装置の組み立てに必要なPVDFメンブレンとろ紙は、事前に浸漬される。インフルエンザワクチンと参照標準サンプルは、スロットブロットによるHAまたはNA検出のための最適なバッファーで希釈されています。バイオドットSFの精密ろ過装置は、メーカーの指示とサンプルをPVDFメンブレンに適用されるにしたがって組み立てられています。 HAとNAの抗原は、それぞれの抗原に対するユニバーサル抗体を用いて検出されます。デンシトメトリー分析は、試験した試料ではHAとNAの定量に得られる化学発光信号で実行されます。
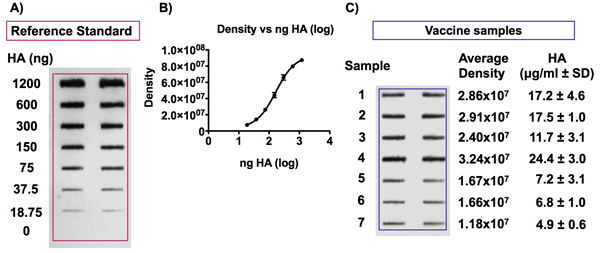
図6。インフルエンザワクチンのサンプル中のHA抗原の検出と参照レンス標準。
パネルは、HAの抗原の免疫後に得られた代表的なブロットを示しています。 HAの参照抗原は0から6μgのHA / mlからの濃度に希釈し、ワクチンはバイオドットSFの精密ろ過装置でPVDF膜に適用される前に、4M尿素/ TBS 0.375μgのHA / mlの濃度に希釈した。 HAの抗原は、ユニ - 1ユニバーサル抗体を用いて検出した。パネルBは、ワクチンの参照標準から様々なHA濃度の信号を検出することにより得られた標準曲線の例を示しています。信号強度は、HAの濃度に比例し、曲線は4 - PLモデルに適合。
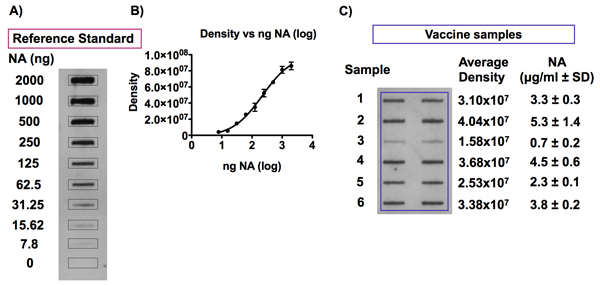
図7。インフルエンザワクチンのサンプルとリファレンスの標準のNAの抗原の検出。
パネルAとBのショーの担当者は、0.01%Zwittergent / TBSとトメトリー分析は、次の結果4 - PL標準曲線に0〜10μgのNA / mLの範囲のNAの濃度に希釈したインフルエンザワクチンの参照標準のNAの検出後に得られた信号。インフルエンザワクチンのサンプル中のNAの抗原のスロットブロット分析は、次の検出された典型的な化学発光シグナルの例は0.01%Zwittergent / TBSで1μgのHA / mlの濃度に希釈されたパネルC.インフルエンザワクチンのサンプルに示されていると上にブロットしたバイオドットSFの精密ろ過装置を用いてPVDF膜。 0〜2.5μgのNA / mlの濃度範囲に対応するワクチンの参照標準の希釈は、ワクチンのサンプル中のNAの抗原の定量のための標準曲線を確立するために、同じブロットに含まれていた。得られた発光信号のNAと密度測定分析に対してHCA - 2ユニバーサル抗体が実行されたとNAの抗原が検出されました。各ワクチンのサンプル中のNAの量は、ワクチンの参照標準のためのNAの濃度に対して信号の強度値をプロットして得られた4 - PL標準曲線に対して計算することができます。
ディスカッション
これら2つの表面のタンパク質が免疫応答の6-11を誘発する最も重要なウイルス成分なので、インフルエンザウイルスのHAとNAの定量は、ワクチンの研究開発にとって重要です。これらのタンパク質の検出のための以前に報告された免疫学的方法は、歪みの特定の抗体が必要です。抗体は彼らの唯一の普遍的に保存されたエピトープ6-8を認識するので、HAとNAの抗原ここで説明を?...
開示事項
謝辞
著者は、原稿の編集審査のために夫人モニカTocchiに感謝したいと思います。 AMHは、カナダにおけるサウジアラビアの文化局を通じて、キングアブドゥルアジーズ大学からの奨学金によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| 試薬や機器の名前 | 会社 | カタログ番号 | コメント |
|---|---|---|---|
| バイオドットSFの精密ろ過装置 | Bio - Rad社 | 170-6542 | |
| バイオドットSFフィルターペーパー | Bio - Rad社 | 162-0161 | |
| イモビロン- FLトランスファーメンブレン(PVDF) | ミリポア | IPFL00010 | |
| 真空ポンプ | ミリポア | WP6111560 | |
| 化学発光Biomaxのライトフィルム | コダック | 178 8207 | |
| FluorChemゲルドキュメンテーションシステム | アルファイノテック | 29から008 - 1896X | |
| HAとNAの抗原に対する普遍的なウサギ抗体 | UNI - 1(HA)HCA - 2、HCA - 3(NA) | 抗体は、MTAを介して入手するか、以前に6,7を説明した手順にしたがって興味のある研究者によって生成することができます。 | |
| インフルエンザワクチンの基準抗原 | CBER / FDAまたはNIBSC | ||
| インフルエンザワクチンのサンプル | ほとんどの国で一般的に使用可能 | ||
| 尿素 | シグマアルドリッチ | U1250 | |
| Zwittergent 3月14日洗剤 | カルビオケム | 693017 | |
| Tween - 20を | フィッシャーサイエンティフィック | BP337 - 500 | |
| ブロッティンググレードブロッカー脱脂粉乳 | Bio - Rad社 | 170-6404 | |
| ImmunoPureヤギ抗ウサギIgG(H + L)、共役ペルオキシダーゼ | サーモサイエンティフィック | 31460 | |
| SuperSignalウエストデュラエース拡張期間の基板 | サーモサイエンティフィック | 34075 |
参考文献
- Webster, R. G., Bean, W. J. Genetics of influenza virus. Annu Rev Genet. 12, 415-431 (1978).
- Skehel, J. J., Wiley, D. C. Receptor binding and membrane fusion in virus entry: the influenza hemagglutinin. Annu Rev Biochem. 69, 531-569 (2000).
- Wood, J. M. The influence of the host cell on standardisation of influenza vaccine potency. Dev Biol Stand. 98, 183-188 (1999).
- Sylte, M. J., Suarez, D. L. Influenza neuraminidase as a vaccine antigen. Curr Top Microbiol Immunol. 333, 227-241 (2009).
- Bright, R. A., Neuzil, K. M., Pervikov, Y., Palkonyay, L. WHO meeting on the role of neuraminidase in inducing protective immunity against influenza infection. Vaccine. 27, 6366-6369 (2008).
- Chun, S. Universal antibodies and their applications to the quantitative determination of virtually all subtypes of the influenza A viral hemagglutinins. Vaccine. 26, 6068-6076 (2008).
- Gravel, C. Qualitative and quantitative analyses of virtually all subtypes of influenza A and B viral neuraminidases using antibodies targeting the universally conserved sequences. Vaccine. 28, 5774-5784 (2010).
- Li, C. A simple slot blot for the detection of virtually all subtypes of the influenza A viral hemagglutinins using universal antibodies targeting the fusion peptide. Nat Protoc. 5, 14-19 (2010).
- Harvey, R., Wheeler, J. X., Wallis, C. L., Robertson, J. S., Engelhardt, O. G. Quantitation of haemagglutinin in H5N1 influenza viruses reveals low haemagglutinin content of vaccine virus NIBRG-14 (H5N1). Vaccine. 26, 6550-6554 (2008).
- Li, C. Application of deglycosylation and electrophoresis to the quantification of influenza viral hemagglutinins facilitating the production of 2009 pandemic influenza (H1N1) vaccines at multiple manufacturing sites in China. Biologicals. 38, 284-289 (2010).
- Johansson, B. E., Pokorny, B. A., Tiso, V. A. Supplementation of conventional trivalent influenza vaccine with purified viral N1 and N2 neuraminidases induces a balanced immune response without antigenic competition. Vaccine. 20, 1670-1674 (2002).
- Hashem, A. Universal antibodies against the highly conserved influenza fusion peptide cross-neutralize several subtypes of influenza A virus. Biochem Biophys Res Comm. , (2010).
Erratum
Formal Correction: Erratum: Quantitative Analyses of all Influenza Type A Viral Hemagglutinins and Neuraminidases using Universal Antibodies in Simple Slot Blot Assays
Posted by JoVE Editors on 11/13/2012. Citeable Link.
An author's affiliation was omitted from the publication of Quantitative Analyses of all Influenza Type A Viral Hemagglutinins and Neuraminidases using Universal Antibodies in Simple Slot Blot Assays.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved