Method Article
精巣カプセル内奇形腫の発生
要約
ヒト多能性幹細胞(hPSCs)は、様々な疾患の無数を治療する可能性があります。これらの細胞のユーティリティは、身体内の任意の細胞型に分化することができるという事実にある。ここではhPSCsのpluripotenceを実証するために使用される奇形腫アッセイを、説明します。
要約
多能性幹細胞(PSCの)彼らはすべての3つの胚葉由来の細胞に分化することができるユニークな特性を持っています。これは、それらのさまざまな疾患の治療のための潜在的に貴重なツールとなっています。ヒト胚性幹細胞(ヒトES細胞)の誘導多能性幹細胞(性IPSC)と継続的な研究の出現により、特定の細胞株は多能性であることを示すことができるアッセイの必要性がある。生殖系列伝達は、マウス胚性幹細胞(MESC)線1,2,3のpluripotenceを実証するためのゴールドスタンダードとされています。このアッセイを使用して、研究者は、MESCラインが生殖細胞4を含む胚内のすべての種類の細胞を作ることができることを示すことができる。ヒトESCが生殖系列伝達のためにテストすることはできませんので、人間のESC線5,6の生成では、これらの細胞のpluripotenceを証明するために適切なアッセイは不明であった。代理として、奇形腫アッセイは現在pluripotを実証するために使用されているヒト多能性幹細胞のency(hPSCs)7,8,9。このアッセイは最近、精査の下に来ており、新しい技術が積極的に検討されていますが、奇形腫アッセイは、現在のゴールドスタンダードは7です。このアッセイでは、問題の細胞は、免疫妥協マウスに注入される。細胞は多能性である場合、奇形腫は、最終的に開発し、腫瘍のセクションでは、全3胚葉10からの組織が 表示されます。奇形腫アッセイでは、hPSCsは、マウスのさまざまな領域に注入することができます。皮下又は筋肉内11のいずれか、または足に、最も一般的な注射部位は精巣カプセル、腎臓被膜、肝臓が含まれています。ここでは、腫瘍の成長のためのサイトとして精巣カプセルを使用してhPSCsから奇形腫を生成するための堅牢なプロトコルを記述します。
プロトコル
注:すべての動物の手順はIACUCまたは同等の承認を得なければならない。
すべての手術用機器は、手術前に滅菌しなければならない。滅菌手袋、ドレープとガーゼを使用する必要があります。
1。手術前の準備
- 6週齢ハツカネズミCbySmn.CB17-Prkdc SCID / J雄マウスまたはマウスの他の免疫不全の株を取得します。
- すべての手術器具、手袋、ガーゼを滅菌する。
- accutaseを注入するhPSCsを解離させる。
- 細胞をカウントし、DMEM/F-12で1:1に希釈したマトリゲルで20から30μLあたり1,000,000細胞を再懸濁します。終了するまで氷上で細胞を維持する。
- しばしばそれはトリパンブルーが注入され、実験の経由実行を行うことが有用であることに注意してください。これは、任意のセルが浪費される前に潜在的な問題を特定するのに役立ちます。
- ビバリウムで、あなたの機関で受け入れられた手順に従って、マウスを麻酔。我々の実験で、我々はanesthを使用しイソフルランとESIAマシン。マウスは、最初に1L/min酸素と3から4パーセントイソフルランで誘導チャンバーに入れた。一度麻酔をかけ、1L/min酸素と2から3パーセントイソフルランとノーズコーンが使用されています。
- 腹部の中心から開始して外側へ時計回りに働く、バリカンで腹部を剃り、マウスの腹部の前壁を清掃してください。最初の使用ポビドンヨード溶液を、次いで70%エタノールで洗浄する。綿棒を毎回変更し、3回繰り返します。組織培養や解剖フード内部の動物は暖かい保つために加熱パッドに動物を転送します。
- ちょうど股関節のレベル以下の滅菌外科用はさみで皮膚と腹膜を介して1センチメートル縦切開を行います。
- 鉗子で腹膜を保持したまま、別の滅菌forceptで右股関節に向かって到達し、添付の精巣と一緒に白い脂肪組織を引き出します。
- 滅菌ガーゼで精巣を配置します。
- ツベルクリンまたはハミルトン(1CC)をシリンジwiを埋めるhPSCsが注入される回。それはあなたがそのようなWA09(またH9)として知ら多能性であることがわかっているコントロールhPSC行を含めることをお勧めであることに注意してください。このようにあなたがあなたの注射や手術は、欠陥があったかどうかを判断するために使用できるポジティブコントロールを持っています。
- ゆっくり精巣カプセルが膨潤し始めた場合、停止、すべての主要な血管から離れた精巣カプセルの中心にhPSCs(20-30μL)を注入します。
- 細胞の逆流を防ぐために徐々に針を外します。
- 鉗子を用いて、腹部の元の位置に精巣と脂肪組織のバックを転送します。
- 2または3 reabsorbable縫合糸で腹膜を閉じて、オートクリップで皮膚を閉じます。
- マウスは1〜2日1日2回、それが回復するまで保温し、手術後に(あなたのビバリウムで受け入れられているものを参照してください)鎮痛剤のいくつかのフォームを与えられるべきである。
と麻酔も鎮痛剤のいずれも腫瘍の発達を妨げることに注意してください。 - モニター番目6-12週間の腫瘍成長のためのeの動物。非常にまれに、腫瘍は前に6週間、注射後のサイズは5mmに成長しないかもしれません、したがって、それは動物を監視することが重要です。この問題が発生した場合、動物を安楽死させ、腫瘍が処理され、いつものように分析する必要があります。
- 腫瘍が触知され、サイズも約5ミリメートルに達すると、マウスを麻酔し、受け入れた動物プロトコルの手順に従って、それを生け贄に捧げる。
- それに応じて腫瘍やドキュメントを削除 - 写真、メジャーサイズ、重量を量る。
- 小さな部分に腫瘍を切り取り、4%パラホルムアルデヒド溶液で固定します。サンプルまでの4%パラホルムアルデヒドでストアが切片、染色と分析のために病理学者に送信されます。
2。代表的な結果:
このプロトコルが実行されると前述のように、注入された細胞株は多能性であり、明白な、視覚的に明らかな腫瘍は最大で12週間以内に形成されなければならない。 WA09のような確立されhPSC行のために、私たちは一般的に参照してください。6週間以内に腫瘍。 IPSCの行のためには8-10週間以内に腫瘍を見ることも珍しくありません。これにより、プロシージャが正しく実行されていることを確認するために、ポジティブコントロールとして、多能性であることが知られている行をマウスに注入することが非常に重要です。腫瘍は通常、非常に不均一を見て、多くの添付嚢胞(図1)を持っています。病理医による腫瘍サンプルの分析はすべての3つの胚葉(図2)から分化した組織が表示されるはずです。
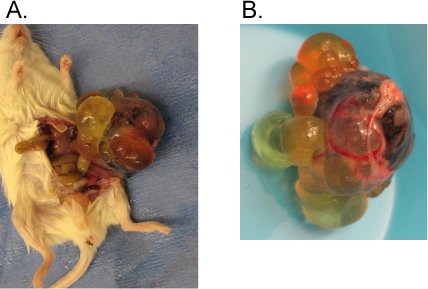
図1精巣カプセルの典型的なhPSC派生した奇形腫。
記述されたプロトコルに続いて、100万WA09細胞は、免疫妥協マウスの精巣カプセルに注入した。 6週間後に奇形が観察された。 A)奇形は、マウスから引き出された。 B)奇形腫の画像をクローズアップ。異質性と嚢胞構造を注意してください。

2。奇形腫から、ヘマトキシリンおよびエオシン染色した切片は、それぞれの胚葉由来の組織を示す図 。
固定後、奇形腫は、断面のヘマトキシリンおよびエオシンで染色した。病理学者による分析は、3つの胚葉のそれぞれからの細胞の存在を明らかにした。
ディスカッション
ここで紹介する方法は、精巣カプセルでhPSCsから奇形を発生させる信頼性の高い、簡単な手段を提供します。この手法では、いくつかの重要なパラメータがあります。特に、それはコントロールとして多能性であることが知られているhPSC細胞株を注入することが重要です。他の重要なパラメータは、注入し、腫瘍の観測の間の時間間隔が含まれています。 WA09のような細胞株では、奇形腫は6-8週間で観察されるべきである。新しいIPSCの行のために私たちはしばしば、10週間が必要とされることがわかります。もう一つの懸念は、注入された細胞の数です。我々は100万セルを挿入しますが、このアッセイは、簡単に少ない細胞で行うことができます。さらに、注入媒体は重要である。我々は、PBSまたはDMEM/F-12とは対照的に、細胞は、マトリゲルとDMEM/F-12の1:1混合物に注入されたとき我々は最良の結果を得ることがわかります。
開示事項
利害の衝突が宣言されません。
謝辞
この作品は、CIRM助成金#TR-1250、RT1-01108、およびCL1-00502によって資金を供給された。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | |
| Accutase | インビトロジェン | A1110501 | |
| DMEM/F-12 | インビトロジェン | 113300-032 | |
| マトリゲル | BDバイオサイエンス | 354277 |
参考文献
- Bradley, A., Evans, M., Kaufman, M. H., Robertson, E. Formation of germ-line chimaeras from embryo-derived teratocarcinoma cell lines. Nature. 309, 255-255 (1984).
- Evans, M. J., Kaufman, M. H. Establishment in culture of pluripotential cells from mouse embryos. Nature. 292, 154 (1981).
- Martin, G. R. Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells. Proc. Natl. Acad. Sci. U. S. A. 78, 7634-7634 (1981).
- Downing, G. J., Battey, J. F. Technical assessment of the first 20 years of research using mouse embryonic stem cell lines. Stem Cells. 22, 1168-1168 (2004).
- Thomson, J. A. Embryonic stem cell lines derived from human blastocysts. Science. 282, 1145-1145 (1998).
- Reubinoff, B. E. Embryonic stem cell lines from human blastocysts: somatic differentiation in vitro. Nat Biotechnol. 18, (2000).
- Muller, F. J., Goldmann, J., Loser, P., Loring, J. F. A call to standardize teratoma assays used to define human pluripotent cell lines. Cell Stem Cell. 6, 412-412 (2010).
- Brivanlou, A. H. Stem cells. Setting standards for human embryonic stem cells. Science. 300, 913-913 (2003).
- Lensch, M. W., Schlaeger, T. M., Zon, L. I., Daley, G. Q. Teratoma formation assays with human embryonic stem cells: a rationale for one type of human-animal chimera. Cell Stem Cell. 1, 253-25 (2007).
- Gertow, K. Organized development from human embryonic stem cells after injection into immunodeficient mice. Stem. Cells. Dev. 13, 421-421 (2004).
- Gertow, K. Isolation of human embryonic stem cell-derived teratomas for the assessment of pluripotency. Curr Protoc Stem Cell Biol. Chapter 1, Unit1B 4-Unit1B 4 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved