このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
チップ上Lensless蛍光顕微鏡
要約
lenslessオンチップの蛍光顕微鏡のプラットフォームは、復号アルゴリズムに基づいて圧縮サンプリングを使用して<4μmの分解能を持つなどの超広角視野上の画像蛍光灯のオブジェクトを、> 0.6〜8平方センチメートルことが実証されている。このようなコンパクトで広視野蛍光のオンチップイメージングモダリティは、高スループットサイトメトリー、希少細胞研究とマイクロアレイ解析のための貴重な可能性があります。
要約
一般にオンチップlenslessイメージングは、特にハイスループットスクリーニングアプリケーション向けに、よりシンプルでコンパクトなデザインでかさばるレンズベースの光学顕微鏡を置き換えることを目指しています。この新たな技術プラットフォームは、小説の理論とデジタル再構成アルゴリズムの助けによってかさばるおよび/または高価な光学部品の必要性を排除される可能性があります。同じ線に沿って、ここで我々はどんなレンズを使用せずに0.6〜8センチメートル2 <超ワイドな視野(FOV)以上4μmの空間分解能>例えば、達成することができるオンチップの蛍光顕微鏡のモダリティを示す、機械的な走査または薄膜ベースの干渉フィルタ。この手法では、蛍光励起はインコヒーレントな光源で照らされたプリズムまたは半球状のガラスインタフェースを介して実現されます。オブジェクト全体のボリュームと相互作用した後、この励起光は、全内部反射(TIR)のサンプルのマイクロ流体チップの底部に発生しているプロセスによって拒否されます。励起されたオブジェクトからの蛍光発光は、光ファイバフェースプレートやテーパーによって収集され、電荷結合素子(CCD)などの光センサアレイに配信されます。圧縮サンプリングベースのデコーディングアルゴリズムを使用することにより、サンプルの買収lensfree生の蛍光イメージが急速に例を生成するために処理することができる、0.6〜8センチメートル2 <のFOV以上4μm解像度>。また、垂直などで区切られているマイクロチャネルを積み重ね、50〜100μmのも成功し、さらにこのモダリティの全体のスループットを増加させる同じlensfreeオンチップの顕微鏡のプラットフォームを、用いて画像化することができます。このコンパクトなオンチップの蛍光イメージングプラットフォームは、その背後に急速圧縮デコーダで、高スループットサイトメトリー、希少細胞研究やマイクロアレイ解析のためにむしろ価値がある。
プロトコル
このセクションでは、我々のlenslessオンチップの蛍光顕微鏡のプラットフォーム1-4の実験方法を検討します。この技術の能力を実証するために、我々は、蛍光微粒子および標識された白血球のためのオンチップイメージング結果が表示されます。ここでは説明しませんが、同じlensfree蛍光顕微鏡のプラットフォームはまた、トランスジェニックC.などの画像小型のモデル動物に使用することができます線虫サンプル 3。
1。 Lenslessオンチップイメージングプラットフォームの設計
私たちのlenslessオンチップイメージングプラットフォームは、デジタルセンサアレイ(例えば、CCDチップ)、インコヒーレント光源、プリズム、吸収フィルター、光ファイバーフェースプレートまたは光ファイバテーパを含むいくつかの光学部品で構成されています。図1に示すように、これらのコンポーネントは、任意のレンズを、機械的なスキャナまたは薄膜ベースの干渉フィルタを使用せずに、チップ上に大規模なサンプル量の蛍光イメージングを実現するためのマイクロ流体デバイスが組み込まれます。
- デジタルセンサアレイ:私たちのlenslessイメージングの設定は、ターゲットのマイクロオブジェクトから蛍光発光を記録するために光センサアレイを利用しています。と相補型金属酸化膜:このプラットフォームでは、蛍光シグナルを検出するため、センサアレイの異なるタイプがこのようなCCDを(KAF - 8300、KAI - 11002、KAF - 39000、コダックからのすべての例、モデル)として、使用することができます。 - 半導体イメージャ(CMOS、例えば、モデル:MT9T031C12STCD、マイクロンテクノロジーから)。これらのセンサーアレイのための関心の重要なパラメータは、ピクセルサイズ(例えば、5.4ミクロン、9ミクロン、KAF - 8300 6.8μmおよび3.2μmの、KAI - 11002、それぞれKAF - 39000とMT9T031C12STCD、)とアクティブイメージングの領域(含まれていますそれぞれKAF - 8300、KAI - 11002、KAF - 39000とMT9T031C12STCD用など、2.4 cm 2で 、8 cm 2で 、18 cm 2および32ミリメートル2)。 CMOSセンサーは、比較的安価で軽量設計(例えば、フィールドの使用のため)のために優先することができますがlensfreeオンチップのイメージングのために、CCDセンサーは、より高いスループット(より広いアクティブエリア)と優れた感度を達成することが好ましい一般的にすることができます。
- 光源:私たちのプラットフォーム、インコヒーレント光の源、例えば、単純な発光ダイオード(LED、例えば、Thorlabs、M455L2 - C2とLEDD1Bから)、で、蛍光励起用に使用することができます。図に示すように実験的なアップセットで。 1,1 mmのコアサイズを持つマルチモード光ファイバケーブル(Thorlabs、BFH37 - 1000)は、LED光源(どんなレンズまたは結合光学系を使用せずに)に突合せ結合され、励起光は、その後に配信されます。この光ファイバの出口開口部を介してサンプルボリューム。このシステムでは、蛍光励起の必要な電力レベルでは、照明光の出口で> 2〜8センチメートル2のFOVのために〜0.2〜5 mWの前後となるはずですが、LEDは出力〜5mWの- 1Wのことができるようになります。突合せ結合のアプローチとして、パワーレベルは、光ファイバの出力で励起パワーを低下させる大幅に非可逆です。様々な色素の励起を達成するために、異なる色のLEDは、光ファイバカプラを用いて多重化することができます。
オンチップの蛍光イメージングに加えて、同じサンプルのlensfreeホログラフィックの透過画像は、図に示すように垂直方向の照明源を利用することによってこのプラットフォームで得ることができる。 2。蛍光励起光とは異なり、ホログラフィック画像取得のために、より小さなコアサイズ(例えば、〜50から400ミクロン)を持つ別の光ファイバケーブルは、別のLED光源(Mightex、FCS - 0625から000)に結合したお尻です。それが試料に伝播するにつれ、この垂直方向の照明光は、ファイバ端を終了した後、部分的な空間コヒーレンスを取得し始めます。この空間的にコヒーレント領域の径は、光が通過すると光ファイバの出口開口部の大きさに反比例することが距離に比例する。限り、試料面でのこの空間的コヒーレンスの直径がセンサー面における各試料の回折のサイズよりも大きいとして、各オブジェクトからの散乱光は、忠実に、サンプルのインラインホログラムlensfreeを作成し、背景光の妨げになることがあります。これらの買収lensfreeホログラムは、その後急速に5月7日のサンプルボリュームの伝送明視野像を再構成するために反復位相回復手法を使用して処理することができます。このホログラフィック照明の終わりのための、より長い波長のLED励起光を遮断するために使用される吸収フィルターは、例えば典型的なカットオフ波長を持つハイパスフィルタであるため(すなわち、〜625から700ナノメートル)、500 - 600nmの選択されています、これは問題のないインライン試料のホログラム伝送の取得を可能にします。 - 他の光学部品:このオンチップの蛍光顕微鏡のプラットフォームでは、2つの異なる励起のフィルタリング方法を図2に示すように、必要な暗視野背景を作成するために並列で使用されています。最初に、ガラスのプリズム(例えば、エドモンド光学、菱形または鳩プリズム)またはガラス半球は、対象のサンプルをホストするマイクロ流体チップの底面に総内部反射を(励起光)を作成するために使用されます。これと並行して、安価な吸収フィルター(例えば、Roscoluxから)TIRのプロセスに従わない場合、弱い散乱の励起光を除去するために使用されます。これらの2つのメカニズムを使用して励起の成功拒絶されると、サンプルの唯一の蛍光発光が検出器面に取得されます。放出される蛍光信号の一定割合が、また同じインターフェイスでTIRを経験することをここで注意してください。蛍光線の残りの部分は依然としてことながら、これほど高い検出開口上の唯一の斜め線は、マイクロチップ内に閉じ込められたままになるように〜1.0〜イメージングアプローチ - チップ上しかし、この唯一の制限本lensfreeの検出開口数、そのピクセルでサンプリングするセンサーアレイのアクティブな領域をヒット。
蛍光発光の方向性、そのため急速に発散していないので、このような大規模な検出開口数にもかかわらず、センサーアレイで生の蛍光スポットは(例えば、〜150から200ミクロン)かなり広範囲になる。エンジニアとよりよい制御たちlenslessプラットフォームでこの蛍光シグナルの拡散空間的に、我々は、オブジェクトとの間に配置された平面光学部品、すなわち、光ファイバフェースプレート(例えば、エドモンドオプティクス、NT55 - 142)、利用センサー面。光ファイバーフェースプレートは他に、デバイスの一方の側から光強度の情報を伝送する光ファイバケーブルの2次元配列で構成されています。私たちのlensfreeにおけるその主な機能は、オンチップの顕微鏡のセットアップカップルに部分的にlensfree蛍光点を絞り込むことができますそれぞれの繊維内に拡散の空間がない状態で移動するガイド付きの光学波にサンプル量からの蛍光発光、の自由空間モードです。オブジェクトと検出器の平面間の広がり関数(PSF)。これはさらに私たちの信号対雑音比(SNR)だけでなく、私たちのlenslessプラットフォームを使用して達成することができる空間分解能を向上させます。
正規の前面プレートに代わるものとして、我々はまた、私たちのオンチップイメージングプラットフォームで底部に較べてその上部端面上に光ファイバケーブルのかなり大きい密度を持っている"テーパー"光ファイバーフェースプレートを利用することができます。このようなテーパーフェースプレートは、私たちはより良いPSFを達成する助けにはならないだけでなく、私たちは、例えば、<4μmにダウン私たちのlensless分解能を向上させるために役立つている、さらに(例えば、> 2 - 3X)私たちのプラットフォームで倍率を導入することができます。我々はまた、例えばの削減を構成することができる定期的なフェースプレートベースのイメージングシステムに比べると約8 cmから、導入された倍率の少なくとも二乗で減少するようなテーパーデザインの視野ことに注意してくださいテーパー付きダウン<2 cm 2から:最初に2 FOV(KAI - 11002 CCD)。
最後に、我々はまた、光ファイバフェースプレートやテーパーの使用は、光ファイバアレイ3の種々の光学モードのサンプルのlensfreeホログラムを歪めることに注意してください。検出器アレイでのこのような歪んだlensfreeパターンはまだ透過画像のホログラフィック再構成のため、特定のサイトメトリーの関係のアプリケーションのための便利ですが、光ファイバアレイ(例えば、フェースプレートまたはテーパー)には、オンチップアセンブリから削除する必要があります蛍光灯モード3でわずかに減少した空間分解能のコストで。 - マイクロ流体チップ:私たちのプラットフォームで使用されているマイクロ流体チップは、オンチップのイメージングに必要なマイクロチャネルを作成するスライドガラス上に置かPDMS(ポリジメチルシロキサン)の壁を使用して製造されています。これらのマイクロ流体チャネルを作製するためには、以下のレシピを追求。
- PDMS AとBのエラストマーは、均一に混合および1:10の体積比で攪拌されています。
- この不均一溶液をペトリ皿に注がれると、それが2時間65℃で硬化させる。
- X - actoのナイフを使用して、マイクロ流体チャネルの壁の必要なサイズと形状は、ペトリ皿から抽出されます。
- デバイスの接合は、カバースライドガラスとPDMSの接合面積の両方を公開する必要がある高周波プラズマ発生装置(エレクトロテクニックプロダクツ(株)、BD - 10AS)を、使用することによって達成される。
- このプラズマ処理した後、デバイスは70〜40〜50分のためのオーブン内に配置される℃の接合を強化する。
- lenslessオンチップの顕微鏡プラットフォームの組み立てと配置:
私たちのlensfreeオンチップイメージングプラットフォームのための組立手順は、次のように詳述することができます。- 光電子センサーアレイのカバーガラスに削除されます。
- 真空ペン(エドモンドオプティクス、NT57 - 636)を使用して、薄い吸収フィルターを穏やかに、検出器、アクティブ領域の上に配置されます。
- 光ファイバーフェースプレートやテーパーは、この吸収Fの最上位に位置しているILTER。
- 作製したマイクロ流体チップは、直接光ファイバアレイの上に配置されます。
- ガラスのプリズムまたは半球は、インターフェイスの屈折率がガラスの屈折率に整合しているような屈折率整合油を(Cargille、液浸オイル300シリーズ)を使用してマイクロ流体チップの上に組み立てられています。
- サイドの照明繊維が近いプリズムへ移動される(または半球)と、その角度は、その全体の内部反射がマイクロ流体チップの底面の基板に対応するガラスと空気の界面で行われるように調整されます。垂直照明は(lensfree伝送イメージングのための)検出器アレイに垂直に整列され、所望の視野に集中しています。
- 面と垂直光源が順次蛍光イメージングと同じオンチッププラットフォームを使用して明視野透過イメージングの両方を達成するためにオン/オフされています。
- Lensfree生のイメージは、PC(例えば、3.2 GHzのプロセッサ、インテルCore)を介して、カスタム開発のLabVIEWインタフェースを使用して取得されます。
2。サンプル準備
我々はそのlensfreeシステムのポイントスプレッド関数(PSF)を測定することによって、私たちのイメージングプラットフォームを校正する(例えば、Invitrogen社、Fluospheres)蛍光マイクロビーズを使用していました。この初期のPSFの測定が行われた後、様々な細胞や小さなモデル動物(例えば、トランスジェニック線虫サンプル)同じオンチッププラットフォームを用いて画像化することができます。
次のサブセクションから始めて、我々はサンプル調製手順のさらなる詳細を提供します。
- 蛍光マイクロビーズ:
- 生の蛍光ビーズのソリューションは、試料の濃度を最適化するために、DI水で結合されます。
- 蛍光ビーズ溶液の約10μLをそれぞれ40μL、5 mLの、とは10μm、4μmのと2μmの直径のビーズ用のDI水20mL、と混合される。互いに異なるビーズ溶液を混合することにより、必要に応じて様々なビーズ(例えば、非蛍光性及び蛍光)の異種のソリューションが用意されています。
- 最後のサンプル溶液を鋭い注射針(フィッシャーサイエンティフィック、BD PrecisionGlide針、14から826シリーズ)を使用してサイドPDMSの壁からマイクロ流体チップに注入されます
- 白血球細胞標識:
- 〜100μLの全血の量は、赤血球の細胞溶解バッファー(eBioscience社)の〜1mLで混合される。
- 〜3分間インキュベーション後、溶解した血液溶液を遠心分離され、ペレットの層は、PBSの〜200μL(リン酸緩衝生理食塩水)に再懸濁する。
- 蛍光色素と細胞の核酸を標識するために、1mMのSYTO 16の5μLをサンプルに、暗所、室温で〜30分間インキュベートされた後、再懸濁の200μLに追加されます。
- 番目の遠心分離上清が、非結合色素からの蛍光発光によるバックグラウンドノイズを減少させるために削除されるこの標識された試料に適用されます。
- 白血球細胞ペレット層を(例えば、図7を参照)lensfreeオンチップ蛍光イメージングのためのマイクロ流体チップへのデータ転送が可能PBSに再懸濁する。
3。後天lensless蛍光画像のデジタル処理
このlenslessイメージングプラットフォームでは、二つの異なるアルゴリズムは、デジタルシステムの分解能、すなわちルーシー-リチャードソンのデコンボリューションとデコーディングに基づいて圧縮サンプリングを高めるために使用されます。これらのデジタル処理の方法を使用することにより、我々は(図を参照してください。5-6)密集ビーズペアを解決することによって、それぞれのアプローチで達成可能な分解能の向上を定量化した。再構成されたlensfree蛍光画像は、確実に蛍光シグナルの波長の事前知識を必要とするマイクロオブジェクトの自然な色を強調するために(必要に応じて) 疑似できる限りカラー(例えば、RGB:赤-緑-青のCCD / CMOS)センサーチップが使われます。これらのデジタル処理の方法の場合は、独自に開発したアルゴリズムは、(例えば、3.2GHzのプロセッサ、インテルCore)のCPUを必要とするために使用されます。潜在的に、次世代グラフィックスプロセッシングユニット(GPU)も高速に処理を使用することができる。必要に応じて画像処理に加えて、、デコードされた蛍光のオブジェクトは自動的にオンチップメトリーアプリケーション用のカスタム開発のインタフェースを(図8参照)を使用して計数することができる。
- システム点広がり関数(PSF)の測定:
前の解像度の向上(そのようなデコンボリューションや圧縮デコードなど)の任意のデジタル処理するために、オンチップシステムのインコヒーレント点広がり関数は、孤立した小さな蛍光によって作成されたいくつかの測定lensfree蛍光パターンを平均することによって達成できる、推定する必要があるセンサーチップから一定の高さにあるビーズ。これらの個々の蛍光パターンは、適切な強度の正規化の1,2の後に平均化する質量の座標の彼らの中心に対して整列されています。この平均lensfreeパターンはその後、私たちのオンチップ顕微鏡の蛍光点広がり関数として使用することができます。 - ルーシー-リチャードソンのデコンボリューション1:デジタル我々のプラットフォームの空間分解能を向上させるために、我々は加速ルーシー-リチャードソンのアルゴリズム8-10に生取得した蛍光像と測定支離滅裂点広がり関数を養う。ベイズの定理を適用することにより、ルーシー-リチャードソンのアルゴリズムは、反復的に物体面8,9での蛍光のソースディストリビューションの最尤推定の精度を測定した点広がり関数を使用しています。反復プロセスは、投影と測定lensfree蛍光パターンの間の最小の平均二乗誤差を確実にするために、ノイズの増幅の出現の前に数百サイクルの後に一般的に終端されています。このデコンボリューションアルゴリズムの収束は、10計算時間を短縮するために、ベクトルの外挿法によって加速された。アイデアを与えるには:このアルゴリズムは、(例えば、〜9μmの画素サイズとCCD / CMOSチップを使用して)〜20μmの効果的な空間分解能を提供し、上の分の数十の中で〜8 cm 2のFOVをデコンできます。 Matlabの1を実行している通常のPC。同じ計算時間は、例えば、のためにわずか数秒に低下することに注意して、典型的な10倍対物レンズの視野に匹敵する〜1mm前方2 FOV。
- 圧縮サンプリング/ベースのスパース信号を感知デコード2:更なる分解能の向上(ダウン<4μmまで)4は、圧縮センシング/サンプリングベースのデコーディングアルゴリズムの11,12を使用することによって達成することができます。圧縮サンプリング/検出は、サンプリング定理にしたがって必要とされるよりもはるかに少ないサンプルからのスパース信号を回復することを目的と最近の新興理論的枠組み13-15を提供します。一般的に、アンダーサンプリングされた測定値からの信号の回復が不良設定問題ですが、機能の特定のクラス(すなわちスパース機能用)については、よく知られているサンプリング定理とその表現の根拠は、最近の用語で非常に非効率であることが示されている必要とされる測定値の数、すなわち、同じスパース信号は一般に一意に古典的なサンプリングの理論と比較して非常に少数のサンプルから回収することができます。
私たちのオンチップ顕微鏡で記録されたLensless蛍光画像は、本質的に圧縮デコードの重要な要件を満たしている:この作品への関心のあるアプリケーションでは、このような広視野蛍光メトリー、希少細胞の解析と高スループットのマイクロアレイイメージングとして、興味の蛍光オブジェクトは、すでに疎であると考えることができる。したがって、私たちのlensless蛍光顕微鏡で、ディストリビューションと物体面にある蛍光エミッタの相対的な強みのデコードは、例えば、インテリアを使って解くことのできる大規模なL 1 -正則化最小二乗問題としてモデル化することができます。ポイント法2,12。この最適化問題は、数学的に式で表すことができます。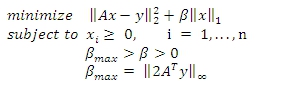
ここで、| | U | | K =(ΣI N | u iの| k)は(1 / k)と| | U | |∞= 最大 I | u iの|。したがって、我々は、L 1 -正則リットル記録/測定(y)とxと復号化されるソースディストリビューションを表し、計測行列が使用して形成された推定値( 斧 )lensfreeの画像の差の2ノルムを最小化それぞれのシステムの実験的なPSF、。我々はまた、物体面でのソースディストリビューションが非負であることが強制的に制約関数を使用してください。コスト関数の値が所定の許容値に達したときに、この反復圧縮復号化処理が終了します。正則化(β)と許容誤差のパラメータは、オブジェクトのスパース性と測定ノイズレベルの一般的な関数にあり、と〜βmax/10と〜0.01〜私たちのシステムで、それぞれに最適化されています。
上記の数値スキームに基づいて、生の蛍光画像の圧縮のデコードは非常に疎なオブジェクトを解決し、ルーシー-リチャードソンデコンボリューション2に匹敵する処理速度を示すために私たちのプラットフォームの能力を向上させます。イメージング単層をに加えて、異なる深さにある蛍光灯のオブジェクトも復号することができると同時に2つの異なる深さの層に対応するすべてのPSFを使用して同じアルゴリズムを実行することによって互いに分離。 - Pseudocoloring:基本的な制限はありませんが、提示オンチップイメージングプラットフォームは、主にモノクロ光電子SEを採用一般に生体試料イメージングのための優れた信号対ノイズ比を提供するnsor配列。したがって、生の蛍光画像はサンプルの実際の色情報が含まれていないフォーマットを、グレースケールで取得されます。これは、3カラーチャネル(赤、緑、青)は各lensfree蛍光測定で取得されるように、私たちのlensfreeイメージングアーキテクチャでカラーCCD / CMOSチップを使用することによって回避することも可能。一方、ラベル色素の発光特性は既に知られている場合、RAW形式は、蛍光画像をグレースケールのモノクロセンサーチップとそのdeconvoled /デコードされたバージョンも人為的に、例えば、MATLABで実装pseudocoloringのアルゴリズムを使用してカラー画像に変換することができます。この目的のために、取り込んだ画像をグレースケールの関心の任意の色は、データキューブの各疑似チャンネルに適切な重み係数を用いて合成することができる3次元データキューブ、に展開することができます。この処理の結果として、モノクロlensfree蛍光画像は、所定の蛍光物体の既知の色の情報を提供するマルチチャンネルの画像に(必要に応じて)変換することができます。
- 自動蛍光細胞計数:サイトメトリーのアプリケーションでは、我々はまた、自動的に私たちのオンチップ顕微鏡のプラットフォームで取得したそのlensfree画像に基づいて、蛍光灯のオブジェクト/セルを数えることができるカスタム設計されたユーザーインターフェイスを(図を参照してください8)開発している。このタスクに向かって、最初にソフトしきい値は、蛍光オブジェクトの候補地を絞り込むために生lensfreeイメージに適用されます。その後、一連の機能(特にregionprops)の位置、面積、形状や強度などの関心の各サブ領域の画像の特性を測定するために使用されます。これらのオブジェクトのデータを使用して、バイナリオブジェクトは、このような細胞、デッドピクセルだけでなく、ほこりや背景自家蛍光などのサブグループに分類される。 regionprops関数の最終結果は、興味のあるセルだけを表示するためにフィルタリングされると、結果として得られる構造体の配列の長さは、私たちのlensfreeオンチップイメージャの全視野にわたって細胞数を取得するために使用することができます。
4。代表的な結果:
私たちのセットアップの概要については、そのアセンブリで使用されているいくつかの光学部品と、 図1に示されています。私たちのオンチップ顕微鏡プラットフォームの主な特徴は、蛍光励起および検出、内部全反射だけでなく、同じプラットフォーム上でholographic伝送イメージングのための部分的コヒーレント照明を含めて、 図2で説明されています。様々な微粒子を(赤/緑が4μmと10μmの緑)を含む不均一な混合物のLensless蛍光オンチップのイメージング結果3-4図に示されています。ルーシー-リチャードソンのデコンボリューションとサンプリング/ベースのデコーディングをセンシング圧縮の比較は、デジタル生lensless蛍光画像の解像度を高めるために、図5に提供されています。圧縮のデコードは、空間分解能(<4μmのは) 図6に定量化され有効になっています。蛍光標識白血球のLenslessオンチップ顕微鏡は、従来の蛍光顕微鏡で撮影した比較画像を提供する図7に示されています。最後に、私たちの自動蛍光オブジェクトカウントのインタフェースを図8に示されています。

図1:私たちのlenslessオンチップイメージングセットアップの概要は、そのアセンブリで使用されているいくつかの光学コンポーネントとともに表示されます。

図2:オンチップlensfree蛍光イメージングプラットフォームの概略図(左画像)が表示されます。蛍光励起はインコヒーレント光源を用いた菱形角柱の側面ファセットによって達成されます。私たちのオンチップ蛍光イメージングプラットフォームの実験的なセットアップは、(右画像)が表示されます。マイクロ流体チップ内の全血サンプル(寸法:2.5 × 3.5 × 0.3 cm)を屈折率整合油がチップとプリズムを組み立てるために使用されたプリズムのインタフェースを介して興奮していた。 TIRとカラーフィルタによる励起光の除去時には、標識された血液細胞からのみ蛍光発光は約2.5 × 3.5 cmのFOVにわたって私たちのCCDセンサチップ(コダック11002)によって記録した。

図3は4μmと10μmの緑色蛍光粒子を含む混合物の広視野lensless蛍光オンチップのイメージングが図示されている。比較のために、10倍顕微鏡対物イメージも私たちのlensless蛍光像とよく一致して提供されており、。

図4。 広視野lensless蛍光イメージングが示されている。私たちのlensless蛍光画像は、同じ試料の10倍顕微鏡対物画像にまともな試合を提供しています。

図5は。ルーシー-リチャードソン(LR)デコンボリューションとデコーディングアルゴリズムをベースに圧縮サンプリング(CS)の性能比較は、様々な10μmのビーズのペアのイメージングのため、提供されています。一番上の行はlensless生の蛍光画像を示しています。一番上の行の挿入画像は、10倍対物レンズを使用して取得される同じ粒子の顕微鏡の比較を示す。一番下の行がルーシー - リチャードソンのデコンボリューションの結果を示しながら、中央の行は、私たちの圧縮復号結果を示しています。 D、D、CS、およびD LRは、顕微鏡画像の中心間の距離を参照して、CSはlensless画像をデコードし、LRはそれぞれ、lensless画像をデコンボリューション。

図6。lensless蛍光RAW画像のデジタル処理が例示されている。圧縮サンプリングベースのアルゴリズムは、最密充填を2μm径ビーズのペアを解決することで、<4μmの空間分解能を達成するために使用されます。インセットはまた、デコードされた蛍光像と非常によく一致40X顕微鏡対物比較を示す。 D CSが CSデコードされたlensless蛍光画像の中心間の距離を指し、ここでdは、顕微鏡画像の中心間の距離を指します。

図7は。蛍光(SYTO 16)標識した白血球細胞のLenslessイメージングが図示されている。生lensfreeイメージは急速に10倍対物レンズで取得されるため、同じサンプルの従来の顕微鏡像と非常によく一致するCSベースのデコーダを、使用してデコードされます。
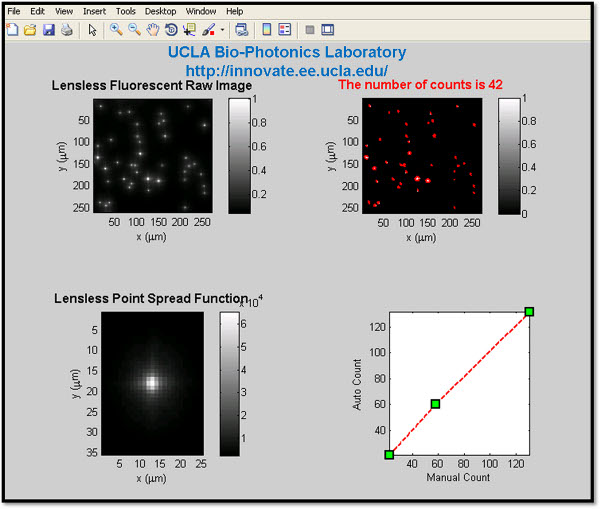
図8。カスタム設計された自動蛍光オブジェクトカウントのインタフェースは(MATLABで)示されています。
ディスカッション
我々は、例えば、達成することができるオンチップの蛍光顕微鏡のプラットフォーム実証<例以上4μmの空間分解能を、> 0.6〜8センチメートル2任意のレンズは、機械的な走査または薄膜干渉フィルターを使用せずにフィールドのビュー。この手法では、光ファイバフェースプレートやテーパーの使用で、オブジェクトからの蛍光発光は、CCD等の光電子センサーアレイに配信される?...
開示事項
利害の衝突は宣言されません。
謝辞
A. Ozcanは感謝ディレクター、NIHのオフィスからNSFのキャリア賞のサポート、ONR若手研究者賞、2009年NIHのディレクターの新イノベーター賞DP2OD006427を認めている。著者はまた、ビル&メリンダゲイツ財団、ボーダフォンアメリカ基金、およびNSFビッシュプログラム(受賞#0754880と0930501の下)のサポートを認める。
資料
| Name | Company | Catalog Number | Comments |
| 材料名 | 会社 | カタログ番号 | |
|---|---|---|---|
| 電荷結合素子(CCD) | コダック | KAF - 8300 | |
| 電荷結合素子(CCD) | コダック | KAF - 11002 | |
| 電荷結合素子(CCD) | コダック | KAF - 39000 | |
| 相補型金属酸化膜半導体(CMOS) | ミクロン | MT9T031C12STCD | |
| ハイパワーLED光源 | Thorlabs | M455L2 - C2 | |
| ハイパワーLEDドライバ | Thorlabs | LEDD1B | |
| ファイバーカップリングには、LED光源 | Mightex | FCS - 0625 - 000 | |
| 真空ペン | エドモンドオプティクス | NT57 - 636 | |
| 2、4、10μmのFluospheres | インビトロジェン | F - 8826、F - 8859、F - 8836 | |
| RBS溶解バッファー1X | ベイバイオサイエンス | 00から4333 | |
| SYTO 16標識試薬 | インビトロジェン | S7578 | |
| 光ファイバーフェースプレート | エドモンドオプティクス | NT55 - 142 | |
| 光ファイバテーパー | エドモンドオプティクス | NT55 - 134 | |
| プリズム | エドモンドオプティクス | NT47 - 626、NT45 - 403 | |
| フィルター | エドモンドオプティクス | NT39 - 417 | |
| PDMSエラストマー | ダウコーニング | Slygard 184 |
参考文献
- Coskun, A. F., Su, T., Ozcan, A. Wide field-of-view lens-free fluorescent imaging on a chip. Lab Chip. 10, 824-824 (2010).
- Coskun, A. F., Sencan, I., Su, T., Ozcan, A. Lensless wide-field fluorescent imaging on a chip using compressive decoding of sparse objects. Opt. Express. 18, 10510-10523 (2010).
- Coskun, A. F., Sencan, I., Su, T., Ozcan, A. Lensfree Fluorescent On-Chip Imaging of Transgenic Caenorhabditis elegans Over an Ultra-Wide Field-of-View. PLoS ONE. 6, e15955-e15955 (2011).
- Coskun, A. F., Sencan, I., Su, T., Ozcan, A. Wide-field lensless fluorescent microscopy using a tapered fiber-optic faceplate on a chip. Analyst. , (2011).
- Seo, S. High-Throughput Lens-Free Blood Analysis on a Chip. Analytical Chemistry. 82, 4621-4627 (2010).
- Mudanyali, O. Compact, light-weight and cost-effective microscope based on lensless incoherent holography for telemedicine applications. Lab Chip. 10, 1417-1417 (2010).
- Tseng, D. Lensfree microscopy on a cellphone. Lab Chip. 10, 1787-1787 (2010).
- Lucy, L. B. An iterative technique for the rectification of observed distributions. The Astronomical Journal. 79, 745-745 (1974).
- Richardson, W. H. Bayesian-Based Iterative Method of Image Restoration. J. Opt. Soc. Am. 62, 55-59 (1972).
- Biggs, D. S. C., Andrews, M. Acceleration of iterative image restoration algorithms. Appl. Opt. 36, 1766-1775 (1997).
- Candes, E., Wakin, M. An Introduction To Compressive Sampling. Signal Processing Magazine, IEEE. 25, 21-30 (2008).
- Kim, S., Koh, K., Lustig, M., Boyd, S., Gorinevsky, D. An Interior-Point Method for Large-Scale L1-Regularized Least Squares. Selected Topics in Signal Processing, IEEE. 1, 606-617 (2007).
- Candes, E. The restricted isometry property and its implications for compressed sensing. Comptes Rendus Mathematique. 346, 589-592 (2008).
- Baraniuk, R. Compressive Sensing [Lecture Notes]. Signal Processing Magazine, IEEE. 24, 118-121 (2007).
- Romberg, J. Imaging via Compressive Sampling. Signal Processing Magazine, IEEE. 25, 14-20 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved