Method Article
生細胞におけるストア作動性カルシウムエントリの蛍光ベースの測定:培養癌細胞から骨格筋線維に
要約
ストア作動性Caの範囲 2 +エントリ(SOCE)は、蛍光Caを使用して監視することができます 2 +指標。 Mnは 2 +消光。機械的に皮筋線維の共焦点イメージングによるSOCEの空間分解能と時間分解能を可能にする技術も記載されています。
要約
店は以前の容量性Ca 2 +のエントリと呼ばれる、Ca 2 +のエントリ(SOCE)を運営し、+枯渇小胞体(ER)や筋小胞体(SR)のCa 2 +ストアを補充する細胞に細胞外Ca 2 +の流入のために厳密に制御メカニズムです。 1,2。のCa 2 +ユビキタスセカンドメッセンジャーであるので、SOCEが増殖、アポトーシス、遺伝子の転写と運動性を含む細胞プロセスの様々な重要な役割を果たしているのを見て驚くことではありません。上皮細胞と骨格筋を含むほぼすべての細胞型で広い発生のため、この経路は、大きな関心3,4を受けています 。ただし、異なる細胞型と生理機能のSOCE特性の不均一性は、まだ5-7クリアされていません。
SOCEの機能チャネルのプロパティは、THIに関する知識の大きな体に対し、パッチクランプ法の研究によって明らかにすることができるの経路があるため、ハイスループットスクリーニングのため、その利便性と実現可能性の蛍光ベースの細胞内Ca 2 +測定によって得られている。このレポートの目的は、単層細胞、浮遊細胞や筋線維5,8-10でSOCEの活性化を測定するためにいくつかの蛍光ベースの方法を要約することである。最も一般的にこれらの蛍光法の使用は、直接細胞内Ca 2 +の動態を監視するために+ F 340nm、レシオメトリックのCa 2 +インジケーターフラ-2のF 波長380nm(発光波長510 nm)の比を使用しています。細胞内Ca 2から一方向SOCEの活性を分離するには+の放出とCa 2 +放出は、Mn 2 +クエンチアッセイが頻繁に使用されます。それは非常に高い親和性ウィットのために+ポンプ表面膜の押出プロセスまたはCa 2によってERの取り込みに不浸透性のある間のMn 2 +は SOCEを介して細胞に浸透することができることが知られているHフラ-2。その結果、細胞内に細胞外のMn 2 +のエントリによって誘発されるフラ-2蛍光の消光がSOCE 9の活性の測定を表しています。レシオメトリック測定とMn 2消光アッセイは、単一細胞を可視化する細胞集団モードまたは顕微鏡ベースのシステムでキュベットベースの蛍光光度計で実行することができます。単一細胞の測定の利点は、遺伝子操作を受け、個々の細胞は、遺伝子組み換えや変異細胞の研究をできるように、GFPまたはRFPレポーターを使用して選択することができることである。構造的に特殊な骨格筋でSOCEの時空間特性は、同時に二つの低親和性Ca 2 +の蛍光を監視することによって、肌の筋線維で達成することができるSRと、このようなにみたFluo-5Nとして筋線維の特定のコンパートメントを対象とした+の指標rhodo-の異形横細管9,11,12で5N。
プロトコル
1。細胞内Ca 2 +個々のセルの測定
- KYSE-150、ヒト食道扁平上皮癌(ECSS)は、細胞株は、37℃5%CO 2雰囲気で培養された℃、5%ウシ胎児血清を含有する混合RPMI 1640/HamのF-12培地(1:1)であった。
- KYSE-150細胞は、Orai1またはスクランブルシーケンスに対して特異的shRNAを含むいずれかのプラスミドでトランスフェクトされています。プラスミドはまた、別のプロモーターによって駆動されるレポーターとして、赤色蛍光タンパク質(RFP)をコードする遺伝子が含まれています。
- 細胞は48時間ガラスボトムディッシュ(第1.5カバーガラス、マテック、MA)で栽培されています。
- 培地を除去し、バランスのとれた塩溶液(BSS)(140mMのNaCl、2.8 mMの塩化カリウム、2mMのCaCl 2を 、2mMのMgCl 2、10mMのHEPES、pH7.2)で細胞をリンス。
- 皿に2μMフラ-2アセトキシメチルエステル(Molecular Probes社)を含む1ミリリットルBSSソリューションを追加し、proteにホイルで全体の料理を包む光からCT。
- 37℃で40分間細胞をインキュベートして、エステルの加水分解が完了できるようにするために、室温でさらに15分間の期間のためにそれらを残す。二回BSSで細胞を洗浄します。
- 510 nmでの350と390 nmの発光の励起波長で、PTI光度計に接続されているニコンTE200倒立顕微鏡のステージ上で料理をマウントします。使用する正確な励起波長がわずかに個々のシステムの光学系によって異なります。動的な最高の比率を持つ2つの波長は、Ca 2 + 0〜39.8μM(またはフラ-2蛍光が飽和するより高濃度)までを含む溶液にフラ-2塩のスキャン励起スペクトルによって決定されます。
- のCa 2 +(2 mM)を、EGTA(0.5 mM)を、EGTA-TG(タプシガルギン、5μM)は、Ca 2 +-2-APB(SOCE阻害剤、75:BSS内の4つの異なるソリューションを重力流システムを設定μM)。コンピューター制御の自動化されたperfusiシステムでも使用することができます。
- 可視化モードでRFPを発現する細胞を選択します。
- 先端が45度の角度で右に関心のある領域を超えるまで10倍の倍率で灌流システムの開口部先端に配置します。
- 同時に蛍光信号FとF 350nmの390nmを記録します 。比(F 350nmの / F 390nm)は、番目のウィンドウに表示されます。 、EGTA、Ca 2 +を 、EGTA-TG、Ca 2 +を 、Ca 2 +の -2-APBのCa 2 +:次の順序で灌流ソリューションを変更します。
上記のプロトコルは、細胞懸濁液システムにおける細胞内Ca 2 +の測定のために変更することができます。
- 上記と同じ培養条件でT25フラスコで培養KYSE-150細胞。
- 細胞が90%コンフルエントに達したときに、培地を除去し、BSS液で細胞をリンス。
- 2μMのフラ-2 AMとインキュベートを含む2.5ミリリットルBSSソリューションを追加します。37℃で40分間細胞を℃で脱エステル化が続く。
- 細胞が剥離するまで、BSSを削除するには、37℃でフラスコとインキュベートに2.5 mlのトリプシンを追加します。その後トリプシン処理を停止し、5分間800rpmで遠心して細胞を採取する2.5 mlの培地を追加します。
- 遠心分離してもう一回培地で細胞を洗浄し、再懸濁細胞のペレットBSS溶液中に(2 mMのCaCl 2の添加せずに、μMの範囲のCa 2 +を含む)とhematometerを用いて細胞数をカウントします。
- 石英キュベット(10ミリメートル、Starna細胞)に約10 6個の細胞を追加して、BSSで2 mlにボリュームを埋める。
- 蛍光光度計にキュベット(磁気棒で攪拌)を配置します。
- 同時に510nmで発光波長で蛍光シグナルF 340nmと波長380nmのF を記録します 。実行しているプロトコルは、次のとおりです。BSS、0.5μlのEGTA(0.25 Mストック)を加え、1μlのタプシガルギンの追加(TG、10mMのストック)、4μlのCa 2 +の (1 Mストック)の追加。
2。培養細胞中のMn消光アッセイ
- 励起波長は、様々なのCa 2を含む溶液にフラ-2のスキャンを実行する等吸収点としてCa濃度に依存しない波長を決定するために、0〜39.8μMまでの濃度+。通常、等吸収点は360 nmで、または周りにある。
- KYSE-150細胞は、ガラスボトムディッシュで培養し、フラ-2午前にロードされます。
- 自由を含む、EGTAまたはCa 2 +の添加なしのCa 2 +(2 mM)を、EGTA / TG(0.5 mMと5μM、それぞれ)は、Mn 2 +(0.5mMの:5つのBSSソリューションを灌流システムを設定のCa 2 +μMの範囲で)は、Mn 2 + / 2-APB(75μM)、EGTA /トリトンX-100(0.1%)。
- 顕微鏡のステージ上に皿をマウントし、510で "励起比" 360 nmと390 nmの励起波長と発光モードを選択するnmである。
- 同時に番目のウィンドウに表示された比(F 360nmの / F 390nm)の蛍光シグナルは360nmの FとF 390nmを記録します 。実行しているプロトコルは、次のとおりです。Ca 2 +の蛍光を安定させるための1分は、Mn 2 +で30秒、EGTA / TGのための10分は、Mn 2 + 2分、EGTA-Triton X-100を1分間(0.1%)にバックグラウンドの測定値を得ることができる。のMn 2 + / 2-APB溶液は+ Mn 2 +のエントリがSOCE経路を介してであることを示し廃止蛍光消光を調べる代わりにMnを2使用することができます。
3。筋細胞中のMn消光アッセイ
- C2C12マウス筋細胞株は、10%ウシ胎児血清、10%ウマ血清を含むDMEM培地で37℃、5%CO 2雰囲気中でガラスボトムディッシュ上で培養されています。
- 細胞がコンフルエントに達した後、培養培地を分化培地(ウシ胎児血清および削減を削除に変更されます。2.5%eは、ウマ血清)。 C2C12筋芽細胞は、4日後に筋管に分化する。
- フラ-2のように1.4から1.6で説明されて午前5μMの最終濃度でC2C12筋管をロードします。
- 筋肉の収縮とそれによるモーションアーチファクトを抑制し、実験を開始する前に15分を可能にするために、20μMのN-ベンジル-p-トルエンスルホンアミド(BTS)の最終濃度を追加します。
- PTIデバイスに接続された顕微鏡のステージ上で料理をマウントし、灌流システムに次のBSSソリューションを読み込む:2のCa 2 +(2 mM)を、0のCa 2 +、Mn 2 +が (0.5 mM)を、Mn 2 +が / TG(0.5 mMの、20μM、それぞれ)。
- 上記のように灌流システムを設定します。
- 同時に番目のウィンドウに表示された比(F 360nmの / F 390nm)の蛍光シグナルは360nmの FとF 390nmを記録します 。実行しているプロトコルは、次のとおりです。2 + 1分間、0のCa 2 +は 、1分間フロリダ州へのCa 2離れてUSHのCa 2 +、Mn 2 +が 0.5分のためには、Mn 2 10分、及びMn 2 + / TG + / EGTA-トリトンX-100(0.1%)。
4。肌の筋線維の空間的·時間的に解決SOCE
- 次の解決策を準備します。
張タイロード緩衝液:140mMのNaCl、5mMのKCl、10mMのHEPES、2mMのMgCl 2、2.5mMのCaCl 2を 、pHが7.2、290浸透圧
培地:2%ウマ血清および1%ペニシリンおよびストレプトマイシンを含むDMEM
解決策#1を洗う:109.6 mMのK-グルタミン酸、2mMのEGTA-KOH、6.7 mMのMgCl 2、2mMのATP、6 mMのクレアチンリン酸(CP)、20mMのN、N-ビス(2 -ヒドロキシエチル)-2 -アミノエタン酸(BES)-KOH、pH 7.0の
140mMのK-グルタミン酸、5mMのEGTA-KOH、6.5 mMのMgCl 2、2mMのATP、6 mMのCP、20mMのBES-KOH、pHが7.0:ソリューション第2位を洗う
スキニングソリューション:140mMのK-グルタミン酸、6.5 mMのMgCl 2、2mMのATP、6 mMのCP、20mMのBES-KOH、pH 7.0の
TT-ローディング解決策:90.6 mMのK-グルタミン酸、18 mMのNa型グルタミン酸、0.55 mMのCaCl 2を 、2mMのEGTA-KOH、6.7 mMのMgCl 2、5.4 mMのATP、15mMのCP、0.0025 mg / mlのクレアチンキナーゼ(CK)、20mMのBES-KOH、5μMカルボニルシアン化合物のp-trifluoromethoxyphenylhydrazone(FCCP)、pH7.0で、PCA 7.0
SRローディング溶液:107.8 mMのK-グルタミン酸、0.98 mMのCaCl 2を 、2mMのEGTA-KOH、6.6 mMのMgCl 2、5.4 mMのATP、15mMのCP、0.0025 mg / mlのCK、20mMのBES-KOH、5μMFCCP、液(pH7.0)、PCA 6.6
SRオゾン溶液:100 mMのK-グルタミン酸、40mMのNa型グルタミン酸、10mMのEGTA-KOH、10mMの1,2 -ビス(o-アミノフェノキシ)エタン-N、N、N '、N'-四酢酸(BAPTA )、0.35 mMのMgCl 2、0.5mMのATP、1 mMのCP、20mMのBES-KOH、5μMFCCP、pHは7.0。 25mMのcaffeine/20μMタプシガルギン(TG)は、実験前に追加されています。 - 長指伸(EDL)筋肉を解剖するには、まず、マウスを下に置くと横位置で足を手配し、カット、最大膝に足首領域から皮膚を取り除く組織の表層筋層EDLを公開し、無傷のEDL筋肉を解放するために上側と下側の腱の両方を断ち切るために、それは可能な限り腱を維持することが重要です。 EDLは、任意の収縮を防ぐために、0のCa 2 +および0.1mM EGTAを含むタイロード溶液に転送されます。
- 実体顕微鏡下で、低挿入腱を保持する2つのピンセットを使用し、2つのバンドルにEDL筋を分割します。 4、8のバンドルを取得するプロセスを繰り返します。それは腱がプロセスの終了時に8バンドルのそれぞれについて、残ることが重要です。彼らはいくつかのバンドルから失われている場合は、それらを破棄します。
- 実体顕微鏡下で、各EDLバンドルストリップは、両方の腱でgripedされており、慎重に3日まで引き伸ばさ〜4区切られた単一筋線維は、両側の腱とそのまま残されます。
- ガラスボトムディッシュの中央にあるCa 2 +の1滴+無料のタイロード緩衝液を入れ、すぐに可能な限りのように削除し、ストレート皿にEDLストリップを下に置く次に、溶液、耐水性、スコッチテープを使用して、両方の腱下にテープ、テープがタイトであることを確認してください。 0のCa 2 +溶液とし、2.5mMのCa 2 +のソリューションの2倍の最初の繊維を洗浄する。ファイバーハイパー契約や損傷が注目されている場合には、繊維を破棄します。
- 必要に応じて、繊維は、遺伝的操作を可能にし、96時間のためにまで培養することができます。完全培地と繊維を3回洗浄し、皿に2 mlの培地、5%CO 2、37℃のインキュベーター内で場所を追加します。各実験前に、筋線維を検討し、明確なストライエーションせずに、あるいは汚染の兆候を持つ、またはそのような筋線維膜の拘縮などの損傷の徴候とのそれらを破棄します。優れた繊維は、塩化カリウム、電気刺激、カフェインの刺激に応答します。
- 単一筋線維は、洗浄溶液#1で3回洗浄し、5分間500μMrhodo-の異形5Nおよび0.5mMのCa 2 +を細胞内のようなスキニングソリューションを浴びています。
- 、実体顕微鏡下で機械的に皮膚の繊維を、ピンホルダーに取り付けられたタングステン針を用いて横細管(TT)には自動的に再シール可能となり、+ TTのCa 2と共役rhodo-の異形5Nをトラップするために、倍肌の繊維を洗う解決策#2を洗浄した。セルの幅の25%未満がスキニング処理中に削除されたときに機械的なスキニングプロセスが最適です。
- SRをロードするためには、肌の繊維は、20μMにみたFluo-5Nは、洗浄溶液#2を使用して広範な洗浄に続いて、室温で1時間、AM、完全な脱エステル化を可能にするためにさらに30分間インキュベートを含むスキニングの溶液とともにインキュベートされている染料の。
- 30分後、肌の繊維は、共焦点顕微鏡の60X客観的で視覚化されます。蛍光画像は、対応する染料(;みたFluo-5Nのために530から560 nmで488 nmおよび発光励起rhodo-の異形5Nのために570 nmより長い543 nmでの励起および発光)の波長で取得されます。レジ興味のあるアドオンは、(ROIの)それぞれの染料ロードされた領域が選択されています。
- 実験プロトコルは以下の通りです:120秒120秒、SR-ローディング溶液、400から750のSRのCa 2 +ストアを枯渇させるためのSR-枯渇ソリューションのTT-ローディング·ソリューションを提供します。このプロセス中に、rhodo-の異形5Nの強度の変化(TTのCa 2 +)とみたFluo-5Nの強度(SRのCa 2 +)が TTとSRの相対蛍光変化の経時測定を作成し、記録されます。複数の繊維から蛍光強度の平均値は、さらに分析されます。 TT / SR-ローディングの終了時に最大荷重強度が100%に正規化されています。
5。代表的な結果
我々は細胞内Ca 2 +測定( 図2)を使用してKYSE-150細胞でSOCE活性を調べた。レポーターとしてRFPを使用して、我々はorai1に対して含むプラスミド特異的なshRNA、SOCE Cをコードする遺伝子でトランスフェクトし、個々のセルを選択することができますhannel。スクランブルのshRNA( 黒トレース )、減少SOCE活性( 赤のトレース )にOrai1タンパク質結果のノックダウンを含むプラスミドをトランスフェクトした細胞と比較した。
KYSE-150細胞内SOCEものMn 2 +クエンチ法( 図3)を確認した。 360 nmの励起波長は、蛍光Ca 2 +濃度に依存しませんフラ-2の等吸収点を報告します。 TGは完全に枯渇し、ERのCa 2 +貯蔵した後は、Mn 2 +灌流は、重要な蛍光減少した。浅い傾きは活性の低いSOCEを意味しながら、全体的なSOCE活動は、より積極的なSOCEを示す急峻なスロープを持つフラ-2蛍光強度の減少率によって測定することができる。 2-APB処理した細胞の蛍光の減少の傾きは、そのSOCE活動が、この化合物によってブロックされた示されている、非常に浅いように見えた。 Mnは2 +消光率は消光が飽和することなく直線範囲にまだあった最初の10秒の記録から決定した。
類似したMn 2 +はクエンチングアッセイは、( 図4)。筋肉で行われた。この場合のMn 2 +は、TGと一緒に適用されました。 TGは、SRのCa 2 +ストアの枯渇したが、その最大速度に達するまで、蛍光消光の傾きが徐々に変更されました。シグモイド曲線は、これらの実験条件下でSOCEの傾斜状態であることを示します。
文化の中で健康な無傷の単一筋線維は、明確かつ均一なストライエーション、汚染の徴候、および収縮に起因する損傷の徴候を示した。これらの繊維は電気的な刺激や脱分極ソリューションに応じて縮小することができました。共焦点イメージングの下で、TTのコンパートメントでrhodo-の異形5N色素の皮の繊維トラッピング(visu特徴哺乳類の二重パターンを示した)赤チャンネルでalized。にみたFluo-5N AMとSRのロードした後、典型的な中断SRパターン(緑のチャネルで)表示されていた。 TT / SRローディング溶液によるスキンドファイバーの灌流時には、rhodo-の異形5NとみたFluo-5Nの両方の蛍光強度が増加し、SRの枯渇溶液を灌流時に、SRのコンパートメントとTTコンパートメント内の蛍光レベルは、密結合を示し、減少し始めSRのCa 2 +の間にそれぞれストアの枯渇とSOCEの活性化、( 図5)。
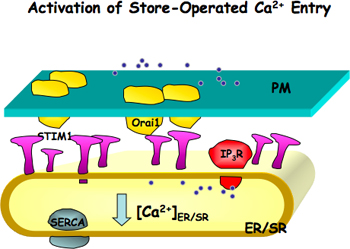
図1。のアクティベーションストア作動性Ca 2 +のエントリ(SOCE)。Orai1、ユニットを形成するチャンネル孔は、細胞膜(PM)とSTIM1は、Ca 2 +センサーに配置されている小胞体や筋小胞体(ER /に配置されているSR)膜。 ER / SRのCa 2 +ストアが原因でER / SRのCa 2 +ポンプ(SERCのブロックのいずれかに減少している場合A)またはCa 2は、IP 3受容体やリアノジン受容体を介し+リリースでは、STIM1がアクティブになります。活性化STIM1分子がパッチを形成し、さらにSOCEの活性化をリードしていますOrai1の凝集を誘導。
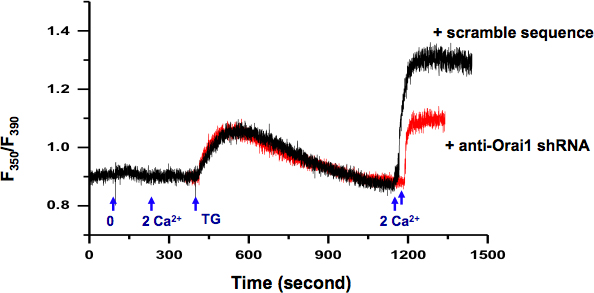
図2。 KYSE-150細胞の細胞内Ca 2 +の測定。0のCa 2 +(0.5mMのEGTA)から2 mMまで細胞外液の交換のCa 2 +は細胞内Ca 2 +の変化を誘発しなかった。 0のCa 2 +バスソリューション誘発受動的なER Ca 2 +放出のTG 5μM。 ERのCa 2 +ストアが持続的な細胞内Ca 2 + SOCE阻害剤によってブロックすることができますSOCE、例えば、SKF-96365と2を経由して標高を活性化し細胞外Ca 2 +(2 mM)を加えて、(> 10分)が枯渇した後- APB(データは表示されません)。に対して特異的shRNAを含むプラスミドでトランスフェクトした細胞orai1(赤)は、スクランブルシーケンス(黒)でトランスフェクトした細胞よりも有意に減少しSOCEを示した。
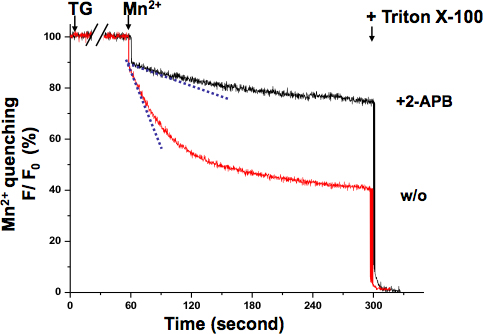
図3。のMn 2 KYSE-150細胞におけるSOCEの+消光アッセイのMn 2 +(0.5 mm)でフラ-2蛍光の消光がフラ-2(360 nm)の+非依存性、励起波長のCa 2で測定した。細胞が完全にERのCa 2 +ストアの枯渇に10分間TG 5μMで処理した。のMn 2時のフラ-2蛍光の減衰の傾きは+加算(破線、最初の10秒以内)は、単位時間あたりの蛍光の減少率(100%として初期値)として表したSOCEの活性化を、表されます。最大限に急冷蛍光シグナルは、0.1%トリトンX-100(0%など)で細胞を溶解することによって、実験の終わりに設立されました。 2-APB(75μM)で処理した細胞は非常に浅く実証スロープ、示唆SOCEはKYSE-150細胞内でこの化合物によってブロックされています。
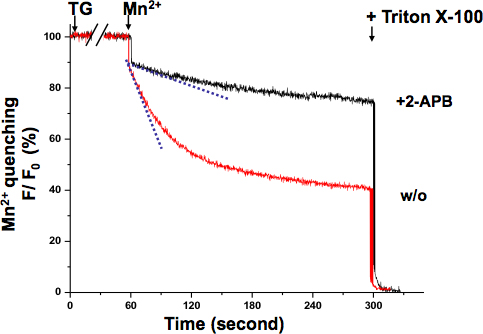
図4。筋細胞におけるSOCEの段階的活性化は、Mn 2 +によって明らかにされた消光アッセイを。TGは、SRのCa 2 +ストアの枯渇している間にSOCEの活性化は、登録されている可能性があります。のMn 2 +(0.5)とTG(20μM)の同時アプリケーションは、初期のMn 2 +から急冷別個であった細胞内のフラ-2蛍光(最速消光点を表示するにはシアン破線)の等級とシグモイド減少を誘発した率(青破線)。のMn 2 +クエンチスロープはそのSOCEが阻害されたことを示唆し、ほぼ2-APB(75μM)で処理した細胞の基底レベルと同じであった。
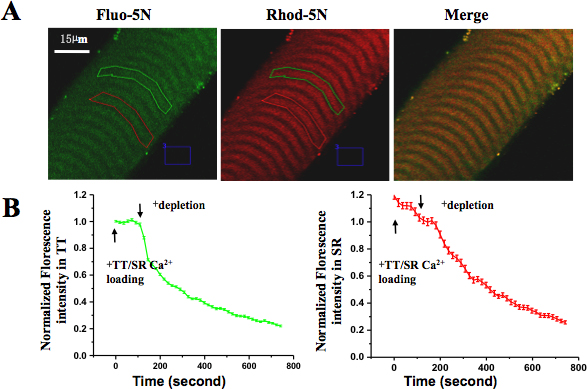
図5。空間的·時間的に肌の筋線維にSOCEを解決しました。 (A)RHOD-5N塩はTTとみたFluo-5N AMにロードされたが、SRに読み込まれました。(B)+枯渇液のCa 2を適用した後、TT、およびSRの各コンパートメントの蛍光は減少した。みたFluo-5N蛍光の損失が急速に解放SR Ca 2 +含量を示したとrhodo-の異形5N蛍光の損失がSOCEの活性化を示唆した。
ディスカッション
Ca 2 +結合およびCa 2 +フリーフラ-2の励起波長は、それぞれ340nmおよび380nmであるが、Caの2のフラ-2の最高の比ダイナミックレンジ+濃度測定は、特に、他の波長で発生する可能性があります顕微鏡システム。波長のようなシフトは、通常、様々な光学部品を添加した光路の変化によるものである。本研究では、フラ-2の励起波長は、フラ-2蛍光のスペクトル解析を行うことにより、350 nmと390 nmで測定した。
を含むいくつかのソースのバランスから、細胞質ゾルの結果細胞内Ca 2 +レベル、細胞内Ca 2 +放出は、細胞外Ca 2 +のエントリと同様に、小胞体と細胞膜でのCa 2 +排除機構。細胞内Ca 2 +放出とCa 2 + EXTRから一方向のSOC-介在Ca 2 +流入を単離するために、usionは、Mn 2 +が消光アッセイを使用することができます。のMn 2 +は SOCEを介して細胞に浸透することができることが知られているが、表面膜の押し出しまたはCa 2によってERの取り込み+ポンプへの浸透です。したがって、蛍光消光は、単方向のMn 2 + SOCEの活性化の度合いを推定する細胞内へのフラックスの測定を表しています。のMn 2 +クエンチアッセイは、このような波長で、等吸収点で行わフラ-2蛍光強度がCa 2 +濃度とは無関係です。されてい各システムの等吸収点は、スペクトラム·スキャンによって決定されるべきである。また、Mn 2 +の消光は、最終的な値は、Ca 2 +濃度の13の独立しているような方法で、任意の2つの波長で調整された蛍光によって記録することができます。
骨格筋におけるSOCEの活動の空間的および時間的情報を得るために、我々は同時measuremeを可能にするデュアル色素法を採用SOCE活動のNTおよびSRのCa 2 +肌の大人の哺乳類のEDL筋線維内のコンテンツ。 SRのCa 2の変化の間に相関が+コンテンツとSOCE活動は、SRのCa 2 +貯蔵の枯渇にSOCE活性化のしきい値と感度を示すためにプロットすることができます。 TT-ローディング溶液は、さらにカルシウム2とT-細管をロードするために最適化されている+とT-細管とSR-ローディング溶液のプライミングのために最大限のSRのCa 2 +ローディングを促進し、さらにT-細管をロードするように設計されています〜500μMのCa 2 +。 FCCPは、TT / SR-ローディング溶液とミトコンドリアからの影響を排除するためにSR-オゾンソリューションに含まれています。
開示事項
利害の衝突が宣言されません。
謝辞
私たちは、読書と、この原稿を編集するために博士ノアWeislederに感謝します。この作品は、MBに0535555N ZP、XZに米国心臓協会SDG2630086、および国立衛生研究所RC2AR058962-01 MBまでに研究費補助金UMDNJ財団62から09でサポートされていました。
資料
特定の試薬や機器の表:
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| RPMI 1640 | メディアテック | 10から040-CV | |
| ハムのF-12 | メディアテック | 10から080-CV | |
| DMEM | メディアテック | 10から013-CV | |
| ガラスボトムディッシュ | マテック | P35G-1.5-14-C | |
| AMフラ-2 | Invitrogen社(Molecular Probes)を | F1221 | -20°C、DMSOに溶解し、光から保護シールタイト、 |
| 蛍光-5N AM | Invitrogen社(Molecular Probes)を | F14204 | -20°C、密封、Lから保護IGHT |
| rhodo-の異形5N | Invitrogen社(Molecular Probes)を | R14207 | -20°C、シールタイト、光から保護 |
| 石英キュベット | Starna細胞 | 3-Q-10 | |
| タプシガルギン | Tocris | 1138 | |
| 2 Aminoethoxydiphenylborane(2-APB) | Tocris | 1224 | |
| N-ベンジル-p-トルエンスルホンアミド(BTS) | Sigma-Aldrich社 | 435600 | |
| コラゲナーゼタイプI | シグマ | C0130 |
設備:
- 分光蛍光光度計(フォトンテクノロジーインターナショナル、NJ):キセノンアークランプ、コンピュータ制御の高速ランダム·アクセス·モノクロ、キュベットベースの発光分光、ニコンTE-200倒立蛍光microscopE、S弗素40x/1.30油浸対物、PMT検出器。
- アルゴンレーザー453/477/488/514、HeNeレーザー543nm、ニコン倒立顕微鏡TE2000、60X対物レンズ(NA 1.4、油):レーザー共焦点顕微鏡(BioRad社Radiance2100)をスキャンしています。
- 倍率の実体顕微鏡> 100(ツァイスSTEMI SV11 APO)。
参考文献
- Parekh, A. B., Putney, J. W. Store-operated calcium channels. Physiol. Rev. 85, 757-810 (2005).
- Ma, J., Pan, Z. Retrograde activation of store-operated calcium channel. Cell Calcium. 33, 375-384 (2003).
- Feske, S. ORAI1 and STIM1 deficiency in human and mice: roles of store-operated Ca2+ entry in the immune system and beyond. Immunol. Rev. 231, 189-209 (2009).
- Parekh, A. B. Store-operated CRAC channels: function in health and disease. Nat. Rev. Drug Discov. 9, 399-410 (2010).
- Pan, Z. Dysfunction of store-operated calcium channel in muscle cells lacking mg29. Nat. Cell Biol. 4, 379-383 (2002).
- Shin, D. W. A retrograde signal from calsequestrin for the regulation of store-operated Ca2+ entry in skeletal muscle. J. Biol. Chem. 278, 3286-3292 (2003).
- Ma, J., Pan, Z. Junctional membrane structure and store operated calcium entry in muscle cells. Front Biosci. 8, d242-d255 (2003).
- Pan, Z., Damron, D., Nieminen, A. L., Bhat, M. B., Ma, J. Depletion of intracellular Ca2+ by caffeine and ryanodine induces apoptosis of chinese hamster ovary cells transfected with ryanodine receptor. J. Biol. Chem. 275, 19978-19984 (2000).
- Hirata, Y. Uncoupling store-operated Ca2+ entry and altered Ca2+ release from sarcoplasmic reticulum through silencing of junctophilin genes. Biophys. J. 90, 4418-4427 (2006).
- Zhao, X. Enhanced resistance to fatigue and altered calcium handling properties of sarcalumenin knockout mice. Physiol. Genomics. 23, 72-78 (2005).
- Zhao, X. Azumolene inhibits a component of store-operated calcium entry coupled to the skeletal muscle ryanodine receptor. J. Biol. Chem. 281, 33477-33486 (2006).
- Launikonis, B. S., Barnes, M., Stephenson, D. G. Identification of the coupling between skeletal muscle store-operated Ca2+ entry and the inositol trisphosphate receptor. Proc. Natl. Acad. Sci. U.S.A. 100, 2941-2944 (2003).
- Shuttleworth, T. J. Temporal relationships between Ca2+ store mobilization and Ca2+ entry in an exocrine cell. Cell. Calcium. 15, 457-466 (1994).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved