Method Article
Basées sur la fluorescence de mesure de l'entrée du calcium magasin fonctionnant dans des cellules vivantes: à partir de cellules cancéreuses en culture de fibre musculaire squelettique
Dans cet article
Résumé
L'étendue de magasin exploité Ca 2 + (SOCE) peut être contrôlée à l'aide fluorescente Ca 2 + Indicateurs. Mn 2 + Trempe de tests indicateurs SOCE dans des cellules cultivées et les fibres musculaires squelettiques tels. Une technique permettant la résolution spatiale et temporelle des SOCE par imagerie confocale de fibres musculaires mécaniquement décortiqués est également décrite.
Résumé
Magasin exploité Ca 2 + entrée (SOCE), plus tôt appelé capacitif Ca 2 + entrée, est un mécanisme étroitement régulé pour afflux de Ca 2 + extracellulaire dans les cellules pour reconstituer appauvri réticulum endoplasmique (RE) ou réticulum sarcoplasmique (SR) de Ca 2 + magasins 1,2. Depuis le Ca 2 + est un messager ubiquitaire seconde, il n'est pas surprenant de voir que SOCE joue un rôle important dans une variété de processus cellulaires, y compris la prolifération, l'apoptose de transcription du gène, et la motilité. En raison de sa grande fréquence dans presque tous les types cellulaires, y compris les cellules épithéliales et des muscles squelettiques, cette voie a suscité un grand intérêt 3,4. Cependant, l'hétérogénéité des caractéristiques Socés dans différents types de cellules et la fonction physiologique ne sont pas encore clairement 5-7.
Les propriétés fonctionnelles des canaux de SOCE peut être révélée par les études de patch-clamp, tandis qu'un vaste corpus de connaissances sur les thivoie s a été acquise par basées sur la fluorescence intracellulaire de Ca 2 + des mesures en raison de sa commodité et de faisabilité pour criblage à haut débit. L'objectif de ce rapport est de résumer quelques basées sur la fluorescence des méthodes pour mesurer l'activation de SOCE dans les cellules, les cellules en suspension monocouches et les fibres musculaires 5,8-10. Le plus couramment utilisé de ces méthodes de fluorescence est de contrôler directement la dynamique de la concentration intracellulaire de Ca 2 + en utilisant le ratio de F et F 340nm 380nm (510nm pour les émissions de longueur d'onde) de la ratiométrique Ca 2 + indicateur de Fura-2. Pour isoler l'activité de SOCE unidirectionnelle de concentration intracellulaire de Ca 2 + et la libération de Ca 2 + extrusion, un Mn 2 + test trempe est fréquemment utilisé. Mn 2 + est connu pour être capable de pénétrer dans les cellules par l'intermédiaire SOCE tandis qu'il est imperméable à des processus de surface de membrane d'extrusion ou d'absorption ER par Ca 2 + pompes en raison de sa savoir très forte affinitéh Fura-2. En conséquence, l'extinction de la Fura-2 fluorescence induite par l'entrée de Mn 2 + extracellulaire dans les cellules représente une mesure de l'activité de SOCE 9. Mesure ratiométrique et les dosages Mn +2 trempe peut être effectuée sur un spectrofluorimètre cuvette à base dans un mode population de cellules ou dans un système de microscope à base de visualiser les cellules uniques. L'avantage des mesures de cellules uniques est que les cellules individuelles soumises à des manipulations génétiques peuvent être sélectionnées en utilisant la GFP ou journalistes de la DP, ce qui permet des études dans des cellules génétiquement modifiées ou muté. Les caractéristiques spatio-temporelles de SOCE dans le muscle squelettique structurellement spécialisée peut être réalisé dans les fibres musculaires à la peau par le suivi de la fluorescence simultanément de deux faible teneur en Ca 2 + affinité indicateurs ciblés dans des compartiments spécifiques de la fibre musculaire, comme Fluo-5N dans le SR et Rhod- 5N dans le sens transversal tubules 9,11,12.
Protocole
1. Ca 2 + intracellulaire de mesure pour les cellules individuelles
- KYSE-150, un être humain cancer de l'œsophage à cellules squameuses (CESS) lignée cellulaire est cultivée dans atmosphère de CO 2 5% à 37 ° C en mixte RPMI 1640/Ham l 'milieu F-12 (1:1) contenant 5% de sérum de veau fœtal.
- KYSE-150 cellules sont transfectées avec les plasmides contenant soit shRNA spécifiquement contre Orai1 ou une séquence embrouillée. Les plasmides également inclus un gène codant pour la protéine fluorescente rouge (RFP) en tant que reporter, qui est entraîné par un promoteur distinct.
- Les cellules sont cultivées dans des plats à fond de verre (couvercle en verre n ° 1.5, MatTek, MA) pendant 48 heures.
- Retirez le support et rincer les cellules avec une solution saline équilibrée (BSS) (140 mM NaCl, 2,8 mM de KCl, 2 mM de CaCl2, MgCl2 2 mM, HEPES 10 mM, pH 7,2).
- Ajouter 1 ml BSS solution contenant 2 uM Fura-2 ester acétoxyméthyle (Molecular Probes) dans le plat et enveloppez le plat avec une feuille de protect de la lumière.
- Incuber les cellules pendant 40 min à 37 ° C, puis les laisser pour une période supplémentaire la période de 15 min à température ambiante pour permettre l'hydrolyse des esters d'être achevé. Laver les cellules avec BSS deux fois.
- Monter l'antenne sur la scène de Nikon TE200 microscope inversé, qui est relié à PTI spectrofluorimètre, avec des longueurs d'onde d'excitation à 350 et 390 nm et une émission à 510 nm. Les longueurs d'onde d'excitation exactes à être utilisés peuvent légèrement varier en fonction de l'optique de chaque système individuel. Les deux longueurs d'onde avec le meilleur rapport dynamique sont déterminées par spectre d'excitation de balayage de Fura-2 dans des solutions contenant le sel de Ca 2 + comprise entre 0 et 39,8 microns (ou concentration plus élevée à laquelle la fluorescence Fura-2 est saturé).
- Mettre en place un système de perfusion par gravité avec 4 solutions différentes dans BSS: Ca 2 + (2 mM), EGTA (0,5 mM), EGTA-TG (thapsigargine, 5 uM), Ca 2 +-2-APB (un inhibiteur de SOCE, 75 uM). Contrôlé par ordinateur automatisé perfusiSystèmes sur peut également être utilisé.
- Sélectionnez les cellules exprimant DP en mode visualisation.
- Placez l'extrémité d'ouverture du système de perfusion à un grossissement de 10x jusqu'à la pointe est juste au-dessus de la région d'intérêt à un angle de 45 degrés.
- Enregistrer simultanément les signaux de fluorescence F et F 350nm 390nm. Ratio (F 350nm / F 390nm) est affiché dans la troisième fenêtre. Changer les solutions de perfusion dans l'ordre suivant: Ca 2 +; EGTA; Ca 2 +; EGTA-TG; Ca 2 +; Ca 2 +-2-APB.
Le protocole ci-dessus peuvent être modifiées pour la mesure de concentration intracellulaire de Ca 2 + dans le système de suspension cellulaire.
- Culture KYSE-150 cellules dans un ballon T25 avec la condition même culture que ci-dessus.
- Lorsque les cellules atteignent 90% de confluence, retirez le support et rincer les cellules avec une solution BSS.
- Ajouter 2,5 ml BSS solution contenant 2 uM Fura-deux heures et incuberles cellules pendant 40 minutes à 37 ° C, suivie par désestérification.
- Retirez le BSS, ajouter 2,5 ml de trypsine dans le flacon et incuber à 37 ° C jusqu'à ce que les cellules se détachent. Puis ajouter 2,5 ml du milieu de culture pour arrêter le traitement à la trypsine et de récolter les cellules par centrifugation à 800 rpm pendant 5 min.
- Laver les cellules avec un milieu de culture One More Time par centrifugation et remettre en suspension culot des cellules dans une solution BSS (sans addition de 2 mM de CaCl2, contenant gamme uM Ca 2 +) et de compter le nombre de cellules en utilisant un hematometer.
- Ajouter ~ 10 6 cellules dans une cuve en quartz (10 mm, les cellules Starna) et de remplir le volume à 2 ml avec BSS.
- Placer la cuvette (en remuant avec un barreau magnétique) dans le spectrofluorimètre.
- Enregistrer simultanément les signaux de fluorescence F et F 340nm 380nm de longueur d'onde d'émission à 510 nm. Le protocole en cours d'exécution est la suivante: BSS, plus de 0,5 ul EGTA (0,25 M de stock), plus de 1 pl thapsigargine(TG, 10 mm Stock), plus de 4 pi Ca 2 + (1 stock M).
2. Dosage de trempe Mn dans les cellules cultivées
- Effectuer longueur d'onde d'excitation de balayage de Fura-2 dans des solutions contenant du Ca 2 + différents concentration allant de 0 à 39,8 pM pour déterminer la longueur d'onde indépendante de la concentration de Ca en tant que point isobestique. Habituellement, le point est à isosbestique ou autour de 360 nm.
- KYSE-150 cellules sont cultivées dans fond de verre plats et chargé avec Fura-2 AM.
- Mettre en place le système de perfusion avec 5 solutions différentes BSS: Ca 2 + (2 mM), EGTA / TG (0,5 mM et 5 uM, respectivement), Mn 2 + (0,5 mM, sans addition d'EGTA ou Ca 2 +, contenant libre Ca 2 + dans la gamme M), Mn 2 + / 2-APB (75 uM), EGTA / Triton X-100 (0,1%).
- Monter le plat sur la platine du microscope et de sélectionner le «Ratio d'excitation" mode avec des longueurs d'onde d'excitation à 360 nm et 390 nm et d'émission à 510nm.
- Enregistrer simultanément les signaux de fluorescence F 360 Nm et F 390nm avec le rapport (F 360nm / 390nm F) affichées dans la fenêtre du troisième. Le protocole en cours d'exécution est la suivante: Ca 2 + pendant 1 min pour stabiliser la fluorescence, Mn 2 + pendant 30 secondes, l'EGTA / TG pendant 10 min, Mn 2 + pendant 2 min, EGTA-Triton X-100 (0,1%) pendant 1 min pour obtenir la lecture de fond. Mn 2 + / 2-APB solution peut être utilisée à la place de Mn 2 + à examiner la trempe aboli la fluorescence, ce qui indique que l'entrée Mn 2 + se fait par voie SOCE.
3. Dosage de trempe Mn dans les cellules musculaires
- C2C12, une lignée cellulaire de souris myogénique, est cultivé sur fond de verre plats dans atmosphère de CO 2 5% à 37 ° C en milieu DMEM contenant 10% de sérum fœtal bovin, sérum de cheval 10%.
- Après que les cellules atteignent la confluence, le milieu de culture est changé en milieu de différenciation (retirer sérum de veau fœtal et la réductionsérum de cheval e à 2,5%). Les myoblastes C2C12 permettra de différencier en myotubes après 4 jours.
- Calcul C2C12 myotubes avec une concentration finale de 5 M Fura-2 AM tel que décrit dans 01.04 à 01.06.
- Ajouter une concentration finale de 20 pM N-benzyl-p-toluène sulfonamide (BTS) pour inhiber les contractions musculaires et des artefacts de mouvement causé par eux et de permettre 15 min avant le début du test.
- Monter l'antenne sur la platine du microscope relié au dispositif de PTI et charger les solutions suivantes BSS dans le système de perfusion: 2 Ca 2 + (2 mM), 0 Ca 2 +, Mn 2 + (0,5 mM); Mn 2 + / TG (0,5 mM, 20 uM, respectivement).
- Mettre en place le système de perfusion tel que décrit ci-dessus.
- Enregistrer simultanément les signaux de fluorescence F 360 Nm et F 390nm avec le ratio (F 360nm / 390nm F) s'affiche dans la fenêtre du troisième. Le protocole en cours d'exécution est la suivante: 2 Ca 2 + pendant 1 min, 0 Ca 2 + pendant 1 min à flush loin de Ca 2 +, Mn 2 + pendant 0,5 min, Mn 2 + / TG pendant 10 min, et Mn 2 + / EGTA-Triton X-100 (0,1%).
4. SOCE spatialement et temporellement résolue dans les fibres musculaires à la peau
- Préparer les solutions suivantes.
Isotonique tampon Tyrode: 140 mM de NaCl, 5 mM de KCl, 10 mM d'HEPES, 2 mM de MgCl2, 2,5 mM CaCl 2, pH 7,2, 290 mosm
Milieu de culture: DMEM avec 2% de sérum de cheval et 1% de pénicilline et la streptomycine
Solution de lavage N ° 1: 109,6 mM de K-glutamate, 2 mM EGTA de KOH, 6,7 mM MgCl 2, 2 mM d'ATP, 6 mM de phosphate de créatine (CP), 20 mM de N, N-bis (2-hydroxyéthyl)-2-aminoéthanesulfonique l'acide (BES) de KOH, pH 7,0
Laver la solution n ° 2: 140 mM K-glutamate, 5 mM EGTA-KOH, 6,5 mM MgCl 2, 2 mM d'ATP, 6 mM CP, 20 mM BES-KOH, pH 7,0
Le dépeçage de solution: 140 mM de K-glutamate, 6,5 mM MgCl 2, 2 mM d'ATP, 6 mM CP, 20 mM BES-KOH, pH 7,0
TT-chargementSolution: 90,6 mM de K-glutamate, 18 mM de Na-glutamate, 0,55 mM de CaCl 2, 2 mM EGTA de KOH, 6,7 mM MgCl 2, 5,4 mM d'ATP, 15 mM de CP, 0,0025 mg / ml de la créatine kinase (CK), 20 mM BES-KOH, 5 uM carbonyle du cyanure de p-trifluoromethoxyphenylhydrazone (FCCP), pH 7,0, 7,0 pCa
SR chargement solution: 107,8 mM de K-glutamate, 0,98 mM de CaCl 2, 2 mM d'EGTA-KOH, 6,6 mM MgCl 2, 5,4 mM d'ATP, 15 mM de CP, 0,0025 mg / ml CK, 20 mM BES-KOH, 5 uM FCCP, pH 7,0, 6,6 pCa
Solution SR appauvrissant: 100 mM de K-glutamate, 40 mM de Na-glutamate, 10 mM EGTA de KOH, 10 mM de 1,2-bis (o-aminophénoxy) éthane-N, N, N ', N'-tétraacétique (BAPTA ), 0,35 mM de MgCl2, 0,5 mM ATP, 1 mM de CP, 20 mM BES-KOH, 5 uM FCCP, pH 7,0. 25 mM caffeine/20 uM (TG) thapsigargine sont ajoutés avant les expériences. - Pour disséquer le muscle long extenseur des orteils (EDL) les muscles, tout d'abord fixer les souris et d'organiser la jambe en position latérale, puis retirez la peau de la zone de la cheville jusqu'au genou, coupezles couches musculaires superficielles de tissu pour exposer l'EDL, et de rompre à la fois les tendons supérieurs et inférieurs pour libérer le muscle EDL intact, il est important de garder les tendons aussi longtemps que possible. L'EDL est transféré à une solution de Tyrode contenant 0 Ca 2 + et de 0,1 mM EGTA pour éviter des contractions.
- En vertu d'un stéréomicroscope, utiliser deux pinces pour tenir les tendons d'insertion inférieures et de diviser le muscle EDL en deux faisceaux. Répétez le processus pour obtenir 4 puis 8 faisceaux. Il est essentiel que les tendons restent pour chacun des 8 faisceaux à la fin du processus. Si elles sont perdues à partir de certains faisceaux, jetez-les.
- En vertu d'un stéréomicroscope, chaque bande faisceau EDL est griped aux deux tendons et soigneusement tendue jusqu'au 3 ~ 4 séparées des fibres musculaires simples sont laissées intactes avec le tendon des deux côtés.
- Mettre 1 goutte de Ca 2 + tampon Tyrode libre dans le milieu de l'assiette à fond de verre, fixer les bandes EDL droite sur le plat, enlever rapidement autant que possible de lasolution, puis avec du ruban adhésif les deux tendons en utilisant du ruban adhésif résistant à l'eau, et assurez-vous de la bande est bien serré. Laver la première fibre avec la solution de Ca 2 0 + et puis avec une 2,5 mM de Ca 2 + 2 fois la solution. Si la fibre hyper-marchés et des dommages est remarqué, jetez la fibre.
- Si nécessaire, la fibre peut être cultivé pendant 96 heures, qui permet des manipulations génétiques. Laver les 3 fibres fois avec milieu de culture complet et ajouter 2 ml de milieu dans le plat, le lieu de 5% de CO 2 et 37 ° C incubateur. Avant chaque expérience, d'examiner les fibres musculaires et de jeter ceux sans stries claires ou avec des signes de contamination, ou avec des signes de dommages tels que la contracture de la membrane du sarcolemme. Fibres bonnes répondre à KCl, la stimulation électrique, et la stimulation de la caféine.
- Fibres musculaires simples sont lavées 3 fois avec la solution de lavage n ° 1 et baigné dans une solution de dépouillement intracellulaire comme avec 500 uM Rhod-5N et 0,5 mM de Ca 2 + pendant 5 min.
- aide d'une aiguille de tungstène fixé à un support de broche, mécaniquement la peau de la fibre sous un stéréomicroscope, permettant tubules transverses (TT) pour refermer automatiquement et à piéger le conjugué Rhod-5N avec le Ca 2 + dans le TT, se laver les fibres dénudées deux fois avec la solution de lavage n ° 2. Le processus de dépouillement mécanique est optimale lorsque moins de 25% de la largeur de la cellule est enlevée pendant le processus de dépouillement.
- Pour charger le SR, fibres dénudées sont incubés avec la solution de dépouillement contenant 20 uM Fluo-5N AM pendant 1 h à température ambiante, suivie de lavages à grande échelle d'# 2 solution de lavage, et incuber pendant 30 minutes supplémentaires pour permettre complète désestérification du colorant.
- Après 30 min, fibres dénudées sont visualisés sous l'objectif 60X du microscope confocal. Images de fluorescence sont acquises à des longueurs d'onde des colorants correspondants (excitation à 543 nm et une émission plus longue que 570 nm pour Rhod-5N; d'excitation à 488 nm et une émission à 530-560 nm pour Fluo-5N). Regions d'intérêt (ROI) sont sélectionnés pour chacun des domaines de colorants chargés.
- Le protocole expérimental est le suivant: TT-chargement solution pour 120 s, SR-chargement solution pour 120 s, SR-épuisement solution pour 400-750 s pour épuiser le Ca 2 + magasin. Au cours de ce processus, des changements dans l'intensité Rhod-5N (TT Ca 2 +) et Fluo-5N intensité (SR Ca 2 +) sont enregistrées, la création d'une détermination de parcours moment de changements de fluorescence par rapport à la TT et SR. Les valeurs moyennes de l'intensité de fluorescence à partir de fibres multiples sont analysés ultérieurement. L'intensité maximale de chargement à la fin de TT / SR-chargement est normalisée à 100%.
5. Les résultats représentatifs
Nous avons examiné l'activité SOCE dans KYSE-150 en utilisant des cellules intracellulaire de Ca 2 + de mesure (Fig. 2.). Utilisation de DP en tant que journaliste, nous avons pu sélectionner les cellules transfectées avec le plasmide individuels shRNA spécifique contenant orai1 contre, un gène codant pour la c SOCEHannel. En comparaison avec les cellules transfectées avec des plasmides contenant ruée shRNA (trace noire), le. Abattre des Orai1 résultats de l'activité de protéines SOCE diminué (rouge trace)
SOCE dans KYSE-150 cellules a également été confirmé avec le Mn 2 + test trempe (Fig 3.). La longueur d'onde d'excitation de 360 nm indique le point isobestique de Fura-2, où la fluorescence est indépendante de la concentration de Ca 2 +. Après TG complètement épuisé ER Ca 2 + magasins, la perfusion de Mn 2 + conduit à une diminution significative de la fluorescence. L'activité globale SOCE peut être mesurée par le taux de diminution de Fura-2 intensité de fluorescence avec une pente plus raide indiquant une SOCE plus actif, tandis qu'un sens SOCE une pente plus faible moins actif. La pente de la diminution de la fluorescence dans le 2-APB cellules traitées semble être beaucoup moins profond, ce qui indique que l'activité SOCE a été bloquée par ce composé. Le Mn2 + taux d'extinction ont été déterminées à partir du bilan des 10 premières secondes, où la trempe était encore dans la gamme linéaire sans saturation.
Une semblable Mn 2 + test trempe a été réalisée dans le muscle (Fig. 4.). Dans ce cas, Mn 2 + a été appliqué avec TG. Alors que TG a été d'épuiser les Ca 2 + magasins, la pente extinction de la fluorescence progressivement changé jusqu'à ce qu'il atteigne sa vitesse maximale. La courbe sigmoïde indique l'activation graduelle de SOCE dans ces conditions expérimentales.
Saine et intacte d'fibres musculaires simples dans la culture ont montré stries claire et uniforme, pas de signes de contaminations, et aucun signe de contraction induite par les dommages. Ces fibres ont pu contracter en réponse à une stimulation électrique ou des solutions dépolarisants. En vertu de l'imagerie confocale, le piégeage de fibre dépouillé de Rhod-5N colorant dans le compartiment TT a montré le modèle doublet caractéristique des mammifères (visumarginalisés dans le canal rouge). Après le chargement de la SR avec Fluo-5N AM, le modèle SR typique ponctuée était visible (dans le canal vert). Sur la perfusion de la fibre à la peau avec une solution de chargement TT / SR, l'intensité de fluorescence des deux Rhod-5N et Fluo-5N augmenté; sur la perfusion avec une solution appauvrissement SR, les niveaux de fluorescence dans le compartiment SR et le compartiment TT a commencé à diminuer, ce qui indique un couplage étroit entre les SR de Ca 2 + et l'appauvrissement de magasin activation SOCE, respectivement (figure 5.).
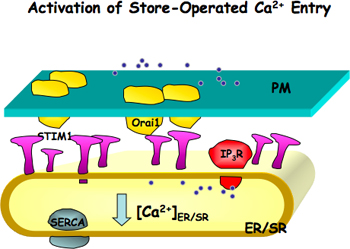
Figure 1. Activation du magasin-Ca 2 + entrée (SOCE). Orai1, une unité de formation d'pore du canal, est situé sur la membrane plasmique (PM) et STIM1, une sonde de Ca 2 +, est situé sur le réticulum endoplasmique ou sarcoplasmique (ER / SR) membranes. Lorsque ER / SR Ca 2 + sont réduits soit à cause du blocage des ER / SR Ca 2 + pompe (SERCA) ou la libération de Ca 2 + par IP 3 récepteur ou récepteur de la ryanodine, STIM1 est activé. Activées STIM1 molécules forment des taches et d'induire l'agrégation de Orai1, ce qui conduit en outre l'activation de SOCE.
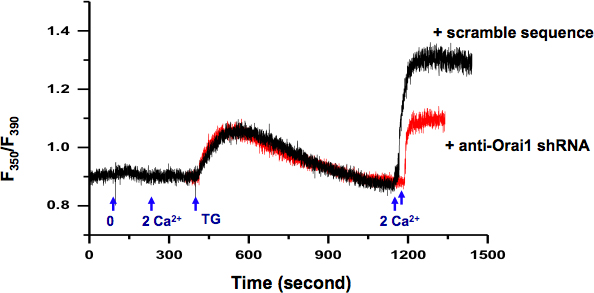
Figure 2. Mesure de la concentration intracellulaire de Ca 2 + dans KYSE-150 cellules. Echange de solution extracellulaire de 0 Ca 2 + (0,5 mM EGTA) à 2 mM de Ca 2 + n'a pas induit de changement de la concentration intracellulaire de Ca 2 +. 5 uM TG en 0 Ca 2 + bain de solution induite passive ER libération de Ca 2 +. Après ER Ca 2 + ont été épuisés (> 10 min), l'ajout de Ca 2 + extracellulaire (2 mM) a activé un soutenue intracellulaire de Ca 2 + d'élévation par les SOCE, qui peut être bloquée par les inhibiteurs Socés, par exemple, SKF-96365 et 2 - APB (données montrent pas). Les cellules transfectées avec des plasmides contenant shRNA spécifiquement contreorai1 (rouge) a démontré de façon significative SOCE réduite que les cellules transfectées avec une séquence de brouillage (noir).
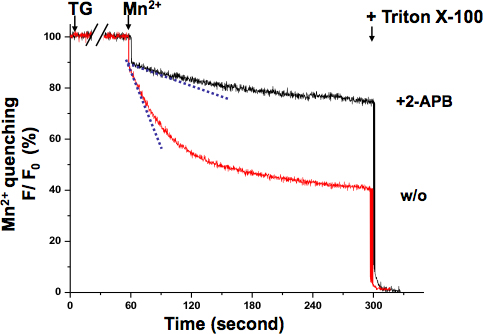
Figure 3. Mn 2 + test trempe de SOCE dans KYSE-150 cellules. La trempe de Fura-2 de fluorescence par le Mn 2 + (0,5 mM) a été mesurée à l'onde d'excitation de Ca 2 +-indépendante de Fura-2 (360 nm). Les cellules ont été traitées avec 5 uM TG pendant 10 min pour épuiser complètement ER de Ca 2 + magasins. La pente de décroissance de la fluorescence Fura-2 sur Mn 2 + plus (les traits pointillés, dans le premier 10 sec) représenté l'activation de SOCE, qui a été exprimée en pour cent de diminution de la fluorescence par unité de temps (la valeur initiale de 100%). Le signal de fluorescence maximale trempé a été créé à la fin de l'expérience par la lyse des cellules avec 0,1% de Triton X-100 (à 0%). Les cellules traitées avec le 2-APB (75 uM) a démontré une plus faible bienla pente, ce qui suggère SOCE est bloqué par ce composé dans KYSE-150 cellules.
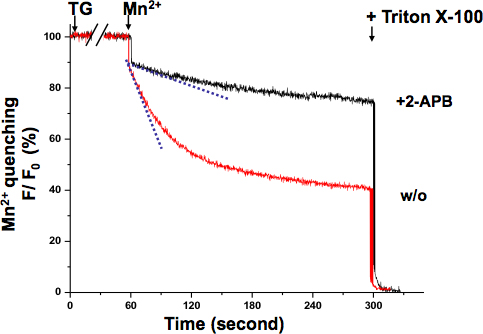
Figure 4. Activation graduée de SOCE dans les cellules musculaires ont révélé par le Mn 2 + test trempe. Activation de SOCE pourrait être enregistré en TG a été appauvrissant SR Ca 2 + magasins. L'application simultanée de Mn 2 + (0,5 mM) et TG (20 uM) induit une diminution graduelle et sigmoïde du intracellulaire Fura-2 fluorescence (ligne pointillée cyan pour montrer le point le plus rapide de trempe), qui est distincte de la formation initiale Mn 2 + trempe taux (ligne pointillée bleue). Mn 2 + trempe pente est resté presque le même que le niveau basal dans les cellules traitées 2-APB (75 uM), ce qui suggère que SOCE a été inhibée.
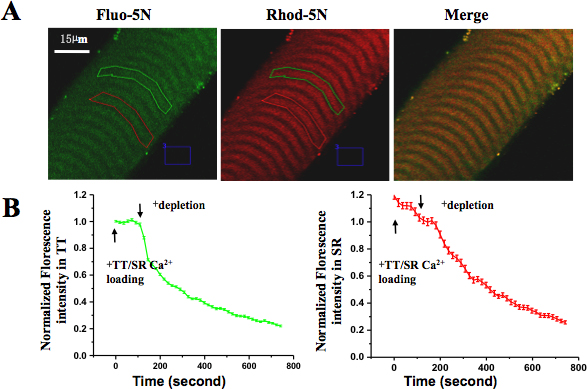
Figure 5. Spatialement et temporellement résolue SOCE en fibre musculaire pelée. (A) Rhod-5N sel a été chargé dans TT et Fluo-5N AM a été chargé dans SR. (B) Après l'application de Ca 2 + solution appauvrissement de la couche, la fluorescence dans les deux compartiments et TT RS a diminué. La perte de Fluo-5N fluorescence indique rapidement libéré Ca 2 + contenu et la perte de Rhod-5N fluorescence suggéré l'activation de SOCE.
Discussion
Bien que les longueurs d'onde d'excitation pour le Ca 2 +-contraignant et Ca 2 + libre Fura-2 sont de 340 nm et 380 nm, respectivement, la meilleure gamme de rapport dynamique de Fura-2 pour le Ca 2 + mesure de la concentration peut se produire à des longueurs d'onde autres dans un particulier Système de microscope. De tels changements de longueur d'onde sont généralement dues à des changements dans le chemin optique avec l'addition des différents composants optiques. Dans cette étude, les longueurs d'onde d'excitation pour Fura-2 ont été déterminées comme 350 nm et 390 nm en effectuant une analyse spectrale de la fluorescence Fura-2.
Le intracellulaire de Ca 2 + dans les résultats du cytosol à partir d'un bilan de plusieurs sources, y compris intracellulaire de Ca 2 +, Ca 2 + extracellulaire entrée, ainsi que le Ca 2 + mécanisme d'exclusion à la membrane du RE et du plasma. Pour isoler le unidirectionnelle SOC-médiation Ca 2 + afflux de Ca 2 + intracellulaire de libération et de Ca 2 + extrusion, le Mn 2 + dosage trempe peut être utilisé. Mn 2 + est connu pour être capable de pénétrer dans les cellules par l'intermédiaire SOCE mais est imperméable à l'extrusion de membrane de surface ou de l'absorption ER par Ca 2 + pompes. Par conséquent, extinction de la fluorescence représente une mesure de unidirectionnel Mn 2 + dans des cellules de flux qui estime le degré d'activation de SOCE. Mn 2 + dosage trempe est effectuée au point isobestique, à longueur d'onde telle Fura-2 intensité de fluorescence est indépendante de la concentration de Ca 2 +. Le point isobestique pour chaque système doit être déterminé par balayage du spectre. En variante, Mn 2 + trempe peut être enregistrée par fluorescence ajusté à des deux longueurs d'onde de telle sorte que la valeur finale est indépendante de la concentration de Ca 2 + 13.
Pour obtenir de l'information spatiale et temporelle de l'activité de SOCE dans les muscles squelettiques, nous avons employé une méthode à double colorant, ce qui permet MeasureMe simultanéent de l'activité SOCE et Ca 2 + contenu dans peau de mammifères adultes fibres musculaires EDL. La corrélation entre les variations de Ca 2 + contenu et SOCE activité peut être tracée pour indiquer le seuil et la sensibilité de l'activation SOCE à l'appauvrissement de la Ca SR de stockage de 2 +. La solution TT-chargement est optimisé pour de plus charger les T-tubules avec le Ca 2 + et pour l'amorçage des T-tubules et la solution SR-chargement est destiné à promouvoir maximale Ca 2 + et de chargement en outre de charger les T-tubules avec ~ 500 pM Ca 2 +. FCCP est inclus dans la solution TT / SR-chargement, et la solution d'appauvrissement SR pour éliminer les effets de la mitochondrie.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Nous remercions le Dr Noah Weisleder pour la lecture et l'édition de ce manuscrit. Ce travail a été soutenu par des subventions de recherche de la Fondation UMDNJ 62-09 à ZP, l'American Heart Association SDG2630086 à XZ, 0535555N à MB, et National Institutes of Health RC2AR058962-01 à MB.
matériels
Table des réactifs spécifiques et des équipements:
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| RPMI 1640 | Mediatech | 10-040-CV | |
| Ham F-12 | Mediatech | 10-080-CV | |
| DMEM | Mediatech | 10-013-CV | |
| Vaisselle à fond de verre | MatTek | P35G-1.5-14-C | |
| Fura-2 AM | Invitrogen (Molecular Probes) | F1221 | -20 ° C, l'étanchéité, à l'abri de la lumière, dissous dans le DMSO |
| Fluo-5N AM | Invitrogen (Molecular Probes) | F14204 | -20 ° C, joint étanche à l'abri de light |
| Rhod-5N | Invitrogen (Molecular Probes) | R14207 | -20 ° C, l'étanchéité, à l'abri de la lumière |
| Quartz Cuvette | Cellules Starna | 3-Q-10 | |
| thapsigargine | Tocris | 1138 | |
| 2-Aminoethoxydiphenylborane (2-APB) | Tocris | 1224 | |
| N-benzyl-p-toluène sulfonamide (BTS) | Sigma-Aldrich | 435600 | |
| Collagénase de type I | Sigma | C0130 |
Equipement:
- Un spectrofluorimètre (Photon Technology International, NJ): au xénon lampe à arc, contrôlé par ordinateur à grande vitesse monochromateur à accès aléatoire, basée sur la cuvette des émissions monochromateur, Nikon TE-200 Microscope inversé à fluorescencee, S Fluor objectif d'huile 40x/1.30, détecteurs de PMT.
- Microscope confocal à balayage laser (BioRad Radiance2100): laser à l'argon 453/477/488/514, laser HeNe 543 nm, Nikon TE2000 microscope inversé, objectif 60X (NA 1.4, huile).
- Un stéréomicroscope avec une puissance> 100 grossissement (Zeiss Stemi SV11 Apo).
Références
- Parekh, A. B., Putney, J. W. Store-operated calcium channels. Physiol. Rev. 85, 757-810 (2005).
- Ma, J., Pan, Z. Retrograde activation of store-operated calcium channel. Cell Calcium. 33, 375-384 (2003).
- Feske, S. ORAI1 and STIM1 deficiency in human and mice: roles of store-operated Ca2+ entry in the immune system and beyond. Immunol. Rev. 231, 189-209 (2009).
- Parekh, A. B. Store-operated CRAC channels: function in health and disease. Nat. Rev. Drug Discov. 9, 399-410 (2010).
- Pan, Z. Dysfunction of store-operated calcium channel in muscle cells lacking mg29. Nat. Cell Biol. 4, 379-383 (2002).
- Shin, D. W. A retrograde signal from calsequestrin for the regulation of store-operated Ca2+ entry in skeletal muscle. J. Biol. Chem. 278, 3286-3292 (2003).
- Ma, J., Pan, Z. Junctional membrane structure and store operated calcium entry in muscle cells. Front Biosci. 8, d242-d255 (2003).
- Pan, Z., Damron, D., Nieminen, A. L., Bhat, M. B., Ma, J. Depletion of intracellular Ca2+ by caffeine and ryanodine induces apoptosis of chinese hamster ovary cells transfected with ryanodine receptor. J. Biol. Chem. 275, 19978-19984 (2000).
- Hirata, Y. Uncoupling store-operated Ca2+ entry and altered Ca2+ release from sarcoplasmic reticulum through silencing of junctophilin genes. Biophys. J. 90, 4418-4427 (2006).
- Zhao, X. Enhanced resistance to fatigue and altered calcium handling properties of sarcalumenin knockout mice. Physiol. Genomics. 23, 72-78 (2005).
- Zhao, X. Azumolene inhibits a component of store-operated calcium entry coupled to the skeletal muscle ryanodine receptor. J. Biol. Chem. 281, 33477-33486 (2006).
- Launikonis, B. S., Barnes, M., Stephenson, D. G. Identification of the coupling between skeletal muscle store-operated Ca2+ entry and the inositol trisphosphate receptor. Proc. Natl. Acad. Sci. U.S.A. 100, 2941-2944 (2003).
- Shuttleworth, T. J. Temporal relationships between Ca2+ store mobilization and Ca2+ entry in an exocrine cell. Cell. Calcium. 15, 457-466 (1994).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon