このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
2Dと3D環境での神経前駆細胞の電界制御監督移行
要約
このプロトコルは、細胞を追跡することができますカスタム設計electrotactic室で2Dと3D環境を確立するために使用されるメソッドを示しています生体/ ex vivoでの直流(DC)電界(EFS)を指示する走電性および他の細胞応答を調べるために、単一細胞レベルでの経時的記録を使用します。
要約
内因性電界(EFS)は、生体内で自然に発生し、中枢神経系の1,2のことを含め、組織/臓器の開発と再生時に重要な役割を果たしている。これらの内因性排出係数は、細胞や組織の電気抵抗と組み合わせてイオン輸送の細胞調節によって生成されます。それが適用され、EF治療は、動物およびヒトにおける3,4 -脊髄損傷の機能的な修復を促進することが報告されている。特に、EF主導細胞遊走は、神経前駆細胞(NPCに)7,8を含む細胞の種類5,6、多種多様な、で実証されている。直流(DC)排出係数の適用は、ほとんどの研究室で一般的に使用可能なテクニックではありません。我々は以前5,11細胞や組織文化へのDCの排出係数の適用のための詳細なプロトコルを記述している。ここでは2Dを設定するには、計算された電界強度に基づいて、標準的な方法のデモビデオを提示dは3DはNPCのための環境、および2Dの単一細胞の成長条件、および3Dの器官脊髄スライスの両方でEFの刺激に対する細胞応答を調査する。 cytoarchitectonic組織の組織が 十分にこれらの培養9,10内に保存されているため、脊髄cordsliceは、移植後、NPC ex vivoでの動作を研究するための理想的な受信者の組織である。さらに、このex vivoでのモデルはまた、単一細胞レベルでの経時的記録を用いたin vivo で細胞を追跡することは技術的に可能ではありません手順をすることができます。それは、2D環境ではないだけでなく、 生体内環境では真似の3D器官の状態で細胞の挙動を評価することが決定的に重要である。このシステムは 、in vitro 及び ex vivo における単一細胞遊走の3Dトラッキングと組織又は器官培養にカバーガラスベースディッシュを用いた高分解能イメージングを可能にし、viで上に移動する前の中間ステップことができますVOのパラダイム。
プロトコル
1。神経前駆細胞の分離
- E14-16マウスと冷たいDMEM/F12培地の場所から全体の脳を解剖する。 35ミリメートルのペトリ皿に解剖顕微鏡および転送の脳の下にあるすべての髄膜を除去します。
- 機械的に組織の断片に脳を分離し、15 mlのチューブにそれらを転送するために微細な鉗子を使用し、破片を除去するために3分間800rpmでサンプルを遠心します。
- DMEM/F12含むbFGFおよびEGFを追加し、1 mlのピペットでひいて粉にする。
- 単一の細胞懸濁液を得るために、セルストレーナーを介して細胞懸濁液を渡します。
- 2から5×10 4細胞/ mlのフラスコに細胞をプレートしてから、6日毎3日ごとに、通路の細胞を完全培地の変更を実行します。
- 少なくとも5つの継代後、ダイジェストは単一の神経細胞にトリプシンとEDTAを使用してpoly-D-lysine/laminin-coated electrotactic室(2に後述するように調製した)上に成長。 、N2-サプリメントを含む成長培地を使用します。bFGFおよびEGFはすべての回でNPCの特性を維持します。
2。 electrotactic室の準備
- ダイヤモンドペンを使用して半分にオートクレーブ処理22×22ミリメートルNo.1の厚さのカバーを割ってガラスの22×11ミリメートルストリップを準備します。
- 接着でよくインテリア寸法22×10 mmの自立ガラスを作成します。一緒に4垂直に高真空用シリコーングリースを持つ22×11ミリメートルストリップを立っている。井戸は完全に一晩乾燥し、硬化することができます。
- 次の日、シリコーングリースを使用して、100 mmの培養皿の底に、10 mmのギャップを残して互いに平行に、2つの22×11 mmのガラス板を取り付けます。センターに最も近いことが三方にグリースを皿の底に取り付けられたそれぞれの端に22×22 mmのカバースリップを配置することにより、これらのストリップとの間の領域、ではなく、を封印。
- カバー内部の壁はシードのために限られたスペースを作成するように、スリップの上にも、ステップ2.2で調製したガラスを配置しプレートの底に細胞。シリコーングリースの耐水すべての関節。その後順次、ポリ-D-リジンでコートこの狭い領域をラミニン:チャンバー内に1ミリリットルポリ-D-リジンを追加して、ポリ-D-リジンプレートの底にバインドできるようにするために5分間のままに、チャンバを洗う滅菌したPBSで2回、その後20μg/ mlを得、プレートの底をカバーするために使用する滅菌PBSにラミニンを薄める。一晩室温で残す。
- 次の日、収穫細胞と1×104細胞を含む懸濁液1 mlを準備します。それは完全に乾燥空気、細胞懸濁液1ミリリットルに置き換えることができ、よくガラスからラミニンを削除します。添付ファイルを可能にするために4時間の最低37℃インキュベーターで皿を置きます。
- 細胞が十分にコンフルエントになったらチャンバーからすべてのメディアを削除します。慎重によくガラスを削除します。シリコーングリース、オートクレーブ22×22 mmのカバーガラスで、慎重に取り付けることによって、細胞上の屋根を形成する2つの22×11 mmのストリップ間のブリッジ。乾燥を避けるために媒体の数滴を持つ細胞をカバーしています。
- 室の屋根上の皿の一方の端から他に実行する2つの水密性シリコーングリースの障壁を作成することで、チャンバーの各端部に分離された媒体の貯水池を形成します。フロースルー1培地リザーバから他のを確保し、新鮮培地でチャンバーを記入してください。細胞の回復を可能にするために12時間インキュベーターに皿を返します。
3。 electrotactic室への電界の印加
- 二つの穴は、移行室の各貯水池の上に配置1をドリルで皿を覆うように蓋を準備します。
- 25mMのHEPES緩衝液を含む培地でチャンバー内にすべての媒体を交換して温度制御された撮像システムに皿を転送します。タイムラプス、マルチポジション記録のための実験パラメータを設定します。陰極と陽極であるように、チャンバーの位置を合わせますそれぞれ左右と上、EFベクトルが実行されるように水平に顕微鏡下に表示およびイメージングシステムに記録されます。
- Steinberg社のソリューション(58 mM塩化ナトリウム、0.67 mMの塩化カリウム、0.44 mMのカルシウム(NO 3)2·4H 2 0、1.3 mMのMgSO 4を 0.7 H 2 Oおよび4.6 mMのTrizma塩基、pH7.4)で2つのビーカーを記入してください。 2%(W /で満たされた、あらかじめ用意したガラスの橋を(〜13センチ、直径〜3ミリメートルのガラス管と、ブンゼン炎で加熱することによりU字型に曲げ)を使用して、各媒体タンクに別々のビーカーを接続蓋の穴を通過v)のSteinberg's寒天ソリューションを提供しています。 Steinberg社のソリューションの各ビーカーに直流電源に接続されたAg / AgCl電極の電極を配置することによって電気回路を完成させます。
- 0とに切り替えるには、電源の電圧、ダイヤルを設定します。電圧計を使用して、電圧、ダイヤルを回しながらelectrotactic室の両端の電圧を測定し、実験的な要件に合わせて調整します。
- タイムラプス録画を開始します。培地交換を行い、時間ごと、必要に応じて、電圧を再調整します。必要に応じて新鮮な培地、薬物または化学物質は、貯水池に追加することができます。培地交換を実行するときに、2つのオプションは以下のように考えることができます。
- オプション1番 - 一時的に休止タイムラプス録画をするには、慎重に、カバーの蓋を乱す避けるために、チャンバーからガラスブリッジを削除するには、新鮮な培地にすべての媒体を交換して静かに滅菌パスツールピペットを使用して、ガラスの橋を元に戻し、次に録音を再開します。
- オプションNo.2は - あるいは、カスタムも培地交換の目的に使用することができる4つの穴(2は、移行室の各貯水池の上に配置)とカバーの蓋を作りました。ガラスのブリッジ接続用の2つ、他の2つのメディアを変更する。オプション2は、培地交換時の干渉を受けずに連続記録することができます。
4。器官脊髄スライスの準備
- ラム解剖2週齢のC57 BL / 6マウスのAR脊髄。
- マッキルウェーン組織チョッパで500μmの厚さのセクションに脊髄のスライス。
- 独立した解剖顕微鏡下でスライスはそのまま軸/矢脊髄構造を持つスライスを選択します。
- マトリゲルのタンパク質が生成するために自己集合するまで、30μlのマトリゲル、それらを配置するを含む35ミリメートルのペトリ皿のプレートスライスはできるだけ中心に近い、少なくとも30分間37℃5%CO 2インキュベーター内で、それらを維持する脊髄スライスの表面を覆う薄膜。それは完全に、別の30分、必要に応じて37℃でペトリ皿をインキュベートマトリゲルが組み立てされていることを確認することが非常に重要です。
- スライス上に直接メディアフローを回避するために、25mMのHEPES緩衝液と非常に穏やかになるように15から20パーセントのウシ胎児血清を含む4〜6ミリリットルDMEM/F-12培地を追加します。スライスが完全にウェルに露出した外植片の表面を残して、培地中に浸漬されていないことを確認空気。週2回培地を変更します。
5。器官、脊髄スライスにヘキスト33342というラベルの付いたNPCの注入
- 1でNPC懸濁液を調製×10 6細胞/μlの。
- 30分間、5μMHoechst 33342で培地中の細胞懸濁液をプレインキュベートする。
- 顕微鏡下で徐々に脊髄のスライスに懸濁液2μlを顕微注入するキャピラリーガラス管を使用しています。キャピラリーガラス管は、マトリゲル(顕微鏡下でピンク色の部分)を通過し、脊髄スライス(顕微鏡下で灰色の組織)の内部に到達していることを確認し、上で実行する細胞懸濁液を避けるために、少なくとも30秒間、脊髄スライスの内部に残る。インキュベーターに脊髄スライスを含むペトリ皿(37℃、5%CO 2)を入れ、一晩そのままにしておきます。
- 次の日、に記載されているメソッドを使用してelectrotacticチャンバー内のヘキスト33342で標識されたNPCを(含まれている脊髄のスライスには500mV / mmのEFを適用する3)。
6。代表的な結果
NPCは、彼らが陰極に向かって非常に指示細胞遊走(図1)を示した生理的な排出係数の範囲にさらされたとき。同じ観測はまた器官脊髄スライスを ex vivoモデルの単一細胞レベル、 生体内条件下で模倣し、3D環境(図2)で行われた。
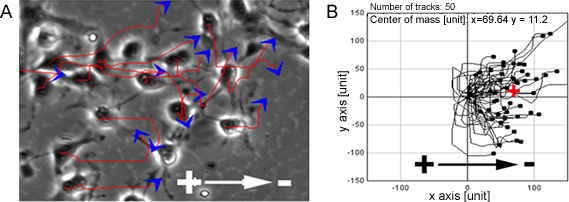
図1。 NPCには、EFSの指示への移行を示しています 。排出係数にさらされたときのPCは陰極に向かって非常に向け移行を示し、赤線と青の矢印は細胞運動の軌跡と方向()を表しています。 Bは、NPCの移行パスを示しています。バー:50μmである。
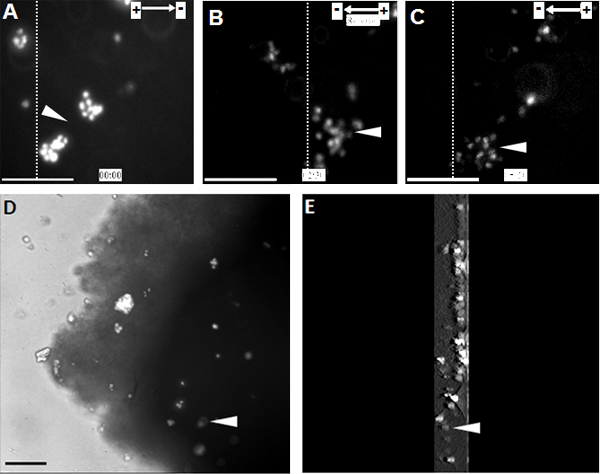
図2。移植されたNPCは器官脊髄スライスのカソードに向け移行を示す 。 (A)ヘキスト33342で標識されたNPCは、EF治療の開始点での器官、脊髄スライスに移植した。 NPCはEFの極性が反転された時点で、2.5時間のためのカソード、(B)に向かって一方向に移行しました。 EFの極性を変更すると、新しい陰極(C)に向かって走電性の鋭い逆転を引き起こした。 (D)タイムラプス録画の終了時に脊髄スライス内に移植されたNPCのイメージ。 (E)脊髄スライス内に移植されたNPCの三次元再構成。 3Dスキャニングのセクションでは、スライスの下部中央からの開始と終了、厚さは300μmであった。点線は反転、初めに移植された細胞の同じ人口の相対的な位置を示しており、EF治療のエンドポイント(A - それぞれC、A)。アローヘッドは、ヘキスト33342標識されたNPCの同じ人口を示しています。バー:50μmである。
ディスカッション
我々が使用するプロトコルは、以前の研究5,11に基づいています。標準化された寸法精度のカスタム設計electrotacticチャンバー内で培養した細胞またはスライスに、寒天橋、Steinberg社のソリューション、及びAg / AgCl電極電極を介してEFを適用しながら、これらのメソッドを使用して、安定した文化や電流条件を維持することができる。チャンバーの深さが異なるサンプルに対応するため?...
開示事項
我々は、開示することは何もありません。
謝辞
この作品は、BSに王立協会URF助成UF051616、英国、欧州研究評議会STG助成金243261によってサポートされていました。 MZラボでの作業は、再生医療助成RB1-01417のカリフォルニア工科大学でサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| FGF-基本的な組換えヒト | インビトロジェン | PHG0026 | 20 ng / mLの |
| EGF遺伝子組換えヒト | インビトロジェン | PHG0311 | 20 ng / mLの |
| N2-サプリメント(100X)液体 | インビトロジェン | 02048 | |
| DMEM/F12培地(高グルコース) | インビトロジェン | 31330-095 | |
| ポリ-D-リジン | ミリポア | -003-E | |
| ナチュラルマウスラミニン | インビトロジェン | 23017-015 | |
| 成長因子の減少基底膜マトリックス(マトリゲル) | BDバイオサイエンス | 354230 | |
| HEPES緩衝液 | ギブコ | 15630 | |
| マッキルウェーン組織チョッパー | ミクル研究所エンジニアリングのCo株式会社 | TC752-PD | |
| ダウコーニング高真空用シリコーングリース | Sigma-Aldrich社 | Z273554 |
参考文献
- Huttenlocher, A., Horwitz, A. R. Wound healing with electric potential. N. Engl. J. Med. 356, 303-303 (2007).
- McCaig, C. D., Rajnicek, A. M., Song, B. Controlling cell behavior electrically: current views and future potential. Physiol. Rev. 85, 943-943 (2005).
- Borgens, R. B., Jaffe, L. F., Cohen, M. J. Large and persistent electrical currents enter the transected lamprey spinal cord. PNAS. 77, 1209-1209 (1980).
- Shapiro, S., Borgens, R., Pascuzzi, R. Oscillating field stimulation for complete spinal cord injury in humans: a phase 1 trial. J. Neurosurg. Spine. 2, 3-3 (2005).
- Zhao, M., Song, B., Pu, J. Electrical signals control wound healing through phosphatidylinositol-3-OH kinase-gamma and PTEN. Nature. 442, 457-457 (2006).
- Yao, L., Shanley, L., McCaig, C. Small applied electric fields guide migration of hippocampal neurons. J. Cell. Physiol. 216, 527-527 (2008).
- Li, L., El-Hayek, Y. H., Liu, B. Direct-current electrical field guides neuronal stem/progenitor cell migration. Stem Cells. 26, 2193-2193 (2008).
- Meng, X., Arocena, M., Penninger, J. PI3K mediated electrotaxis of embryonic and adult neural progenitor cells in the presence of growth factors. Exp. Neurol. 227, 210-210 (2011).
- Bonnici, B., Kapfhammer, J. P. Bone marrow stromal cells promote neurite extension in organotypic spinal cord slice: significance for cell transplantation therapy. Neurorehabil. Neural Repair. 22, 447-447 (2008).
- Shichinohe, H., Kuroda, S., Tsuji, S. Bone marrow stromal cells promote neurite extension in organotypic spinal cord slice: significance for cell transplantation therapy. Neurorehabil. Neural Repair. 22, 447-447 (2008).
- Song, B., Gu, Y., Pu, j. Application of direct current electric fields to cells and tissues in vitro and modulation of wound electric field in vivo. Nature Protocol. 2, 1479-1479 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved