Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
2D ve 3D Ortamlarda Sinir Progenitör Hücreleri Elektrik Alanı kontrollü Yönetmen Göç
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol hücreleri izleyebilirsiniz özel tasarımlı electrotactic odalarında 2D ve 3D ortamlar oluşturmak için kullanılan yöntemler, gösteriyor In vivo / ex vivo Akım (DC) elektrik alanlar (EF'in) yönlendirmek için galvanotaksis / electrotaxis ve diğer hücresel yanıtları incelemek amacıyla, tek hücre seviyesinde time-lapse kayıt kullanarak.
Özet
Endojen elektrik alanlar (EF'in) in vivo doğal olarak bulunur ve merkezi sinir sistemi 1,2 de dahil olmak üzere doku / organ gelişimi ve yenilenmesi sırasında kritik bir rol oynar. Bu endojen EF'in hücre ve dokuların elektriksel direnci ile birlikte iyonik ulaşım hücresel regülasyon tarafından oluşturulur. Bu uygulamalı EF tedavi hayvanlarda ve insanlarda 3,4 omurilik yaralanmalarında fonksiyonel onarım teşvik ettiği bildirilmiştir. Özellikle, EF-yönlendirmeli hücre göçü sinir progenitör hücreleri (NPCs) 7,8 dahil olmak üzere hücre tipleri 5,6 geniş bir yelpazede, kanıtlanmıştır. Doğru akım (DC) EF'in Uygulama en laboratuarlarında yaygın olarak mevcut bir teknik değildir. Biz hücre ve doku kültürleri, daha önce 5,11 DC EF'in uygulanması için ayrıntılı protokoller tanımlamışlardır. Burada 2D bir kurmak için hesaplanan alan gücüne dayalı standart yöntemlerin bir video gösterisi sunmakNPC d 3D ortamlarda, ve 2D hem de tek hücre büyümesi koşullarında EF stimülasyon ve 3D organotipik omurilik dilim hücresel yanıtları incelemektir. Spinal cordslice cytoarchitectonic doku organizasyon iyi bu kültürlerin 9,10 içinde korunmuş çünkü NPC ex vivo davranışları, transplantasyon sonrasında, eğitim için ideal bir alıcı dokudur. Ayrıca, bu ex vivo model de tek hücre seviyesinde time-lapse kayıt kullanılarak in vivo olarak hücreleri izlemek için teknik olarak mümkün değildir prosedürleri sağlar. Bu eleştirel bir 2D ortamda sadece hücre davranışlarını değerlendirmek için gerekli değil, aynı zamanda in vivo ortamda taklit edebilmektedir 3D organotipik durumdadır. Bu sistem sağlayacak in vitro ve ex vivo olarak tek hücre göç 3D izleme ile doku veya organ kültüründe kapak cam tabanlı yemekleri kullanarak ve vi geçmeden önce bir ara adım olabilir yüksek çözünürlüklü görüntülemevo paradigmalar.
Protokol
1. Sinir progenitör hücre izolasyonu
- Soğuk DMEM/F12 bazal orta E14-16 fareler ve yerden bütün beyinleri parçalara ayır. 35 mm petri içine anatomik bir mikroskop ve transfer beyinleri altındaki tüm meninksler çıkarın.
- Mekanik doku parçaları içine beyinleri ayrışır ve 15 ml tüp aktarmak için ince pens kullanın, sonra enkaz kaldırmak için 3 dk süreyle 800 rpm'de örnekleri santrifüj.
- DMEM/F12 içeren bFGF ve EGF ekleyin ve 1 ml pipet ile çiğnemek.
- Tek bir hücre süspansiyonu elde etmek için bir hücre süzgecinden hücre süspansiyonu geçmektedir.
- 2-5 de ölçülü balona Plakalı hücreleri x 10 4 hücre / ml, sonra tam bir orta 3 gün ve geçiş hücreleri her 6 günde bir değiştirmek gerçekleştirmek.
- En az 5 pasajlar sonra, özet neurospheres tek hücrelerin tripsin ve EDTA kullanılarak ve poly-D-lysine/laminin-coated electrotactic odalarına (2, aşağıda tarif edildiği gibi hazırlanmıştır) üzerinde yetişebilir. , N2-takviyesi içeren büyüyen orta kullanınbFGF ve EGF her zaman NPCs özellikleri sağlamak için.
2. Electrotactic haznesi hazırlanması
- Bir elmas kalem kullanarak yarısında 22 x 22 mm kalınlık no.1 lamelleri otoklava Bölünen ile camı 22 x 11 mm şeritler hazırlayın.
- Yapıştırılarak de iç boyutları 22 x 10 mm ayaklı cam oluşturun birlikte dört dikey yüksek vakum silikon gres ile 22 x 11 mm şeritler ayakta. Tamamen kuruması için kuyu ve sertleşmesine gecede izin verin.
- Ertesi gün, silikon yağı kullanılarak bir 100 mm kültürü çanağı baz, 10 mm arasında bir boşluk bırakarak birbirlerine paralel olarak, iki adet 22 x 11 mm ebadındaki bir cam şeritler takın. Merkeze yakın bir 22 x 22 mm kapak üç taraftan gres tabağın tabanına bağlı her iki ucunda kayma, fakat yerleştirerek bu şeritler arasındaki bölgede kapatmak.
- Iyi kapak üzerine adım 2.2 hazırlanmış cam yerleştirin iç duvarları tohumlama için kapalı bir alan yaratmak böylece sığarplakanın alt üzerine hücreleri. Silikon gres Su geçirmez, tüm eklemleri. Coat poli-D-lizin sonra da laminin ile sırayla bu dar bir bölgeyi: haznesine 1 ml poli-D-lizin ekleyin ve poli-D-lizin plakanın alt bağlamak için izin verecek şekilde 5 dakika boyunca terk; haznesi yıkayıp Steril PBS ile iki kez, daha sonra 20 ug / ml verim ve plakanın alt kapsayacak şekilde kullanmak için steril PBS içinde laminin seyreltik. Gece boyunca oda sıcaklığında bırakın.
- Ertesi gün, hasat hücreleri ve 1 x 104 hücre içeren 1 ml süspansiyon hazırlamak. Tamamen kuru hava ve hücre süspansiyonu 1 ml ile değiştirmek için izin de cam laminin çıkarın. Tutturulması için izin vermek üzere 4 saat arasında en az 37 ° C'de inkübatörde çanağı yerleştirin.
- Hücreleri yeterince konfluent olduğunuzda odasından tüm orta kaldırın. Dikkatle de camı kaldırın. Silikon yağ, bir otoklavlanmış 22 x 22 mm cam coverslip ile dikkatlice takarak hücreleri üzerinde bir çatı Formuiki adet 22 x 11 mm şeritler arasındaki köprü. Kurumasını önlemek için orta birkaç damla hücreleri örtün.
- Odanın çatı üzerinde tepsinin bir kenarından diğerine koşmak iki su geçirmez silikon gres bariyerler oluşturarak odasının her sonunda izole bir ortamda rezervuar oluşturur. Bir akış yoluyla bir orta rezervuar diğerine sağlanması, taze aracı madde ile haznesi doldurun. Hücre geri kazanımı için izin vermek için 12 saat için inkübatöre geri dönmek çanağı.
3. Electrotactic odasına bir elektrik alanı uygulanması
- Iki delik, göç odasının her rezervuar üzerine yerleştirilmiş bir delerek çanak kapsayacak bir kapak hazırlayınız.
- 25 mM HEPES tampon içeren kültür ortamı ile haznesi tüm orta yerini ve sıcaklık kontrollü bir görüntüleme sistemi çanağı transfer. Zaman ayarlı, çok-pozisyon kayıt için deney parametrelerini. Katod ve anot böylece haznesi hizalamakSağ sırasıyla sol ve üzerinde, EF vektör çalışmasını sağlamak için yatay olarak mikroskop aşağı incelendi ve görüntüleme sistemi kaydedildi.
- Steinberg'in çözeltisi (58 mM NaCl, 0.67 mM KCI, 0.44 mM Ca (NO 3) 2 ,4 H 2 0, 1,3 mM MgSO 4 0,7 H 2 0 ve 4.6 mM Trizma baz, pH 7,4) ile iki beher doldurun. % 2 (w / ile doldurulmuş önceden hazırlanmış cam köprüler (~ 13 cm uzunluğunda ve ~ 3 mm çaplı ve bir Bunsen alev içinde ısıtmak suretiyle U-biçimli bir bükülebilmektedir cam tüpler), her biri kullanılarak, orta rezervuara ayrı bir behere Connect Kapağın deliklerden geçerek v) Steinberg's-agar çözeltisi,. Steinberg çözümü her behere bir DC güç kaynağına bağlı Ag / AgCl elektrot yerleştirerek elektrik devresi tamamlayın.
- 0 ve açmak için güç kaynağı gerilimi kadranını. Bir gerilim ölçer kullanarak, gerilim çevirmeli açarken electrotactic odasının arasındaki gerilimi ölçün ve deneysel gereksinimlerine uygun şekilde ayarlamak.
- Time-lapse kayıt başlatın. Orta değişiklik yapın ve her saat, gerektiği gibi, gerilimi tekrar ayarlayın. Gerekli olan taze aracı madde, ilaç ya da kimyasal ajanlara rezervuar ilave edilebilir. Orta değişiklik yaparken, iki seçenek aşağıdaki gibi düşünülebilir:
- Opsiyon No.1 - geçici duraklama time-lapse kayıt için dikkatli kapak kapak rahatsızlık vermesini önlemek için odasından cam köprüleri kaldırmak, taze ortam ile tüm orta yerine hafifçe steril bir Pastör pipeti kullanın ve cam köprüler geri koymak, sonra kayda devam.
- Seçenek No.2 - Alternatif olarak, aynı zamanda özel bir orta değişim amaçlı kullanılabilir 4 delikler (iki geçiş bölmesinin üzerine yerleştirilmiş her bir rezervuar) ile kapak kapak yapmıştır. Cam köprü bağlantısı için iki, diğer iki orta değiştirmek için. Seçenek 2 orta boy değişimi sırasında müdahalesi olmadan sürekli kayıt sağlar.
4. Organotipik omurilik dilim hazırlanması
- Lumb teşrih2 haftalık C57 BL / 6 farelerde ar omurilik.
- Bir McIlwain doku kıyıcı ile 500 mikron kalınlığında kesitler halinde omurilik dilimleyin.
- Ayrı anatomik bir mikroskop altında dilimleri ve sağlam aksiyel / sagital omurilik yapısıyla dilim seçin.
- Matrigel proteinler üretmek için kendini araya kadar 30 ul Matrigel ve koyun içeren bir 35 mm Petri kabındaki Plaka dilimler mümkün olduğunca merkeze yakın ve en az 30 dakika 37 ° C'de% 5 CO2 inkübatör içinde onları korumak spinal kord dilim yüzeyine ince bir tabaka içerir. Tamamen, bir 30 dakika gerekirse 37 ° C'de Petri inkübe Matrigel monte edilmiş emin olmak çok önemlidir.
- Dilim doğrudan orta akışını önlemek için 25 mM HEPES tampon ve çok yavaşça olarak% 15-20 oranında fetal sığır serumu içeren 4-6 ml DMEM/F-12 orta ekleyin. Kesit tamamen de maruz eksplantlarının yüzeyi bırakarak, orta sokulmasına emin olmakhava. Haftada iki kez orta değiştirin.
5.. Organotipik omurilik dilim içine Hoechst 33342 etiketli NPCs Enjeksiyon
- 1 NPC süspansiyon × 10 6 hücre / ml hazırlayın.
- 30 dakika boyunca 5 uM Hoechst 33.342 olan bir ortamda hücre süspansiyonu ön-kuluçkaya.
- Mikroskop altında yavaş yavaş omurilik dilim içine süspansiyon 2 ul microinject kapiler cam tüp kullanın. Kapiller cam tüp matrigel (mikroskop altında pembe kısmı) geçer ve omurilik dilim (mikroskop altında gri doku) içine ulaşmak emin olun, üzerinde çalıştırmak hücre süspansiyonu önlemek için en az 30 saniye boyunca omurilik dilim içinde kalır. Inkübatöre omurilik dilim içeren petri (37 ° C'de% 5 CO 2) koyun ve gece boyunca bekletin.
- Ertesi gün, (açıklanan yöntemler kullanılarak electrotactic odacık içinde 33.342-etiketli NPCs Hoechst içeren spinal kord dilimlenmesi 500 mV / mm arasında bir EF uygulamak3).
6. Temsilcisi Sonuçlar
NPC onlar katot doğru yönlendirilmiş yüksek hücre migrasyonu (Şekil 1) gösterdi fizyolojik EF'in bir dizi ortaya çıktı. Aynı gözlem organotipik omurilik dilim ex vivo modelde, in vivo koşullarda bir 3D ortamı taklit eden (Şekil 2) tek bir hücre düzeyinde yapıldı.
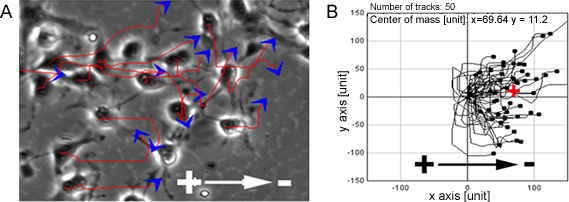
Şekil 1.. NPC EF'in yönlendirilmiş göç göstermektedir. EF'in maruz kaldığında PC'ler katot yönelik yüksek yönettiği göç gösterdi, kırmızı çizgiler ve mavi oklar hücre hareket yörüngeleri ve yön (A) temsil eder. B NPC göç yollarını gösterir. Bar: 50 mikron.
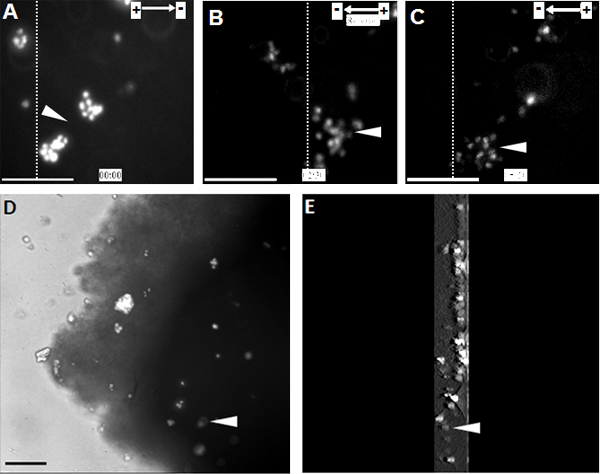
Şekil 2. Nakledilen NPC organotipik omurilik dilim katot yönelik göç göstermek . (A) Hoechst 33342 ile etiketlenmiş NPC'ler EF tedavinin başlangıç noktasında organotipik omurilik dilim içine transplante edildi. NPC EF polarite (B) tersine edildiği noktada, 2,5 saat süreyle katoda doğru yönde göç ettiler. EF kutup değiştirme, yeni katot (C) doğru electrotaxis keskin bir geri tetikledi. Time-lapse kayıt sonunda omurilik dilim içinde nakledilen NPC (D) Görüntü. Omurilik dilim içinde nakledilen NPC (E) A 3D rekonstrüksiyon. 3D tarama bölümleri dilim altındaki ortasında başlayan ve biten, kalınlığı 300 mikron idi. Noktalı çizgiler, başlangıçta, ters ve EF tedavi uç noktaları (- C, sırasıyla A) ile nakledilen hücrelerin aynı popülasyon parçasının göreli konumlarını gösteren. Ok uçları Hoechst 33342 etiketli NPC aynı nüfusa hitap etmektedir. Bar: 50 mikron.
Tartışmalar
Kullandığımız protokolleri önceki çalışmalarda 5,11 dayanmaktadır. Standart ve hassas boyutlarda özel tasarlanmış electrotactic odaları kültüre hücreleri veya dilimleri için agar köprüler, Steinberg çözümü ve Ag / AgCl elektrot aracılığı ile bir EF uygularken bu yöntemleri kullanarak, istikrarlı bir kültür ve elektrik mevcut koşullar sağlanabilir. Odacık derinliği farklı örnek 11 kalınlığı için uygun şekilde ayarlanabilir, ve hücrelerin durumda, oda boyut...
Açıklamalar
Biz ifşa hiçbir şey yok.
Teşekkürler
Bu çalışma Royal Society URF hibe UF051616, Birleşik Krallık ve BS Avrupa Araştırma Konseyi StG hibe 243.261 tarafından desteklenmiştir. MZ laboratuvar çalışmaları da Rejeneratif Tıp hibe RB1-01.417 bir California Institute tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | Yorumlar |
| FGF-temel Rekombinant İnsan | Invitrogen | PHG0026 | 20 ng / ml |
| EGF Rekombinant İnsan | Invitrogen | PHG0311 | 20 ng / ml |
| N2-Supplement (100X) sıvı | Invitrogen | 02048 | |
| DMEM/F12 orta (yüksek glukoz) | Invitrogen | 31330-095 | |
| Poli-D-Lizin | Millipore | A-003-E | |
| Doğal fare Laminin | Invitrogen | 23017-015 | |
| Büyüme faktörü Basement Membran Matrix (Matrigel) azaltılmış | BD Biosciences | 354230 | |
| HEPES tampon | Gibco | 15630 | |
| McIlwain doku kıyıcı | Mickle Laboratuvarı Mühendislik Ltd | TC752-PD | |
| Dow Corning, yüksek vakum silikon gres | Sigma-Aldrich | Z273554 |
Referanslar
- Huttenlocher, A., Horwitz, A. R. Wound healing with electric potential. N. Engl. J. Med. 356, 303-303 (2007).
- McCaig, C. D., Rajnicek, A. M., Song, B. Controlling cell behavior electrically: current views and future potential. Physiol. Rev. 85, 943-943 (2005).
- Borgens, R. B., Jaffe, L. F., Cohen, M. J. Large and persistent electrical currents enter the transected lamprey spinal cord. PNAS. 77, 1209-1209 (1980).
- Shapiro, S., Borgens, R., Pascuzzi, R. Oscillating field stimulation for complete spinal cord injury in humans: a phase 1 trial. J. Neurosurg. Spine. 2, 3-3 (2005).
- Zhao, M., Song, B., Pu, J. Electrical signals control wound healing through phosphatidylinositol-3-OH kinase-gamma and PTEN. Nature. 442, 457-457 (2006).
- Yao, L., Shanley, L., McCaig, C. Small applied electric fields guide migration of hippocampal neurons. J. Cell. Physiol. 216, 527-527 (2008).
- Li, L., El-Hayek, Y. H., Liu, B. Direct-current electrical field guides neuronal stem/progenitor cell migration. Stem Cells. 26, 2193-2193 (2008).
- Meng, X., Arocena, M., Penninger, J. PI3K mediated electrotaxis of embryonic and adult neural progenitor cells in the presence of growth factors. Exp. Neurol. 227, 210-210 (2011).
- Bonnici, B., Kapfhammer, J. P. Bone marrow stromal cells promote neurite extension in organotypic spinal cord slice: significance for cell transplantation therapy. Neurorehabil. Neural Repair. 22, 447-447 (2008).
- Shichinohe, H., Kuroda, S., Tsuji, S. Bone marrow stromal cells promote neurite extension in organotypic spinal cord slice: significance for cell transplantation therapy. Neurorehabil. Neural Repair. 22, 447-447 (2008).
- Song, B., Gu, Y., Pu, j. Application of direct current electric fields to cells and tissues in vitro and modulation of wound electric field in vivo. Nature Protocol. 2, 1479-1479 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır