Method Article
膣洗浄、クリスタルバイオレット染色、およびマウス発情周期ステージング識別のための膣細胞学的評価を行う
要約
ここでは、単純な、非侵襲的なコレクションと膣の塗抹標本の細胞学的評価によるマウス生殖(発情前期、発情期、発情後期、もしくは発情間期)の段階を識別する方法について説明します。我々はさらに膣細胞診は、ネズミ生殖サイクルを通じての移行の基礎となるホルモンの循環レベルを反映する方法を説明します。
要約
げっ歯類での生殖状態を評価するの迅速な手段だけではなく、生殖機能障害の研究に有用であるだけでなく、病的なチャレンジに続く組織変性のホルモン調節(または再生)に新しいマウスの病気のモデルと調査の生産のために必要とされる。発情前期、発情期、発情後期、発情休止と:マウス生殖(または発情)サイクルは4段階に分かれています。卵巣ステロイド17-β-エストラジオールとプロゲステロンの循環レベルで定義されている変動は、性腺刺激ホルモンは、黄体と卵胞刺激ホルモン、これらの生殖段階を経て黄体刺激ホルモンプロラクチン信号遷移。ネズミ膣内の細胞類型の変化は、これらの基礎となる内分泌事象を反映しています。有核上皮細胞、角化扁平上皮細胞、膣スメア中に存在する白血球の相対的な比率の毎日の評価は、ネズミ発情を識別するために使用することができます段階。侵襲性の程度は、しかしながら、これらのサンプルを収集する際に採用すると、生殖状態を変更し、スメアの細胞学的評価を混乱させることができる炎症性応答を誘発することができます。ここでは、彼女の生殖サイクルを変えることなく、雌マウスの発情周期のステージを決定するために使用できる単純な、非侵襲的なプロトコルを記述します。膣スメアで優勢な細胞類型の収集と分析による発情周期の4つの段階を区別し、我々はこれらの変更が内分泌状態を基準に解釈することができる方法を示すために、どのように我々は詳細。
プロトコル
1。準備する試薬
- 必要になるまで無菌膣洗浄は、再蒸留水(蒸留H 2 O)をオートクレーブ滅菌し、室温で密閉容器に保管してください。
- 細胞学的評価のために、蒸留H 2 Oを100mlにクリスタルバイオレットの粉末0.1グラムを追加よく混ぜる。必要になるまで、クリスタルバイオレット染色液(0.1%)を室温で密閉容器に保存することができます。
2。収集膣細胞(膣胞洗浄)
- 無菌200μlの先端の先端にラテックス球を置き、滅菌蒸留H 2 Oは、ボリュームの指針となるべきものとして、先端にグラデーションを使用しての約100μlを描く。
- 彼女のケージのマウスを持ち上げて、あなたに向かって彼女の後肢/後端にケージホッパー(フタ)の上に彼女を置く。
- しっかりと尻尾をつかんで後端を持ち上げる。マウスは今ホッパーを把握するだけで彼女の前足を持つことになります。この時点でマウスが排尿することがあります。もしそうなら、排尿が止まるまで待ちます。そこに膣の入り口に残った尿である必要があり、個別の先端( すなわち 、あなたのサンプル採取チップ)を使用して過剰ddH 2 Oで口をすすぐことをお勧めします。
- 膣(および頸部)刺激がラットの1,2に偽妊娠を誘発することができるようにオリフィスを貫通しないように注意しながら膣の開口部ddH 2 Oを充填したチップの先端を置きます。最近の報告では、マウスは、この効果の影響を受けにくくなりますそれにもかかわらず、注意を繰り返し分析3の侵襲の程度を最小限に抑えるよう注意が必要を示唆している。
- 優しく膣管のオープニングで水の体積の半分(〜25から50μl)に四半期を排出するバルブを押し下げる。液体が自発的に先端挿入せずに管の中に吸引されます。ゆっくり電球に加わる圧力を解放します。流体は、先端に戻って撤退します。流体の吸引を防ぐために、早すぎる圧力の放出を避ける電球に。たばこのフィルターは、この目的のために有用であろう。
- 単一試料中に十分な細胞数を得るために、同じチップ、電球、および流体を使用して、前のステップ4から5回繰り返します。
- スライドガラス上に液を入れ、汚れが完全に室温で乾燥することができます。一度乾燥した、これらの発情塗抹標本を直ちに染色または保存され、後日染色することができる。
3。クリスタルバイオレットを用いて細胞染色法* 4
- クリスタルバイオレットが1分間染色含むコプリンジャー(または他の同等の染色槽)で乾式スライドを配置します。
- 蒸留H 2 Oを含有する第二のコプリンジャーに取り外し1分間ddH 2 Oでスライドを洗浄します。繰り返します。
- 染色塗抹との接触を避け、軽量組織ワイパー付きスライドの端から過剰蒸留H 2 Oを削除します。
- スミアとカバーの上部にあるグリセロールのピペット約15μlのスリップ。あるいは、他の組織学的マウンティング試薬は、非拡散、より恒久的な染色を得るために利用することができます。
ここで説明する*染色法は、どの研究室で行うことができる最も簡単な手順です。他の方法としては、追加の詳細を提供することができます。たとえば、パパニコロウ染色を用いて、有核上皮細胞の成熟度は、染色されたターコイズと、より成熟した細胞は、ピンクやオレンジ色に染色された未成熟細胞と区別することができます。これらの違いは、早朝または深夜の発情前期を上演するために使用できます。4
4。膣細胞診
- 現在のセルの種類を決定するために光学顕微鏡下で塗抹を調べます。顕微鏡検査は、封入のためにグリセロールを使用しているとき、クリスタルバイオレットは時間をかけて細胞から拡散するように染色した後、直ちに行われるべきである。顕微鏡写真では、細胞診を文書化するために、分析の際に取られるべきである。
- entirを調べることから始め低倍率のe塗抹。代表的な地域を選択して、高倍率に移動します。あなたは、角化扁平上皮細胞、白血球、および/ または有核上皮細胞( 代表的な結果は、 図1A〜C)が表示されます。存在する細胞の割合は、サンプル採取( 代表的な結果は、 図1D-G)と彼女の即時のホルモン状態の時間( ディスカッション 、 図2)でマウスの発情期を決定することができます。
5。代表的な結果
細胞診:3つの主要な種類の細胞は膣塗抹標本で検出することができる:(1)有核上皮細胞( 図1A)、(2)角化扁平上皮細胞( 図1B)、(3)白血球( 図1C)。有核上皮細胞が染色された細胞質軽く、暗いステンド形質膜、および楕円形の核を持っている( 図1A)。角化扁平上皮細胞はそれらの有核上皮前任者よりも、より多角形状、均一に染色され、核( 図1B)を欠いている。多形核白血球は、その不規則な形状、暗くステンドポリモーフィック型核、小サイズ( 図1C、黒矢印)によって上皮細胞と区別することができる。尿汚染がスメア中に存在すべきである、尿酸の結晶が容易に予想される、任意の細胞型( 図3)に似ていないその結晶構造によって検出されます。これが発生し、優勢な細胞型の曖昧な検出すべき、スミアは破棄され、目的のステージング用に使用すべきではない。
ステージング:塗抹標本で観察された細胞型の相対比は、サンプル採取の日( 図1D-G)の上でマウスの発情周期のステージを識別するために使用することができます。発情前期の間に、細胞がほぼ独占的にアールラウンドのクラスタ、整形式有核上皮細胞( 図1D、白い矢印で示さ代表セル)。発情期の間に、細胞が密集したクラスター内に存在し、主に角化扁平上皮細胞( 図1E、矢印で示す代表的な細胞)である。発情後期中に、小さなステンド暗く白血球( 図1F、黒い矢印で示された代表的な細胞)が優勢。角化扁平上皮細胞は、しばしば断片( 図1F、黒矢印で示す代表的なセル)で、観察することができる。発情間期の間に、珍しい角化扁平上皮細胞はまだ( 図1G、黒矢印で示す代表的な細胞)が存在しているかもしれませんが、白血球はまだ( 図1G、黒い矢印で示された代表的な細胞)が優勢。発情後期は発情間期中の有核上皮細胞の出現によって発情間期と区別することができる( グラム>図1G、白い矢印で示さ代表セル)。
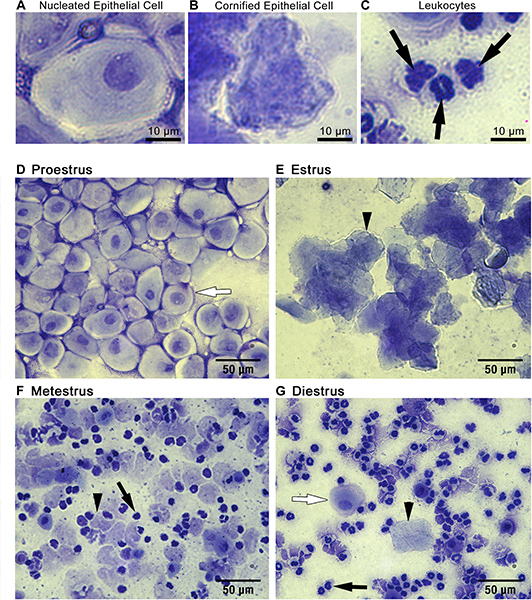
図1。 (A)は、有核上皮細胞、(B)は角化扁平上皮細胞、および(C)白血球:膣スメアの細胞学的評価は、主に次の3つの種類の細胞が膣塗抹標本で検出された発情段階を識別するために使用することができます 。塗抹標本内に存在これらの細胞型の比率は代表的な結果で説明したように(D)発情前期は、(E)は発情期が、(F)は発情後期、または(G)は発情間期のマウスを識別するために使用することができます。代表的な角化扁平上皮細胞へのE、FおよびGポイントの黒矢印。代表leykocytesにC、F、Gの点の黒矢印。 DおよびGハイライト代表の白い矢印は上皮細胞核。
jpgのは "alt ="図2 "/>
図2。膣スメア細胞診は、基礎となる内分泌事象を反映しています詳細はまたディスカッションで提供されています。 拡大図を表示するには、ここをクリックしてください 。
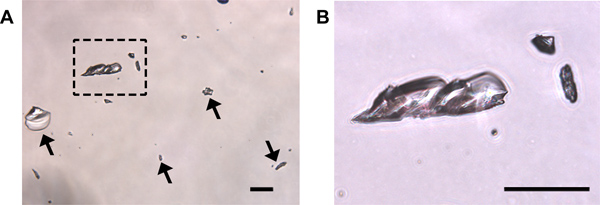
図3。尿酸の結晶が尿に汚染されたサンプルの現在の次のクリスタルバイオレット染色可能性があります (A)の結晶は透明であり、様々なサイズ(矢印と(B)に拡大された箱入りの領域)にすることができます。無細胞はこの分野に存在していない。細胞学的染色のために使用されるフィールド内で尿酸結晶の汚染が存在する必要があります、それは正確に存在し、塗抹標本を廃棄すべきセルの種類を識別することは困難かもしれません。スケールバー=50μmである。
ディスカッション
細胞類型におけるこれらの変化は、基本的な内分泌のイベントを示している。発情周期の発情前期フェーズは、月経周期中のヒト卵胞期に相当し、17-β-エストラジオールのレベル6と同様、プロラクチン7( 図2の小さなサージを循環におけるプレ排卵増加によって定義され発情前期、左パネル)。 17-β-エストラジオールの増加は間接的に、順番に、循環8,9( 図2中に黄体形成ホルモンと卵胞刺激ホルモンを解放するために下垂体前葉に敏感な細胞を活性化し、視床下部および中隔の性腺刺激ホルモン放出ホルモンニューロンを刺激する、発情前期、左パネル)。発情前期の動物から採取した膣スメアでは、細胞は、ほぼ独占的に楕円形の有核上皮細胞( 図1D、図2、発情前期、右パネル)です。卵胞刺激HORMのピーク1レベル信号排卵、発情10,11への参入。発情期、17-β-エストラジオールレベルの低下やプロラクチン濃度の間にピーク6,7( 図2、発情、左パネル)。膣スメアが塊になって、しばしば不規則な形の角化扁平上皮細胞( 図1E、図2、発情、右パネル)のほぼ独占的検出によって特徴付けられる。発情後期への参入はプロゲステロンホルモンレベル6の継続的な上昇と一致していると人間の黄体期12の始まり( 図2、発情後期、左パネル)に対応しています。プロゲステロンのレベルが上昇し始めると黄体活性化6,13,14( 図2、発情後期、左パネル)に対応して17-β-エストラジオールのレベルの小さなサージがあるとして。この段階で膣スメアに存在する細胞の種類は、断片化され、角質化した上皮細胞と小さな暗いステンド白血球(Figurアール電子1F、 図2、発情後期、右パネル)。最後に、マウスでは発情間期へのエントリーは人間の黄体期後期12に対応し、ピーク6を発生し、血中プロゲステロンレベル。黄体の退縮は、プロゲステロンのレベル15,16の後続の急激な低下( 図2、発情間期、左パネル)につながる。白血球は、発情間期の間にスメアで一世を風靡。角質化した上皮細胞の頻度は減少し、有核上皮細胞は、直前に発情前期( 図1G、図2、発情間期、右パネル)への移行を検出することが開始されています。
要約すると、この簡単な日常のプロトコルは毎日ホルモンの変動を推定して、次の予防措置を講じている場合は生殖状態を変更することなく、実験用マウスの発情ステージを確立するために使用することができます。サンプリングは、非侵襲的なプロトコルdescを使用し、毎日1回のみ行われるべきではない膣管、吸引、および攪拌の繰り返しの浸透に比べて、ここribed。これは、細胞学的評価を混乱かもしれスメア中に存在することが白血球やその他の細胞型で生じる炎症応答17その結果、膣の炎症を引き起こす可能性があります。また、あってもコロニーに収容され、雌では、それも無発情期の18の誘導と、この識別は、生殖や性別のホルモン影響の解釈に有用であり、病気の研究など、さまざまなマウスで拡張発情間期と発情期のステージを見ることは正常です。サイクルの長さの変動も年齢とともに女性と7,19-21のコロニー内の住宅の違い(個人またはグループ·ハウジング)によって導入される。女性専用コロニー内に収容された女性がサイクリングを中止し、サイクリングはサイクリング24,25を引き出すための男性の尿で前処理したケージへの曝露によって再インストールされることができるが長引く発情間期18,22,23の状態を入力することができます。したがって、individuaを確立する与えられたマウスのlのサイクルの長さは、それは2つの完全なサイクルが観察されるまで、ここで説明した非侵襲的な評価は、注意して、毎日実行することをお勧めします。
開示事項
著者らは、利害の衝突を宣言しない。動物に関するすべての実験は、オタワアニマルケア委員会の大学とアニマルケアに関するカナダ評議会によって定められたガイドラインおよび規制に厳密に従って行った。
謝辞
我々は、視覚モデル支援のための映像制作·編集とカールトンからマーティン·ベルトラン没入型メディアスタジオ/神経再生研究室で専門的な技術支援のためカールトン没入型メディアスタジオからマルクレオナルドに感謝したいと思います。作者は感謝博士マリリンKeaneyとオタワのアニマルケアと獣医サービスの大学の彼女の献身的なスタッフのすべての専門家の助言を認める。この作品はSALBとSF、カナダの財団への神経変性リピドミクスにおけるヘルスリサーチ/ CIHRトレーニングプログラム(TGF-96121)にSALB、老化のCIHR研究所と戦略的トレーニングイニシアチブに保健研究のカナダ研究所(CIHRは、MOP 62826)によって賄われていたSFにSFとSF、オンタリオ州イノベーショントラスト、およびAutodesk研究へのイノベーションのため。 ACMはCIHRのバンティングとベスト博士賞を受賞しました。 NVは加齢と神経変性リピドミクスでCIHR研修プログラムの研究所からポストプロのフェローシップを受信します。
資料
| Name | Company | Catalog Number | Comments |
| 名前 | 会社 | カタログ# | |
| 無菌200μlのピペットチップ | Diamed | E340901 | |
| ラテックス球(1ミリリットル) | フィッシャー | 03-488-21 | |
| ガラス顕微鏡スライド | フィッシャー | 12-550-15 | |
| クリスタルバイオレット(25g)の染色 | フィッシャー | C581-25 | |
| 軽ティッシュワイパー | VWR | 82003-820 | |
| グリセロール | フィッシャー | BP229-1 | |
| 顕微鏡カバーガラス(22x30) | フィッシャー | 12-544A |
参考文献
- Adler, N. T., Zoloth, S. R. Copulatory behavior can inhibit pregnancy in female rats. Science. 168, 1480-1482 (1970).
- Adler, N. T., Resko, J. A., Goy, R. W. The effect of copulatory behavior on hormonal change in the female rat prior to implantation. Physiology. 5, 1003-1007 (1970).
- Yang, J. J., Larsen, C. M., Grattan, D. R., Erskine, M. S. Mating-induced neuroendocrine responses during pseudopregnancy in the female mouse. Journal of. 21, 30-39 (2009).
- Hong, H. Changes in the mouse estrus cycle in response to BRCA1 inactivation suggest a potential link between risk factors for familial and sporadic ovarian cancer. Cancer research. 70, 221-228 (2010).
- Hawkins, S. M., Matzuk, M. M. The menstrual cycle: basic biology. Annals of the New York Academy of Sciences. 1135, 10-18 (2008).
- Walmer, D. K., Wrona, M. A., Hughes, C. L., Nelson, K. G. Lactoferrin expression in the mouse reproductive tract during the natural estrous cycle: correlation with circulating estradiol and progesterone. Endocrinology. 131, 1458-1466 (1992).
- Parkening, T. A., Collins, T. J., Smith, E. R. Plasma and pituitary concentrations of LH, FSH, and prolactin in aging C57BL/6 mice at various times of the estrous cycle. Neurobiology of aging. 3, 31-35 (1982).
- Sarkar, D. K., Chiappa, S. A., Fink, G., Sherwood, N. M. Gonadotropin-releasing hormone surge in pro-oestrous rats. Nature. 264, 461-463 (1976).
- Rajendren, G., Gibson, M. J. A confocal microscopic study of synaptic inputs to gonadotropin-releasing hormone cells in mouse brain: regional differences and enhancement by estrogen. Neuroendocrinology. 73, 84-90 (2001).
- Kumar, T. R., Wang, Y., Lu, N., Matzuk, M. M. Follicle stimulating hormone is required for ovarian follicle maturation but not male fertility. Nature. 15, 201-204 (1997).
- Montgomery, V., Loutradis, D., Tulchinsky, D., Kiessling, A. FSH-induced ovulation in intact and hypophysectomized mice. Journal of reproduction and fertility. 84, 1-6 (1988).
- Mihm, M., Gangooly, S., Muttukrishna, S. The normal menstrual cycle in women. Animal reproduction science. , 124-229 (2011).
- Appelgren, L. E. Histochemical demonstration of drug interference with progesterone synthesis. Journal of reproduction and. 19, 185-186 (1969).
- Sander, V. A., Facorro, G. B., Piehl, L., de Celis Rubin, E., Motta, A. B. Effect of DHEA and metformin on corpus luteum in mice. Reproduction. 138, 571-579 (2009).
- Stocco, C., Telleria, C., Gibori, G. The molecular control of corpus luteum formation, function, and regression. Endocrine reviews. 28, 117-149 (2007).
- Rudolph, M. Induction of overt menstruation in intact mice. PLoS One. 7, e32922 (2012).
- Yano, J., Lilly, E., Barousse, M., Fidel, P. L. Epithelial cell-derived S100 calcium-binding proteins as key mediators in the hallmark acute neutrophil response during Candida vaginitis. Infection and immunity. 78, 5126-5137 (2010).
- Whitten, W. K. Occurrence of anoestrus in mice caged in groups. The Journal of endocrinology. 18, 102-107 (1959).
- Lamond, D. R. Effect of stimulation derived from other animals of the same species on oestrous cycles in mice. The Journal of endocrinology. 18, 343-349 (1959).
- Nelson, J. F., Felicio, L. S., Randall, P. K., Sims, C. A longitudinal study of estrous cyclicity in aging C57BL/6J mice: I. Cycle frequency, length and vaginal cytology. Biology of reproduction. 27, 327-339 (1982).
- Felicio, L. S., Nelson, J. F., Finch, C. E. Longitudinal studies of estrous cyclicity in aging C57BL/6J mice: II. Cessation of cyclicity and the duration of persistent vaginal cornification. Biology of reproduction. 31, 446-453 (1984).
- Van Der Lee, S., Boot, L. M. Spontaneous pseudopregnancy in mice. II. Acta physiologica et pharmacologica Neerlandica. 5, 213-215 (1956).
- Van Der Lee, S., Boot, L. M. Spontaneous pseudopregnancy in mice. Acta physiologica et pharmacologica Neerlandica. 4, 442-444 (1955).
- Armaiz-Pena, G. N. Estrous cycle modulates ovarian carcinoma growth. Clinical cancer research : an official journal of the American Association for Cancer Research. 15, 2971-2978 (2009).
- Jemiolo, B., Harvey, S., Novotny, M. Promotion of the Whitten effect in female mice by synthetic analogs of male urinary constituents. Proceedings of the National Academy of Sciences of the United States of America. 83, 4576-4579 (1986).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved