Method Article
ゼブラフィッシュにおけるGal4のを用いた遺伝子トラップ
要約
このプロトコルは、ゼブラフィッシュにおける二次レポーターとして、第一次報告およびGFP / RFPとしてのGal4-VP16を用いた遺伝子トラップ挿入変異誘発方法が記載されている。 GFPおよびRFPを共発現が約1 10人に高発現F0魚の歩留まり遺伝子トラップ子孫。スクリーニング手順は、容易に挿入突然変異画面を行なう研究室のサイズに適合するようにスケーリングすることができる。
要約
大型クラッチサイズと光学的に透明な胚の外部開発は、ゼブラフィッシュの突然変異した遺伝子の発現をタグ付けする蛍光レポーターを用いたin vivo挿入変異誘発のための例外的な脊椎動物のモデルシステムを作る。いくつかの研究室は記者1-7として蛍光タンパク質、Gal4の-とのlexAベースの転写活性化因子を使用して、ゼブラフィッシュでエンハンサーと遺伝子トラップベクターを構築し、テストしている。 (まれにヌル対立遺伝子を生じなかった遺伝子に例えば統合)次善ジェンシー( 例えばエンハンサーおよび遺伝子トラップ事象を区別する能力の欠如)と低変異原性:これらのベクターは、2つの潜在的な欠点を持っていた。遺伝子ブレイキングトランスポゾン(GBTs)は、これらの欠点8月10日に対処するために開発された。遺伝子トラップイベントの直接検出のための二次レポーターとしてのeGFP:我々は、一次遺伝子トラップレポーターを追加しましたUASとしてのGal4-VP16で使用するために、最初のGBTベクトルの1、GBT-R15を変更した。 A主な遺伝子トラップレポーターとしてのGal4-VP16のpplicationは2つの主な利点を提供します。まず、低い発現レベルで発現する遺伝子の感度を増加させる。第二に、それは非常に特定の組織における他の導入遺伝子の発現を指示するためのGal4ドライバとして遺伝子トラップ系統を使用するために研究者を可能にする。これは、遺伝子トラップ統合が明白な表現型をもたらさないことがあり、非必須または冗長機能を持つ遺伝子のために特に適切である。一次遺伝子トラップレポーターとしてのGal4-VP16を使用することの欠点は、得られたGal4-VP16融合タンパク質が核に入ることができそうにないと活性化するように、N-末端シグナル配列を有するタンパク質をコードする遺伝子は、トラッピングに適していないということである転写。重要なのは、Gal4の-VP16の使用は、核タンパク質のために事前に選択されません:私たちは、核、細胞質と細胞質膜に機能するタンパク質をコードする遺伝子に遺伝子トラップ突然変異を回復した。
概要
挿入変異誘発は、マウスおよび植物のような多細胞生物、細菌および酵母などの単細胞生物からの種々のモデル系において遺伝子機能を解剖する強力なアプローチであることが証明された。任意の外来性DNA(ウイルス、トランスポゾンまたはプラスミド)は、エクソン又はプロモーターなどの遺伝子の必須要素を遮断することによって、変異原として働くことができる。エクソンは、典型的な脊椎動物のゲノムのわずか1〜3%含み、以来、このような単純なアプローチの効果的な目標は、大規模で複雑なゲノムにおいて非常に小さい。ゼブラフィッシュ11,12におけるレトロウイルス挿入変異の大成功によって例示されるような小さい有効目標サイズは、非常に高いベクトル積分率によって克服することができる。対照的に、イントロンは、脊椎動物ゲノムの約20-30%を含む。ゼブラフィッシュでは、効果的にイントロンにNULLまたは統合時に重度の低形質変異を導入するトランスポゾン挿入変異ベクトルはtransposoを壊す「遺伝子と命名されましたNS」(GBTs)8月10日 。効率的な遺伝子トラップの統合のために、彼らは最小限のトランスポゾン13,14を使用しています。GBTsの変異原性は、魚由来のスプライス受容および転写終結/ポリアデニル化配列に依存しています。GBT変異原性に責任の要素が隣接しているCreリコンビナーゼによる切除のための直接のloxP部位にあるため、CreをmRNAの注入は、いくつかのトランスポゾン配列が組み込み遺伝子座9,10のままであっても、GBT誘発される変異の効率的な復帰につながる。
最近発表されたGBTベクトルは、2つの潜在的な欠点につながる、遺伝子トラップレポーター9,10としてmRFPを使用してください。まず、直接蛍光レポーター融合タンパク質によって検出される十分に高いレベルで発現されるゼブラフィッシュ遺伝子のどの部分知られていない。第二に、遺伝子の小さなサブセットのみが、基本的な機能を有することが期待される。これは、ゼブラフィッシュdevelopmeに必要な唯一1,400-2,400の遺伝子があると推定されているNT 15,16。ほとんどの遺伝子トラップ変異体は、明白な表現型を表示するために、したがって、限られた有用性を有するであろうと予想されていない。これら2限界を克服するために、我々は、一次遺伝子トラップレポーターとしてのGal4-VP16で使用するGBT-R15 9,10を変更した(Balciuniene ら準備中)。 GBT-R15での8月レスmRFPを持つように、翻訳開始部位は、Gal4の-VP16から削除されました。遺伝子トラップ事象の直接検出のために、私たちのベクトルは14倍のGal4、UAS 17,18の制御下にEGFPレポーターが含まれています。
いくつかの追加機能は、当社の二連遺伝子トラップベクター中に操作されています。 UAS:のeGFPカセットを直接FRT部位( 図1の灰色の山形)に隣接している。 eGFP蛍光でマークされていない遺伝子トラップ突然変異を残したeGFPカセット:のFlpリコンビナーゼmRNAの注入は、UASの切除につながる。その後、GFP蛍光によって特定の組織又は発生事象をマークするトランスジェニック系統で使用することができる。他のように、GBTsは、全遺伝子トラップカセットを直接loxP部位( 図1の開いた五角形)が隣接している。これは容易に特定の遺伝子トラップの統合の間に因果関係の証明を確立した( 図2)の表現型を観察し、Creリコンビナーゼの発現による遺伝子トラップイベントは、可逆的になります。最後に、遺伝子トラップカセットを反転し、I-SceIメガヌクレアーゼ部位( 図1の黒三角)が隣接している。 ショウジョウバエでは、トランスポゾンの統合は、多くの場合、P要素の不正確な切除により失(欠陥)に変換されます。トランスポゾンの切除(またはそのような美しさは、piggyBacまたはAC / DSは眠るよう脊椎動物に積極的に他のトランスポゾン)が失につながる可能という証拠はない。したがって、我々はI-SceIではゼブラフィッシュにおいて欠失を誘導することができるという証拠がないにもかかわらず、欠失を誘導するための潜在的な代用法としてI-SceI制限酵素部位を含んだ。なお、一方のI-SceIメガメガヌクレアーゼはI-SceIメガヌクレアーゼによるDNAの切断は、酵母および哺乳動物細胞中で19-22、エラープローン非相同末端接合を含むDNA修復機構を研究するために使用され、ゼブラフィッシュ遺伝子導入を容易にするために使用することができる。
私たちの遺伝子トラップベクターの組込みは、二つの異なるメカニズムによってeGFP発現につながることができます。最初は、真の遺伝子トラップ·イベント( 図1C)である:ベクター遺伝子(挿入的変異遺伝子のIMG)に統合され、内因性のIMG転写産物とのGal4-VP16の5 'との間の融合転写物にされ、翻訳されているIMGとのGal4-VP16によってコードされるタンパク質のN末端を含む融合タンパク質。この融合タンパク質は、14倍UASに結合し、eGFPの転写を活性化する。第二に、あまり望ましくないイベントがエンハンサートラップ( 図1D)である:eGFPの前にある最小プロモーターは、ABにおけるEGFPの生成をもたらす、組み込み部位の近くにエンハンサーの制御に該当するのGal4-VP16生産のSENCE。見積りでは、EGFP発現事象の30〜50%がエンハンサートラップによるもので50〜70%が遺伝子トラップ23によるものである(Balciuniene ら準備中)。をmRFPトランスジェニック系統( 図1B)、レンズ固有のγCryでマーク便宜上:(。Balciunieneら準備中)のGFPのイベントのこれら2つのクラスを区別するために、我々は14xUASをした。遺伝子トラップ事象はGFPおよびRFP( 図2のCとDを比較)の共発現によって確認される。
私たちのパイロットの画面では、トランスポゾンDNAとトランスポザーゼmRNAの混合物を注射された270のF0魚をスクリーニングした後、40以上の遺伝子トラップイベントを回復した。 NSFとFLR:私たちの遺伝子トラップ統合の二つは、以前に発表され、化学的に誘発された変異体との遺伝子に発生している。私たちの挿入変異体NSF tpl6とFLR tpl24の表現型は、表面的な表現型と区別できない対応する化学的に誘発突然変異体のS。我々はまた、遺伝子トラップイベントは、このようにヌル対立遺伝子の確率が高く、遺伝子の5 '末端付近のイントロンに向かって付勢表示されていることを指摘した。私たちは、遺伝子トラップラインのすべてにおいて、UASサイレンシング(斑入り)ある程度の観察を行うと、いくつかの遺伝子座は、明らかに他より斑入りの影響を受けやすい。我々は簡単に一人でGFPの発現について選択することによって、少なくとも5世代にわたって私たちの遺伝子トラップラインのすべてを伝播することができたように、UASのサイレンシングは、遺伝子トラップ系統の増殖のために重要な問題であるとは考えていない。
プロトコル
1。遺伝子トラップのマイクロインジェクションにより、F0世代の製造。
ABとチュービンゲン株は貧しい生存していながら、ロングフィン(TLF)が最も寛容であること - 我々は、異なる遺伝的背景の胚はペット店頭野生型およびチュービンゲンで、この手順に異なる許容範囲を表示することを発見した。
- トランスポゾンDNAの調製。 GBT-B1を準備します(pDB783、Balciuniene ら準備中)の標準をQIAprepミニプレップキット(キアゲン27106)を使用してプラスミドDNA。それ以外のミニプレップDNAは、トランスポザーゼmRNAの分解を導く、RNアーゼAによって汚染され、(プレップ手順において任意である)PB洗浄工程を含むことが必須である。注射の前に、10 ngの/μlにRNaseフリー水(Ambion社AM9937)でDNAを希釈する。
- トランスポザーゼmRNAの準備。をXbaIを使用してpT3TS/Tol2(pDB600)13を直線化し、mMessage機T3を使って線状化DNAを転写in vitro転写キット内 (アンビオンAM1348)。我々はRiboLock RNase阻害剤(ThermoFisherファーメンタスEO0381)の0.5μLを添加することにより、in vitro転写反応を変更しました。 DNase処理工程の後、のMinEluteをRNeasyキット(Qiagen 74204)を用いてmRNAを精製する。アガロースゲル電気泳動によるインビトロ転写されたmRNAの品質を評価する。 -80℃で2μlのアリコートとして40 ngの/μL、および格納するためにRNaseフリー水でmRNAを薄める
- マイクロインジェクションミックスの調製。注射の前に、トランスポザーゼmRNAの2μlの分量まで希釈トランスポゾンDNAの8を添加する。
- マイクロインジェクション。卵黄/割球インタフェースを目指し、標準的なマイクロインジェクション技術を使用して1セルゼブラフィッシュ胚の卵黄にDNA / RNA混合物の3 NLを注入する。 1細胞期の注入を確実にするために、胚を20分毎に収集する。我々の経験では、熟練した人は簡単に1〜1.5時間で千胚を注入することができます。
- 注入後、左側の5μLを実行品質管理のための1%アガロースゲル上で注射液の上に、トランスポザーゼmRNAが分解されていないことを保証する。
- 注入された胚のケア。午後遅く、未受精および異常胚を削除し、100ミリメートルペトリ皿当たり60から80に胚を配布します。異常で死んだ胚を1日後受精(DPF)、2 DPFと3 DPFで除去される。
- GFP発現についてスクリーニングする。 3 DPF( 図3)でのGFP蛍光のための明白な欠陥のない画面の胚。スクリーニングは、(我々は5X Fluar目的とツァイスAxioImagerを使用)を装備した蛍光実体顕微鏡で(我々はニコンSMZ1500を使用)、または正立顕微鏡のいずれかで行うことができます。低GFPの発現は、RNaseのコンタミ( 図3A)に失敗した注射またはトランスポザーゼRNAの分解のいずれかを示しています。 (Fを比較する複数の組織において、または特定の組織の細胞が高い割合でGFP発現を有するいずれかの明るい胚の約30%を選択図3B及び3C)は igures。千胚の注入から、我々は通常、最大100発生的に正常な、高GFP発現胚を持っている。
- 標準ゼブラフィッシュ飼育手順を使用して、選択したF0胚を上げる。これは、飼育用に選択注入した胚の20〜30%は成人期まで生存すると予想するのが妥当である。
2。 UASのメンテナンス:mRFPをテスターライン。
GFP:レンズ固有γCryでマークをmRFPライン:我々は14xUASを生成した。 UASは、DNAメチル化を介してサイレンシングを受けるので、在庫を伝播するサイレン低レベルの魚を選択することが重要である。
- 個々のUAS設定する:私達の最も信頼性の高いのGal4遺伝子トラップ系統の1と嵌合するためのmRFPをホモ接合体を、NSF tpl6(Balciunieneら準備中。)。
- 翌日、UASを転送:胚が収集されている間、個々の静的なタンクに胚を与えたmRFPを魚と清掃。
- 1 DPFと3 DPFのGFPおよびRFPの蛍光の画面の胚。
- UASの次の世代を確立するために、高をmRFP式で胚を与えた交雑魚:mRFPを行。
3。 F0魚のスクリーニング。
- をmRFPの魚( 図4):ホモ接合UASで、個々のF0を渡ります。我々は通常、野生型またはヒョウの色素沈着パターンで線に私達のGBTsを注入し、私たちのホモ接合UAS:mRFPをラインは真鍮のバックグラウンドである。したがってGBTを注入し、F0の魚は、UASから容易に区別することができるmRFPを魚、スクリーニングされるF0が男性か女性だけでなく、記録の間違いに起因する潜在的なエラーおよび/または性別を決定したかどうかを記録する必要がありませんそれぞれの魚。非常に限られた経験を持つ担当者が、私たちの学部学生など、そのための設定と、魚の交配を分解することができます。このアプローチは、2つの異なる遺伝的背景であるという欠点を有している潜在的に機能表現型の喪失の解釈を複雑にし、使用されている。
- そのタンクにmRFPと魚:翌日、 真鍮の UASを返す。胚を収集し、スクリーニングしている間(我々はハーゲンエキソテラFaunarium小を使用していますが、どんな小さなタンクは、この目的のために使用することができます)は、個々の静的なタンクに胚を与えたF0の魚を置きます。
- 清潔で転送が0日目の午後に新しいペトリ皿(<皿につき100)に胚を収集した。
- GFPおよびRFPの蛍光1 DPFで、2 DPFおよび3 DPFの画面の胚。 GFPおよびRFP外両方に陽性胚を引き出します(複数のパターンがクラッチで観察されている場合)、GFP / RFP発現パターンによってそれらをソートし、F1世代を確立するためにそれらを上げる。
- (50〜100の胚の総数のうち)のみ負の胚を生成し、F0の魚を安楽死させる。
- 陽性の第二のバッチを取得するために、もう一度、GFP / RFP陽性子孫を生成し、F0の魚を渡ります。
4。F1魚のスクリーニング。
F1の魚は、F2ファミリーを確立するために、遺伝子トラップ発現パターンを文書化し、5 'RACEおよびインバースPCRによる遺伝子トラップ座の分子同定のための胚のバッチを凍結するためにスクリーニングされる。
- をmRFPの魚( 図4):ホモ接合UAS個々のF1魚を渡ります。
- 次の日、胚を収集し、スクリーニングしている間、個々の静的なタンクに胚を与え、F1の魚を置く。
- GFPおよびRFPの蛍光1 DPFで、2 DPFおよび3 DPFの画面の胚。 GFPおよびRFP 24の両方に陽性の別々と写真胚。
- 5 DPFで、20 GFP / RFP陽性とインバースPCRおよび5 'RACE 9,10による挿入的変異した遺伝子を同定するための20のGFP / RFP陰性胚のバッチを凍結する。 F2世代を確立するために、残りのGFP / RFP陽性胚を上げる。
結果
成功した注射では、胚の少なくとも80%がGFP蛍光のある程度( 図3)を表示する遺伝子トラップDNA / Tol2トランスポゾンのトランスポザーゼmRNAの混合物を注射した。明るいGFP-陽性胚( 図3C)は、F0·プールを確立するために選択された場合、約10でスクリーニングしF0フィッシュ遺伝子トラップ子孫を生じるであろう。遺伝子トラップイベントが回収されるF0の魚の中では、ほとんどが、いくつかの非発現トランスポゾン統合に加えて、単一の遺伝子トラップイベントを送信する。しかし、我々は、単一のF0個体に由来する4遺伝子トラップ行まで確立しています。遺伝子トラップ系統におけるGFP / RFP発現パターンは、(嗅球内など)非常に組織の特定にかなりのユビキタスの範囲にある。
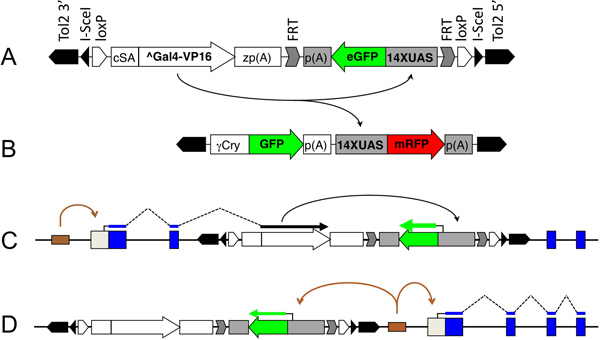
図1。 T彼は、含有GAL4二連遺伝子トラップベクターGBT-B1とその応用。 A. Gal4の含有遺伝子トラップベクターの構成要素:Tol2の5 'とTol2 3'は、最小限のトランスポゾンは、13を終了し、CSA、コイβ-アクチンスプライスアクセプター8; ^のGal4-VP16、8月レスのGal4-VP16; ZP( GBT-R15 9,10からA)、ゼブラフィッシュβ-アクチン3 'UTRおよびポリ(A)要素。 eGFP発現カセット17,18:14XUAS、SV40のeGFPおよびpの(A)は、UASの成分である。矢印は、UASの活性化を示しています。のGal4-VP16によるEGFPを遺伝子トラップによって生成B.ザ·14XUAS:GFPカセット:mRFPを導入遺伝子は、レンズ固有のγCryでマーク。矢印は、UASの活性化を示しています。 トランスでのGal4-VP16によってMRFP C.遺伝子トラップイベントを。。青いボックスはエクソンです。スプライシングは、破線で示されている。D.エンハンサートラップイベント。エンハンサー(ブラウンボックス)に近いベクトルの統合は、(このエンハンサーの制御下に茶色の矢印を最小限にeGFPプロモーターを置くことができる)。これは、eGFPの組織特異的発現をもたらすであろう、しかしのGal4-VP16が行われないので、mRFPを発現が活性化されないであろう。
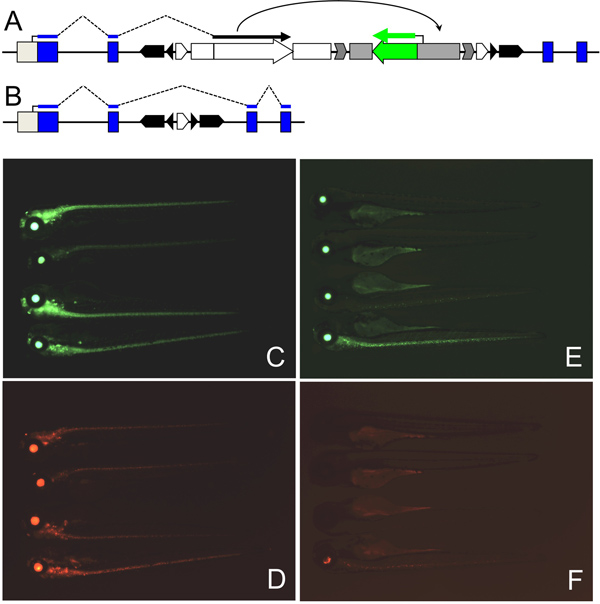
図2。 Creリコンビナーゼを用いて、遺伝子トラップ事象の復帰。遺伝子トラップ突然変異(A)とのCre-復帰遺伝子トラップ対立遺伝子(B)は、B.図... C、D. GFP(C)の同時発現およびNSF tpl6遺伝子の神経系におけるRFP(D)トラップライン。NSF tpl6胚へのCre RNAのE、F·インジェクションは、GFP(E)およびRFP(F)式の損失につながる。期待どおり、レンズ内のGFP発現の減少は存在しないことに注意してください。
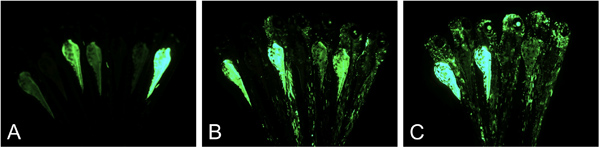
図3。 GBT-B1(pDB783)遺伝子トラップを注入した胚。 。A.胚はpGBT-B1(pDB783)体内で単独の表示はほとんどGFP蛍光を注射されたB、C胚はpGBT-B1とTol2トランスポゼースmRNAを注入:子育てのために選択された胚(B)と高発現体のランダムなグループを(C)。
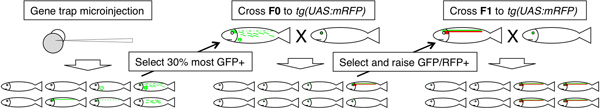
図4。のGal4遺伝子トラップ系統の確立のための実験概要。だけでは緑色の遺伝子トラップまたはエンハンサートラップイベントのモザイク現象を示している曇りの重複赤/緑の構造は、GFPおよびRFPの共発現を示している。
ディスカッション
ここで説明する遺伝子トラップベクターおよび方法は、既にいくつかの独立した研究室で使用されている。我々の経験では、プロセス内の2つの重要なステップがあります。最初の重要なステップは、注入されたF0胚における遺伝子トラップ高い集積率を達成することである。この段階での失敗は、多くの場合、注入試薬のRNaseのコンタミ、特にミニプレップDNAに起因することができます。これは、遺伝子トラップ実験のために1細胞期の胚を注入することも非常に重要である。我々の経験では、Tol2の媒介遺伝子導入することで、後の1細胞期よりまたは低品質のDNAを用いた注射場合でも、トランスジェニック系統を得ることが、非常に効率的である。遺伝子トラップ突然変異誘発を行う際に、ベクトル統合のごく一部は、効果的な遺伝子トラップイベントが発生するので標準以下の注射は、はるかに問題がある。第二の重要なステップは、我々のUASに交配することによって、遺伝子トラップ事象を確認することである。mRFPを行。をmRFP発現の欠如があるほとんどの場合、エンハンサートラップ事象を示す。しかし、時にはmRFPと発現の欠如は、14X、UASのサイレンシングを示すことがあります。 NSF tpl6と交配時に高いRFP発現を有する個人を使用して次の世代に伝播することにより、非サイレンシング状態にmRFPをライン:それは、UASを維持することが重要である。
私たちは、遺伝子トラップベクターおよびプロトコルにいくつかの改善を行うことを予見することができます。最初は、遺伝子トラップ構築物でより少ない反復UASを使用することである。なお、5×UASは、細胞培養実験において完全な活性を達成するのに十分である、より少ない反復UAS配列はメチル化およびサイレンシング6,25を受けにくいことが示されている。また、国際的なマウス遺伝子トラップコンソーシアムによって使用され、最近ではゼブラフィッシュ2,26,27に適合ベクターと同様に、完全に条件付き突然変異誘発のための遺伝子トラップベクターを設計することが可能であってもよい。別の改善は、異なるTを使用することですmRFPをレポーターライン: 美容 28、UASを生成するためのスリーピング例えばransposonシステム。これはincrossingによって直接F0sのレポーターラインとスクリーニングにTol2のベースの遺伝子トラップの注入を可能にする。さらに、これは、機能表現型の喪失の解釈がより簡単にすること、二つの異なる遺伝的背景の使用を排除するであろう。でも、これらの改善で、ここで紹介する一般的なのGal4遺伝子トラッププロトコルは、まだ完全に適用可能であろう。
開示事項
これらの著者は、開示することは何もありません。
謝辞
我々は技術支援のために、原稿の重要な読書のためのライアンギル博士ジェニファーEmtageに感謝し、試薬のためのゼブラフィッシュのケアと博士はスティーブン·C. Ekkerさん(メイヨークリニック、Rochster、ミネソタ州)を支援する。私たちの仕事は、科学技術のテンプル大学と米国立衛生研究所(R01-HD061749)によって支えられてきた。
資料
| Name | Company | Catalog Number | Comments |
| Miniprep Kit | Qiagen | 27104 | Optional PB wash step is a must |
| XbaI restriction enzyme | ThermoFisher | ER0681 | |
| mMessage Machine T3 | Ambion | AM1348 | |
| RiboLock RNase Inhibitor | ThermoFisher | EO0381 | |
| RNeasy MinElute | Qiagen | 74204 | Can be replaced by phenol extraction and precipitation. Do not use LiCl! |
| Nuclease-free water | Ambion | AM9937 | Has to be non-DEPC treated |
| Borosilicate glass capiliaries for microinjection needles | World Precision Instruments | 1B100F-4 | |
| Microcapiliaries for calibration | Drummond Scientific | 1-000-0010 | |
| Microloader tips | Eppendorf | 5242 956.003 | |
| Needle puller * | Sutter Instruments | P-87 | |
| Stereomicroscope for microinjection * | Nikon | SMZ1500 | We also use Wild 5M and Olympus SZ61 with transmitted light stand |
| Picoinjector * | Harvard Instruments | Pli-90 | We also use Pli-100 |
| Screening microscope with GFP/RFP fluorescence * | Zeiss | Zeiss AxioImager | 5X Fluar objective has sufficient working distance |
| Screening microscope with GFP/RFP fluorescence * | Nikon | SMZ1500 | |
| * We suggest this equipment only because we successfully use it in our laboratory. In each category, several comparable options from multiple manufacturers are available. | |||
参考文献
- Balciunas, D., et al. Enhancer trapping in zebrafish using the Sleeping Beauty transposon. BMC Genomics. 5 (1), 62 (2004).
- Trinh le, A., et al. A versatile gene trap to visualize and interrogate the function of the vertebrate proteome. Genes Dev. 25 (21), 2306-2320 (2011).
- Kawakami, K., et al. A transposon-mediated gene trap approach identifies developmentally regulated genes in zebrafish. Dev Cell. 7 (1), 133-144 (2004).
- Emelyanov, A., Parinov, S. Mifepristone-inducible LexPR system to drive and control gene expression in transgenic zebrafish. Dev Biol. 320 (1), 113-121 (2008).
- Ellingsen, S., et al. Large-scale enhancer detection in the zebrafish genome. Development. 132 (17), 3799-3811 (2005).
- Distel, M., Wullimann, M. F., Koster, R. W. Optimized Gal4 genetics for permanent gene expression mapping in zebrafish. Proc Natl Acad Sci U S A. 106 (32), 13365-13370 (2009).
- Davison, J. M., et al. Transactivation from Gal4-VP16 transgenic insertions for tissue-specific cell labeling and ablation in zebrafish. Dev Biol. 304 (2), 811-824 (2007).
- Sivasubbu, S., et al. Gene-breaking transposon mutagenesis reveals an essential role for histone H2afza in zebrafish larval development. Mech Dev. 123 (7), 513-529 (2006).
- Clark, K. J., et al. In vivo protein trapping produces a functional expression codex of the vertebrate proteome. Nat Methods. 8 (6), 506-512 (2011).
- Petzold, A. M., et al. Nicotine response genetics in the zebrafish. Proc Natl Acad Sci U S A. 106 (44), 18662-18667 (2009).
- Gaiano, N., et al. Insertional mutagenesis and rapid cloning of essential genes in zebrafish. Nature. 383 (6603), 829-832 (1996).
- Amsterdam, A., Hopkins, N. Mutagenesis strategies in zebrafish for identifying genes involved in development and disease. Trends Genet. 22 (9), 473-478 (2006).
- Balciunas, D., et al. Harnessing a high cargo-capacity transposon for genetic applications in vertebrates. PLoS Genet. 2 (11), e169 (2006).
- Urasaki, A., Morvan, G., Kawakami, K. Functional dissection of the Tol2 transposable element identified the minimal cis-sequence and a highly repetitive sequence in the subterminal region essential for transposition. Genetics. 174 (2), 639-649 (2006).
- Haffter, P., et al. The identification of genes with unique and essential functions in the development of the zebrafish, Danio rerio. Development. 123, 1-36 (1996).
- Amsterdam, A., et al. Identification of 315 genes essential for early zebrafish development. Proc Natl Acad Sci U S A. 101 (35), 12792-12797 (2004).
- Scheer, N., Campos-Ortega, J. A. Use of the Gal4-UAS technique for targeted gene expression in the zebrafish. Mech Dev. 80 (2), 153-158 (1999).
- Koster, R. W., Fraser, S. E. Tracing transgene expression in living zebrafish embryos. Dev Biol. 233 (2), 329-346 (2001).
- Rouet, P., Smih, F., Jasin, M. Introduction of double-strand breaks into the genome of mouse cells by expression of a rare-cutting endonuclease. Mol Cell Biol. 14 (12), 8096-8106 (1994).
- Thermes, V., et al. I-SceI meganuclease mediates highly efficient transgenesis in fish. Mech Dev. 118 (1-2), 91-98 (2002).
- Lisby, M., Mortensen, U. H., Rothstein, R. Colocalization of multiple DNA double-strand breaks at a single Rad52 repair centre. Nat Cell Biol. 5 (6), 572-577 (2003).
- Bennardo, N., Cheng, A., Huang, N., Stark, J. M. Alternative-NHEJ is a mechanistically distinct pathway of mammalian chromosome break repair. PLoS Genet. 4 (6), e1000110 (2008).
- Rehn, K., Wong, K. S., Balciunas, D., Sumanas, S. Zebrafish enhancer trap line recapitulates embryonic aquaporin 1a expression pattern in vascular endothelial cells. Int J Dev Biol. 55 (6), 613-618 (2011).
- Petzold, A. M., et al. SCORE imaging: specimen in a corrected optical rotational enclosure. Zebrafish. 7 (2), 149-154 (2010).
- Akitake, C. M., Macurak, M., Halpern, M. E., Goll, M. G. Transgenerational analysis of transcriptional silencing in zebrafish. Dev Biol. 352 (2), 191-201 (2011).
- Boniface, E. J., Lu, J., Victoroff, T., Zhu, M., Chen, W. FlEx-based transgenic reporter lines for visualization of Cre and Flp activity in live zebrafish. Genesis. 47 (7), 484-491 (2009).
- Skarnes, W. C., et al. A public gene trap resource for mouse functional genomics. Nat Genet. 36 (6), 543-544 (2004).
- Davidson, A. E., et al. Efficient gene delivery and gene expression in zebrafish using the Sleeping Beauty transposon. Dev Biol. 263 (2), 191-202 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved