Method Article
細胞内病原体によって引き起こされる液胞破裂のシングルセル測定
* これらの著者は同等に貢献しました
要約
我々は内膜破裂を追跡するための方法を説明することは細胞内細菌によって誘発赤痢菌と結核菌。我々のアッセイはCCF4を利用し、細胞質のホストは、ライブまたは固定細胞におけるFRETプローブ。この記者は、細菌表面上の酵素活性が存在することによって分解される。
要約
赤痢菌は、エンドサイトーシスの液胞に入る宿主細胞に侵入する病原性細菌である。次に、この膜に囲まれた区画の破裂は、細菌が細胞質内で移動することができ増殖し、さらに隣接セルに侵入。 結核菌が免疫細胞によって貪食されており、最近ではマクロファージにおける破断ファゴソーム膜に示されている。私たちは、 赤痢菌や結核菌の宿主細胞侵入後ファゴソーム膜破壊を追跡するための堅牢なアッセイを開発しました。アプローチはCCF4を利用する、宿主細胞の細胞質ゾルで平衡化β-ラクタマーゼに対して感受性レポーターのFRET。細菌が膜で囲まれた区画内に存在するように細菌の病原体による宿主細胞への侵入の際、プローブは限りそのまま残ります。細胞内の病原体を切断CCF4の表面上の液胞、β-ラクタマーゼ活性を破壊した後瞬時につながるFRETシグナルの損失をると、その発光スペクトルを切り替える。この強固なレシオメトリックアッセイは侵入した細菌により誘発される液胞破裂のタイミングについての正確な情報が得られ、それはの発光シグナルの検出に特化したアルゴリズムによって、自動顕微鏡及び画像処理に結合することができるドナーとアクセプターのFRET。さらに、単一細胞内のリアルタイムで細胞内細菌によって誘発される液胞分裂のダイナミクスを調査できます。最後に、完全に従来の方法を越える時空間分解能で高スループット分析に適している。ここでは、HeLa細胞と赤痢菌ならびに結核marinum、ウシ型結核菌、などの複数のマイコバクテリアの菌株を用いたタイムラプス実験やエンドポイントの実験のためのTHP-1マクロファージCCF4液胞の破裂アッセイのための代表的なプロトコルの実験の詳細を提供しますと結核 。
概要
多数の細菌性病原体は、感染の過程で彼らの真核細胞の膜に囲まれた区画内に内在化されています。セルエントリは、マクロファージによって摂取、または病原体を積極的に典型的には非食細胞へのそれらの取り込みを誘導している結核菌の場合のように、特殊な宿主細胞による貪食のいずれかを介して起こる。誘発摂取の場合には、 赤痢菌のために例えば、病原体は、他の細胞機能エンドソーム区画1,2内細菌の局在が生じる厳しく規制内膜選別機械の中でハイジャック宿主細胞質ゾルにエフェクタータンパク質を注入。その後、 赤痢菌は液胞破裂とホスト膜輸送とリソソームへの回避の配信を妨害する病原体の細胞質へのアクセスにつながる囲む膜を破壊する。より最近では、ファゴリソソーム破裂も感染列strとして見出されているategy 結核 、もっぱら膜結合コンパートメント3,17内に局在するのに長い時間のために考えられていた病原体によって使用される。
侵襲性病原体の細胞内膜輸送の動態を調査するために、大きな改善は4,5 1980年代後半の研究をもとに、透過型電子顕微鏡(TEM)以降に達成された。例えば、染料を使用して蛍光顕微鏡ベースの方法は、細菌表面のコンポーネント、または細胞内コンパートメントとの共局在のマーカーに対する抗体は、6,7を引き継いだ。しかし、彼らはまだ正確な時空間分解能と定量的に細菌の病原体によって液胞破裂を測定するための堅牢性を得られない。
このハードルは、最初の遺伝子発現8を研究するために使用されたセファロスポFRET CCF4-AM派生リポーターに基づくアッセイで対処されています。そして、infファイルのコンテキストで使用されたECTION生物学、エフェクター分泌を調査すると、宿主細胞9,10,11にナイセリアの取り込みに従うこと。私たちは、 赤痢菌 12と結核菌 17によって誘発される液胞破裂を研究するため、この記者を利用してアッセイを開発しました。本手法の原理は、 赤痢菌を用いて、図1に記載されている。まず、宿主細胞はAMエステル部分を開裂した後に細胞質内に閉じ込められているFRET CCF4-AM基板がロードされる。その後、細胞は赤痢菌に感染している。細菌の表面上のβ-ラクタマーゼ存在裂CCF4基質液胞破裂が発生するとすぐにすることができます。これは、405nmでの励起時にプローブ450 nmの535nmでの発光ピークを切り替えFRETシグナルの損失につながる。 535分の450 nmの強度のレシオメトリック測定は、液胞の整合性を強調:低比率は、膜·アン反映高い比率一方クローズドまたは細胞外細菌はバクテリアとホスト細胞質との間の接触を反映しています。また、THP-1マクロファージにおける結核菌によって誘導されるファゴソーム破裂を研究するため、この方法の適応を報告する。実験的な原則は、順序が逆転しているが、CCF4-AMローディングが細菌感染した後にのみ適用されるものと同じまま。
したがって、単一細胞レベルでの定量的なレシオメトリック蛍光測定によって、 赤痢菌液胞の破裂は、異なる細胞型12,13,14から、即座に、固定試料における追跡することができる。さらに、この方法は、 ウシ型結核菌および結核菌を使用して、この研究で示すように、他の侵襲性病原体の数に適合させることができる。最後に、96ウェル(または384ウェル)に我々のプロトコルフォーマットの小型化、高スループットで、多数の条件のスクリーニングを可能にします。
プロトコル
アッセイは、様々な形式で動作しますが、しかし、我々は、特に試薬、CCF4-AMを保存するためにサンプル量をスケールダウンをお勧めします。したがって、以下のプロトコルが35ミリガラスボトムディッシュにHeLa細胞ライブし、次いで、96ウェルフォーマットで固定したHeLa細胞又はTHP-1マクロファージ様細胞に記載されている。アッセイは、他の病原体に適合させることができる。 赤痢菌感染に加えて、我々はTHP-1は、異なるM Y cobacterial株を 貪食するためのアッセイを記述します。
重要なのは、CCF4-AMロード後、洗浄バッファーを含むすべての試薬およびバッファーは1 mMのでプロベネシドの存在を必要とする。プロベネシドは、プロトコルのすべてのステップを通してCCF4の細胞質の保持を促進するアニオンチャネル阻害剤である。 CCF4信号は長時間にわたって安定していないので、固定のサンプルは、実験後数時間以内に取得する必要があります。
1。 赤痢菌Fを使用した固定サンプルでCCF4アッセイlexneri(96ウェルプレート)
- 一晩培養するための細菌を準備。細菌プレ文化野生型(赤痢菌AfaI)および変異(BS176 AfaI)株37℃で一晩振とう機にアンピシリン(50μgの/ ml)で補足8ミリリットルトリプシンカゼイン大豆ブロス(TCSB)での感染の1日前に接種。
- 感染のめっきセル。最終容積の5%CO 2インキュベーター内で10%ウシ胎児血清(FCS)および1%ペニシリン-ストレプトマイシンを含有するDMEM中でウェルあたり5×10 3細胞の密度で96ウェルプレート感染前1日にシードHeLa細胞100μlに。 THP-1マクロファージ様細胞の場合には、細胞播種は、5×10 4細胞/ウェルの密度で2日間感染の前に行われ、それらは10%を含有するRPMI中で30 nMのホルボールミリスチン酸アセテート(PMA)と共にインキュベートするウシ胎児血清(FCS)、1%ペニシリン - ストレプトマイシンおよび0.05 mMの2 - メルカプトエタノール。
- サブカルチャーのために細菌を準備。一晩細菌培養に接種2.5時間(OD600 = 0.3〜)のために37℃で50μgの/シェーカーでアンピシリンを補っTCSBで1/100希釈で。
- CCF4-AMで細胞を読み込んでいます。 CCF4-AMをウェルあたり25μlの最終容量のための組合せを読み込ん1mMのプロベネシド(Sigma社製)、1.5μMCCF4-AM(THP-1の場合6μM)とB液(100mgのをロード1.25μLを含むを準備/ mlのプルロニック-F127 Invitrogen社CCF4-AM LiveBlazerローディングキットに沿って設けられDMSO/0.1%酢酸中の界面活性剤)EMバッファー(120mMのNaClを、7のKCl、1.8mMのCaCl 2を、0.8のMgCl 2、5mMグルコース、内pHは7.3)に25 mMのHEPES。 PBSで細胞を1回洗浄し、2.5時間、暗所で室温でウェル当たりCCF4-AMローディングミックス25μLを加える。
- 感染細菌を準備。 1分間9,000 rpmで細菌のサブカルチャーを1mlスピン。 10μgの/ mlのポリ-L-リジン(Sigma社)および40μgの/ mlのβ-lactaを補充した500μlのPBSで1分間再懸濁しために9,000 rpmでスピン、500μlのPBSで1回洗浄する(シグマ)間瀬。室温で回転ホイールでのインキュベーションの10分後、500μlのバッファーEM /の1mMプロベネシドで500μlのPBSで再懸濁しバクテリアで一度洗う。
- 細胞感染および固定。プロベネシド150μlのPBS / 1 mmの細胞を1回洗浄し、EMバッファー/ 1ミリメートルプロベネシド100μlの最終容量中に再懸濁し、細菌を10μlのミックスを調製し、各ウェルに、それを配布します。室温で暗所で15分間インキュベートした後、1時間(THP-1の場合は90分)を37℃にプレートを切り替える、150μlのPBS / 1ミリメートルプロベネシドで洗浄し、50μlのホルムアルデヒド4%で固定/ 1mMのは暗闇の中で10分間プロベネシド。その後、10μM核染料DRAQ5(Biostatus)30μlのと30分間インキュベート150μlのPBS / 1ミリメートルプロベネシド、で洗浄、150μlのPBS / 1ミリメートルプロベネシドで洗浄し、100μlのPBS / 1ミリメートルプロベネシドのサンプルを残して。
- 固定されたサンプルの取得設定。買収は、(i)は倒立エピ蛍光ミクロスを使用していずれかで実行される10倍を目的とした共焦点顕微鏡を用いて20倍(0.5開口数(NA)、2.1作動距離(WD))または40倍(0.75 NA、0.72 WD)N-プラン空気目的または(ii)にも対応しています。蛍光イメージングは、405 nmで励起し実行(Semrock、FF01-387/11-25)と排出量は450 nmの(Semrock、FF02-447/60-25)および535 nmのフィルター(Semrock、を介して検出されFF01-520/35- 5ミリ秒(透過光)の露光時間、1,000ミリ秒(535 nm)を、500ミリ秒(450 nm)を用いた25)。共焦点イメージングは、以下の露光時間を使用して実行されます:405 nmレーザー(870μW)のために240ミリ秒(450ナノメートル)と360ミリ(535 nm)を、640 nmレーザー(2560μW)のために640ミリ秒(DRAQ5)。
- 取得後の分析。続いて、画像は、個々の細胞について、蛍光シグナルの自動採点を可能にするコンピュータアルゴリズムによって分析される。このような変形者7.1やアカペラなどのソフトウェアは、(リクエストに応じて利用可能)と450nmの535nmの発光信号間の比を測定するためのスクリプトを作成するために使用することができ。注目すべきは、取得時に自動顕微鏡に結合された焦点較正装置の使用は、同時に複数のウェル内の異なる位置の数十を取得することができる。
2。 赤痢菌を使用したライブサンプルでCCF4アッセイ(34 mmガラスボトムフォーマット、マテック)
- 一晩培養するための細菌を準備。前述のように進みます。
- 感染のめっきセル。 2ミリリットルの最終体積で2×10 5細胞/ディッシュの密度で35ミリのガラス底培養皿(マテック10ミリメートルマイクロウェル、マテック株式会社)感染症の1日前に種子HeLa細胞。
- サブカルチャーのために細菌を準備。前述のように進みます。
- CCF4-AMで細胞を読み込んでいます。以前に皿あたり2 mlの最終容積について記載したようにCCF-AMローディングミックスを調製する。ロードする前に、PBSで1回細胞を洗浄。
- 感染細菌を準備。前述のように進みます。
- Acquisitライブサンプルのイオン設定。買収は37℃加熱室内20X(0.5 NA、2.1 WD)または40倍(0.75 NA、0.72 WD)N-プラン空気対物レンズを用いて倒立落射蛍光顕微鏡で60分ごとに90秒間実行されます。蛍光イメージングは、405 nmで励起し実行(Semrock、FF01-387/11-25)と排出量は450 nmの(Semrock、FF02-447/60-25)および535 nmのフィルター(Semrock、を介して検出されFF01-520/35- 5ミリ秒(透過光)、200ミリ秒(535 nm)とし、100ミリ秒(450ナノメートル)の露光時間を用いて25)。
- 細胞感染およびライブ買収。 EM /の1mMプロベネシド2 mlを加え、2つのmlのPBS / 1ミリメートルプロベネシドで一回細胞を洗浄し、顕微鏡のステージ上にお皿をマウントして取得を開始します。 6分(時点4)の後、保留に買収を入れた細胞の上に細菌懸濁液250μlを追加し、買収を再起動します。
- 取得後の分析。映画は変形者またはImageJのを使って可視化することができる。各INDIVIための535分の450 nmの強度比デュアルセルは、ImageJのを用いて得ることができる。前述したように、取得時に自動顕微鏡に結合された焦点較正装置の使用は、時間経過に応じて複数の異なる位置を取得することができる。
3。使用して、固定サンプルにCCF4アッセイ マイコ(96ウェルフォーマット)
- 細菌を準備する。育つ 30°C( 結核marinumの場合)または37℃( ウシ型結核菌 BCGと結核菌用)でカタラーゼアルブミンデキストロース(ADC)を含む7H9における中期対数期にマイコバクテリア菌株。
- 感染のめっきセル。 10%ウシ胎児血清(FCS)、1%ペニシリン-ストレプトマイシンおよび最終容積の5%CO 2インキュベーター中0.05mMの2 -メルカプトエタノールを含有するRPMI中で30 nMのPMAでそれらをインキュベート1-2日感染前板THP-1マクロファージ5×10 4細胞/ウェルの密度で100μlの。
- 感染細菌を準備。 HARVESTの文化は、洗って凝集を避けるために、注射器を通して超音波処理し、ろ過前にPBSで再懸濁します。 OD600測定により各菌株の濃度を決定し、5%、30°C( 結核marinumの場合)またはRPMI培地中で37°C( ウシ型結核菌 BCGと結核菌用)でMOI 1:1でTHP-1細胞に感染CO 2。 2時間後、培地を除去し、PBSで3回洗浄し、1-2日( 結核marinumの場合)、または3〜7日( ウシ型結核菌 BCGと結核菌の場合)のための完全な新鮮な培地を追加します。
- CCF4-AMと固定で細胞を読み込んでいます。 PBSで1回細胞を洗浄し、以前6μMのCCF4-AM最終濃度を使用してウェル当たり25μlの最終容量について説明したようCCF4-AMローディングミックスを調製する。ロードは150μlのPBS / 1ミリメートルプロベネシドで洗浄前に2時間、暗所で室温で行われ、修正4%で50μlのホルムアルデヒドを使用してATIONは暗闇の中で30分間プロベネシドwith1 mMのを補足。その後、150μlのPBS / 1ミリメートルプロベネシドで洗浄し、100μlのPBS / 1ミリメートルプロベネシドのサンプルを残して。
- 取得設定と取得後の分析。以前に赤痢菌を使用して最初の段落で説明したように進んでください。
補足プロトコル
蛍光アッセイは、細菌の表面でβ-ラクタマーゼの活性を確認するために行われる。これは、記載されたアッセイで使用するためのもので、各菌株に対して行われるべきである。この目的のために、洗浄した細菌は、暗闇の中で37℃で1時間、PBS 1mlに100 nMのCCF4-AM(Invitrogen社)、50μgの/ mlのブタエステラーゼ肝臓エキス(シグマ)に接触させている。可溶性ラクタマーゼ1 mg / mlの(Invitrogen社)をポジティブコントロールとして使用することができる。そして、発光スキャンPTI Quantamasterの蛍光と、1mlのクォートを使用して405nmの励起で行われるzのキュベット。の損失は535 nmでFRETと高い450 nmのピークの出現はCCF4プローブに細菌の添加時に可視化する。
結果
CCF4-AM/β-lactamaseのアプローチは、 赤痢菌 ( 図1)のような細胞内病原体の液胞破裂を追跡するための堅牢かつ高感度な方法である。この研究で使用されている赤痢菌の菌株は、赤痢菌AfaIとBS176 AfaIと呼ばれる。赤痢菌AfaI効率的に上皮細胞の表面15にCD55を結合することができるアドAfaEを発現赤痢菌株である。したがってAfaE発現株は上皮細胞における野生型赤痢菌株に比べてはるかに高い侵攻能力を表示します。 BS176 AfaIプラスミドは赤痢菌の病原性を欠いた変異赤痢菌株を表現AfaEです。この株は、HeLa細胞の細胞に侵入することができません。それにもかかわらず、この株は、このセルラインの取り込みは、古典的な食作用にのみ依存し、官能タイプ3分泌システムを必要としないので、THP-1細胞に侵入することができる。両方の株は、β-ラクタマーゼを発現、プラスミドAfaE符号化の存在に起因するその表面上にβ-ラクタマーゼ活性を示す。 1時間のための非侵襲的なBS176 AfaI株とHeLa細胞の感染後、CCF4は、緑色信号(波長535nm)によって、図2Aに示すように、プローブは、無傷のままFRET。逆に、1時間のために病原性赤痢菌AfaI株の感染は、細胞質内にプローブの切断を強調青(450 nm)に向けた信号のスイッチにつながる。これを定量化するために、我々は自動化された細胞の検出信号とレシオメトリックの決定のための535および450nmのチャネルにおける強度の測定を可能と変形者アカペラソフトウェアのスクリプトを開発した。 図2Bは 、細胞の核と細胞質に示すように、DRAQ5チャネルを用いて分割される。その後、アルゴリズムは、個々のセルのための2つの強度間の比率を計算するために450 nmおよび535 nmの正の細胞集団を検出することが可能である図2Cにヒストグラムとして表現。低い比率は、強毒株に対する高い比率対変異株に対して得られる。この代表的な感染実験は、共焦点顕微鏡を用いて取得したが、落射蛍光顕微鏡法も、この作業に適している図 2の異なるヒト細胞型を使用して、図3および図4の例:HeLa細胞、上皮細胞およびTHP-1マクロファージ様細胞。病原性赤痢菌AfaI 赤痢の 1時間ひずみとHeLaおよびTHP-1細胞、青に緑(535 nm)のからの信号のスイッチの90分の感染時には(450 nm)をBS176 AfaI感染細胞( 図3Aに比べて観察されと4A)。我々は変形者ソフトウェア開発のスクリプトは、直接細胞のCCF4陽性集団を検出し、個々の細胞のための450および535 nmのチャネルにおける強度との比率を計算します。次いで、細胞をマクロdeveloを用いてそれらの比の関数として分類されるExcelでペッドは、従って細胞分布を示すヒストグラムが得られる。それはアカペラために開発された他のスクリプトについてはそうであったように、BS176 AfaI感染細胞比率が低いことを特徴とする、赤痢菌AfaI感染細胞は、HeLa細胞およびTHP-1マクロファージ( 図3Bおよび4B)に変形者アルゴリズムを用いた高比率を表示するのに対し。最後に、マイコバクテリアの研究にこの方法の適応を図5に示します。 ウシ型結核菌 BCGは、実験の時間経過を通して検出強力な535 nmの信号によって反射実験の全体のコースのファゴソームに存在します。対照的に、 結核菌感染の 7日間( 図5Aおよび5B)における450nmの信号によってハイライトされているように、感染の3日以上後にTHP-1マクロファージにおけるファゴソーム膜の破裂を誘発する。 赤痢菌による液胞破裂を研究するためのものと同じアルゴリズムを使用しては、私たちは、 結核菌に感染した細胞は、感染の7日間( 図5Cおよび5D)の後にウシ型結核菌 BCGよりも高い535分の450 nmの比を表示することがわかった。
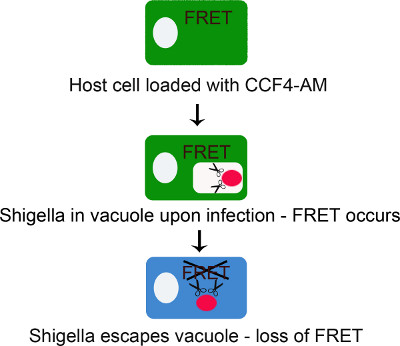
図1。エステル部分がCCF4陰イオンを生成する細胞質エステラーゼにより切断されて細胞質に、原形質膜を通して赤痢菌液胞破裂。自由CCF4-AM拡散を追跡するためのCCF4-AM/β-lactamaseアッセイの原理を表すスキーム 。この反応は、任意の膜に埋め込まコンパートメントに入るCCF4を防ぎます。このステップでは、CCF4は405nmで励起により535 nmでFRET誘発する。プローブは、β-ラクタマーゼを発現する細菌rupturまで無傷のままEエンドサイトーシス液胞を。このステップでは、CCF4はβ-ラクタマーゼ405nmで励起時に535から450nmの発光でスイッチをトリガすることによって切断されるので、信号が失われたFRET。
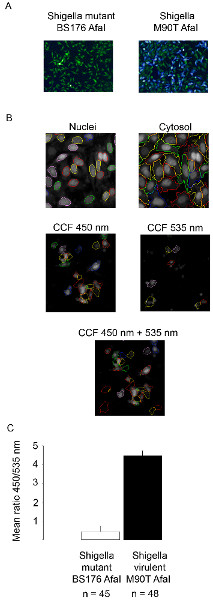
図2。 CCF4-AM負荷、HeLa細胞のβ-ラクタマーゼを発現する赤痢菌 BS176 AfaI変異株又は1時間と、固定用の赤痢菌AfaI強毒株に感染しているの2時間30分後、 共焦点顕微鏡を用いて赤痢菌液胞の破裂します()の追跡 10分間、4%パラホルムアルデヒドを用いた。その後、核DRAQ5で染色し、細胞を10倍の対物レンズとの共焦点顕微鏡を用いて結像される。代表的な画像は、次のマージされたチャンネルを選択されました:無傷CCF4プローブは、535 nmの(GREEに現れるn)は、切断されたCCF4プローブが450nmの(青)で表示されます(B)ピクチャの例としては、アカペラソフトウェア上で我々の自動化されたアルゴリズムの検出システムを強調。細胞(核細胞質ゾル+)の区分は、DRAQ5チャネルを用いて得られる。 CCF4陽性細胞は一緒にプール450および535 nmのチャネルを使用して取得されます(C)ヒストグラムは、 赤痢菌 BS176 AfaI変異株または赤痢菌AfaI強毒株を用いたアカペラで私たちの自動化された分析の結果を示す。平均比率は、450および535 nmのチャネルにおける強度との比を表す。 より大きい数字を表示するには、ここをクリックしてください 。
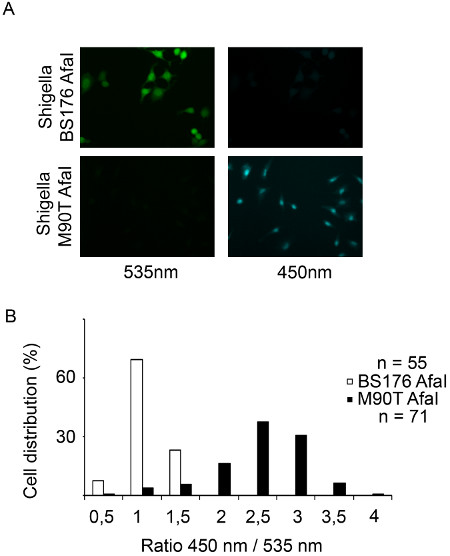
図3。 赤痢菌FLEトラッキング落射蛍光顕微鏡を用いてHeLa細胞におけるxneri胞の破裂。()CCF4-AMローディングの2時間30分後、HeLa細胞は、β-ラクタマーゼ発現赤痢菌 BS176 AfaI変異株又は1時間赤痢菌AfaI毒性株に感染していると10分間、4%パラホルムアルデヒドを用いて固定した。次いで、細胞を20倍対物レンズと落射蛍光顕微鏡を使用して結像される。代表的な画像は、以下のチャンネルを選択されました:。CCF4そのままプローブ535 nmの(緑色)とCCF4劈開プローブ450nmの(青)(B)変形者ソフトウェア上で我々の自動分析の結果を表すヒストグラム。個々のセルは450および535 nmのチャネルにおけるそれらの強度の比の関数で分布している。
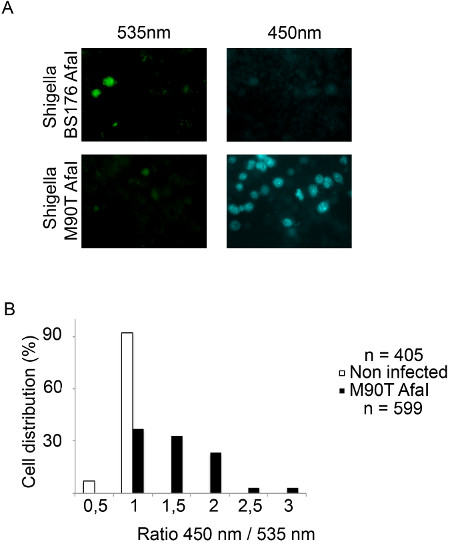
> 図4。 。落射蛍光顕微鏡を用いたTHP-1細胞では赤痢菌液胞の破裂トラッキング()CCF4-AMの2時間30分は、ロードした後、THP-1細胞は、β-ラクタマーゼを発現する赤痢菌 BS176 AfaI変異株や赤痢菌AfaIに感染している10分間、4%パラホルムアルデヒドを使用して1時間30分と固定のため毒株。次いで、細胞を20倍対物レンズと落射蛍光顕微鏡を使用して結像される。代表的な画像は、以下のチャンネルを選択されました:。CCF4そのままプローブ535 nmの(緑色)とCCF4劈開プローブ450nmの(青)(B)変形者ソフトウェアを使用して、我々の自動分析の結果を表すヒストグラム。個々のセルは450および535 nmのチャネルにおけるそれらの強度の比の関数で分布している。
ghres.jpg "SRC =" / files/ftp_upload/50116/50116fig5.jpg "/>
図5。 ウシ型結核菌 BCGと落射蛍光顕微鏡を用いたTHP-1マクロファージ。(A、B)THP-1細胞を2時間β-ラクタマーゼを発現するウシ型結核菌 BCGまたは結核菌に感染して3〜7日間培養している中で結核菌ファゴソーム破裂のトラッキング 。洗浄後、細胞を画像化は40倍対物レンズと落射蛍光顕微鏡を使用する前に、30分間、4%パラホルムアルデヒドを用いて2時間および固定のためにCCF-4-AMがロードされる。 。;劈開CCF4、プローブ450nmの(青)(C、D)の変形者ソフトウェアを使用して我々の自動分析の結果を提示するヒストグラム無傷CCF4プローブ、535 nmの(緑):代表的な画像は、以下のチャンネルが選ばれました。個々のセルは450および535 nmのチャネルにおける強度との比の関数として分配される。
ディスカッション
CCF4-AM/β-lactamaseアッセイは、細胞内の赤痢菌と異なる種類の細胞におけるマイコバクテリアによって誘発される液胞分裂を追跡する簡単な方法です。それはラクタマーゼ敏感細胞質は、細菌の表面に活性酵素によって切断されている記者のFRETを利用しています。
CCF4-AM基板の損失は簡単に基板からロードした後、すべてのソリューションにプロベネシドを追加することで回避することができます。示したように、アッセイは、複数の細胞型(上皮細胞、食細胞)およびフォーマット(96ウェル、35ミリガラスボトムディッシュ、6/12/24ウェルプレート)に適合させることができる。 6/12/24ウェルプレートの使用については、無菌カバースリップ細胞を播種する前に、各ウェルの底部に分布している。実験の最後に、カバースリップを金退色防止試薬(Invitrogen)を延長するなど、実装媒体にスライド上に転写される。この方法では、信号は、アッセイの後、より長い時間にわたって安定である試料は固定後、PBSに保存されている96個のウェルフォーマットに比べて。 CCF4-AM基板の高コストは、試料の体積を決定する前に考慮されるべきである。我々は彼らをスケールダウンをお勧めする理由です。実験では、6/12/24ウェルフォーマットで、より高価ですが、信号が日間安定です。逆に、実験は、96ウェルフォーマットで安価であるが、サンプルは実験日で分析されなければならない。それはライブの実験はまた、96ウェルまたは384ウェルフォーマットで行うことができることは注目に値する。これは、ウェルあたりのポジションの番号を同時に(変異体細菌、MOI、プラスミド又はsiRNAトランスフェクション、化学薬品など)で条件の多数を使用してライブの実験を行うことができます。 赤痢菌に適していますが、私たちは感染サイクルは、細胞質内に保持することができますCCF4の測定可能な濃度を超えているので、 "true"をリアルタイムまたはタイムラプス実験がマイコバクテリアの研究のために実現不可能であることを強調する。のためにこの理由は、CCF4-AM基板を浸潤が達成された後にのみ、セルに適用される。
変形者ソフトウェアを取得し、分析のために使用されているケースでは、我々はよく当たりの画像の指定した数で全体の384分の96ウェルプレートを取得することができるモジュール "画面取得"を使用することをお勧めします。さらに、モジュールの "確認画面データは、"(i)が大きな "ポスター"で同時に任意のチャンネルのためによく、それぞれのステッチ画像モザイクを可視化すると、(ii)535の強度を測定するための特殊なアルゴリズムをループ可能にし、 450 nmのチャネル。にもかかわらず、我々はタイムラプス顕微鏡を使用して単一の細菌によって液胞破裂を測定することができました、我々は個々の細菌の表面の酵素活性は、それが困難な細胞内細菌と液胞の有効数を正確に相関させるためにレンダリング変化することを注意したいと思います破裂。
アッセイの堅牢性を考えると、それは、hに適していますIGHのスループットは、96または384ウェルフォーマットで近づく。また、成功したサスペンション16の細胞の感染を調べるためにFACS分析のためにこのプロトコルを適応している。アッセイはまた、広範囲のアプリケーションにつながる、その表面にラクタマーゼを提示する他の細菌又はキャリアの調査のために使用することができる。例えば、このアプローチは、例えば、β-ラクタマーゼを発現するレジオネラ菌 、 リステリア菌又はネズミチフス菌 12などの他の病原体により誘発される液胞破裂を研究するために使用することができる。 リステリア菌は、赤痢菌感染に匹敵短い周期を有するので、時間経過実験が可能である。これとは対照的に、ためレジオネラ·ニューモフィラとネズミチフス菌ディスプレイ長い感染サイクルは、我々は、エンドポイントの実験を行うことをお勧めします。
可能な様々なアプリケーションがCCF4-AM/β-lactamaseアッセイ作る固定したサンプル中またはリアルタイムに細胞内病原体によって誘発される液胞破裂を追跡するための興味深い蛍光法。
開示事項
我々は、開示することは何もありません。
謝辞
この作品は、通信社国立注ぎラルシェルシュによっておよび欧州研究評議会によって資金を供給された。
資料
| Name | Company | Catalog Number | Comments |
| LiveBlazer FRET-B/G Loading Kit (CCF4-AM) | Invitrogen | K1089 | Protect from light, stock in - 80 ° aliquots |
| Draq5 | Biostatus | DR50050 | |
| Poly-L-lysine | Sigma | P9155 | |
| μCLEAR-PLATE, BLACK, 96 well | Greiner Bio-One | 655090 | |
| 35 mm glass bottom dishes | MatTek corp. | P35G-1.5-10-C | |
| Probenecid | Sigma | P8761 | |
| β-lactamase | Sigma | P0389 |
参考文献
- van der Goot, F. G., Gruenberg, J. Intra-endosomal membrane traffic. Trends Cell Biol. 16, 514-521 (2006).
- Raposo, G., Marks, M. S., Cutler, D. F. Lysosome-related organelles: driving post-Golgi compartments into specialisation. Curr. Opin. Cell Biol. 19, 394-401 (2007).
- van der Wel, N., et al. M. leprae translocate from the phagolysosome to the cytosol in myeloid cells. Cell. 129, 1287-1298 (2007).
- Sansonetti, P. J., Ryter, A., Clerc, P., Maurelli, A. T., Mounier, J. Multiplication of Shigella flexneri within HeLa cells: lysis of the phagocytic vacuole and plasmid-mediated contact hemolysis. Infect Immun. 51, 461-469 (1986).
- Bobard, A., Mellouk, N., Enninga, J. Spotting the right location- imaging approaches to resolve the intracellular localization of invasive pathogens. Biochim. Biophys. Acta. 1810, 297-307 (2011).
- Beauregard, K. E., Lee, K. D., Collier, R. J., Swanson, J. A. pH-dependent perforation of macrophage phagosomes by listeriolysin O from Listeria monocytogenes. J. Exp. Med. 186, 1159-1163 (1997).
- Shaughnessy, L. M., Hoppe, A. D., Christensen, K. A., Swanson, J. A. Membrane perforations inhibit lysosome fusion by altering pH and calcium in Listeria monocytogenes vacuoles. Cell Microbiol. 8, 781-792 (2006).
- Zlokarnik, G., et al. Quantitation of transcription and clonal selection of single living cells with beta-lactamase as reporter. Science. 279, 84-88 (1998).
- Charpentier, X., Oswald, E. Identification of the secretion and translocation domain of the enteropathogenic and enterohemorrhagic Escherichia coli effector Cif, using TEM-1 beta-lactamase as a new fluorescence-based reporter. J. Bacteriol. 186, 5486-5495 (2004).
- Mills, E., Baruch, K., Charpentier, X., Kobi, S., Rosenshine, I. Real-time analysis of effector translocation by the type III secretion system of enteropathogenic Escherichia coli. Cell Host Microbe. 3, 104-113 (2008).
- Bish, S. E., Song, W., Stein, D. C. Quantification of bacterial internalization by host cells using a beta-lactamase reporter strain: Neisseria gonorrhoeae invasion into cervical epithelial cells requires bacterial viability. Microbes Infect. 10, 1182-1191 (2008).
- Ray, K., et al. Tracking the dynamic interplay between bacterial and host factors during pathogen-induced vacuole rupture in real time. Cell Microbiol. 12, 545-556 (2010).
- Blocker, A., et al. The tripartite type III secreton of Shigella flexneri inserts IpaB and IpaC into host membranes. J. Cell Biol. 147, 683-693 (1999).
- Mounier, J., et al. The IpaC carboxyterminal effector domain mediates Src-dependent actin polymerization during Shigella invasion of epithelial cells. PLoS Pathog. 5, e1000271(2009).
- Nowicki, B., Hart, A., Coyne, K. E., Lublin, D. M., Nowicki, S. Short consensus repeat-3 domain of recombinant decay-accelerating factor is recognized by Escherichia coli recombinant Dr adhesin in a model of a cell-cell interaction. The Journal of Experimental Medicine. 178, 2115-2121 (1993).
- Nothelfer, K., Dias Rodrigues, C., Bobard, A., Phalipon, A., Enninga, J. Monitoring Shigella flexneri vacuolar escape by flow cytometry. Virulence. 2, 54-57 (2011).
- Simeone, R., et al. Phagosomal rupture by Mycobacterium tuberculosis results in toxicity and host cell death. PLoS Pathog. 8, e1002507(2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved