Method Article
Misure singole cellule di Rottura Vacuolar causate da patogeni intracellulari
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Si descrive un metodo per l'inseguimento della rottura endomembrane suscitato dai batteri intracellulari Shigella flexneri E Mycobacterium tuberculosis Su di invasione della cellula ospite. La nostra analisi si avvale di CCF4, un host citoplasmatica sonda FRET in cellule vive o fisso. Questo reporter è degradata da una attività dell'enzima presente sulla superficie batterica.
Abstract
Shigella flexneri sono batteri patogeni che invadono le cellule ospiti che entrano in un vacuolo endocitico. Successivamente, la rottura di questo compartimento di membrana-incluso permette ai batteri di muoversi all'interno del citoplasma, proliferare e invadere ulteriormente le cellule vicine. Mycobacterium tuberculosis viene fagocitato da cellule del sistema immunitario, ed è stato recentemente dimostrato che la rottura della membrana phagosomal nei macrofagi. Abbiamo sviluppato un test affidabile per il monitoraggio phagosomal interruzione della membrana dopo l'entrata della cellula ospite di Shigella flexneri o Mycobacterium tuberculosis. L'approccio fa uso di CCF4, un FRET giornalista sensibile alla β-lattamasi che equilibra nel citosol delle cellule ospiti. Upon invasione delle cellule ospiti da batteri patogeni, la sonda rimane intatto finché i batteri risiedono in compartimenti membrana chiusi. Dopo interruzione del vacuolo, l'attività β-lattamasi sulla superficie dei patogeni intracellulari fende CCF4 istantaneamente portarerelativa ad una perdita di segnale FRET e della commutazione suo spettro di emissione. Questo robusto saggio raziometrica produce informazioni accurate sulla tempistica di rottura vacuolare indotta dai batteri invasori, e può essere accoppiata alla microscopia automatizzata ed elaborazione immagini con algoritmi specializzati per la rilevazione dei segnali di emissione FRET donatore e accettore. Inoltre, permette investigare le dinamiche di disgregazione vacuolare provocata da batteri intracellulari in tempo reale in cellule singole. Infine, è perfettamente adatto per l'analisi ad alta produttività con una risoluzione spazio-temporale superiore a metodi precedenti. Qui, forniamo i dettagli sperimentali di protocolli di esemplari per il vacuolare saggio CCF4 rottura su cellule HeLa e THP-1 dai macrofagi per esperimenti di time-lapse o finali esperimenti usando Shigella flexneri e più ceppi di micobatteri come il Mycobacterium marinum, Mycobacterium bovis, e Mycobacterium tuberculosis.
Introduzione
Numerosi agenti patogeni batterici sono internalizzati in compartimenti di membrana recintato di cellule eucariotiche durante il loro corso di infezione. Immissione di cella avviene tramite fagocitosi di cellule ospiti specializzate, come è il caso per Mycobacterium tuberculosis che vengono ingeriti dai macrofagi, o gli agenti patogeni inducono attivamente il loro assorbimento nelle cellule tipicamente non fagocitiche. Nel caso di assorbimento indotto, per esempio per Shigella flexneri, il patogeno inietta proteine effettrici nel citosol host che dirottare tra le altre funzioni cellulari del macchinario smistamento endomembrane strettamente regolata conseguente localizzazione batterica all'interno di un compartimento 1,2 endosomiale. Successivamente, Shigella sconvolge la membrana che racchiude porta alla rottura vacuolare e accesso citosolica del patogeno interferire con il traffico di membrana ospitante ed evitare la consegna al lisosoma. Più di recente, la rottura fagolisosomale è stata trovata anche come infezione strategy utilizzati dal Mycobacterium tuberculosis, un agente patogeno che è stato pensato per un lungo tempo per essere localizzati esclusivamente all'interno di un compartimento di membrana 3,17.
Per studiare la dinamica del traffico di membrana subcellulare di agenti patogeni invasivi, grandi miglioramenti sono stati compiuti dopo la microscopia elettronica a trasmissione (TEM) studi alla fine del 1980 4,5 base. Per esempio, i metodi basati microscopia a fluorescenza con coloranti, anticorpi contro i componenti della superficie batterica, o marcatori per la co-localizzazione con compartimenti subcellulari ha assunto 6,7. Tuttavia, ancora non diano precise risoluzione spazio-temporale e la robustezza per misurare la rottura vacuolare da batteri patogeni quantitativamente.
Questo ostacolo è stato affrontato con un metodo basato sul derivato CCF4-AM FRET giornalista cefalosporina che è stato prima utilizzato per studiare l'espressione genica 8. Poi, è stato utilizzato nel contesto di infbiologia ezione di indagare secrezione effettrici e di seguire l'assorbimento di Neisseria nelle cellule ospiti 9,10,11. Abbiamo sviluppato un saggio approfittando di questo reporter per lo studio di rottura vacuolare indotto da Shigella flexneri 12 e Mycobacterium tuberculosis 17. Il principio del nostro metodo è descritto in Figura 1 utilizzando Shigella flexneri. In primo luogo, le cellule ospiti vengono caricati con il FRET substrato CCF4-AM che viene intrappolato all'interno del citoplasma dopo fendendo largo delle frazioni AM estere. Successivamente, le cellule sono infettate con Shigella flexneri. β-lattamasi presente sulla superficie dei batteri è in grado di scindere il substrato CCF4 appena si verifica la rottura vacuolare. Questo porta ad una perdita di FRET segnale di commutazione del picco di emissione da 535 nm a 450 nm su di eccitazione della sonda a 405 nm. La misura ratiometrica dei 450/535 nm intensità evidenzia integrità vacuolare: bassi rapporti riflettono membrana-enbatteri chiusi o extracellulare, mentre alti rapporti riflettono il contatto tra i batteri e il citosol host. Segnaliamo anche un adattamento di questo metodo per studiare la rottura phagosomal indotta da Mycobacterium tuberculosis in THP-1 macrofagi. I principi sperimentali rimangono gli stessi anche se la sequenza è invertita, CCF4-AM carico è applicato solo dopo infezione batterica.
Così, da misure di fluorescenza raziometrici quantitativi a livello di singola cellula, la rottura vacuolare di Shigella flexneri possono essere monitorati in tempo reale e in campioni fissi da diversi tipi cellulari 12,13,14. Inoltre, questo metodo può essere adattato ad una serie di altri patogeni invasivi come mostrato in questo studio utilizzando Mycobacterium bovis e Mycobacterium tuberculosis. Infine, la miniaturizzazione del nostro protocollo a 96 bene (o 384 anche) formati consente lo screening di numerose condizioni a elevato throughput.
Protocollo
Il test funziona in vari formati, tuttavia si consiglia di scalare verso il basso il volume del campione per salvare i reagenti, in particolare CCF4-AM. Pertanto, la seguente protocollo è descritto per le cellule HeLa fisse o THP-1 i macrofagi in un formato a 96 pozzetti, poi per cellule HeLa vivi nel 35 millimetri piatti fondo di cristallo. Il dosaggio può essere adattato per altri patogeni. Oltre infezione Shigella, descriviamo il test per THP-1 phagocytosing diversi m y ceppi cobacterial.
È importante sottolineare che, dopo CCF4-AM carico, tutti i reagenti e tamponi tra cui buffer di lavaggio richiedono la presenza di probenecid a 1 mm. Probenecid è un inibitore canale anionico che favorisce la ritenzione citosolico di CCF4 durante tutte le fasi del protocollo. Campioni fissati dovranno essere acquisite entro poche ore dopo l'esperimento in quanto il segnale CCF4 non è stabile per lunghi periodi di tempo.
1. CCF4 Assay su campioni fissati con Shigella flexneri (96 pozzetti)
- Preparazione di batteri per le culture durante la notte. Inoculare i batteri pre-culture di tipo selvatico (M90T Afai) e mutanti (BS176 Afai) ceppi 1 giorno prima infezione in 8 ml trittico caseina di soia brodo (TCSB) integrato con ampicillina (50 mg / ml) in un agitatore a 37 ° C per una notte .
- Cellule placcatura per l'infezione. Seme cellule HeLa in piastre da 96 pozzetti 1 giorno prima dell'infezione a una densità di 5 x 10 3 cellule per pozzetto in DMEM contenente 10% siero fetale bovino (FCS) e 1% di penicillina-streptomicina in un 5% di CO 2 incubatore in un volume finale di 100 microlitri. Nel caso di cellule THP-1 macrofaghe, placcatura cella viene effettuata 2 giorni prima dell'infezione a una densità di 5 x 10 4 cellule / pozzetto, ed essi vengono incubati con 30 nM Phorbol miristato acetato (PMA) in RPMI contenente 10% Fetal Calf Serum (FCS), 1% di penicillina-streptomicina e 0,05 mM di 2-mercaptoetanolo.
- Preparazione di batteri per sottocultura. Inoculare colture batteriche durante la nottea una diluizione in TCSB 1/100 integrata con 50 ug / ml di ampicillina in un agitatore a 37 ° C per 2,5 hr (OD600 = 0,3 a 0,4).
- Celle di carico con CCF4-AM. Preparare la miscela CCF4-am carico per un volume finale di 25 pl per pozzetto contenente 1 mM probenecid (Sigma), 1,5 mM CCF4-AM (6 mM nel caso di THP-1) e 1,25 ml di soluzione di carico B (100 mg / ml Pluronic-F127 tensioattivo in acido acetico DMSO/0.1% prevista lungo CCF4-AM LiveBlazer Caricamento Kit da Invitrogen) in EM tampone (120 mM NaCl, 7 mM KCl, 1.8 mM CaCl 2, 0,8 mM MgCl2, 5 mM di glucosio, HEPES 25 mM a pH 7.3). Lavare le cellule una volta con PBS e aggiungere 25 ml di CCF4-AM carico della miscela per bene a temperatura ambiente al buio per 2,5 ore.
- Preparazione di batteri per l'infezione. Spin 1 ml di sottoculture batteriche a 9.000 rpm per 1 min. Lavare una volta con 500 microlitri di PBS, centrifugare a 9000 rpm per 1 min e risospendere in 500 microlitri di PBS addizionato con 10 mg / ml di poli-L-lisina (Sigma) e 40 mcg / ml β-lattazionemase (Sigma). Dopo 10 min di incubazione su una ruota girevole a temperatura ambiente, lavate una volta con 500 microlitri di PBS e batteri risospendere in 500 microlitri tampone EM / 1 mM probenecid.
- Infezione delle cellule e la fissazione. Lavare le cellule una volta con 150 microlitri di PBS / 1 mM probenecid, preparare una miscela di 10 ml di batteri risospese in un volume finale di 100 microlitri di tampone EM / 1 mM probenecid e distribuirlo a ciascun pozzetto. Dopo 15 min di incubazione al buio a temperatura ambiente, passare la piastra a 37 ° C per 1 ora (90 minuti nel caso di THP-1), lavare con 150 microlitri di PBS / 1 mM probenecid e fissare con 50 microlitri paraformaldeide 4% / 1 mM probenecid per 10 minuti al buio. Poi, lavare con 150 microlitri di PBS / 1 mM probenecid, incubare per 30 minuti con 30 ml di 10 mM nuclei colorante DRAQ5 (Biostatus), lavare con 150 microlitri di PBS / 1 mm probenecid e lasciare i campioni in 100 l di PBS / 1 mm probenecid.
- Impostazioni di acquisizione dei campioni fissi. Acquisizione viene effettuata sia mediante (i) un epifluorescenza micros invertitafar fronte a un 20x (0,5 Apertura numerica (NA), 2.1 Distanza di lavoro (WD)) o 40x (0.75 NA, 0,72 WD) Obiettivo aria N-Plan o (ii) utilizzando un microscopio confocale con un obiettivo 10x. Imaging di fluorescenza viene eseguita con eccitazione a 405 nm (Semrock, FF01-387/11-25) ed emissione rilevata tramite 450 nm (Semrock, FF02-447/60-25) e 535 nm (filtri Semrock, FF01-520/35- 25) con tempi di esposizione di 5 msec (luce trasmessa), 1.000 msec (535 nm) e 500 msec (450 nm). Confocale viene eseguita utilizzando il seguente tempo di esposizione: 240 msec (450 nm) e 360 msec (535 nm) per il laser 405 nm (870 μW), 640 msec (DRAQ5) per il laser 640 nm (2560 μW).
- L'analisi post-acquisizione. Successivamente, le immagini vengono analizzate da un algoritmo che consente analisi automatica del segnale di fluorescenza per ogni singole celle. Software come Metamorph 7.1 o Acapella può essere usato per creare uno script per misurare il rapporto tra i segnali di emissione 450nm e 535nm (su richiesta). Di nota, l'uso di un dispositivo di calibrazione fuoco accoppiata alla microscopia automatizzata durante l'acquisizione permette acquisire decine di posizioni differenti in pozzi multipli contemporaneamente.
2. CCF4 Assay su campioni dal vivo grazie Shigella flexneri (formato 35 mm con fondo di vetro, MatTek)
- Preparazione di batteri per le culture durante la notte. Procedere come descritto in precedenza.
- Cellule placcatura per l'infezione. Seed cellule HeLa in 35 millimetri di vetro con fondo piatti della cultura (MatTek 10 millimetri Microwell, MatTek società) 1 giorno prima infezione ad una densità di 2 x 10 5 cellule / piatto in un volume finale di 2 ml.
- Preparazione di batteri per sottocultura. Procedere come descritto in precedenza.
- Celle di carico con CCF4-AM. Preparare la miscela carico CCF-AM come precedentemente descritto per un volume finale di 2 ml per piastra. Prima del carico, lavare le cellule una volta con PBS.
- Preparazione di batteri per l'infezione. Procedere come descritto in precedenza.
- Acquisizimpostazioni di ioni di campioni vivi. Acquisizione avviene per 60 min ogni 90 sec con un microscopio a epifluorescenza invertito utilizzando un 20x (0,5 NA, 2.1 WD) o un (NA 0,75, 0,72 WD) obiettivo aria N-Plan 40x all'interno di un 37 ° C camera di riscaldamento. Imaging di fluorescenza viene eseguita con eccitazione a 405 nm (Semrock, FF01-387/11-25) ed emissione rilevata tramite 450 nm (Semrock, FF02-447/60-25) e 535 nm (filtri Semrock, FF01-520/35- 25) con tempi di esposizione di 5 msec (luce trasmessa), 200 ms (535 nm) e 100 msec (450 nm).
- Infezione delle cellule e l'acquisizione diretta. Lavare le cellule una volta con 2 ml di PBS / 1 mM probenecid, aggiungere 2 ml di EM / 1 mM probenecid, montare il piatto sul palco del microscopio e avviare l'acquisizione. Dopo 6 min (punto 4 tempi), ha messo l'acquisizione in attesa, aggiungere 250 ml di batteri risospensione in cima alle cellule e riavviare l'acquisizione.
- L'analisi post-acquisizione. I filmati possono essere visualizzati utilizzando Metamorph o ImageJ. 450/535 rapporti di intensità nm per ogni individoppia cella può essere ottenuto utilizzando ImageJ. Come accennato in precedenza, l'uso di un dispositivo di calibrazione fuoco accoppiata alla microscopia automatizzata durante l'acquisizione permette acquisendo molteplici posizioni diverse a seconda del tempo-intervallo.
3. CCF4 Assay su campioni fissati con Micobatteri (96 Well Format)
- Preparazione di batteri. Crescere ceppi di micobatteri a metà fase log in 7H9 contenenti destrosio albumina catalasi (ADC) a 30 ° C (per Mycobacterium marinum) o 37 ° C (per il Mycobacterium bovis BCG e Mycobacterium tuberculosis).
- Cellule placcatura per l'infezione. Piastra THP-1 macrofagi 2 giorni prima infezione li dell'incubazione con 30 nM PMA in RPMI contenente 10% siero fetale bovino (FCS), 1% di penicillina-streptomicina e 0,05 mM 2-mercaptoetanolo in un 5% di CO 2 incubatore in un volume finale di 100 pl ad una densità di 5 x 10 4 cellule / pozzetto.
- Preparazione di batteri per l'infezione. Harvculture est, lavare e sospendere nuovamente con PBS prima di sonicazione e filtrazione attraverso una siringa per evitare grumi. Determinare la concentrazione di ciascun ceppo mediante misurazione OD600 e infettare cellule THP-1 ad una MOI di 01:01 a 30 ° C (per Mycobacterium marinum) o 37 ° C (per Mycobacterium bovis BCG e Mycobacterium tuberculosis) in mezzo RPMI con il 5% CO 2. Dopo 2 h, togliere medie, lavare 3 volte con PBS e aggiungere mezzo fresco completo per 1 a 2 giorni (nel caso di Mycobacterium marinum) o 3 a 7 giorni (nel caso di Mycobacterium bovis BCG e Mycobacterium tuberculosis).
- Caricamento di cellule con CCF4-AM e la fissazione. Lavare le cellule una volta con PBS e preparare il CCF4-AM mix caricamento come precedentemente descritto per un volume finale di 25 pl per pozzetto utilizzando un CCF4-AM concentrazione finale di 6 mM. Caricamento in corso avviene a temperatura ambiente al buio per 2 ore prima di lavare con 150 microlitri di PBS / 1 mm probenecid e fissarezione utilizzando 50 ml di paraformaldeide al 4% completato con1 mM probenecid per 30 min al buio. Poi, lavare con 150 microlitri di PBS / 1 mm probenecid e lasciare i campioni in 100 l di PBS / 1 mm probenecid.
- Impostazioni di acquisizione e analisi post-acquisizione. Procedere come precedentemente descritto nel primo paragrafo utilizzando Shigella flexneri.
Protocollo supplementare
Saggi fluorimetriche vengono eseguiti per verificare l'attività β-lattamasi alla superficie dei batteri. Questo dovrebbe essere fatto per ogni ceppo batterico destinato ad essere utilizzato nel saggio descritto. A questo scopo, i batteri lavati sono messi in contatto con 100 nM CCF4-AM (Invitrogen), 50 ug / ml suina estratti di fegato esterasi (Sigma) in 1 ml di PBS per 1 ora a 37 ° C al buio. Solubile lattamasi 1 mg / ml (Invitrogen) possono essere usati come controllo positivo. Poi, una scansione delle emissioni è effettuato a eccitazione 405 nm utilizzando un PTI Quantamaster fluorimetro e un litro 1 mlz cuvetta. La perdita di FRET a 535 nm e la comparsa di un picco di 450 nm elevato sono visualizzati su di batteri oltre alla sonda CCF4.
Risultati
L'approccio CCF4-AM/β-lactamase è un metodo robusto e sensibile per il monitoraggio rottura vacuolare di patogeni intracellulari come Shigella flexneri (Figura 1). I ceppi di Shigella che vengono utilizzati in questo studio sono definiti M90T Afai e BS176 Afai. M90T Afai è un ceppo Shigella flexneri che esprime la adesina AfaE, che è in grado di legare in modo efficiente CD55 sulla superficie delle cellule epiteliali 15. Ceppi che esprimono pertanto AfaE visualizzare capacità di invasione molto più elevate rispetto al ceppo M90T wild-type in cellule epiteliali. BS176 Afai è un AfaE esprimere mutante Shigella flexneri ceppo privo della virulenza Shigella plasmide. Questo ceppo è in grado di invadere le cellule HeLa. Tuttavia questo ceppo è in grado di entrare cellule THP-1 in quanto l'assorbimento in questa linea cellulare conta soltanto su fagocitosi classica e non richiede un sistema di tipo-3 secrezione funzionale. Entrambi i ceppi esprimono β-lattamasiE visualizzazione dell'attività β-lattamasi sulla loro superficie a causa della presenza del plasmide codificante AfaE. Al momento dell'infezione cellule HeLa con la non-invasivo BS176 Afai ceppo per 1 ora, il CCF4 FRET sonda rimane intatto, come mostrato in Figura 2A dal segnale verde (535 nm). Al contrario, l'infezione con il ceppo virulento M90T Afai per 1 ora porta ad un interruttore di segnale verso il blu (450 nm) evidenziando la scissione della sonda nel citosol. Per quantificare questo, abbiamo sviluppato uno script per il software Metamorph e Acapella che permette la rilevazione automatizzata delle celle e la misurazione delle intensità nei canali 535 e 450 nm per la determinazione del segnale raziometrico. Come mostrato nella Figura 2B, nuclei e citosol delle cellule sono segmentati utilizzando il canale DRAQ5. Quindi, l'algoritmo è in grado di rilevare i 450 nm e le popolazioni di cellule positive nm 535 per calcolare i rapporti tra le due intensità per ogni singola cella che èrappresentate come un istogramma in Figura 2C. Bassi rapporti sono ottenuti per il ceppo mutante contro alti coefficienti del ceppo virulento. Anche se questo esperimento di infezione rappresentante è stata acquisita utilizzando la microscopia confocale, microscopia in epifluorescenza è adatto anche per questo compito figure 3 e 4 mostrano esempi utilizzando 2 diversi tipi di cellule umane:. HeLa cellule epiteliali e cellule THP-1 macrofago-come. Al momento dell'infezione con il virulento M90T Afai Shigella ceppo per 1 ora e 90 min per HeLa e cellule THP-1, un interruttore di segnale da verde (535 nm) al blu (450 nm) viene osservato rispetto a BS176 Afai cellule infettate (Figure 3A e 4A). Lo script che abbiamo sviluppato sul software MetaMorph rileva direttamente la popolazione CCF4 positiva di cellule e calcolare il rapporto tra le intensità a 450 e 535 nm canali per ogni singolo celle. Poi le cellule sono classificate in funzione del loro rapporto utilizzando una macro sviped in Excel, ottenendo così istogrammi mostrano la distribuzione di celle. Come è stato il caso per l'altro script sviluppato per Acapella, BS176 Afai cellule infettate sono caratterizzati da bassi rapporti, mentre M90T Afai cellule infette mostrano elevati indici utilizzando l'algoritmo di MetaMorph sulle cellule HeLa e THP-1 nei macrofagi (figure 3B e 4B) . Infine, un adattamento di questo metodo per lo studio di micobatteri è mostrato in Figura 5. Mycobacterium bovis BCG risiede nel phagosome per tutto il corso dell'esperimento, come riflesso dal forte segnale rilevato 535 nm per tutto il corso temporale dell'esperimento. Al contrario, il Mycobacterium tuberculosis suscita phagosomal rottura della membrana in THP-1 macrofagi dopo più di 3 giorni di infezione, come evidenziato da un segnale di 450 Nm a 7 giorni di infezione (Figura 5A e 5B). Utilizzando lo stesso algoritmo per lo studio di rottura vacuolare da Shigella , abbiamo scoperto che Mycobacterium tuberculosis cellule infette mostrano alti 450/535 nm rapporti di Mycobacterium bovis BCG dopo 7 giorni di infezione (figure 5C e 5D).
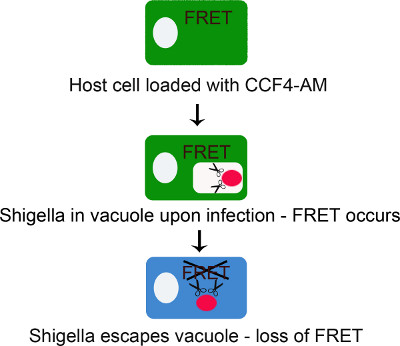
Figura 1. Schema rappresenta il principio del saggio CCF4-AM/β-lactamase per l'inseguimento Shigella flexneri vacuolare rottura. CCF4-AM diffonde liberamente attraverso la membrana plasmatica nel citoplasma dove gruppi esterei vengono scisse fuori dalle esterasi citosoliche producono CCF4 anioni. Questa reazione impedisce CCF4 di entrare qualsiasi membrana vano incorporato. In questa fase, CCF4 suscita FRET a 535 nm su di eccitazione a 405 nm. La sonda rimane intatto fino a quando i batteri che esprimono β-lattamasi rupturE il vacuolo endocitico. In questa fase, il segnale FRET è perso perché CCF4 è tagliata da β-lattamasi innescando un interruttore a emissione da 535 nm a 450 nm su di eccitazione a 405 nm.
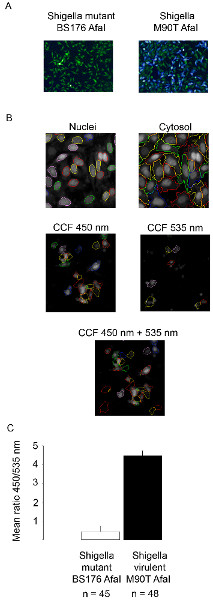
Figura 2. Monitoraggio Shigella flexneri vacuolare rottura usando la microscopia confocale. (A) Dopo 2 h 30 min di CCF4-AM carico, cellula HeLa sono infettati con il β-lattamasi che esprime Shigella flexneri BS176 Afai ceppo mutante o il Afai ceppo virulento M90T per 1 ora e fisso con paraformaldeide 4% per 10 min. Poi, i nuclei sono colorati con DRAQ5 e le cellule sono state riprodotte utilizzando un microscopio confocale con un obiettivo 10x. Immagini rappresentative sono stati scelti con i seguenti canali uniti: la sonda intatta CCF4 appare a 535 nm (green), la sonda spaccati CCF4 compare a 450 nm (blu). (B) Esempi di immagini evidenziando il sistema di rilevamento del nostro algoritmo automatizzato sul software Acapella. Segmentazione delle cellule (nuclei + citosol) è ottenuto utilizzando il canale DRAQ5. CCF4 cellule positive sono ottenuti utilizzando i canali 450 e 535 nm in pool insieme. (C) Istogramma che mostra il risultato della nostra analisi automatizzata su Acapella utilizzando Shigella flexneri BS176 Afai ceppo mutante o M90T Afai ceppo virulento. Il rapporto medio rappresenta il rapporto tra l'intensità nei canali 450 e 535 nm. clicca qui per ingrandire la figura .
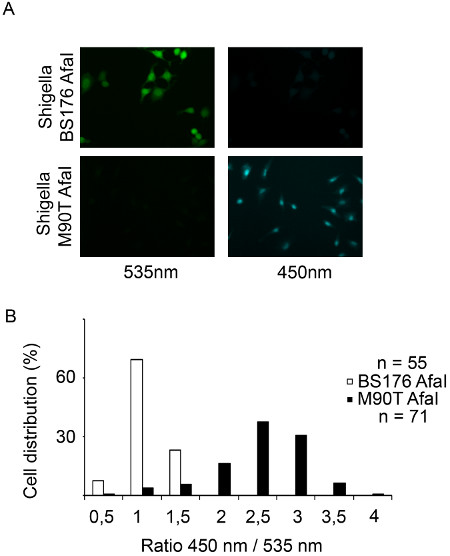
Figura 3. Monitoraggio Shigella flexneri vacuolar rottura in cellule HeLa mediante microscopia in epifluorescenza. (A) Dopo 2 h 30 min di CCF4-AM carico, le cellule HeLa sono infettati con il β-lattamasi che esprime Shigella flexneri BS176 Afai ceppo mutante o il Afai ceppo virulento M90T per 1 ora e fissato con paraformaldeide al 4% per 10 min. Poi, le cellule vengono esposte utilizzando un microscopio a epifluorescenza con un obiettivo 20x. Immagini rappresentative sono stati scelti con i seguenti canali:. CCF4 intatto sonda 535 nm (verde) e CCF4 spaccati sonda 450 nm (blu) (B) Istogramma che rappresenta il risultato della nostra analisi automatizzata del software MetaMorph. Le singole celle sono distribuiti in funzione del loro rapporto tra le intensità dei canali 450 e 535 nm.
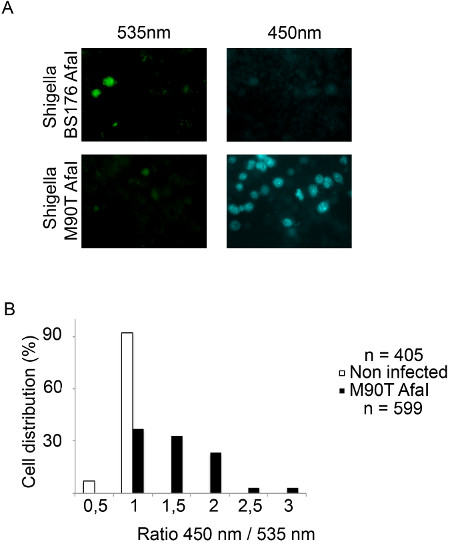
> Figura 4. Monitoraggio Shigella flexneri vacuolar rottura in cellule THP-1 usando la microscopia a epifluorescenza. (A) Dopo 2 h 30 min di CCF4-AM carico, cellule THP-1 sono infettati con il β-lattamasi che esprime Shigella flexneri BS176 Afai ceppo mutante o il M90T Afai ceppo virulento per 1 ora e 30 minuti e fissati con paraformaldeide 4% per 10 min. Poi, le cellule vengono esposte utilizzando un microscopio a epifluorescenza con un obiettivo 20x. Immagini rappresentative sono stati scelti con i seguenti canali:. CCF4 intatto sonda 535 nm (verde) e CCF4 spaccati sonda 450 nm (blu) (B) Istogramma che rappresenta il risultato della nostra analisi automatizzata utilizzando il software MetaMorph. Le singole celle sono distribuiti in funzione del loro rapporto tra le intensità dei canali 450 e 535 nm.
ghres.jpg "src =" / files/ftp_upload/50116/50116fig5.jpg "/>
Figura 5. Monitoraggio Mycobacterium bovis BCG e Mycobacterium tuberculosis rottura phagosomal in THP-1 macrofagi mediante microscopia in epifluorescenza. (A, B) cellule THP-1 sono infettati con β-lattamasi che esprime Mycobacterium bovis BCG o Mycobacterium tuberculosis per 2 ore e coltivate per 3 a 7 giorni . Dopo il lavaggio, le cellule sono caricati con CCF-4-AM per 2 ore e fissati con paraformaldeide al 4% per 30 minuti prima di imaging utilizzando un microscopio a epifluorescenza con un obiettivo 40x. Immagini rappresentative sono stati scelti con i seguenti canali: intatto sonda CCF4, 535 nm (verde); spaccati CCF4, sonda 450 nm (blu) (C, D) Gli istogrammi che presentano i risultati della nostra analisi automatizzata utilizzando il software MetaMorph.. Le singole celle sono distribuiti come funzione del rapporto tra l'intensità nei canali 450 e 535 nm.
Discussione
Il saggio CCF4-AM/β-lactamase è un metodo semplice per rintracciare perturbazione vacuolare intracellulare indotto da Shigella flexneri e micobatteri in diversi tipi cellulari. Si fa uso di una lattamasi sensibili citoplasmatica FRET reporter che viene scisso da un enzima attivo sulla superficie dei batteri.
Perdita del substrato CCF4-AM può essere facilmente evitato aggiungendo probenecid a tutte le soluzioni dopo il caricamento del substrato. Come dimostrato, il dosaggio può essere adattato a diversi tipi di cellule (cellule epiteliali, cellule fagocitarie) e formati (ben 96, 35 millimetri di vetro piatti peggiori, 6/12/24 piastre a pozzetti). Per l'uso della piastra ben 6/12/24, coprioggetto sterili sono distribuiti sul fondo di ciascun pozzetto prima della semina delle cellule. Alla fine dell'esperimento, coprioggetto vengono trasferiti su vetrini in mezzo di montaggio, come Prolong Oro Antifade Reagent (Invitrogen). Questo modo il segnale è stabile per periodi di tempo più lunghi dopo il dosaggiorispetto al formato a 96 pozzetti in cui i campioni sono conservati in PBS dopo la fissazione. L'elevato costo del substrato CCF4-AM dovrebbe essere preso in considerazione prima di determinare il volume del campione. Questo è il motivo per cui si consiglia di scalare verso il basso. Gli esperimenti sono più costosi in formato ben 6/12/24 ma i segnali sono stabili per giorni. Al contrario, gli esperimenti sono più economici nel formato ben 96, ma i campioni devono essere analizzati il giorno dell'esperimento. È interessante notare che gli esperimenti dal vivo possono essere eseguite anche a 96 o formato ben 384. Questo permette di eseguire esperimento vivo utilizzando dozzine di condizioni contemporaneamente (batteri mutanti, MOI, trasfezione plasmide o siRNA, sostanze chimiche ecc) con numeri di posizioni per pozzetto. Anche adatto per Shigella flexneri, si evidenzia che "vero" tempo reale o esperimenti di time-lapse non sono fattibili per gli studi di micobatteri in quanto il ciclo di infezione supera concentrazioni misurabili di CCF4 che possono essere conservati nel citosol. PerPertanto, il substrato CCF4-AM è applicato su cellule solo dopo invasione è raggiunto.
Nel caso in cui viene utilizzato il software MetaMorph per l'acquisizione e l'analisi, si consiglia di utilizzare il modulo "acquisizione schermo" che permette l'acquisizione di un intero 96/384 pozzetti con un determinato numero di immagini per bene. Inoltre, i dati di schermata del modulo "recensione" permette (i) visualizzando l'immagine cucita mosaico di ogni pozzetto per qualsiasi canale contemporaneamente su un grande "poster" e (ii) il ciclo di un algoritmo specializzato per misurare le intensità nel 535 e i 450 canali nm. Anche se, siamo stati in grado di misurare la rottura vacuolare da batteri singoli usando la microscopia time-lapse, vorremmo mettere in guardia che l'attività enzimatica sulla superficie dei singoli batteri varia rendendolo difficile da correlare con precisione il numero di batteri intracellulari e l'efficacia delle vacuolare rottura.
Data la robustezza del test, esso è adatto per hil throughput igh avvicina a 96 o 384 formati pure. Inoltre abbiamo adattato con successo questo protocollo per l'analisi FACS per studiare l'infezione di cellule in sospensione 16. Il saggio può essere utilizzato anche per la ricerca di altri batteri o di vettori lattamasi che presentano sulla loro superficie, portando ad una vasta gamma di applicazioni. Ad esempio, questo approccio può essere utilizzato per studiare rottura vacuolare indotta da altri agenti patogeni come β-lattamasi esprimendo Legionella pneumophila, Listeria monocytogenes o Salmonella typhimurium 12. Dal momento che la Listeria monocytogenes è un breve ciclo di infezione paragonabili a Shigella flexneri, esperimenti di time-lapse sono possibili. Al contrario, perché Legionella pneumophila e Salmonella typhimurium cicli di infezione lunghi di visualizzazione, si consiglia di effettuare esperimenti di punto finale.
La varietà di applicazioni possibili consente un dosaggio CCF4-AM/β-lactamaseinteressante metodo fluorimetrico per il monitoraggio rottura vacuolare indotta da patogeni intracellulari in campioni fissi o in tempo reale.
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Questo lavoro è stato finanziato dalla Agence Nationale pour la Recherche e dal Consiglio europeo della ricerca.
Materiali
| Name | Company | Catalog Number | Comments |
| LiveBlazer FRET-B/G Loading Kit (CCF4-AM) | Invitrogen | K1089 | Protect from light, stock in - 80 ° aliquots |
| Draq5 | Biostatus | DR50050 | |
| Poly-L-lysine | Sigma | P9155 | |
| μCLEAR-PLATE, BLACK, 96 well | Greiner Bio-One | 655090 | |
| 35 mm glass bottom dishes | MatTek corp. | P35G-1.5-10-C | |
| Probenecid | Sigma | P8761 | |
| β-lactamase | Sigma | P0389 |
Riferimenti
- van der Goot, F. G., Gruenberg, J. Intra-endosomal membrane traffic. Trends Cell Biol. 16, 514-521 (2006).
- Raposo, G., Marks, M. S., Cutler, D. F. Lysosome-related organelles: driving post-Golgi compartments into specialisation. Curr. Opin. Cell Biol. 19, 394-401 (2007).
- van der Wel, N., et al. M. leprae translocate from the phagolysosome to the cytosol in myeloid cells. Cell. 129, 1287-1298 (2007).
- Sansonetti, P. J., Ryter, A., Clerc, P., Maurelli, A. T., Mounier, J. Multiplication of Shigella flexneri within HeLa cells: lysis of the phagocytic vacuole and plasmid-mediated contact hemolysis. Infect Immun. 51, 461-469 (1986).
- Bobard, A., Mellouk, N., Enninga, J. Spotting the right location- imaging approaches to resolve the intracellular localization of invasive pathogens. Biochim. Biophys. Acta. 1810, 297-307 (2011).
- Beauregard, K. E., Lee, K. D., Collier, R. J., Swanson, J. A. pH-dependent perforation of macrophage phagosomes by listeriolysin O from Listeria monocytogenes. J. Exp. Med. 186, 1159-1163 (1997).
- Shaughnessy, L. M., Hoppe, A. D., Christensen, K. A., Swanson, J. A. Membrane perforations inhibit lysosome fusion by altering pH and calcium in Listeria monocytogenes vacuoles. Cell Microbiol. 8, 781-792 (2006).
- Zlokarnik, G., et al. Quantitation of transcription and clonal selection of single living cells with beta-lactamase as reporter. Science. 279, 84-88 (1998).
- Charpentier, X., Oswald, E. Identification of the secretion and translocation domain of the enteropathogenic and enterohemorrhagic Escherichia coli effector Cif, using TEM-1 beta-lactamase as a new fluorescence-based reporter. J. Bacteriol. 186, 5486-5495 (2004).
- Mills, E., Baruch, K., Charpentier, X., Kobi, S., Rosenshine, I. Real-time analysis of effector translocation by the type III secretion system of enteropathogenic Escherichia coli. Cell Host Microbe. 3, 104-113 (2008).
- Bish, S. E., Song, W., Stein, D. C. Quantification of bacterial internalization by host cells using a beta-lactamase reporter strain: Neisseria gonorrhoeae invasion into cervical epithelial cells requires bacterial viability. Microbes Infect. 10, 1182-1191 (2008).
- Ray, K., et al. Tracking the dynamic interplay between bacterial and host factors during pathogen-induced vacuole rupture in real time. Cell Microbiol. 12, 545-556 (2010).
- Blocker, A., et al. The tripartite type III secreton of Shigella flexneri inserts IpaB and IpaC into host membranes. J. Cell Biol. 147, 683-693 (1999).
- Mounier, J., et al. The IpaC carboxyterminal effector domain mediates Src-dependent actin polymerization during Shigella invasion of epithelial cells. PLoS Pathog. 5, e1000271(2009).
- Nowicki, B., Hart, A., Coyne, K. E., Lublin, D. M., Nowicki, S. Short consensus repeat-3 domain of recombinant decay-accelerating factor is recognized by Escherichia coli recombinant Dr adhesin in a model of a cell-cell interaction. The Journal of Experimental Medicine. 178, 2115-2121 (1993).
- Nothelfer, K., Dias Rodrigues, C., Bobard, A., Phalipon, A., Enninga, J. Monitoring Shigella flexneri vacuolar escape by flow cytometry. Virulence. 2, 54-57 (2011).
- Simeone, R., et al. Phagosomal rupture by Mycobacterium tuberculosis results in toxicity and host cell death. PLoS Pathog. 8, e1002507(2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon