Method Article
の生産
要約
我々は、未受精卵の集合を記述するアフリカツメガエルトロピカ卵と減数分裂II-逮捕卵抽出物生産。この卵抽出物は微小管と微小管結合RNAを精製するために使用することができる。
要約
多くの生物は、空間的及び時間的に制御する遺伝子の発現に特異的な細胞内の目的地へのmRNAをローカライズする。最近の研究では、トランスクリプトームの大部分が細胞及び胚における非ランダム位置に局在することが示されている。ローカライズされたmRNAを同定するための一つのアプローチは、生化学的に関心のある細胞構造を精製して、関係するすべての転写産物を同定することである。最近開発されたハイスループットシーケンシング技術を使用して、それは今では細胞内の構造に関連付けられているすべてのRNAを特定することは簡単です。トランスクリプトの識別を容易にするために、それは完全に配列ゲノムを持つ生物で動作することが必要である。細胞内構造の生 化学的精製の ための一つの魅力的なシステムでは、カエルアフリカツメガエルから生産卵抽出ですが、X.ツメガエルは 、現在転写識別を妨げる完全に配列ゲノムを持っていない。この記事では、方法を説明関連カエル、X.から卵抽出物を生成する完全に配列ゲノムを持っているトロピカ、。私たちは、微小管重合、精製および転写分離のための詳細を提供します。この記事は、微小管関連転写産物の同定のための具体的な方法を説明しているが、我々はそれが簡単に他の細胞内構造に適用され、ローカライズされたRNAの同定のための強力な方法を提供すると信じています。
概要
遺伝子発現の空間的および時間的制御のすべてのセルのために重要であり、1パターニング初期胚の制御のために特に重要です。遺伝子発現の空間的な制御は、細胞や胚内の特定の宛先へのmRNAの積極的なローカライズによって達成される。多くの非常に大細胞型において、( 例えば、卵母細胞、胚、およびニューロン)のmRNA局在化が符号化されたタンパク質の作用部位へのタンパク質の発現を制限するために使用される。ローカライズされたmRNAがタンパク質生産の多くのラウンドを触媒することができるので、それは個々のタンパク質分子をローカライズするより、mRNAをローカライズするほうが効率的です。彼らはさらにコード化タンパク質2の局在を制限するために役立つ彼らの目的地に到達するまで、ローカライズされたmRNAは通常、翻訳抑制される。胚のパターン形成を制御するRNAの局在化の多くはよく文書の場合に加えて、いくつかの研究では、ローカライズされたmRNAを文書化していますコードされたタンパク質の作用部位である。著名な例では、減数分裂と紡錘体5-7に多くの分裂レギュレータの運動性線維芽細胞およびmRNAの局在のリーディングエッジまでのβ-アクチン3及びArp2 / 3複合4 mRNAの局在を含む。
ローカライズされたmRNAの古典的な例の多くは、母性効果変異の遺伝的スクリーニングによって同定されたと後でローカライズされたRNAをエンコードするために決定した。しかし、最近のゲノムワイドな研究では、ローカライズされたRNAのスコープに広範な洞察を提供し始めている。 ショウジョウバエ胚におけるin situハイブリダイゼーション画面で最近は、すべてのmRNAの〜70%は多くの小説の宛先8を含む特定の局在を、持っていることを実証した。マウス線維芽細胞から偽足の精製は、ローカライズされたmRNAの9の多様なグループを同定した。減数Xenoのから微小管の生化学的精製を使用して、私たちのグループからの仕事膿卵スピンドル5,7とcopurify mRNAの識別数百を抽出します。私たちの仕事は、mRNAのがコード化された蛋白質の作用部位に局在しているという考えを支持し、微小管に局在するmRNAの大半は有糸分裂の制御にその機能タンパク質をコードすることが示された。また、生化学的精製によって細胞内画分中のmRNA濃縮を検出する能力は、ローカライズされたmRNAを同定するためのこのアプローチの力を強調する。
ほとんどのローカライズされたRNAは、彼らの最終目的地10への輸送を達成するために、細胞骨格のアクチンや微小管のどちらかを能動輸送を使用しています。それは細胞骨格のプロセスを繰り返すことができ、インビトロ系を有することが必要である生化学的ア プローチを使用して、特定の宛先にローカライズされたRNAの程度や種類のより良い理解を得るために。細胞骨格の生物学を研究するための最初のシステムの一つは、卵抽出物を生産しているカエルのアフリカツメガエル。X.から未受精卵からツメガエル卵抽出物は、細胞骨格のプロセスの広い配列を研究するために何十年も使用されており、細胞骨格の組み立てとダイナミクス11を制御するメカニズムと分子の我々の理解に大きく貢献してきました。さらに、X.ツメガエル卵抽出物は微小管関連タンパク質12,13の大規模精製に適していると卵抽出物14-16の様々な種類の製造にうまく設計された方法がある。しかし、ゲノム研究のためにXの使用にはいくつかの欠点があるモデル系としてツメガエル 。
何十年ものアフリカツメガエルカエルは発達と細胞生物学の研究のための強力なシステム、大規模な卵母細胞の大きさと堅牢な外部の開発17のおかげであった。さらに、多くの細胞processeてを繰り返すことができる卵抽出システムの開発試験管でsがこのカエルを強力実験モデルを作りました。しかし、 アフリカツメガエルは genome.Inコントラストの異質4倍体の性質によって遅くされた完全なゲノム配列、密接に関連した種は、 アフリカツメガエルトロピカの不足によって妨げられている、2010年18に配列決定した二倍体ゲノムを持っています。しばらくX.トロピカはXのように実験的に扱いやすいではないツメガエル17はシーケンスゲノムの可用性はゲノムワイド解析を実行するために魅力的なモデルシステムになります。
本稿では、Xから減数分裂II-、細胞増殖抑制因子逮捕抽出(CSF)を作成する方法を説明しますトロピカ 19。我々は、この抽出物から微小管と関連するRNAを精製する簡単な方法を説明します。 RNAは、その後、最近開発されたハイスループットシーケンシング技術を用いて配列決定に適しライブラリーに変換することができる。ライブラリは一度それらは全抽出物と比較して微小試料中に濃縮されている特定のmRNAを同定するために蛙のゲノムに整列させることができる配列決定する。これは、ゲノムワイドなスケールで微小管を標的とするmRNAの局在を検出するための強力な方法を提供します。ローカライズされたmRNAを検出することができることに加えて、高スループット配列決定し、配列ゲノムの使用は、公開データベース注釈で現在は存在しない新規な転写物を発見する可能性を提供する。
プロトコル
1。 ツメガエル卵の生成
すべてのアフリカツメガエルトロピカカエルはNASCOから注文されています。当社のカエルは、循環水システムは27に保た水生生息地に収容されています℃のXのケアのための水システムのための多くのオプションがありますトロピカ。このカエルの種のいくつかの良い一般的な情報は、ハーランドとグレンジャーラボのWebサイト(で見つけることができますhttp://tropicalis.berkeley.edu/home/ 、 http://www.faculty.virginia.edu/xtropicalis / )。当社のカエルは、以下からなるtankwater(0.4グラムのCiclid湖塩、0.6グラムの海洋塩、水1リットル当たり0.625グラムのNaHCO 3、pH7.0)で20に保持されます。 X用高塩分です〜1800μSの導電率、このレシピ結果トロピカはいますが 、私たちはカエルはTHIで繁栄することを発見したの環境および卵母細胞の品質が向上する。代替tankwaterレシピは一般的なXの記載されたリソースで、上記記載されていますトロピカケア 。
- カエルが産卵を刺激するために3つの連続した日にヒト絨毛性性腺刺激ホルモン(hCG)を注射されています:まず、hCGのソリューションの2つの濃度を準備します。 1,000 U / mlの最終濃度を10 mlの滅菌、脱イオンH 2 O中のhCGの凍結乾燥粉末を懸濁し10,000 U。その後、100 U / mlの最終濃度9ミリリットルH 2 Oで1,000 U / mlのhCGの溶液1mlを希釈。 4℃で両方のソリューションを保存する
- 1日目に、2:00-3:00 PMの間でhCGを注射することによって産卵のために4-6カエルを準備します。 0.2ミリリットル100 U / mlのhCGの溶液を排出腔の近くに背のリンパ嚢の各カエルを注入。その後の2回の注射の間に速いカエルを持つことは、産卵時にカエルの廃棄物の量を最小限に抑えますが、オプションであるでしょう。
- 2日目に、同じカエルを注入2:00-3:00 PMの間に0.2ミリリットル100 U / mlのhCGの溶液を用いて。
- 3日目、午前7:00-10:00の間で、0.2ミリリットル1,000 U / mlのhCGの溶液と同じカエルを注入。卵を産むためにカエルを設定します。新鮮tankwater付き6クォートのプラスチックバケツを埋める、25℃、暗所でカエルと場所を追加℃にこの注入後、産卵は4時間後に開始され、7時間で完了します。カエルは25の最小値に維持される℃環境で卵を産むべき
- 解決策を抽出して、卵を収集する前にすぐに機材を用意してください。
20X MMR:100ミリメートルHEPES、pHは7.8、2 mMのEDTA pHは7.8、2 MのNaCl、40mMのKClを、20のMgCl 2、40 mMのCaCl 2を。室温でオートクレーブや店舗。準備を抽出する直前1X MMRの1 Lを用意してください。
10X XB:100のHEPES、pH7.7、10mMのMgCl 2、1mMのCaCl 2を、1 MのKCl、500mMのスクロース。 4℃でオートクレーブや店舗1X XB jの1 Lを用意します製剤を抽出するために、従来UST。 Dejellyソリューション:10 N NaOHで7.8から8.0に脱イオンH 2 OとpHの250ミリリットル3%システイン溶液を準備します。準備を抽出する直前に準備します。
CSF-XB:1X XB 200mlのを取ると、2ミリリットル、0.5M EGTA pHは7.7と200μlの1 MのMgCl 2を追加します。準備を抽出する直前に準備します。
CSF-XB +:CSF-XB 50mlのを取るとLPC50μlのを(10 mg / mlの各ロイペプチン、ペプスタチンの株式、およびDMSOにおけるキモスタチン)を追加します。 50μlのサイトカラシンD(DMSO中10 mg / mlの)を追加します。準備を抽出する直前に準備します。
殺菌を溶解し、フィルタリングする脱イオンH 2 O、電子レンジで0.2%ゼラチン溶液を準備します。室温で保管してください。
リザーブ2ベックマン×2½インチ超遠心チューブ。
緩和する各H 2 O 0.5mlの2つの15ミリリットルの丸底ガラス遠心管を準備チューブを超遠心機にかける。
ファイアーポリッシュガラスパスツールピペットを作る。広い開口部を露出させるために5¾インチガラスピペットの先端を折り、新しい暴露ピペットチップを滑らかにするために炎にさらす。
- コートビーカーの壁を周りに0.2%ゼラチン溶液を渦巻くことで卵を保存するため、500mlのガラスビーカーを準備します。使用後のビーカーからゼラチン溶液を捨てる。
- 3日目の3回目の注射の後に6-7時間を敷設するために使用されるプラスチックのバケツから卵を収集します。必要であれば、静かに残りの卵を得るために一度、各カエルを絞る。新鮮tankwater、0.2%ゼラチン溶液でコーティングした500mlのガラス製ビーカーに転送に一度卵を洗ってください。
2。 X.からの抽出物の調製トロピカの卵
抽出物製剤のすべてのステップを約25℃で、室温で行うことができる洗浄を通じて、卵を維持することが重要である彼らは濡れたままになるようにsが液体の下に沈ん。空気に暴露すると、卵は細胞周期停止を逃れるか、溶解する恐れがあります。
- 卵が濡れ維持するのに十分液体確保しながら、できるだけ多くtankwaterとしてデカント。側に卵を入れたビーカーを傾けて、ビーカーの壁にゆっくり〜300ミリリットル1X MMRを追加、卵のように物理的な攪拌は最小化される。上清を含む破片オフデカントその後、卵が落ち着くしましょう。X.トロピカの卵は、この段階で糸なので、活性化卵の除去はdejellying後に行われます。 3 1X MMRの洗浄の合計に対して、この手順を繰り返します。
- Dejelly卵。 dejellyソリューションの可能性とアドオンが半分くらいMMRとしてオフデカント。約5分間連続渦巻。ゼリーのコートを溶解すると、数分後に上清中に表示されます。オフデカントし、残りdejellyソリューションを追加します。卵は非常にしっかりと梱包し、それらの植物極を持つすべての向き(極まで連続渦に進み皿の底に向かってと白色顔料)。迅速に、できるだけ多くdejellyソリューションとしてオフデカント。卵がdejelliedされると彼らは機械的な操作に非常に敏感です。
- 慎重に卵にXBを追加します。最初XBウォッシュで、溶解、ふくらんで、白、そしてpseudocleavage卵を除去することにより、CSFの逮捕を免れた卵を除去する。活性化X.トロピカの卵が上部中央に定住する傾向があるので、これらを引き出しにプラスチックピペットを使用しています。また、皮膚やカエル廃棄物の部分を削除します。優しく洗浄の間に卵を渦巻く、それらがビーカーの底に沈降させ、〜300ミリリットル1X XB液で卵を合計3回洗浄する。卵はウェット維持しながら、可能な限り各洗浄溶液のような以前のように、デカント。
- CSF-XBとデカントで二回卵を洗ってください。
- CSF-XBを追加+卵。電子メールを公開しないように注意しながら、CSF-XB +と超遠心管への転送卵、ゼラチン処理ファイアーポリッシュパスツールピペットを用いて空気にGGS。水クッションで15ミリリットルのガラス製遠心管の内側に配置。
- 1分間200 xgで臨床遠心機で卵を回し、30秒間800 XGとスピンにスピードを上げる。
- 卵からできるだけ多くのバッファを削除するには、吸引器を使用してください。彼らは、上に、ほぼ乾燥する必要があります。迅速HB-6ローター(または同等品)を搭載したソーバルRC-6遠心分離機に卵を移動し、20℃で15分間17,000 xgでスピン℃に
- 1ミリリットルの注射器に接続されている18ゲージの針を使って色素と脂質層の間に黄色の細胞質の層を除去する。穿刺チューブの側面および細胞質抽出層を得るために、ゆっくりと注射筒を引く。色素顆粒できるだけ避けてください。
- 新しい遠心チューブに細胞を移す。抽出物はこの段階で少し曇った表示されるのは正常です。水クッションで15ミリリットルのガラス製遠心管の内側に配置。 20℃で10分間再び17,000×gでのスピン内線を繰り返し18ゲージ針でraction。
- 1.5 mlのマイクロチューブに細胞を移す。抽出量を推定し、抽出液にサイトカラシンDおよびLPC 1:1,000に希釈。気泡を導入することなく、何度も上下にピペッティングし、1ミリリットルピペットチップとよく混ぜる。健全なカエルのコロニーからの典型的な収率は、抽出/カエルの約300-500μLです。最大活性を維持するためには、抽出物を保存し、室温(20-25℃)で実験操作を行う必要がある。
3。 Xから精製タキソール安定化微小管トロピカエキス
- 10μMの最終濃度で抽出物100-200μlのアリコートにタキソール追加し、30分間室温でインキュベートする。コントロール反応の場合は、微小管destablilzing薬ノコダゾール(10μM)で抽出と同等のボリュームを扱う。分析のために未処理の抽出の準備を100μl。
- 薬剤処理を希釈10ボリュームBRB-80(80 mMのパイプpHは6.8、1のMgCl 2、1mMのEGTA)+ 30%のグリセリンで抽出。 BRB-80 + 60%グリセロールクッション10mlのを含む14ミリリットル丸底ポリプロピレンチューブを組み立てます。ワイドボアピペットチップ、BRB-80 + 60%グリセロールクッションの上にそっと層薬剤処理抽出反応を用いた。 20℃で17,000×gで10分間遠心°HB-6ローター(または同等)、チューブ·アダプターを装備ソーバルRC-6遠心機でC。
- 上清を含むunsedimented抽出物質を吸引し、脱イオンH 2 Oで二回洗浄するインタフェースを微小管、微小管関連タンパク質、およびタキソール処理サンプルにおける微小管関連RNAを含むゲル状の沈殿を乱さないように注意しながら、徐々に残りのクッションのボリュームを吸引。ノコダゾール処理サンプルは、目に見える物質が含まれていません。 1ミリリットルトリゾールでペレットを再懸濁し、RNAを単離するためのメーカーの指示に進みます。 Untreated抽出物(最大100μl)を、1mlのトリゾールで直接再懸することができます。
- RNA-seqのに適したトランスクリプトームライブラリを準備するための市販のキットが存在することになります。これらを通じて購入することがhttp://www.illumina.com/とhttp://www.454.com/ 。
結果
X.を識別するには微小管に関連付けられているトロピカ転写物は、私たちは、減数分裂IIの中期(CSF)で逮捕された未受精卵から細胞質抽出液を調製。タキソールのこの抽出物の治療は、グリセロールクッション( 図1A)を介して沈殿により精製することができる安定した微小管を形成することができる。クマシーゲル分析は、タキソール依存的にそのα/β-チューブリン堆積を確認し、これらの調製( 図1B)に回収さ主要なタンパク質種を表す。他のタンパク質の低いレベルは、微小管(のMAP)でそのタキソール画分中のタンパク質は特に準を示す、タキソールペレットではなく、薬ノコダゾール解重合微小管で処理された製剤中にも存在する。
アジレント·バイオアナライザは、全てXに一般的なRNA組成物を検査するために使用されるトロピカ抽出画分( 図1C )。のrRNAとtRNA種の両方が翻訳がXの微小管とスピンドルに発生することを以前の結果と一致し、CSFエキスと微小管含有タキソールペレットに存在しているツメガエル卵抽出5,21。ゲル投影のライントレースはmRNAの信号が著しく低くなって明らかに微小含有を示す、28S rRNAの上の領域への移行の中で最も顕著なタキソールペレットを、そのXの微小管とのmRNAのcosedimentのサブセットトロピカ 。このように単離されたRNAは、市販の試薬を用いてRNA-seqの実験に適している。
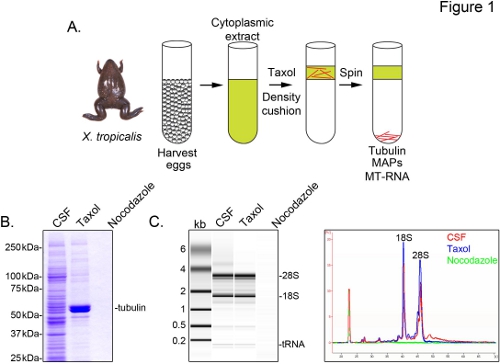
図1。 RNA-seqのためのMT-RNAの精製。MT-RNAを単離する(A)精製スキーム。卵は雌のXから収穫されるTROpicalisカエル。細胞質抽出物の調製後、タキソールは、微小管重合を誘導するために添加される。微小管およびMT-RNAは、グリセロールクッションを介して沈殿により精製する。(A)に記載の手法を用いて単離されたタンパク質の(B)クマシーゲル分析。総CSFは、タキソールまたはノコダゾールの存在下で沈殿タンパク質と比較して抽出する。RNAの(C)バイオアナライザゲル分析()に記載の手法を用いて単離。 CSFから単離されたRNAは、タキソールまたはノコダゾールの存在下で沈降RNAに比べて抽出します。ゲル突起とライントレースの両方が示されている。 ら 、シャープからの許可を得て転載。、(2011)。 大きな画像を表示するには、ここをクリックしてください 。
ディスカッション
本稿では、XからCSF-逮捕卵抽出物を生成する簡単な方法を説明してきましたトロピカ 19と微小管結合RNAは7を勉強するために、この抽出液を使用しています。 X.からCSF-逮捕卵抽出物を製造するための基本手順トロピカはXに使用したのと同じですいくつかの重要な違いがツメガエル 。 X.での作業に最も困難な側面の一つトロピカカエルはXに匹敵する微小管の核またはスピンドルアセンブリ活性を有する抽出液を作るのに十分な高品質の卵を得ることであるツメガエル卵抽出。減数分裂IIの細胞周期停止、X.ためのホルモン注射間の間隔から滑りを防止しながら最適な産卵条件を達成するためにトロピカはXのそれが以前より短くなっているツメガエル 、そして産卵の先頭に第三のhCGの注射からタイミングもはるかに短いです。 XとhCGの注射からTへのタイミングをツメガエル彼は産卵の始まりは、それがバッファの中に一晩置いた卵するための便利で効率的であるようなものである。しかし、Xに敷設hCGの注射と卵の間に短い時間のそれは頻繁に手動でカエルから卵を表現することが必要であるトロピカ 。二つの異なるカエルの卵のエキスを作る間にもう一つの重要な違いはdejellyingステップです。 Xとツメガエルの卵は、それがゼリーコートが卵をビーカーに離間されている方法と密接観察することによって溶解したときに決定することは容易であるように大きいです。 dejellying反応が始まるように、卵がより密にパックし始める。しかし、X.トロピカの卵は、はるかに小さく、ゼリーのコートだけでは卵充填密度により解散したときにそれを判断するのは非常に困難になる可能性があります。私たちは、ゼリーのコートが溶解したときに決定するための最も信頼性の高い方法は、動物(黒)と植物(白)極の向きを監視することであること。発見したときに、すべての植物の極ORIビーカーの底に向かってENTゼリーコートは十分な抽出を続行するために除去されています。最後に、一方X.ツメガエル卵抽出物を冷却温度で保存することができる(4-12°C)我々はそれがX.を維持するために重要であることを観察したトロピカの卵は、生化学的活性を維持するために準備し、実験操作中に室温(20〜25℃)で抽出します。そのため、使いやすさの違いにより、我々はXを使用することを好む卵のエキスの生産のためのツメガエルカエル。しかし、必要とする、またはシーケンスのゲノム、Xと生物によって促進される実験用トロピカは、優れた代替システムです。
我々は、この報告書に記載していることの方法は、微小管重合を誘導する微小管安定化剤としてタキソールを使用しています。タキソールは、精製された微小管の大規模な分離を容易に堅牢な微小管安定化剤であるため、我々はこの方法を選んだ。メソッド番目我々が説明で代替可能性微小管重合法を用いて微小管に関連するタンパク質およびRNAを比較することによって改善することができる。選択肢はGTP誘起重合(古典技法)、22またはクロマチンドリブンスピンドルアセンブリ23によって誘導される微小管を模倣するために、微小管重合としてRAN-GTPを使用してを使用して重合を含めることができます。最後に、微小管重合が近い有糸分裂(中心体、クロマチン、および動原体媒介)の間に核される微小管のタイプの模倣だろう誘導する精子核の精製使用。微小管の核生成のこれらの代替エネルギー源への欠点は核剤は、タキソールと同じくらい容易に入手できないことであり、彼らは核しないまたは効率タキソールなどの微小管を安定させる。したがって、これらの方法の各々は、大規模精製のために使用することがより困難になる。微小管の核複数の異なるタイプを比較することの利点それは微小管の核形成の各経路に特異的であるタンパク質および/またはRNAを同定することが可能かもしれないことである。
我々はここで説明していることの方法は、両生類の細胞質抽出物を利用しています。しかしながら、このアプローチは、他の生物からの抽出システムの使用に拡張することができる。有糸分裂抽出物を忠実に微小管アセンブリの多くの局面を要約することを同期化されたヒト組織培養細胞から24に記載されている。我々は正常5 HeLa細胞からの微小管関連RNAを識別するためにこれらの抽出物を使用している。微小管関連したRNAは検討されていないが、同様の微小管精製スキームは、多くの異なる生物25,26について記載されている。ここで説明するアプローチは、微小管の核形成が可能な濃縮された細胞質抽出物を生産する任意の生物を使用することができる。
最後に、我々はデそのアプローチもののここでは、スクライブ微小管関連タンパク質およびRNAの精製について説明し、このアプローチは、他の細胞内構造に一般化することができる。ほとんどのローカライズのmRNAが生化学的方法を用いて同定されていないが、DNAとRNAシーケンシング技術の最近の進歩は、このアプローチをローカライズされたRNAを識別するための魅力的な方法を作る。このアプローチでは、興味のある任意の細胞内またはサブ胚構造は、単離または精製することができた。その後、関連するタンパク質やRNAをゲノム規模で識別することができます。 RNAは、次に、濃縮されたローカライズされたRNAを識別するために、全細胞又は胚のRNA含有量と比較することができる。このアプローチは、全卵( アフリカツメガエル 27の最初のローカライズされたRNAを同定したアプローチに似て動物や植物の分離)、アクチン関連RNAは、ER-関連したRNAは、ミトコンドリア関連性RNA、またはすることができます任意の細胞内構造を使用することができる無傷関連したRNAを用いて精製する。に基づく微小管関連RNA上の私たちの仕事は、我々は、これは与えられた場所で、その関数の新しいタンパク質を発見するための優れた方法であろうと予測している。さらに、すべてのローカライズされたRNAの位置と範囲の同定は、細胞および胚は、遺伝子発現を制御するためのmRNAの局在化をどのように使用するかについての洞察を提供する。
開示事項
利害の衝突は宣言されていない。
資料
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Xenopus tropicalis | NASCO | LM00823MX | |
| human Chorionic Gonadotropin | Sigma-Aldrich | CG10 | |
| HEPES | Sigma-Aldrich | H4034 | |
| EDTA | Sigma-Aldrich | E5134 | |
| NaCl | Sigma-Aldrich | S3014 | |
| KCl | Sigma-Aldrich | P9541 | |
| MgCl2 | Sigma-Aldrich | M8266 | |
| CaCl2 | Sigma-Aldrich | C8106 | |
| sucrose | Sigma-Aldrich | S0389 | |
| NaOH | Sigma-Aldrich | S5881 | |
| EGTA | Sigma-Aldrich | E3889 | |
| Leupeptin | Sigma-Aldrich | L9783 | |
| Pepstatin | Sigma-Aldrich | P5318 | |
| Chymostatin | Sigma-Aldrich | C7268 | |
| Cytochalasin D | Sigma-Aldrich | C8273 | |
| Gelatin, porcine skin | Sigma-Aldrich | G1890 | |
| PIPES | Sigma-Aldrich | P6757 | |
| Taxol | Sigma-Aldrich | T7191 | |
| Nocodazole | Sigma-Aldrich | M1404 | |
| Trizol | Invitrogen | 15596-026 | |
| L-Cysteine, free base | USB Corporation | 14030 | |
| Cichlid Lake Salt | Seachem | 47894 | |
| Marine salt | Seachem | SC7111 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| EQUIPMENT | |||
| 1 ml syringes | BD Biosciences | 309659 | |
| 18 gauge needles | BD Biosciences | 305195 | |
| 30 gauge needles | BD Biosciences | 305106 | |
| Rubbermaid Plastic bucket | Amazon | 6306 | |
| Beckman Polyallomer 2 x ½ inch Ultracentrifuge tubes | Beckman | 326819 | |
| 15 ml round-bottomed glass centrifuge tubes | Fisher Scientific | 45500-15 | |
| Rubber adapter sleeves for 15 ml tubes | Kimble-Chase | 45550-15 | |
| 5 ¾ inch glass Pasteur pipettes | Fisher Scientific | 13-678-20A | |
| 14 ml polypropylene round-bottom tube | BD Biosciences | 352059 | |
| Sorvall HB-6 rotor | Thermo Scientific | 11860 | |
| Sorvall RC-6 centrifuge | Thermo Scientific | 46910 | |
参考文献
- Martin, K. C., Ephrussi, A. mRNA localization: gene expression in the spatial dimension. Cell. 136, 719-730 (2009).
- Besse, F., Ephrussi, A. Translational control of localized mRNAs: restricting protein synthesis in space and time. Nat. Rev. Mol. Cell Biol. 9, 971-980 (2008).
- Lawrence, J. B., Singer, R. H. Intracellular localization of messenger RNAs for cytoskeletal proteins. Cell. 45, 407-415 (1986).
- Mingle, L. A., et al. Localization of all seven messenger RNAs for the actin-polymerization nucleator Arp2/3 complex in the protrusions of fibroblasts. J. Cell Sci. 118, 2425-2433 (2005).
- Blower, M. D., Feric, E., Weis, K., Heald, R. Genome-wide analysis demonstrates conserved localization of messenger RNAs to mitotic microtubules. J. Cell Biol. 179, 1365-1373 (2007).
- Eliscovich, C., Peset, I., Vernos, I., Mendez, R. Spindle-localized CPE-mediated translation controls meiotic chromosome segregation. Nat. Cell Biol. 10, 858-865 (2008).
- Sharp, J. A., Plant, J. J., Ohsumi, T. K., Borowsky, M., Blower, M. D. Functional analysis of the microtubule-interacting transcriptome. Mol. Biol Cell. 22, 4312-4323 (2011).
- Lecuyer, E., et al. Global analysis of mRNA localization reveals a prominent role in organizing cellular architecture and function. Cell. 131, 174-187 (2007).
- Mili, S., Moissoglu, K., Macara, I. G. Genome-wide screen reveals APC-associated RNAs enriched in cell protrusions. Nature. 453, 115-119 (2008).
- Holt, C. E., Bullock, S. L. Subcellular mRNA localization in animal cells and why it matters. Science. 326, 1212-1216 (2009).
- Desai, A., Murray, A., Mitchison, T. J., Walczak, C. E. The use of Xenopus egg extracts to study mitotic spindle assembly and function in vitro. Methods Cell Biol. 61, 385-412 (1999).
- Gache, V., Waridel, P., Luche, S., Shevchenko, A., Popov, A. V. Purification and mass spectrometry identification of microtubule-binding proteins from Xenopus egg extracts. Methods Mol. Med. 137, 29-43 (2007).
- Gache, V., et al. Xenopus meiotic microtubule-associated interactome. PLoS One. 5, e9248 (2010).
- Cross, M. K., Powers, M. Obtaining eggs from Xenopus laevis females. J. Vis. Exp. (18), e890 (2008).
- Cross, M. K., Powers, M. Preparation and fractionation of Xenopus laevis egg extracts. J. Vis. Exp. (18), e891 (2008).
- Cross, M., Powers, M. In vitro nuclear assembly using fractionated Xenopus egg extracts. J. Vis. Exp. (19), e908 (2008).
- Harland, R. M., Grainger, R. M. Xenopus research: metamorphosed by genetics and genomics. Trends Genet. 27, 507-515 (2011).
- Hellsten, U. The genome of the Western clawed frog Xenopus tropicalis. Science. 328, 633-636 (2010).
- Brown, K. S. Xenopus tropicalis egg extracts provide insight into scaling of the mitotic spindle. J. Cell Biol. 176, 765-770 (2007).
- Godfrey, E. W., Sanders, G. E. Effect of water hardness on oocyte quality and embryo development in the African clawed frog (Xenopus laevis). Comp. Med. 54, 170-175 (2004).
- Groisman, I., et al. CPEB, maskin, and cyclin B1 mRNA at the mitotic apparatus: implications for local translational control of cell division. Cell. 103, 435-447 (2000).
- Budde, P. P., Desai, A., Heald, R. Analysis of microtubule polymerization in vitro and during the cell cycle in Xenopus egg extracts. Methods. 38, 29-34 (2006).
- Kalab, P., Pu, R. T., Dasso, M. The ran GTPase regulates mitotic spindle assembly. Curr. Biol. 9, 481-484 (1999).
- Gaglio, T., Saredi, A., Compton, D. A. NuMA is required for the organization of microtubules into aster-like mitotic arrays. J. Cell Biol. 131, 693-708 (1995).
- Hughes, J. R., et al. A microtubule interactome: complexes with roles in cell cycle and mitosis. PLoS Biol. 6, e98 (2008).
- Suprenant, K. A., Tempero, L. B., Hammer, L. E. Association of ribosomes with in vitro assembled microtubules. Cell Motil. Cytoskeleton. 14, 401-415 (1002).
- Rebagliati, M. R., Weeks, D. L., Harvey, R. P., Melton, D. A. Identification and cloning of localized maternal RNAs from Xenopus eggs. Cell. 42, 769-777 (1985).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved