このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
自由に学習の三つの段階を越えハトを移動する単一ニューロン」の活動電位を記録する
要約
新しい刺激応答の関連付けを学ぶことは、最終的には個々のニューロンのスパイク出力を変えるに反映されている神経プロセスを幅広く行っています。ここでは、動物は、取得し消火し、単一の実験セッション内で条件反応を再取得しながら、単一ニューロン活動の継続的な登録を可能にする行動のプロトコルを記述します。
要約
学習の対象は、両方の行動や神経科学者から絶大な関心を集めている一方で、動物がoperantly条件反応を獲得している間、またはその応答が消滅した場合には、比較的少数の研究者らは、単一ニューロン活動を観察した。しかし、これらのケースでは、観察期間は、通常、単一の学習の段階、 すなわち、取得又は消滅を包含し、両方ではない(例外は、逆転学習を用いたプロトコルを含む;例えばBingman ら 1を参照)。しかし、取得および消光は異なる学習メカニズムを必要とするので、異なるタイプおよび/または神経可塑性の遺伝子座を伴うことが予想される。
したがって、我々は一つの行動のセッションで学び、そのうちの3段階が単一ニューロン '活動電位の同時録画に適している機関の行動パラダイムを開発しました。動物A再マッピング異なる新たな視覚刺激(買収)のプレゼンテーションに2の可能な選択肢の回答のそれぞれを必要とする単一区間強制選択課題で訓練。事前に定義された性能基準に到達した後、2選択肢のいずれかの応答は、もはや(絶滅)を補強していない。パフォーマンスレベルにおける一定の減少分に続いて、正しい応答が(再取得)を再び強化している。各セッションにおける刺激の新しいセットを用いて、動物を繰り返し取得 - 消光再取得処理を受けることができる。学習の3つのすべての段階が単一の行動のセッションで発生するため、パラダイムは、複数の単一ニューロンのスパイク出力の同時観測に最適です。我々は、モデル系としてハトを使用するが、タスクが容易に馴化弁別学習することができる任意の他の種に適合させることができる。
概要
新しい刺激応答 - 成果の関連付けを学ぶことは神経可塑性プロセスを幅広く行っています。これらのプロセスは、最終的には個々のニューロンの変化スパイク出力に反映される。おそらく、最も頻繁に使用される学習パラダイムの1は、げっ歯類を用いて行っパブロフ恐怖条件です。この設定では、条件反応の獲得と絶滅は数十トライアル2内で行われる。それは短い時間内に多数の動物を実行することができるので、恐怖条件付けの急速な発展は、有利であり得る。また、買収や絶滅は、3,4ナイーブ動物で、一日に試行数十内で観察または2から3日間2,5-8に分散することができます。しかし、洞察力は必ずしも恐怖条件付けのドメイン外適用されないこれらの実験で学習中の神経活動の変化をあげました。例えば、目標指向行動はPOSIで駆動TIVE補強がより適切ではなく、オペラントパブロフの条件付けの手順によりモデル化され、部分的に異なる神経基板9,10に依存し得る。また、恐怖条件は、CSへの神経応答が唯一の学習中の神経活動の変化の分析に重大な制限を置くこと、数十試験のために観察できるように、急速に開発しています。
残念ながら、応答オペラントの取得と絶滅は、通常は何日かかります。それは数時間以上かけて単一細胞の活動を記録するために悪名高く困難であるので、これは、神経生理学的研究にとって有害である。原因細胞外に記録された活動電位の波形の類似度が高いためには、1日に記録されたスパイクは、特に高い地域で、次の11,12に記録された同じような波形のスパイクと同じ細胞から生成していることを主張する問題があるこのような海馬などの細胞密度。
これらの問題に対処するために、我々は、1日に1実験セッション内で3学習条件を利用した新規の行動パラダイムを開発しました。これは実験動物は、補強の薄いスケジュールで様々な条件下での試験の数百を実行する意思があることを要求する。ホーミングハト( コロンビアリヴィアのフォーマイエバエ ) は、実験心理学13から17に古典的なモデル生物である。これらの鳥は、柔軟に補強偶発19,20の変化に行動を適応し、独自に熱心な労働者である、補強材の最小量の千試験を行うことができ、複雑な視覚差別18を実行することができます。これらの特徴は、以下に記載の実験用に特に適しています。
プロトコル
倫理に関する声明
すべての実験は、科学における動物の管理と使用のためのドイツのガイドラインに従って行った。手順は、ノルトライン=ヴェストファーレン州、ドイツの国の国民倫理委員会によって承認された。
システム概観
オペラントテスト商工会議所
オペラントチャンバー( 図1)は、x 34センチメートル×50cmの34センチメートルを測定します。 (約20cm床レベルの上方に位置する4センチメートル×4 cmの)三つの半透明応答キーは、チャンバの後壁内に凹んでいる。刺激は、応答キーの後ろに取り付けられたLCDフラットスクリーンを介して表示されます。側壁に位置する2つの2ワットの電球は、薄暗い照明を提供する。チャンバは無関係な音をマスクするために音響減衰キュービクル内に収容されている。ラウドスピーカは、常にホワイトノイズを与える。食料(穀物)はセントの下にある食品のホッパーによって提供されますERキー。実験的ハードウェアはカスタム記述MATLABコード21によって制御されます。動物は絶えず室の前壁に付着したデジタルカメラで監視されています。
特注のマイクロドライブ
16電極ワイヤを収容するマイクロドライブは、我々の研究室で独自に構築されています。デザインはBilkeyや同僚22,23の作品に基づいており、読者は詳細な説明については、以下の記事を参照されている。我々は、電極のより多くの(代わりに8の16、25μmのニクロム線)を可能にするために、その設計を変更し、我々はヘッドステージソケットへの導電性銀接着剤を介して電極線を接続。さらに、我々は、インピーダンスを低減し、より良好な信号対雑音比を達成するために、電極先端の金メッキを使用(適用-3〜3秒間Vと、インピーダンスが<100kΩのに落ちるべきである)。
マイクロドライブが組み立てられると、電極を所望の長さに切断され、ヒントがCLEANEです蒸留水で20分間すすぎ、さらに20分間超音波浴(蒸留水中Tergazyme)におけるd。電極チップの金めっきは、移植の直前に行われるべきである。アースのために、我々は横小脳の上に配置銀ボール電極を使用しています。材料の仕様は、この記事に付属の資料の表に記載されている。
自由に動く動物を扱う重要な問題は、運動の成果物である。私たちは、動物が移動している間に私たちのセットアップでモーションアーチファクトが大きく)高い電極のインピーダンス(> 500kΩの)およびプラグ(インプラント)とソケット間の接触B)不完全な添付ファイル(ヘッドステージ)によるものであることがわかった。プラグとソケットとの間の機械的接触が急速にハト(ヘッドボビング、キーつつき)の積極的な動きで悪化しているため、市販のマイクロコネクタの様々な自由に鳥を移動するのを記録するために十分に機能しません。インプラントとヘッドステージの間で最良の機械的な接続がGinder Scientificからheadplugアセンブリで達成された。これらのプラグソケット·アセンブリは、18接点を備え、しっかりとリングナットによって互いに固定されている。
電気生理学的記録のセットアップ
2)2つのラックに収納された15の差動アンプ·モジュールは、それぞれのユニット(DPA-2FSとEPMS-07を、マウントユニティゲイン(オペアンプ)付き1)特注のヘッドステージ、NPI電子社、ドイツ:電気生理学のセットアップは以下のコンポーネントで構成)、3)16チャンネルのアナログ - デジタル変換器(パワー1401マークI)。生信号1,000 x及びバンドパスフィルター(500〜5,000 Hzで、1次フィルタ)、16〜20 kHzのサンプリングレートでデジタル化し、オフライン処理のためにSpike2バージョン7.06aで格納さを増幅する。 (このような刺激開始または動物の個々のキーユニペックスなど)イベント時間は、実験室で構築されたパラレルポートのIOボックスを経由して取得される(ローズを参照してください。;ら 21)及び神経生理学的データと共に記憶するためのAD変換器に転送する( 図1参照)。オフライン処理は、以下にさらに記載されている。
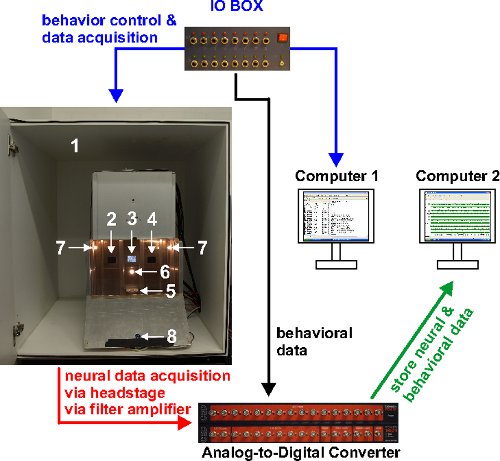
図1。システムの概要。情報の流れは、色付きの矢印で表されている。 (フラットスクリーンモニター、家の光、食品ホッパー、フィーダー光、応答キーで刺激ディスプレイ)行動出力に関係するコンピュータ1の制御ハードウェアおよびADコンバータにイベントのタイムスタンプを送信します。 A / Dコンバータおよびイベントのタイムスタンプから取得した神経生理学的信号は、コンピュータ1から受信したコンピュータ2店舗。左の写真は、音響減衰キュービクル内部の調整チャンバーを示しています。その要素は、1)音響減衰殻、2-4)応答キーS、5)食品ホッパー、6)フィーダ光7)家の光、8)観察カメラ。
シングルインターバル - 強制選択(SIFC)差別タスク
明確にするために、我々はここで最終的なSIFCタスクを記述し、以下、この作業には、動物を訓練するために必要な手順を説明します。
SIFCタスクは試行間間隔(ITI)が経過した後、中央キーが最大5秒(「初期化フェーズ')緑色透照される。図2に概説されている。すぐに5秒以内に動物の第3応答に続いて、いくつかのサンプルの刺激のうち、1は2秒、センターキーで表示されている(「サンプル·フェーズ';例刺激は、図2を挿入図に示されている)。 2秒後、センターキーをもう一度緑透照され、動物は2サイドキーは( '確認フェーズ')透照される前に、もう一度応答しなければならない。示さ刺激のアイデンティティに依存サンプル段階で、動物は左右キー(チョイス相」)のいずれかへの1つの応答を指示するために必要とされている。それが正しい宛先を選択した場合、報酬(粒)へのアクセスは、2秒間付与されます。このように、タスクのコアは、センターキーの1特定の刺激を提示した後に左の選択キーに対応し、かつ、他の刺激のプレゼンテーションの後に正しい選択キーに対応し構成されています。サンプル位相を初期化し、確認段階で囲まれている理由は、サンプルの刺激が提示されている間中央キーの前に動物の頭を維持することである。
刺激(以下、「馴染みの '刺激、FS)の単一のペアのための動物の巨匠、このタスクと、それはすべての新しいセッションで小説の刺激(NS)のペアを提示されており、2つの新規の刺激のどちらを学ぶ必要がありますされている左または右の選択キーに対応し続けることができます。 FS対は番目の中に提示され続けるOSEの実験は、適切な制御条件を提供します。最後の作業に十分な性能を全体的に強化確率<0.5で>千試験を実行するために、動物の意思に決定的にかかっている。以下の段落では、動物はSIFCのレベルに達するまで、タスクの複雑さを徐々に増加させたトレーニング手順を記述し;同時に、補強確率およびセッションあたりの試行回数は、最後の作業に一貫して高い性能を確保するために増加する必要がある。
1。ペットのためのトレーニング
- 食事制限
- 食品への自由なアクセスの少なくとも2週間後に動物を秤量する。自由給餌重量としてこの重量を取る。動物が彼らの自由摂食体重の85%に到達するまで、次の1〜2週間の食料へのアクセスを制限します。
- これは、ハトは実験全体の期間を通して健全な物理的な外観と正常な活動を維持することが重要です。へそのためには、慎重に行動訓練と試験の全期間にわたる動物の外観と重量を監視します。毎日の食物摂取量を評価するために、各実験セッションの前および後の動物を秤量する。必要に応じてさらなる重量損失を防ぐために、追加の食料を供給する。週末に食品への無制限アクセスを提供します。
- Autoshaping
Autoshaping実験室に動物を慣らすと、馴化応答を確立するのに役立つ。- センターキーに(以下、初期刺激で)5秒視覚刺激を提示する。すぐに応答キー(最初に来る何でも)することですまたは単一ペックが終了すると、キー照明、現在の食品の報酬(食料ホッパーの2秒の活性化)をOFFにしてください。
- 24の学習を容易にするためのサンプルのプレゼンテーション時間よりもかなり長いITIを保管してください。 ITIのために120秒の値を使用し、一日あたり40試験を実行します。遅いを再利用最後のタスクでの初期化、確認、および選択キー刺激として( 図2参照)。訓練のこの段階では、約1週間の動物がかかります。
- 動物は(試験の> 85%に)確実に応答すると、下に2秒10秒とサンプルプレゼンテーション時間までITIを段階的に減少させる。同時に、3(3の固定比率は、FR 3)に補強のために必要な応答の数を増やす。また、一日あたりの試行の合計数を増加させる。動物は約1時間、毎日訓練を受けられるようなパラメータを選択します。訓練のこの段階は、大きく分けて2週間続く。
- 被験者は確実にすべての3つのキーONになっているに応答するまで、左右の応答キーの1.2.3 - ステップ1.2.1を繰り返します。左、右、ランダムにセンターキーの活性化と交互試験。
- 今中心に最初に提示してから、レスポンスが条件、いずれかの側のキーに(のための補強を省略)キーレスポンスを中央に配置します。代替は裁判を裁判からランダムにサイドキーを活性化した。対象は、5秒後にセンターキーに反応しないような臨床試験を終了します。動物が確実に実行されるまで繰り返します(〜3日間)。
- (例については、 図2、挿入図参照)後、最終的なタスクのFSとなる2新しい刺激をご紹介します。これらの刺激と1.2.3 - を繰り返して、1.2.1を繰り返します。応答は通常、4日以内に、より迅速に最初の刺激よりも確立されます。
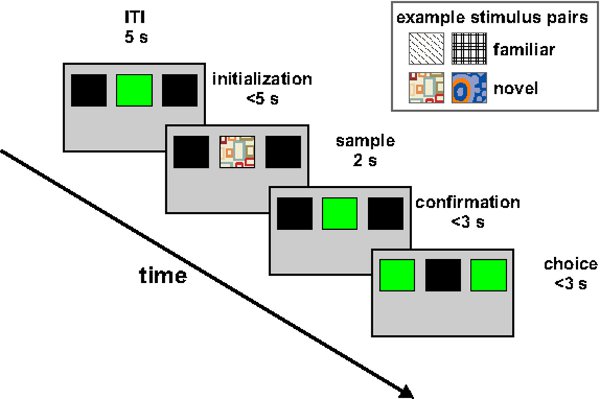
図2。行動パラダイムのイラスト。5秒のITIした後、中央のキーは、最大5秒(初期化)のために緑の透照されています。動物がこれらの5秒以内に3回応答した場合、1 4のうち;サンプル刺激が同じ位置に提示される。動物が少なくとも一度は応答しなければ、その間2秒の固定試料提示時間の後、中央つつきキーが緑色に再び(確認)透照される。別ペックの後、2サイドキーが緑色に透照されています。被験者は、サイドキーのいずれかに一回応答することによって、その選択肢を表します。取得と再取得の際に、正しい応答は2秒の食品フィーダー光の活性化を伴うアクセス、または単独のフィーダ光の活性化が続いている。正しくない場合は、家のライトが3秒間オフになります。絶滅の間に、消光刺激に対する正しいと誤った応答が取るに足らない残る。挿入図は、例の小説とおなじみの刺激のペアを示しています。
- おなじみの刺激に対する単一区間強制選択(SIFC)タスクの訓練
- 初期化、サンプル、確認、および選択の全配列を確立します。各試行に対して、本FiのIS(FR 3)RSTは、2のFS(2秒固定期間)のいずれか、そして再び(FR 1)。各試験では、与えられたFS用に記述されている光を通過させる唯一の選択肢キー:プロンプトが表示され、選択設計を行ってください。訓練のこの段階では約1週間かかります。
- 対象は、(それぞれのサイドキーに> 85%の応答を)確実に実行したら、自由選択試験(選択フェーズ中に透照両側キー)をご紹介します。動物が正しい側に応答した場合、2秒のための食品のアクセスを提供します。誤った応答がタイムアウト罰(houselightsオフ2秒)が続きます。応答が3秒以内に与えられなければ、裁判を終了し、再起動しITI。動物は通常、2週間以内にタスクのこれらのサブコンポーネントを学ぶ。
- 徐々に20%から100%、その後のセッションで自由選択試験の割合を増加させる。
- 対象は、自由選択試験で> 90%が正しい実行する場合は、0.5への正しい応答のための報酬確率を減少させる並列に1,000セッションあたりの試行回数を増加させながら。パラメータ毎日/セッションを変更しますが、柔軟に初期化忘れや正答率について、被験者のパフォーマンスのレベルに応じてそれらを選択しないでください。訓練のこの段階では、約4週間続く。
- ハトは不慣れな刺激に応答を拒否する傾向があります。動物が確実に実行されるとそのため、>千試験、視覚刺激の大規模なセットにオートシェイプ応答(セクション1.2を参照)。しかし、最終的なパラダイムが、均一な色のディスプレイでは新しい刺激として後で使用するために運命づけ視覚刺激をpreexposeません。
- 最終的なシングル·インターバルは、別の補強条件の下で新しい刺激とタスクの選択を強制
- ウォーミングアップ
件名のみ、FSで50試験を実行できます。これらの刺激のための報酬確率を<1(例えば、0.5から0.8)時期尚早飽食とを防ぐために、すべてのフェーズで、そのため、対応するモチベーションの欠如。 - 調達段階
FSおよびNSの提示と、ランダムに別の試験。 2 NSのために正しいと異なる応答キーを割り当てて、すべての正しい応答を強化する。最後の120試行にわたる移動平均として正答率を計算します。 NSの各々についての性能は85%を超えるが、150試験の最小の前に実行されなかったら、取得が完了したと見なされる。 - 絶滅ステージ
正しい強化し、ランダムNS(消光刺激)への不正な応答を罰する停止します。絶滅の刺激に応答して、正しいが60%以下に低下し、動物は合計で、この段階で少なくとも150試験を経験した際に再取得フェーズを開始。 - 再取得の段階
再び正しい補強し、取得段階中など、絶滅刺激に間違った回答を罰する。この刺激のパフォーマンスが85%とアニマを超えた場合にセッションを終了LSは、合計で、この段階では少なくとも150試験を行った。
- ウォーミングアップ
2。電気生理学
- 電極注入
移植手術は、全体の取得-消光再捕捉シーケンスを完了した(3〜4倍)を繰り返し、動物後に行われ、他の場所25でより詳細に説明する。- 歯科用セメントヘッドはマイクロドライブを含む、マウント固定するための頭蓋骨に5-6ステンレス製microsrewsを配置します。
- ちょうど興味のある脳領域の上に開頭を行う。慎重硬膜を分析し、目的の位置に電極を下げる。
- 頭にマイクロドライブを固定する前に、ガイドカニューレの周りにワセリンを適用、実装、これは、案内管を包むから歯科用セメントを防ぐことができます。
- グランドとして小脳の上にある頭蓋骨の下に置かれた絶縁銀ボール電極を使用してください。
- 鎮痛剤(カルプロフェン、10ミリグラム/ Kで動物を提供Gは、手術後3日間1日2回)を注入。動物は、少なくとも2週間回復することができます。
- 録音動物は、タスクの実行中
- 開始する前に、各セッションおよび事前の電極は、少なくとも125ミクロン(駆動ねじの半回転)するための新規な刺激の新しいペアを使用してください。十分な信号対雑音比のない活動電位が観察されない場合は、セッションを中止ホームケージに動物を配置し、次の日に再度実行してください。
- それは、動物の正常な序列や摂食行動に干渉しないようにヘッドステージケーブルを配置します。これは、コンディショニングチャンバの上部にいくつかの弾性ストラップでケーブルを接続し、いくつかの時間のケーブルに取り付け鳥をhabituatingことによって達成することができる。
- 利用可能な場合には、鳥のための動きの余分な自由度を提供するための整流子を使用しています。
- オフライン信号解析
- バンド-Pお尻フィルターSpike2を使用して急峻なロールオフをオフラインで500〜5,000 Hzのからすべてのチャンネル。振幅しきい値とスパイクを抽出し、手動で主成分分析を利用し、それらを並べ替える。
- (MATLAB Centralは為替、ファイルID#37339ファイルで入手可能)カスタム記述MATLABコードで結果をソート調べる。十分に単離され、単一のユニット( 図3)は、次の基準をすべて満たしている必要があります。a)主成分空間における明確に分離クラスタ、記録されたすべての波形を重ねてヒートマップ( 図3Aのようにプロットされている複数台のB)兆候ない)、C)対称に分布のピーク波形の振幅( 図3B)、不変のスパイク振幅( 図3C)、E)によって証明されるように、セッションを通してD)安定した記録前のスパイクの不応期中に発生していないか、または非常に少数のスパイクイベント( 図3D)、および少なくとも2(SNRの信号対雑音比(SNR)は、ここでdはノイズ帯域(2.5 番目及び全ての波形の最初のビンの値の分布の97.5 パーセンタイル ))のトリミング幅で割った平均化スパイク波形の最小値と最大値の間の差としてefined。 図3に示されるユニットのSNRは3.9である。
- 運動関連の成果物の原料のチャネルをオフラインに点検してください。示されたときのチャネルを破棄します。
- キーつつき時に発生する電気的な成果物は、まれに、適切なスパイク波形と混同することができます。スパイクの時間ヒストグラムを調べることによって、録音の汚染のためのテストは、各登録キーペック(ペリペック時間のヒストグラム、PPTH、 図3E)を基準にカウントします。序列によって誘発されるアーティファクトは、時間0にヒストグラムの近くのピーク(±50秒)として表示されます。追加のチェックとして、個別にキーペックの±20ミリ秒以内に登録されているすべての推定スパイクイベントの波形をプロットし、それがスパイクと比較outsid検出された波形Eこのウィンドウ( 図3F)。

ユニットの分離については、図3。の品質指標。すべての波形の時間-電圧値のA)ヒートマップB)全ての波形の最大値(赤色)、最小値(緑)、ノイズ(青)の電圧値の分布。分布はよく優れたユニットの分離を示し、分離されている。C)セッション中の時間の関数としての自発発火率(すべての試行間間隔で2秒間のセグメントから計算された赤、)およびスパイク振幅(ピーク·ツー·ピーク)。 D)このユニットのスパイク間間隔分布:両方の曲線は、ボックスカー機能(50データポイントの幅)で平滑された。ビン幅、10ミリ秒(挿入図:1ミリ秒)。非常に短い間隔がほぼ存在しない(<4ミリ秒以下の間隔の0.1%)である。 <強い> E)PSTHキーユニペックスにトリガ。イベントキー·ペック(±20秒)に近いカウント赤く強調表示されています。F)キーペックイベントの±20ミリ秒以内に記録されているすべての157の波形。波形は、パネルAに示されている全体的な波形形状に引けを取らない
結果
行動
図4Aは、1例セッションで動物の行動の性能を示している。動物のパフォーマンスレベルは、180試験(45刺激プレゼンテーション)内で、NS 2の基準に達し、最初から、NS 1、100%に近い。この戦略 - まず両方の新しい刺激のために同じキーに対応し、その後、刺激のいずれかの応答を調整するには - 同じくらい頻繁に両方のNSに応答する初期乱数として観測さ...
ディスカッション
このプロトコルは、同時シングルユニットの録音に適して複雑な行動のタスクについて説明します。我々は、ハトのためSIFCタスクを記載しているが、それは容易にノーズポーク又はレバー押圧ではなく、キーユニペックスを必要とし、嗅覚、聴覚、または触覚刺激によって視覚的に置換することにより齧歯類に適合させることができる。
おそらく、訓練手順中で最も重?...
開示事項
著者らは、開示することは何もありません。
謝辞
この研究は、MCS(1581の場合は、STU 544/1-1)と(1581年の場合は、SFB 874)OGにドイツ研究協会(DFG)からの補助金によって支えられている。 DFGのウェブサイトはhttp://www.dfg.de/en/index.jspです。資金提供者は、電気生理学のセットアップに助けを金メッキプロトコルをご提供だけでなく、トビアス·オットーのためにトーマスSeidenbecher感謝研究デザイン、データ収集と分析、公開することを決定、またはmanuscript.The作者の調製において何の役割も持っていません録音機器。
資料
| Name | Company | Catalog Number | Comments |
| Resistance wire (for use as electrodes) | California Fine Wire, Grover Beach, CA, USA | Stablohm 675; formvar-coated nichrome wires (outer diameter 25 µm) | |
| Microconnectors | Ginder Scientific, Nepean, Ontario, Canada | GS18PLG-220 (plug) & GS18SKT-220 (socket to build headstage) | |
| Cannulae | Henke Sass Wolf, Tuttlingen, Germany | 0.4 x 20 mm/ 27 Gx3/4" | |
| Gold solution for plating | Neuralynx, Bozeman, MT, USA | SIFCO Process Gold Non-Cyanide, Code 5355 | |
| Solution for ultrasonic bath | Alconox, Inc., New York, USA | 1304 | Tergazyme |
| Conductive glue | Henkel Loctite | LOCTITE 3888 Silver filled, conductive, adhesive | |
| Stainless steel screws | J.I. Morris, Southbridge, MA, USA | F0CE125 self-tapping miniature screws, body length 1/8 inches | |
| Light-curing dental cement | van der Ven Dental, Duisburg, Germany | Omniceram Evo Flow A2 | |
| Light-curing unit | van der Ven Dental, Duisburg, Germany | Jovident Excelled 215 Curing Light (wireless LED light curing unit) | |
| Filter amplifiers | npi electronic GmbH, Germany | DPA-2FS | |
| A/D converter | Cambridge Electronic Design, Cambridge, UK | power 1401 | |
| Spike2 software | Cambridge Electronic Design, Cambridge, UK | Version 7.06a | |
| MATLAB | The Mathworks, Natick, MA, USA | R2012a |
参考文献
- Bingman, V. P., Gasser, B. A., Colombo, M. Responses of pigeon (Columba livia) wulst neurons during acquisition and reversal of a visual discrimination task. Behav Neurosci. 122, 1139-1147 (2008).
- Herry, C., Ciocchi, S., Senn, V., Demmou, L., Müller, C., Lüthi, A. Switching on and off fear by distinct neuronal circuits. Nature. 454, 600-606 (2008).
- Quirk, G. J., Repa, C., LeDoux, J. E. Fear conditioning enhances short-latency auditory responses of lateral amygdala neurons: parallel recordings in the freely behaving rat. Neuron. 15, 1029-1039 (1995).
- Quirk, G. J., Armony, J. L., Ledoux, J. E. Components of Tone-Evoked Spike Trains in Auditory Cortex and Lateral Amygdala. Neuron. 19, 613-624 (1997).
- Maren, S. Auditory fear conditioning increases CS-elicited spike firing in lateral amygdala neurons even after extensive overtraining. Eur J Neurosci. 12, 4047-4054 (2000).
- Milad, M. R., Quirk, G. J. Neurons in medial prefrontal cortex signal memory for fear extinction. Nature. 420, 713-717 (2002).
- Hobin, J. A., Goosens, K. A., Maren, S. Context-dependent neuronal activity in the lateral amygdala represents fear memories after extinction. J Neurosci. 23, 8410-8416 (2003).
- Maren, S., Hobin, J. A. Hippocampal regulation of context-dependent neuronal activity in the lateral amygdala. Learn Mem. 14, 318-324 (2007).
- Knapska, E., et al. Differential involvement of the central amygdala in appetitive versus aversive learning. Learn Mem. 13, 192-200 (2006).
- Harloe, J. P., Thorpe, A. J., Lichtman, A. H. Differential endocannabinoid regulation of extinction in appetitive and aversive Barnes maze tasks. Learn Mem. 15, 806-809 (2008).
- Gray, C. M., Maldonado, P. E., Wilson, M., McNaughton, B. Tetrodes markedly improve the reliability and yield of multiple single-unit isolation from multi-unit recordings in cat striate cortex. J Neurosci Methods. 63, 43-54 (1995).
- Lewicki, M. S. A review of methods for spike sorting: the detection and classification of neural action potentials. Network. 9, (1998).
- Skinner, B. F. 34;Superstition" in the pigeon. J Exp Psychol. 121, 273-274 (1948).
- Herrnstein, R. J. Relative and absolute strength of response as a function of frequency of reinforcement. J Exp Anal Behav. 4, 267-272 (1961).
- Brown, P. L., Jenkins, H. M. Auto-shaping of the pigeon's key-peck. J Exp Anal Behav. 11, 1-8 (1968).
- Epstein, R., Kirshnit, C. E., Lanza, R. P., Rubin, L. C. 34;Insight" in the pigeon: antecedents and determinants of an intelligent performance. Nature. 308, 61-62 (1984).
- Mazur, J. E. Varying initial-link and terminal-link durations in concurrent-chains schedules: a comparison of three models. Behav Processes. 66, 189-200 (2004).
- Herrnstein, R. J., Loveland, D. H. Complex visual concept in the pigeon. Science. 146, 549-551 (1964).
- Stüttgen, M. C., Yildiz, A., Güntürkün, O. Adaptive criterion setting in perceptual decision making. J Exp Anal Behav. 96, 155-176 (2011).
- Stüttgen, M. C., Kasties, N., Lengersdorf, D., Starosta, S., Güntürkün, O., Jäkel, F. Suboptimal criterion setting in a perceptual choice task with asymmetric reinforcement. Behav Processes. 96, 59-70 (2013).
- Rose, J., Otto, T., Dittrich, L. The Biopsychology-Toolbox: a free, open-source Matlab-toolbox for the control of behavioral experiments. J Neurosci Methods. 175, (2008).
- Bilkey, D. K., Muir, G. M. A low cost, high precision subminiature microdrive for extracellular unit recording in behaving animals. J Neurosci Methods. 92, 87-90 (1999).
- Bilkey, D. K., Russell, N., Colombo, M. A lightweight microdrive for single-unit recording in freely moving rats and pigeons. Methods. 30, 152-158 (2003).
- Gallistel, C. R., Gibbon, J. Time, rate, and conditioning. Psychol Rev. 107, 289-344 (1993).
- Starosta, S., Güntürkün, O., Stüttgen, M. C. Stimulus-response-outcome coding in the pigeon nidopallium caudolaterale. PLoS One. 8, (2013).
- McNaughton, B. L., O'Keefe, J., Barnes, C. A. The stereotrode: a new technique for simultaneous isolation of several single units in the central nervous system from multiple unit records. J Neurosci Methods. 8, 391-397 (1983).
- Hill, D. N., Mehta, S. B., Kleinfeld, D. Quality metrics to accompany spike sorting of extracellular signals. J Neurosci. 31, 8699-8705 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved