Method Article
代替として舌下免疫療法は、急性呼吸器感染症に対する保護を誘導するために
要約
The present work illustrates the convenience of using sublingual immunotherapy to boost the innate immune response in the lungs and confer protection against acute pneumococcal pneumonia in mouse.
要約
Sublingual route has been widely used to deliver small molecules into the bloodstream and to modulate the immune response at different sites. It has been shown to effectively induce humoral and cellular responses at systemic and mucosal sites, namely the lungs and urogenital tract. Sublingual vaccination can promote protection against infections at the lower and upper respiratory tract; it can also promote tolerance to allergens and ameliorate asthma symptoms. Modulation of lung’s immune response by sublingual immunotherapy (SLIT) is safer than direct administration of formulations by intranasal route because it does not require delivery of potentially harmful molecules directly into the airways. In contrast to intranasal delivery, side effects involving brain toxicity or facial paralysis are not promoted by SLIT. The immune mechanisms underlying SLIT remain elusive and its use for the treatment of acute lung infections has not yet been explored. Thus, development of appropriate animal models of SLIT is needed to further explore its potential advantages.
This work shows how to perform sublingual administration of therapeutic agents in mice to evaluate their ability to protect against acute pneumococcal pneumonia. Technical aspects of mouse handling during sublingual inoculation, precise identification of sublingual mucosa, draining lymph nodes and isolation of tissues, bronchoalveolar lavage and lungs are illustrated. Protocols for single cell suspension preparation for FACS analysis are described in detail. Other downstream applications for the analysis of the immune response are discussed. Technical aspects of the preparation of Streptococcus pneumoniae inoculum and intranasal challenge of mice are also explained.
SLIT is a simple technique that allows screening of candidate molecules to modulate lungs’ immune response. Parameters affecting the success of SLIT are related to molecular size, susceptibility to degradation and stability of highly concentrated formulations.
概要
The overall goal of this work is to illustrate the benefits of sublingual immunotherapy for the treatment of acute respiratory infections (ARI) and present the advantages of this delivery route compared to other routes of administration, namely intranasal.
ARI cause millions of deaths every year especially in children under five. Streptococcus pneumoniae remains as one of the major etiological agents of bacterial pneumonia in infants and the elderly1,2. To present, the main available treatment relies on the use of antibiotics but resistant strains are continuously arising3,4.
SLIT induces broad responses at systemic and also mucosal level, particularly at the respiratory tract5. It has proven effectiveness against influenza infection, promoting long term protection with production of humoral and cellular responses6,7. Besides, it has been shown that prophylactic treatment with bacterial lysates delivered by sublingual route reduced exacerbations of chronic obstructive bronchitis in the elderly8 and prevented recurrent respiratory infections in children9. SLIT has been widely used for the treatment of allergies and asthma. Clinical studies had not only demonstrated its efficacy to modulate the immune response in the respiratory tract but also its safety10. Despite the growing interest of pharmaceutical companies and researchers in SLIT, the mechanisms involved in the induction of mucosal immune responses after sublingual delivery of compounds remain obscure. Recently, attention has been focused on the mechanisms promoting tolerance associated with allergen desensitization. It has been proposed that resident and recruited cells at the sublingual mucosa, like dendritic cells and macrophages, can promote tolerance after SLIT11-13. Dendritic cells of the oral mucosa can promote IFN-gamma and IL-10 producing T helper cells11 as well as recirculate to the distal genital mucosa and promote CD8+ T cells14. However, little is known about the impact of SLIT on innate cells or its capacity to improve pathogen clearance during acute respiratory infections.
The natural control of pneumococcal infection in the lungs greatly depends on the efficient and swift activation of local innate defences. We previously showed that enhancement of lungs’ innate immunity by a single intranasal dose of flagellin (FliC), a TLR5 and NLRC4 agonist, protects 75-100% of mice challenged with a lethal dose of a clinical isolate of Streptococcus pneumoniae serotype 1. This protection was shown to be dependent on local recruitment of GR1+ cells (likely polymorphonuclear neutrophils, PMNs) and not dependent on antibodies, B or T cells15.
Flagellin is the structural component of the bacterial flagellum. In its monomeric form it is recognized by two Pathogen Recognition Receptors (PRRs), TLR5 that senses extracellular FliC16 and NLRC4/NAIP5 inflammasome that detects intracellular flagellin17,18. When FliC is sensed by the PRRs an important inflammatory response is triggered. We and others have demonstrated that instillation of purified FliC from Salmonella enterica serovar Typhimurium into the lungs drives swift production of chemokines and cytokines specially when recognized by the lungs’ epithelium that in turn orchestrate the recruitment of immune cells into the airways, mainly PMNs15,19-21. Although transient, the substantial neutrophil infiltration that takes place into the airways after nasal delivery of FliC could be a concern if moving towards clinical therapies for human use. Excessive inflammation could be detrimental for the lungs’ function. Moreover, it has been shown that intranasal delivery of immunostimulatory molecules may cause facial paralysis and/or brain toxicity22-24.
Sublingual immunotherapy offers a safer alternative to modulate the immune response in the respiratory tract compared to the intranasal route. It is non-invasive, painless, simple and has good patient compliance25. Furthermore, as mentioned before, it can induce protective responses in the respiratory mucosa without the risks associated to direct intranasal or intrapulmonary delivery of formulations. Sublingual route could be alternatively used to deliver molecules that have great effects onto the lung’s immune system but that have been proven to be toxic or to elicit great inflammation when administered intranasally. Besides these advantages, formulations for sublingual immunotherapy have lower cost of manufacture since non-sterile products can be delivered by this route and endotoxic shock is not a concern for SLIT. On the other hand, it is worth noticing that higher doses of the immunostimulatory compounds compared to those used by intranasal or parenteral routes are necessary to induce an immune response in the lungs; also highly concentrated solutions are needed when using the mouse model of SLIT since the anatomical site where the formulations are deposited is small.
Based on our previous published data, we developed a model of protection using sublingual immunotherapy with flagellin as model immunostimulant. We demonstrated that a single dose of flagellin induced 60% survival against invasive pneumococcal pneumonia caused by the serotype 1 strain while all mice in the control group died of infection within 5 days. Flow cytometry analysis showed that higher numbers of PMN are recruited into the airways of protected animals after sublingual treatment with flagellin suggesting that these cells might be involved in the mechanism of protection induced by sublingual immunotherapy.
This video shows in detail how to perform sublingual immunotherapy and also how to recover relevant tissue from the sublingual mucosa, draining lymph nodes as well as lungs and airways to perform further analysis. Additionally, it illustrates the general technique of cell preparation for FACS analysis and briefly shows how to prepare Streptococcus pneumoniae suspensions and how to perform intranasal infections in mouse to set up the acute infection model.
プロトコル
ウルグアイ - 動物を含む手順は、動物実験や医学部の指令委員会、大学·デ·ラ·レプブリカのために名誉委員会によって承認されたプロトコルN°071140-000821-12と08052010に従って行った。
治療剤の舌下投与1。
- 試験される治療薬を含有する溶液を調製する。マウスあたり10μlを最大音量を管理するために濃度を調整します。
注: サルモネラ·エンテリカ血清型から精製されたフラジェリンのためにSの最初の致死量に感染させたマウスにおいて防御を誘導するための最適な投与量をネズミチフス菌ニューモニエ血清型1 E1586は、100%の死亡率の原因となることを10μg/マウスである。フラジェリン溶液は、モノマーの放出を確実にするために5分間65℃で加熱しなければならない。フラジェリン浄化の詳細については、リファレンス26を参照してください。- バールその分子サイズ、純度、タンパク質分解に対する感受性や粘膜接着剤の使用に応じて異なる免疫調節剤の有効濃度のy。その効果を最大化するために、試験される各化合物の最適濃度を調整します。鼻腔内経路による以前の研究は、特定の化合物について行われてきた場合は、舌下経路によるその有効性を試験するために、5〜10倍高い開始用量を使用する。
- 5.5ミリグラム/ kgのXylacineで110ミリグラム/ kgのケタミンを含むカクテルを注入することにより、マウスを麻酔し、および動物が7から10分間休ませ。
- 静かに後ろ足の一つのフットパッドを押して、適切なanaesthetizationを確認。適切に麻酔をかけた場合、動物は、刺激に反応して動きません。
- 麻酔下ながら乾燥を防ぐために、各マウスの目の上に獣医軟膏の薄層を広げる。
注:システムが装備する場合は、イソフルオランのような吸入麻酔薬ではなく、ケタミン/ Xylacineをも使用することができます誘導室と鼻コーンとのPEDが可能です。動物をanaesthetiseおよび舌下経路による免疫賦活剤を管理するために、誘導チャンバーを使用してください。すぐに嚥下回避し、治療用化合物の吸収を可能にするために麻酔下でそれを維持するために、少なくとも15分間、ノーズコーンに動物を接続してください。 - 免疫賦活剤またはビヒクル対照溶液を含む溶液をピペット;親指と非利き手の人差し指を使用してマウスを取り、垂直位置に保持。
- 舌の下に利き手の場所を閉じたピンセットを使用し、中·薬指を使って所定の位置に保持し、舌を持ち上げるために、わずかに鉗子を開きます。
- ピペットを取ると舌の口と背側の床の上にソリューションを管理します。
- 鉗子を外し、ケージに戻ってそれを置く前に、3〜5分間のマウスの残りをしましょう。正常体温は麻酔をかけたマイクで維持されるようにするにはE、ケージヒータシステムへのケージに接続します。そのようなシステムが利用できない場合、場所マウスはベッドの上に隣同士に対応するケージつにバック同じ処置グループに属している、部分的に、それらが体温を維持するのを助けるためにきれいなティッシュペーパーシートでそれらをカバー。
- 治療によって誘導される細胞集団の変化を分析するための免疫調節剤の点滴注入後の任意の時点で組織サンプルを収集する。
注:フラジェリンのこの特定のプロトコルに投与する場合は、チャレンジの前に2時間実施した。試験対象の各特定の治療薬および病原体に対する治療と挑戦間の最適な時間を決定します。
肺炎球菌による細菌懸濁液と鼻腔内チャレンジの調製
注:S.肺炎連鎖球菌は、侵襲性肺炎、敗血症などの生命を脅かす疾患を引き起こす可能性があり、天然のヒト病原体である髄膜炎。吸入したり粘膜に接触したときに送信が発生する可能性があります。したがって、S.と接触したかもしれないすべての試料肺炎連鎖球菌は、クラスIIバイオセーフティキャビネットを使用して、適切なバイオセキュリティレベルⅡの施設で処理する必要があります。防護服、廃棄物処理および適用される場合があり、追加のセキュリティ対策のためのタイプIIの病原体の取り扱いに関するあなたの機関の標準作業手順を確認してください。感染した動物は、HEPAフィルターを装備したアイソレーター内の個別換気ケージに保管してください。アンチ肺炎球菌ワクチンと抗生物質療法が利用できます。詳細については、参考文献27および1を参照してください。
- 15に記載したように調製した公知の細菌のCFU数の肺炎球菌の作業ストック懸濁液のアリコートを解凍する。
- 2,500×gで、室温で5分間遠心する。
- 上澄みを捨て、ST 1mlに懸濁して細菌のペレットを洗浄erile食塩水。細菌懸濁液、希釈液または動物挑戦のために準備するときにフィルターチップを使用してください。
- 遠心分離し、再びステップ2.2で説明したように。
- 上澄みを捨て、4×10 5 CFU / 50μlと懸濁液を得た滅菌生理食塩水の適切な量でペレットを再懸濁します。この用量は、Sの最小細菌の投与量に対応している以前の研究15に従ってBALB / cマウスにおける100%の死亡率を引き起こす肺炎連鎖球菌血清型1 E1586。
注:マウスでは肺炎球菌性肺炎のモデルを確立するとき、死亡率100%を引き起こす最小細菌用量は、細菌株、血清型およびマウス系統のそれぞれの特定の組み合わせについて決定しなければならない。 - ボルテックスまたは下に5回ピペッティングして細菌懸濁液を均質化する。
- 負荷の滅菌フィルターチップを用いて細菌懸濁液50μlと麻酔したマウスの鼻孔に、全量を植え付ける。マウスupriホールド2分間GHTし、それがさらに2分間仰臥位で休むましょう。目に獣医軟膏を適用し、ケージに動物を返します。麻酔下ながら正常体温を維持するようにしてください。
注:この研究では、細菌チャレンジは15,28で先に決定された肺に総CFUの少なくとも90%の送達を確実にするために50μlの容量で行った。動物の小容量( 例えば 、20μL)の苦痛を最小限にするために使用することができます。しかし、肺への細菌の効率的な配信をチェックしなければなりません。これは、チャレンジ後の肺5分を採取し、血液寒天プレート上に連続希釈をプレーティングすることによって、肺 'ホモジネート中のCFUを計数することにより行うことができる。 - 血液寒天プレート上に連続10倍希釈液をメッキすることにより、感染に用いた細菌懸濁液中のCFU番号を確認してください。 5%CO 2、37℃でO / Nインキュベートしらの緑色のハロー特性を提示するムコイドコロニーの数を数えるPHAの溶血性細菌。
3組織収集およびフローサイトメトリー(FACS)分析のためのサンプル調製
3.1)組織収集
- 頚椎脱臼により動物を安楽死させるか、CO 2チャンバーを用いて;すべての方法まで首まで胸腔を開き、首と顎下領域の腹側を露出させるために、前脚に沿って切開する。
- 先端の細い湾曲した鉗子でそっと口底の背側を露出させ、唾液腺および隣接する軟組織を引き上げます。曲がった細い先端鉗子を使用して、静かに引き上げて下顎とアクセサリ下顎リンパ節を取り、%ウシ胎児血清500 ML- 10完全RPMI(cRPMI中、10,000 U / mlを含む溶液5mlを含む試験管に配置しますその意志下流の手順に従って、ペニシリンおよび10 mg / mlのストレプトマイシン溶液および5mlのL-グルタミン200 mM)のまたは核酸の保存液後に行う。
- 胸腔を開くには、横隔膜の切開をすることができる。ラット歯ピンセットを使用すると、胸骨の剣状軟骨をクランプし、慎重に虚偽の肋骨から上がって真の肋骨が胸骨柄を満たす点に到達するまで、すべての道を開始し、両方の背側にリブをカット。
- 鉗子で胸骨の剣状軟骨を保持することによって、胸腔の臓器を露出させるために静かに引き上げます。
- 第1のリブと鎖骨を切断して完全にリブを削除します。胸腺は心臓のベースに胸部の近くの前腹部分に位置する2つの葉の白い構造として表示されます。
- ピンセットでそれをクランプすることによりローブのいずれかを取ると、その下方の顔と心膜の間靭帯を除去するためにハサミを使用しています。二葉を削除しますか。
- 腹腔を特定し、そしてmの中央値軸に沿って切断して開きuscular壁が臓器を露出させる。一対の鉗子と後部大静脈および胸部大動脈をカット。吸収性、組織と血液の過剰を取り除く。
- 居住者および肺胞の細胞集団の浸潤を分析することが気管支肺胞洗浄(BAL)を行う。気管と食道を露出させ、首の腹側の部分の筋肉をカット。それらを分離する構造体の側方および背側に切開を行う。
- 鉗子で気管を持ち上げおよびCa 2 + / Mgの2 +プラス1 mMのEDTAを含まない1mlのPBSで満たされた薄チップトランスファーピペットを導入するメスで小切開する。浸透させると、総体積を少なくとも三回吸引し;吸引物は、無菌の1.5mlチューブに細胞懸濁液を移し、氷上に置き。
- 最初の右心室へのCa 2 + / Mg 2+を加えた1mMのEDTAを含まない5mlのPBSを注入することによって、肺灌流、肺実質中に存在する細胞集団を分析するために心の。
注:これは、肺「血管に存在する赤血球および免疫細胞のほとんどを排除する。灌流が正しく実行された場合、肺の色は白にピンクからシフトします。 - 左心室の底からそれをクランプすることにより、肺から心臓を単離し、微妙にそれを完全に除去するためにはさみで血管を切った。のcRPMIまたは下流の分析に応じて、核酸防腐剤溶液でそれらを潅流し、肺を取り出し、配置が行われる。
- 舌下粘膜における細胞集団の分析のために、動物の頭を隔離し、ステップ3.2.1で行われていない場合、唾液腺および隣接する軟組織を除去する。
- 下顎の関節に到達するまで、口の両側にあるの切開を行い、ピンが解剖ボード上にそれを修正使用して、口の中の舌と床と一緒に劣る顎を分離する。舌を引き上げ。メスを使用して切開BA作る舌のSEは舌下粘膜を露出するために第三大臼歯に到達するまで口腔底を満たしています。
- 完全に舌を外します。 0.5ミリメートル生検パンチを取り、下前歯の隣に配置します。口腔底が完全にカットされるまで、静か舌下組織とプレスの歯肉挿入からカット。
- 舌下組織の除去を完了させる第三大臼歯に近い生検パンチを配置することになりましたもう一回繰り返します。のcRPMIまたは核酸防腐剤を含む清潔なチューブに置きます。
FACS分析のため3.2)試料の調製。
- 24ウェルプレートに各マウスから分離された肺の '組織を移し、約2mmの組織の小片を得るまでハサミのクリーンペアでそれらをミンチ。 FBSを含まないRPMI 1mlに、II型コラゲナーゼ30mgを含有する消化培地のウェル当たり1ミリリットルの追加の50μgのDNアーゼ-I。アップピペット5回ダウンして、インキュベート37℃、40分間、5%CO 2。
- 舌下組織中の細胞集団の分析のために、ディスパーゼ2単位、RPMI 1ml中30mgのII型コラゲナーゼ、50μgのDNA分解酵素-Iを含むものと3.2.1で消化培地に置き換えてください。 50rpmでオービタルシェーカーにおいて37℃で20分間消化培地500μl中に1匹のマウスから採取した組織をインキュベートする。
- 組織のほとんどが破壊されるまでインキュベートした後、ピペット上下最大10倍、または30秒のダウン。 40ミクロンの滅菌セルストレーナーかかわら細胞懸濁液を濾過し、5mlのPBSで洗浄し、5mMのEDTAを補充した。
注:細胞外マトリックスと線維組織の完全な消化が達成されることはありません。しかしそれは、Fの全体的な結果に影響を与える細胞外タンパク質の増加した細胞死と破壊の原因となりますので、コラゲナーゼおよび/またはディスパーゼもしくは攻撃的なチュレーションの存在下で、より長いインキュベーション時間が推奨されていませんACS分析。 - 400×gで、5分間、4℃で遠心します。
- BAL中の細胞集団の分析のために、4℃で、400×gで、5分間で細胞を遠心し、3.2.4に進みます。
- リンパ節における細胞集団の分析のために、無菌のペトリ皿上に70μmのセルストレーナーを配置し、リンパ節を入れストレーナへのcRPMI 1mlと一緒にノード。 2ミリリットルの無菌注射器の急落を取り出し、ストレーナのメッシュに対するリンパ節を粉砕する乳棒として使用します。新鮮なのcRPMI 1mlで細胞ストレーナーをすすぎ、滅菌チューブにペトリ皿から細胞を移す。
- 各サンプルの代表的なアリコートを取り、生存細胞数を決定するためにトリパンブルーでそれを染色する。
- 2×10 7細胞/ mlの懸濁液を構成し、サイトメーターチューブに50μlのを追加するために、PBS-5mMのEDTA-1%ウシ血清アルブミン:FACS-EDTAで細胞を再懸濁します。
- APPRを含む2X抗体ミックスを調製する利用可能なFACS機器による表面マーカーおよび蛍光色素に対する抗体のopriate組み合わせ。細胞懸濁液を含む各チューブに2倍の抗体混合物を50μl加える。
注:リファレンス29を参照して詳細なプロトコルのために、使用される最適量を決定するために、各蛍光色素標識抗体を滴定する。 - 暗闇の中で氷上で30分間インキュベートします。
- FACS-EDTA 3mlで1回洗浄し、4℃で5分間、400×gで遠心分離して細胞をスピンダウンし、同緩衝液200μlで細胞を再懸濁し、フローサイトメーターで解析します。
注:サンプルの大きな数を扱う場合は、上述のFACS分析のために染色プロトコルの代わりサイトメーター管のU底96ウェルプレート中で実施することができる。しかし、96ウェルプレートの洗浄工程を使用する場合、各和紙の間、4℃で5分間、400×gで細胞をスピンダウンして、4回FACS-EDTAまでの200μLを添加し、繰り返して行わなければならないngのステップ。 - この時点で、フローサイトメーター以降(固定後72時間まで)流れの中で、分析のためのサンプルを修正します。
- 細胞を固定するために、FACSに抗体での標識後、PBS無しのCa 2 + / Mg 2+を 、FBSを含まない1mMのEDTAで細胞を洗浄する。何のCa 2 + / Mgの2+同じ緩衝液50μlで細胞をサスペンドせず、高張(2X)PBS中に新たに調製した4%パラホルムアルデヒド溶液50μlを加える。
- RTで20分間インキュベートし、FACS-EDTAで3回洗浄する。
- 4℃で、FACS-EDTAや店舗の200μl中の細胞を再懸濁し、最大72時間、光から保護。
注:FSC-SSCは固定によって影響を受ける可能性があります。サンプルを固定した場合のタンデム色素は、固定剤剤の存在下で分解することができるため、メーカーとの蛍光標識された抗体の互換性をチェック。サンプルは感染動物から発信した場合の固定を強くするときANALY生存可能な病原体が存在しないことを保証することが推奨されているmicroaerosolsは、サンプルの収集中に発生させることができるので、FACS機で試料を歌う。
4。全RNAの抽出、cDNA合成およびリアルタイムPCR。
4.1)RNA抽出およびcDNA合成。
- 機械的破壊による任意の核酸保存液中で組織を均質化する( 例えば、ローター-ステーターホモジナイザーを用いて、組織ruptor及びビーズ等を振っ高速)。組織片を除去するために、15分間、4℃のために12,600×gで遠心分離します。きれいなチューブに上清を移す。
- メーカーの指示に従って、選択した方法では、RNAを抽出します。
注:RNAが、それが単離後すぐに使用する予定がない場合には、一定分量を作成し、-80℃でのRNAseフリーのチューブに保存し、分解を非常に受けやすい。凍結融解の繰り返しは避けてください。チューブは常に手袋をして取り扱う必要があります。 Aサンプルを解凍した後、lways氷上に保管してください。 - 260nmでの核酸の吸光度を測定し、μgの/μlの濃度を計算する。
- 超純水7.6μlの10XのDNAse-Iバッファー1μlの、DNアーゼ-I(増幅グレード)の株式1 U /μlに0.4μlの、および8.4μLを追加します。DNアーゼ-Iは、(1サンプル用)を添加することにより混合する準備DNアーゼ-Iは、1μgの全RNAを含む各サンプルに混ぜる。
- 使用に1μg/μlの濃度でRNAを鋳型として全RNAを1μlを添加することにより逆転写反応(RT-PCR)を行う。サンプルが希釈されすぎており、濃度が予想よりも低い場合、トータルRNAの代わりに水のより大きなボリュームを追加する。フェノールトレースはRT-PCRの収量に影響を与える可能性があるので、任意のRNA抽出プロトコルをフェノール - クロロホルム混合物を含んだ特別な場合にはRNAを追加するときに最終反応容量の20%を超えない。
- 4°Cやiで10分間、続いて室温で15分間インキュベートするCE。 (インキュベーション時間を超えないようにしてください!)
- 各チューブに、EDTAを25mM(分子生物学グレード)を1μlを追加し、DNアーゼ-Iを不活性化するために10分間65℃でインキュベートする。
- (1反応のために)、以下のように逆転写(RT)ミックスを調製する:1μlのランダムヘキサマープライマーのストック0.2 mg / mlの、1μlのdNTPをストックを10mM、4μlの5X M-MLV-RTバッファー、2μlのDTT、0.1M、1μlのRNアーゼOUT株式40 U /μL、及び1μlのM-MLVは、株式200 U /μlのレトロトラン。
- RT-PCRの10μlを10μlのDNアーゼ-I反応チューブにミックスに追加します。
- 以下のプログラムに従って、サーマルサイクラーにおけるPCR反応を行う。
1Xサイクル:10分、25°C; 50分、37℃; 15分間、70°C - 超純水80を添加することにより5:cDNAの1に希釈する。 -20℃で保存してください。
4.2)リアルタイムPCR(定量PCR)。
- (1反応のために)、以下のように定量PCR反応ミックスを調製する:Taq DNAポリメラーゼのPを含む5μlのマスターミックスをolymerase、SYBR Green色素、PCRバッファー、dNTPミックスおよびMgCl 2(下記4.2.2を参照)。フォワードプライマー10μMの原液を、逆方向プライマー10μMの原液を、1.2μlの超純水、ステップ4.1.10に示すように、以前に希釈されたcDNA鋳型2μlの0.9μlに0.9μlの。
注:このセクションで使用されている試薬濃度、サイクリングプロトコルは、「材料および試薬一覧表」に記載された試薬と器具と特異的に行わなければ、最適化された他のブランドを使用することができるが、反応体積は、試薬濃度、サイクリングプロトコルが異なる場合があります。 RT-qPCRのを実行する前に、製造元の説明書を確認してください。 - 以下のように定量PCR機器をセットアップします。
1Xサイクル:15分、95℃
40Xサイクル:15秒、95℃1分、60℃(この時点で獲得蛍光で)が続く。
注:mRNAの相対定量のためにCt法30によればreferencE遺伝子は、Ct値の正常化のために選択する必要があります。その発現は変更になる場合がありますように、選択した参照遺伝子は、特定のアッセイ条件下でテストされるべきである; ACTB、GAPDHまたは18Sは通常、リファレンスとして選択された遺伝子のいくつかである。 - しきい値を設定し、データを分析する。
結果
舌下免疫療法は、正常肺の免疫応答を調節するために使用することができる。私たちは、フラジェリン、TLR5及びNLRC4アゴニストの単回投与は、ケモカインCXCL1、CCL20および生理食塩水処置対照と比較してサイトカインIL-6をコードするmRNAの有意なアップレギュレーションを誘導することができることを示した。 mRNAレベルの誘導倍率は、スリット後の8時間でピークに達し、20時間( 図1)の後に基礎レベルに戻ります。 SLITはS。肺炎連鎖球菌で2時間前に鼻腔内感染を行った場合しかし、CXCL1およびIL6 mRNAのレベルは、有意に非処置動物( 図2)と比較して、SLIT後においても24時間後にアップレギュレートされたままであった。
FACSによってBAL中の細胞集団および肺組織の分析は、舌下経路によりFliCで処置した動物は、気道内ではなく肺'組織( 図3)で好中球の数が増加したことが明らかになった。
最後に、肺炎球菌チャレンジ後の生存率は、以前は、舌下経路により、または対照として生理食塩水でのFliCで処置した動物に比較した。 図4に示すように、フラジェリンとSLIT、保護を促進し、急性の肺炎球菌性肺炎に対する生存を増加させた。
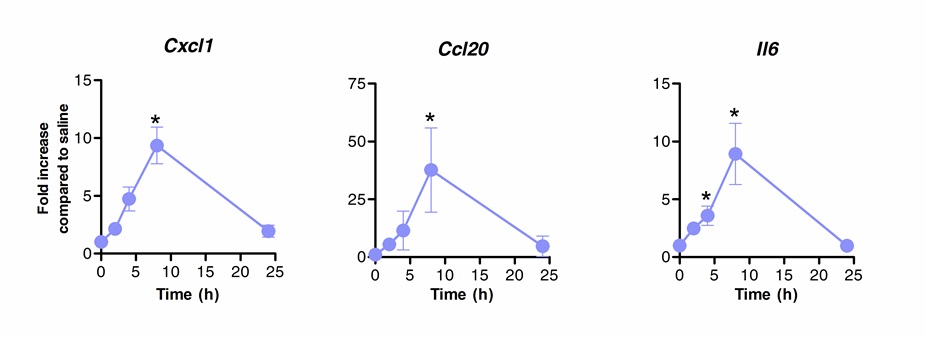
図1フラジェリンと舌下免疫療法後の肺の「転写プロファイルの動態。八〜10週齢のBALB / cマウス(n = 4)は麻酔下で舌下経路によりフラジェリンまたは生理食塩水を10μgで処理した。肺は、異なる時点で採取し、核酸の保存剤中に置いた。全RNA抽出を実施し、cDNAを合成した。 mRNAレベルはTABLに記載されている特異的なプライマーを用いてリアルタイムPCRによって評価した電子1相対的定量化は、正規化のためACTB mRNAレベルを使用したΔCt法に従って行った。結果は、中央値±SEMとして生理食塩水処置群と比較して増加倍数として示されている。アスタリスクは、マンホイットニー検定に従って計算し、統計的に有意な差(p <0.05)を示す。結果は、2つの独立した実験の代表である。
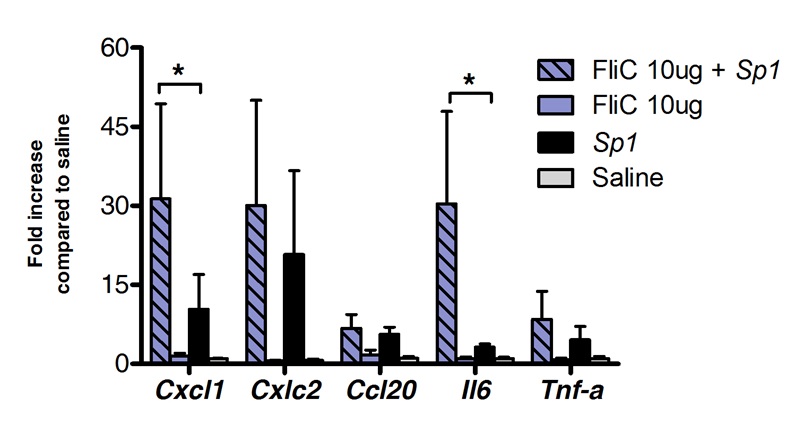
とフラジェリン。エイト10週齢のBALB / cマウス(n = 4対照群であり、n = 7処理されたグループのために) 舌下免疫療法後に肺炎球菌性肺炎の間に、図2の肺'転写プロファイルは、によってフラジェリンまたは生理食塩水を10μgで処理した麻酔下で舌下経路。 2時間後、マウス10を起こす最小致死量(MLD)を鼻腔内経路により攻撃したS.の臨床分離株の0%の死亡率4×10 5 CFU /50μlに対応する肺炎連鎖球菌血清型1 E1585、。肺は、チャレンジ後24時間後に回収し、RNA抽出およびcDNA合成を実施するまでの核酸保存剤で保存した。リアルタイムPCRを行った(表1のプライマーのリストを参照)および相対的定量化は、正規化のためACTB mRNAレベルを用い応じたΔCt法を実施した。結果は、中央値±SEMとして生理食塩水処置群と比較して増加倍数として示されている。アスタリスクは、マンホイットニー検定に従って計算し、統計的に有意な差(p <0.05)を示す。
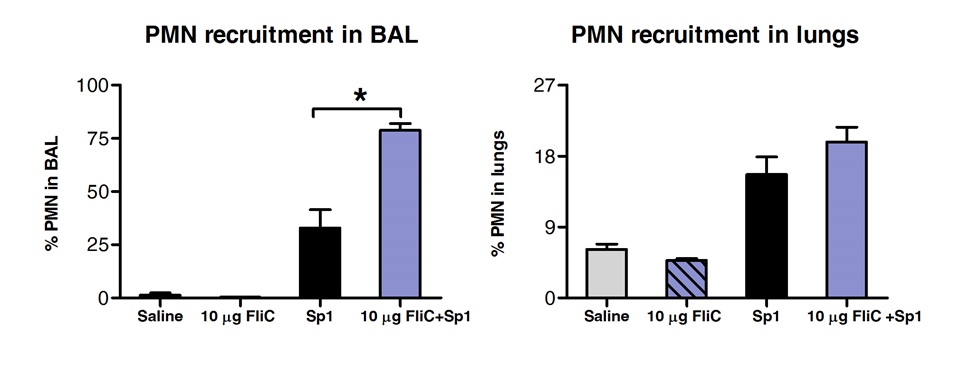
多形核好中球の図3。分析(PMN)SLIT後に肺の'組織や気道における募集。エイトへ10週齢のBALB / cマウス(N = 4)を麻酔下で舌下経路により、フラジェリンまたは生理食塩水を10μgで処理した。 2時間後、マウスにSのMLDで鼻腔内経路により攻撃した·ニューモニエ血清型1 E1585。 24時間チャレンジ後、BALを実施し、肺をFACS分析のために処理した。 PMNはLy6G 高 / CD11bの高 / CD11cの陰性細胞として同定され、FCS-SSCプロファイルに基づいていた。結果は、BALまたは肺中の全細胞数のに対して、PMNの割合として表されます。バーは、平均±SEM中央値を表す。アスタリスクは、一方向マンホイットニー検定に従って計算統計的に有意な差(p <0.05)を示す。
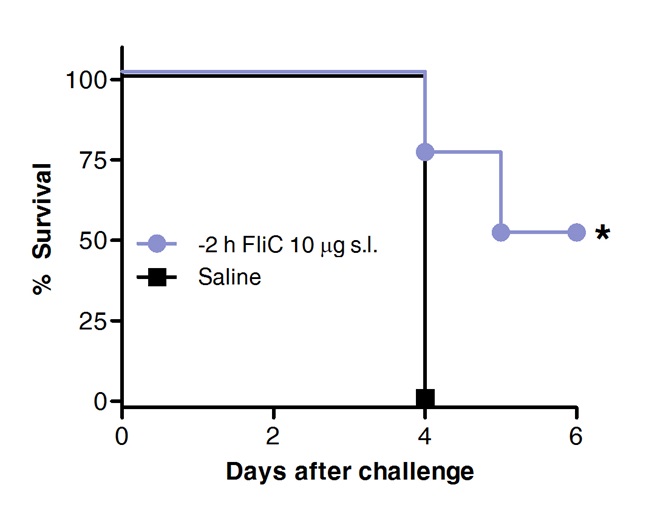
フラジェリンと図4 SLITは、急性肺炎球菌性肺炎に対してマウスを保護します。 エイト10週齢のBALB / cマウス(n = 8)に麻酔下で舌下経路により、フラジェリンまたは生理食塩水を10μgで処理した。 2時間後、マウスにSのMLDで鼻腔内経路により攻撃した·ニューモニエ血清型1 E1585。生存率は、日常的に評価した。カプラン·マイヤー曲線をログランク(マンテル·コックス)検定に従って比較した。アスタリスクは統計的に有意な差(P <0.05).Resultsは2つの独立した実験の代表であることを示す。
| 名前 | 配列5'-3 ' | PCR産物lenght(bp)の |
| MB-actin_F | GCTTCTTTGCAGCTCCTTCGT | 68 |
| MB-actin_R | CGTCATCCATGGCGAACTG | |
| mCCL20_F | TTTTGGGATGGAATTGGACAC | 69 |
| mCCL20_R | TGCAGGTGAAGCCTTCAACC | |
| mCXCL1_F | CTTGGTTCAGAAAATTGTCCAAAA | 84 |
| mCXCL1_R | ACGGTGCCATCAGAGCAGTCT | |
| MIL-6_F | GTTCTCTGGGAAATCGTGGAAA | 78 |
| MIL-6_R | AAGTGCATCATCGTTGTTCATACA | |
| mTNFalpha_F | CATCTTCTCAAAATTCGAGTGACAA | 63 |
| mTNFalpha_R | CCTCCACTTGGTGGTTTGCT | |
| mCxcl2_F | CCCTCAACGGAAGAACCAAA | 72 |
| mCxcl2_R | CACATCAGGTACGATCCAGGC |
リアルタイムPCR分析のために用いたプライマーを表1のリスト。qPCR分析のために使用される特定のプライマー配列。フォワードおよびマウスACTBのためのリバースプライマー、Cccl20、CXCL1、IL6、TNFAとCXCL1は 、5'-3 '配列として提示され、予想された生成物の長さは塩基対(bp)で示されている。
ディスカッション
治療剤の舌下投与は気道における免疫応答を調節するための有用な手段として実証されている。呼吸器疾患の治療のためのSLITの主な利点は、鼻腔内投与31に基づく治療法よりも安全である、肺や鼻孔への化合物の直接の送達を必要としないことである。
舌下免疫療法は、いずれかのアレルギー性炎症および喘息32の症状を改善するか、またはここに示されているように、急性肺感染症を治療するために先天性免疫機構の一時的活性化を誘導するために、調節応答の誘導のために、さまざまな方法で免疫応答を調節するために使用することができる。
このビデオで提示マウスモデルは、SLITための治療剤としての異なる化合物のスクリーニングのための便利な方法である。
この動物モデルは影響を決定するために有用な手段を提供肺の免疫応答、ならびに他の器官( 例えば 、リンパ節または遠位粘膜部位を排出する)in vitroモデルを使用することによって模倣することができないでSLITの。舌下免疫療法を用いて得られた結果を説明するいくつかの論文がありますが、舌下投与の手順のための詳細な方法は、まだ利用可能とされていない。さらに、モデルは、気道における全身ならびに局所防御を付与することを目的舌下ワクチンの評価のために用いることができる。
添付のビデオに示されるように、化合物の舌下投与を容易に広範囲なトレーニングを必要とせずに行うことができる簡単な手順である。一般的には、動物取扱に習熟人が、このプロトコールに記載されているように注射用麻酔薬を使用した10匹のマウスのグループにスリットを実行するために1時間が必要になります。肺炎球菌チャレンジが同様に実行される場合、追加の90分を準備する必要があります細菌懸濁液と動物の鼻腔内チャレンジを行う。
ここで紹介するのFACSプロトコルは、リンパ節だけでなく、肺の「細胞動態への影響を排液、投与ローカルサイトのSLITの影響の便利な特性評価を可能にする。
気管支コンテンツおよび肺実質の個別の分析では、組織内にとどまるものから、気道の免疫常駐し、浸潤細胞型を区別することが重要です。 BALの内容の分析は、肺胞マクロファージの代謝回転の研究だけでなく、異なる処理によって誘導された肺胞腔、 例えば 、PMNの、好酸球、単球への細胞動員のダイナミクスを可能にする。 BALはまた、酵素結合免疫吸着アッセイ(ELISA)または舌下ワクチン接種後に誘発された分泌されたIgA抗体の検出によって分泌されるサイトカインおよびケモカインの存在を評価するために使用することができる。肺の「組織に関する研究他の細胞型、古典的樹状細胞、T細胞およびB細胞の特徴付けを可能にする。
FACS分析のためのBAL試料及びリンパ節の調製は簡単である。サンプル収集の後、通常は60分〜20のサンプルについて染色プロトコルを完了するために必要とされる。対照的に、肺または舌下組織からの細胞の単離は、細胞外マトリックスの消化が必要とされるので、より多くの時間を必要とする。舌下経路により送達される治療剤の吸収は、 生体内撮像系を用いて 、蛍光または放射性標識された分子を追跡することによって対処することができる。
舌下免疫療法は効果的に呼吸器疾患を治療または予防するために使用することができ、気道ならびに全身的に免疫応答を誘導するための魅力的な方法である。スリットiの後に気道における免疫応答の寛容対活性化を決定メカニズムの解明単独でまたは別の呼吸器状態に対する利用可能な治療と組み合わせて使用することができる新たな治療戦略の合理的設計を可能にするために重要だ。
開示事項
The authors have nothing to disclose.
謝辞
We acknowledge Dr. Jean-Claude Sirard from the Center for Infection and Immunity of Lille, Institute Pasteur de Lille-France, for kindly providing the purified flagellin and Dr. Teresa Camou, Director of the National Reference Laboratory, Ministry of Health of Uruguay for kindly providing the pneumococcal strain.
The authors would like to express their acknowledgement to Mr. Diego Acosta and Mr. Ignacio Turel form BichoFeo Producciones-Uruguay for their commitment and hard work during the entire video production and edition.
This work was supported by the grants PR_FCE_2009_1_2783 and BE_POS_2010_1_2544 from the National Agency of Research and Innovation, ANII from Uruguay, the Program for Development of Basic Sciences, PEDECIBA of Uruguay and Sectoral Commission of Scientific research, CSIC-Universidad de la República, Uruguay.
資料
| Name | Company | Catalog Number | Comments |
| Ketamine solution (50 mg/ml) | Pharma Service, Uruguay | ||
| Xilacine solution (2 %) | Portinco S.A., Uruguay | ||
| Sterile 1 ml syringe | Modern, Uruguay | ||
| Sterile 27 G needle | Modern, Uruguay | ||
| RPMI 1640 | General Electric Health Care | E15885 | |
| Fetal Bovine Serum | ATCC | 302020 | |
| Penicillin/Streptomycin Solution | SIGMA | P4333 | |
| Sterile PBS without Ca2+/Mg2+ | PAA | H21002 | |
| Type-I Collagenase | Life Technologies/Gibco | 17100017 | |
| Deoxyribonuclease I (DNAse-I) | SIGMA | D4513 | |
| Dispase | Life Technologies/Gibco | 17105041 | |
| PerCP-Cy5.5 conjugated rat anti mouse IgG2b anti CD11b | BD | 550993 | Clone M1/70 |
| APC conjugated hamster anti mouse IgG1 anti CD11c | BD | 550261 | Clone HL3 |
| APC-Cy7 conjugated rat anti mouse IgG2a anti Ly6G | BD | 560600 | Clone 1A8 |
| Sterile Saline Solution | Laboratorio Farmaco Uruguayo, Uruguay | ||
| Tryptic Soy Agar | BD Difco, France | 236950 | |
| Defibrinated Sheep Blood | Biokey, Uruguay | ||
| Sterile Petri Dishes | Greiner | 633180 | |
| p10 Pipette | Gilson | F144802 | |
| p20 Pipette | Eppendorf | 3120000097 | |
| p200 Pipette | Gilson | F123601 | |
| p200 Pipette | Capp | C200 | |
| p200 Pipette | Eppendorf | 3120000054 | |
| p1000 Pipette | Eppendorf | 3120000062 | |
| Sterile Filter Tips p10 | Greiner | 771288 | |
| Sterile Filter Tips p200 | Greiner | 739288 | |
| Sterile Filter Tips p1000 | Greiner | 750288 | |
| Vortex | BIOSAN | V1-plus | |
| Stainless steel fine tip forceps | SIGMA | Z168785/Z168777 | Curved and straight |
| Dressing tissue forceps | SIGMA | F4392 | Length 8 inches |
| Micro-dissecting forceps | SIGMA | F4017 | Straight |
| Micro-dissecting forceps | SIGMA | F4142 | Curved |
| Mayo Scissors | SIGMA | Z265993 | |
| Scalpel | SAKIRA MEDICAL | ||
| Sterile Biopsy Punch Ø 3mm | Stiefel Laboratories Ltd. | 2079D | 5 mm diameter can also be used |
| Sterile 1.5 ml Tubes | Deltalab | 200400P | |
| Sterile 15 ml Tubes | Greiner | 188271 | |
| Sterile 50 ml Tubes | Greiner | 227261 | |
| Sterile serological pipettes 5 ml | Greiner | 606160 | |
| Sterile serological pipettes 10 ml | Greiner | 607160 | |
| Sterile serological pipettes 25 ml | Greiner | 760180 | |
| Biological safety cabinet, class II | Thermo Scientific | 1300 series, type A2 | |
| Micro-Isolator Rack | RAIR IsoSystem | 76144W | Super Mouse 1800 AllerZone |
| Refrigerated Microcentrifuge | Eppendorf | Legend Micro 21R | |
| Microcentrifuge | Heraeus | Biofuge-pico | |
| Centrifuge | Thermo Scientific | Sorval ST40R | |
| CO2 Incubator | Thermo Scientific | Model 3111 | |
| Sterile Thin-tip pasteur pipettes | Deltalab | D210022 | |
| Sterile pasteur pipettes | Deltalab | 200007 | |
| Sterile 24-well plate | Greiner | 662160 | |
| Trypan Blue Solution | Life Technologies | T10282 | |
| Automatic Cell Counter - Countess | Life Technologies | C10227 | |
| Countess Cell Counting Chamber Slides | Life Technologies | C10312 | |
| Flow Cytometry Tubes | BD | 343675 | |
| Flow Cytometer - FACS Canto-II | BD | ||
| Real Time PCR Instrument - Rotor Gene Q or ABI 7900 | Qiagen / Applied Biosystems | ||
| Trizol Reagent | Life Technologies | 15596-026 | Molecular Biology Grade |
| DNAse-I | Life Technologies | 18068-015 | Molecular Biology Grade |
| DNAse-I Buffer 10X | Life Technologies | 18068015 | Molecular Biology Grade |
| EDTA 25 mM | Life Technologies | 18068015 | Molecular Biology Grade |
| Ultra-Pure Water | Life Technologies | 10977 | Molecular Biology Grade |
| RNAse Out | Life Technologies | 100000840 | Molecular Biology Grade |
| Random Hexamer Primers | Life Technologies | N8080127 | Molecular Biology Grade |
| M-MLV-RT buffer | Life Technologies | 18057-018 | Molecular Biology Grade |
| M-MLV-RT enzime | Life Technologies | 28025-021 | Molecular Biology Grade |
| QuantiTect Syber Green PCR Kit | Qiagen | 204143 | Molecular Biology Grade |
| Specific primers | Life Technologies | Molecular Biology Grade |
参考文献
- Pneumococcal vaccines WHO position paper--2012. Weekly Epidemiological Record. 14, 129-144 (2012).
- Pneumonia - Facts Sheet N°331. , WHO. Available from: http://www.who.int/mediacentre/factsheets/fs331/en (2013).
- Appelbaum, P. C., et al. Carriage of antibiotic-resistant Streptococcus pneumoniae by children in eastern and central Europe-a multicenter study with use of standardized methods. Clin Infect Dis. 23, 712-717 (1996).
- Ramirez, J. A., Anzueto, A. R. Changing needs of community-acquired pneumonia. J Antimicrob Chemother. 66, 3-9 (2011).
- Cuburu, N., et al. Sublingual immunization induces broad-based systemic and mucosal immune responses in mice. Vaccine. 25, 8598-8610 (2007).
- Pedersen, G. K., et al. Evaluation of the sublingual route for administration of influenza H5N1 virosomes in combination with the bacterial second messenger c-di-GMP. PLoS One. 25, 1-12 (2011).
- Song, J. H., et al. Sublingual vaccination with influenza virus protects mice against lethal viral infection. Proc Natl Acad Sci USA. 105, 1644-1649 (2008).
- Cogo, R., Ramponi, A., Scivoletto, G., Rippoli, R. Prophylaxis for acute exacerbations of chronic bronchitis using an antibacterial sublingual vaccine obtained through mechanical lysis: a clinical and pharmacoeconomic study. Acta Biomed. 74, 76-87 (2003).
- Rosaschino, F., Cattaneo, L. Strategies for optimizing compliance of paediatric patients for seasonal antibacterial vaccination with sublingually administered Polyvalent Mechanical Bacterial Lysates (PMBL). Acta Biomed. 75, 171-178 (2004).
- Senna, G., Caminati, M., Canonica, G. W. Safety and tolerability of sublingual immunotherapy in clinical trials and real life. Curr Opin Allergy Clin Immunol. 13, 656-662 (2013).
- Mascarell, L., et al. Oral dendritic cells mediate antigen-specific tolerance by stimulating TH1 and regulatory CD4+ T cells. J Allergy Clin Immunol. 122, 603-609 (2008).
- Mascarell, L., et al. Mapping of the lingual immune system reveals the presence of both regulatory and effector CD4+ T cells. Clin Exp Allergy. 39, 1910-1919 (2009).
- Mascarell, L., et al. Oral macrophage-like cells play a key role in tolerance induction following sublingual immunotherapy of asthmatic mice. Mucosal Immunology. 4, 638-647 (2011).
- Hervouet, C., et al. Antigen-bearing dendritic cells from the sublingual mucosa recirculate to distant systemic lymphoid organs to prime mucosal CD8 T cells. Mucosal Immunology. 7, 280-291 (2014).
- Munoz, N., et al. Mucosal administration of flagellin protects mice from Streptococcus pneumoniae lung infection. Infect Immun. 78, 4226-4233 (2010).
- Hayashi, F., et al. The innate immune response to bacterial flagellin is mediated by Toll-like receptor 5. Nature. 410, 1099-1103 (2001).
- Lightfield, K. L., et al. Critical function for Naip5 in inflammasome activation by a conserved carboxy-terminal domain of flagellin. Nature Immunology. 9, 1171-1178 (2008).
- Lightfield, K. L., et al. Differential requirements for NAIP5 in activation of the NLRC4 inflammasome. Infect Immun. 79, 1606-1614 (2011).
- Honko, A. N., Mizel, S. B. Mucosal administration of flagellin induces innate immunity in the mouse lung. Infect Immun. 72, 6676-6679 (2004).
- Janot, L., et al. Radioresistant cells expressing TLR5 control the respiratory epithelium's innate immune responses to flagellin. Eur J Immunol. 39 (6), 1587-1596 (2009).
- Van Maele, L., et al. TLR5 signaling stimulates the innate production of IL-17 and IL-22 by CD3(neg)CD127+ immune cells in spleen and mucosa. J Immunol. 185, 1177-1185 (2010).
- Lee, S. J., et al. Neurologic adverse events following influenza A (H1N1) vaccinations in children. Pediatrics international: official journal of the Japan Pediatric Society. 54, 325-330 (2012).
- Lewis, D. J., et al. Transient facial nerve paralysis (Bell's palsy) following intranasal delivery of a genetically detoxified mutant of Escherichia coli heat labile toxin. PLoS One. 4, e6999(2009).
- Mutsch, M., et al. Use of the inactivated intranasal influenza vaccine and the risk of Bell's palsy in Switzerland. N Engl J Med. 350, 896-903 (2004).
- Kuo, C. H., Wang, W. L., Chu, Y. T., Lee, M. S., Hung, C. H. Sublingual immunotherapy in children: an updated review. Pediatr Neonatol. 50, 44-49 (2009).
- Nempont, C., Cavet, D., Rumbo, M., Bompard, C., Villeret, V., Sirard, J. C. Deletion of flagellin's hypervariable region abrogates antibody-mediated neutralization and systemic activation of TLR5-dependent immunity. J. Immunol. 181, 2036-2043 (2008).
- Pathogen Regulation Directorate, Public Health Agency of Canada . Streptococcus pneumoniae: Pathogen Safety Data Sheet - Infectious Substances. , Available from: http://www.phac-aspc.gc.ca/lab-bio/res/psds-ftss/streptococcus-pneumoniae-eng.php (2011).
- Marques, J. M., et al. Protection against Streptococcus pneumoniae serotype 1 acute infection shows a signature of Th17- and IFN-gamma-mediated immunity. Immunobiology. 217, 420-429 (2012).
- Stewart, C. C., Stewart, S. J., et al. Titering antibodies. Current Protocols in Cytometry. 4, Unit 4.1(2001).
- Kubista, M., et al. The real-time polymerase chain reaction. Molecular Aspects of Medicine. 27, 95-125 (2006).
- Pedersen, G., Cox, R. The mucosal vaccine quandary: intranasal vs. sublingual immunization against influenza. Human Vaccines & Immunotherapeutics. 8, 689-693 (2012).
- Vitaliti, G., et al. Mucosal immunity and sublingual immunotherapy in respiratory disorders. Journal of Biological Regulators and Homeostatic Agents. 26, S85-S93 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved