このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
電界誘起リリースおよび測定によるエキソソームのバイオマーカーの検出(EFIRM)
Erratum Notice
要約
Exosomes are microvesicular structures found within biofluids that potentially carry important disease discriminatory biomarkers. Here, a novel method is used to specifically extract exosomes and rapidly test the exosomal cargo for both RNA/protein targets following the disruption of exosomes using non-uniform electric cyclic square waves.
要約
エキソソームは、細胞間コミュニケーションにおける仲介の役割を果たして微小胞構造体である。彼らは病気差別バイオマーカーを運ぶかどうかを決定するエキソソームの内部の貨物を研究するために重要である。エキソソーム分析を行うためには、内部コンテンツに損傷を与えることなく、標的生体液からエキソソームを抽出し、分析するための方法を開発する必要がある。
電界誘起放出および測定(EFIRM)は、特に、生体液からのエキソソームを抽出し、その積荷を降ろして、その内部RNA /タンパク質含有量を試験するための方法である。抗ヒトCD63特異的抗体磁性微粒子を用いて、エキソソームは、まず生体液から沈殿させる。抽出後、低電圧電気サイクリック方形波(CSW)は、小胞膜を破壊し、貨物搬出を引き起こすために適用される。エキソソームの内容は、資格でのために電極表面上に固定化されたDNAプライマーまたは抗体とハイブリダイズさせる分子コンテンツのntification。
EFIRM方法は、エキソソームを抽出し、溶解緩衝液なしの分析のために貨物をアンロードするために有利である。この方法は、エキソソームの両方のRNA及びタンパク質バイオマーカー標的の特異的な検出を行うことができる。サイズベースの技術とは対照的にEFIRMは、具体的には、それらの表面マーカーに基づいて、エキソソームを抽出する。
透過型電子顕微鏡(TEM)およびアッセイは、エキソソームキャプチャおよび分析のための方法の機能性を実証する。 EFIRM法は、生理食塩水コントロールを受けた11匹のマウスに対して彼らエキソソームプロファイルをテストするために、ヒト肺癌H640細胞を注射した9匹のマウス(エキソソームマーカー、ヒトCD63-GFPを発現するようにトランスフェクト細胞株)の分析をエキソソームに適用した。エキソソームのバイオマーカーのレベルの上昇(参照遺伝子GAPDHおよびタンパク質表面マーカーのヒトCD63-GFP)は、H640の両方の血清および唾液サンプルをマウスに注射するために見出された。さらに、SalIでvaの血清試料を、直線性(R = 0.79)を有することが実証された。これらの結果は、遠位疾患の検出のための唾液エキソソームのバイオマーカーの生存のために示唆している。
概要
エキソソーム研究は、RNA 1、DNA 2、およびタンパク質3貨物を運ぶ脂質微小胞を調べ、調査の新興分野である。エキソソーム生物学の以前の研究は、血液4、尿5、母乳6、および唾液7などの生体液中のエキソソームの同定につながった。研究では、遠隔体8の異なるシステム間の通信を瞑想、エキソソームは、異なる細胞経路に役割を果たすことが実証されている。ロールのエキソソームは細胞間コミュニケーションにおいて役割を果たすので、それらは疾患状態と相関して生体分子標的(タンパク質、RNA、およびDNA)をパッケージ化することができると仮定される。 インビトロ 3および動物モデル9の研究は、この仮説を裏付けるように見える。バイオマーカー発見のためのエキソソームコンテンツを調査において、それは生体液から選択エキソソームを単離するための方法論を開発することが必要である、誘起expulsiエキソソームからの貨物、およびエキソソーム生体分子の定量化の上で。この作業の範囲では、エキソソームは、構造体は、約70~100ナノメートルの直径を有し、表面マーカーCD63を有するとして定義される。
研究者は、通常、最初の超遠心分離10によってエキソソームを精製した後、溶解バッファーキットの使用を通じてエキソソームコンテンツを処理する。溶解緩衝液法の使用は、数分から時間の範囲のインキュベーション時間を必要とする。このプロセスは、潜在的にエキソソーム貨物を害する劣化をサンプリングする可能性がある。例えば、周囲の細胞外環境への溶解緩衝液を介して放出唾液エキソソームRNAは、エキソソームRNA溶解後の測定が安定化試薬11を添加せずに、特に困難な作業バッファ作る、1分間の下での半減期を有している。溶解および安定化のための様々な試薬を加えるの配合効果が複雑にエージェントを導入し、ANALYを妨害する可能性がエキソソームコンテンツのSIS。別のアプローチは、迅速にエキソソームコンテンツをアンロードし、安全に特徴づけのために貨物を保持するのに役立つことができる。
本研究では、エキソソーム内容物の放出のために不均一な電界の使用を提案する。電気フィールドが分極し、細胞膜を構成する脂質二重層を破壊する能力を運ぶことが知られている。私たちの実験的な作品は、エキソソームの微小胞の構造を破壊し、運ば貨物を解放するために、不均一な周期的な方形波(CSW)の使用方法を探ります。この方法は、ほとんどの生体分子が中断されないことを意味し、数百ミリボルトの範囲で電圧を使用しています。我々は、環状方形波の使用は、周囲の流体環境に唾液エキソソームのmRNA内容物の放出を作動することができることを実証する。エキソソームコンテンツのこのリリースは、シームレスに、バイオマーカーの発現レベルを定量するために使用することができ、電極システムに統合されている12,13。この提案された方法は、エキソソームコンテンツの迅速、高感度、および溶解バッファー無料で分析することができます。

EFIRMワークフロー図1.概要。。EFIRM法が広くエキソソームを精製し、分析するために必要な三つの主要段階に分けられる。
このCSWベースエキソソームコンテンツ放出および分析方法は、エキソソームを単離するためのCD63特異的磁気ビーズと組み合わせて使用される。これらのCD63-親和性ビーズは、唾液サンプル(および他の生体液)からのエキソソームの選択的な単離を可能に。インキュベーションおよび磁化ビーズを使用してエキソソームの抽出に続いて、ビーズは、 図1を参照 。内容物の放出実験の分析部をベースCSWための電気化学センサーシステムに移行作業の概要を示しているEFIRM方法のフローチャート。
プロトコル
1.磁気ビーズベースのエキソソームの抽出
- ビーズを再懸濁し微小遠心管にリン酸緩衝生理食塩水(PBS)バッファーの495μlの中にストレプトアビジン被覆磁性微粒子を5μlのよく混合溶液をピペットで。磁気ラックを使用して3回洗浄し、500μlのPBSでビーズを懸濁します。ラックは、サンプル微小遠心管を保持することができる収納部側の磁石のアレイである。
- 各洗浄のために、最初のチューブは1分間のラックの上に座るし、その後慎重にビーズを乱すことなく上澄み液を除去するためのピペットチップを使用してみましょう。
- 側の磁石せずに定期的なラックにチューブを置きます。チューブに500μlのPBSを追加し、一緒に解決し、ビーズを混合するために、ピペットを使用しています。その後、再び溶液からビーズを分離するための磁気ラック上に戻ってチューブを置く。
- PBS aの磁化と再懸濁を介してバッファのこの削除を実行します合計3回。これは、磁性粒子の最初の洗浄を行います。
- 磁気ラックの非磁化部分に配置されたチューブを、PBS緩衝液490μlの中にビーズを再懸濁する。ビーズの混合物中に1.0 mg / mlのストック濃度でビオチン化マウス抗ヒトCD63抗体のピペットで5μL。溶液中のビーズと抗体を混合するためにピペットを使用してください。
- サンプル回転子上のビーズとビオチン化抗体混合物を用いてマイクロチューブを置きます。 5秒間傾けると1秒間5℃で振動90°で相互の回転のためのサンプル回転子のための回転子のパラメータを設定します。 RTで30分間、これらのパラメータでサンプル·ビーズ混合管を回転させます。
- 共役した後、未結合抗体を除去する。
- RTで回転の30分に続いて、5分間のバック磁気ラック内のチューブを配置します。
- マイクロピペットを用いて、液相を除去することにより、ビーズの3回の洗浄を行い、500μで洗浄、PBSのリットル。トリプル洗浄後、490カゼイン-PBSのμLとラックの磁化されていない部分に所定の位置にビーズを再懸濁します。
- 抗体コートビーズを使用したエキソソーム抽出。
- ターゲットを絞ったサンプルIDを各チューブにラベルを付けます。マイクロ遠心チューブに血清または唾液10μlのサンプルをピペットで。数回ピペッティングしてサンプルとした磁気ビーズを混合するためにピペットを使用してください。
- ローテーター上のサンプルと抗ヒトCD63抗体ビーズを有する管を配置し、室温で2時間回転させる。ステップ1.2で説明したのと同じ回転子パラメータを使用してください。
- 回転サンプルの2時間に続いて、溶液からビーズを分離するために磁化するマイクロピペットで液相を除去し、トリス塩酸緩衝液500μlでビーズを再懸濁することにより、トリプル洗浄を行う。結果として得られるビーズは今エキソソームに結合させ、電界放出および測定のための準備ができているされている。
2.電界誘起リリースNDエキソソーム量の測定
- GADPHプライマーを有する電極の初期のプレコーティング
- プラスチックウェルに個別電極の交差汚染を防ぐために電極アレイを適用する。この実験では、裸の金製の作業、カウンタ、および基準電極からなるアレイ内のそれぞれの単位電極16センサ電極アレイを使用する。
- 超純蒸留水でチューブに株式試薬をピペッティングすることにより100 nMのDNAプローブ、0.3 MのKCl、および10mMのピロールの原料混合物を準備します。ボルテックスで完全に混合。
注:この研究のために選択されたDNAプローブは、エキソソーム内に存在することが知られているGAPDHを参照遺伝子に対応する。使用したプローブ配列は5'-ビオチンAGGTCCACCACTGACACGTTG-3 '。すべての電極上でこの混合物を使用してください。 - ピペットで各金電極の表面にモノマー-DNAプローブ混合物を60μl。作業、cは適切な範囲があることを保証するために電極を調べる液体混合物によるounter、及び基準電極。
- Electropolymerizeモノマープローブの混合物は、電極表面に周期的な方形波(CSW)電界プロファイルを適用することにより、電極表面上に導電性高分子層を作成する。この電界は9秒350 mVのを適用すると、すぐに1秒間950 mVのへの切り替えで構成されています。印加電界の100秒、合計10サイクルの電極は、この環状の方形波プロファイルを適用する。
- 電極の表面から液体を除去するために蒸留水および窒素ガスで乾燥して、センサ表面を3回すすぐ。液体が適切に電極から削除されていることを確認してください。
- エキソソーム貨物アンロード
- ビーズ - エキソソーム複雑な混合物の495μLにロード検出プローブの1μMの5μlのと混合するピペットを使用しています。
注記:検出プローブは、3 '末端にフルオレセイン分子に結合DNAプライマー配列である。検出器PROBこの研究のために使用される電子シーケンスはエキソソーム内にあるGAPDH mRNAに対応している。フルオレセイン結合検出プローブの配列は以下のとおりである:5'-GCAGTGGGGACACGGAAGGCC-フルオレセイン-3 '。 - ピペットの下に磁石アレイと金電極表面へのプローブとビーズ - エキソソーム複雑な混合物60μlの。この磁石アレイは、センサの作用電極に対応するように整列16 2.54ミリメートルの直径のネオジム磁石で構成されています。 図2(a)は、磁石とビーズエキソソームソリューションの配置を示している。
- サンプルは電極表面にロードされると、-300 Mvで9秒、200 MV(200秒の合計)で1秒でCSW電界の20サイクルを適用します。解放されるエキソソーム貨物は電極の表面にプライマーにハイブリダイズするであろう。エキソソームの表面マーカーは、調査の対象である場合、実験のこの部分をスキップする。 図2Bは、このプロセスを示している。 <李>ウォッシュオフ三重蒸留水で電極表面を洗浄することにより、電極表面に結合していない分析物。窒素ガスで電極を乾燥させる。
- ビーズ - エキソソーム複雑な混合物の495μLにロード検出プローブの1μMの5μlのと混合するピペットを使用しています。
- レポーター抗体および読み出し
- (:1,000希釈1にHRP)カゼイン/ PBSで希釈した西洋ワサビペルオキシダーゼに結合し150単位/ mlの抗フルオレセイン抗体60μlのを追加します。
- プローブサンドイッチに複雑な抗フルオレセインHRPに電界駆動型共役を使用してください。電極表面に5サイクルのために1秒1秒、500 mVのために-200 mVのを適用します。 図2(a)は、タンパク質および核酸システムの両方のための捕捉および検出プローブ複合体を示しています。
- 蒸留水と窒素ガスとの乾燥を使用してトリプル洗浄センサー表面。
- 未結合の過剰抗フルオレセイン抗体の洗浄除去に続いて、3,3 '、5,5'-テトラメチルベンジジン(TMB)基質の60μlを添加する。マルチチャンネルピペットを使用して、各センサー表面上に、この基板をロードします。
- 16チャネルの同時測定が可能な電気化学ポテンショスタットを用いて60秒間-200 Mvで電極電流を測定することにより、現在の電流測定読み出しを実行します。 図2Cは、読み出し時の電流プロファイルの一例である。
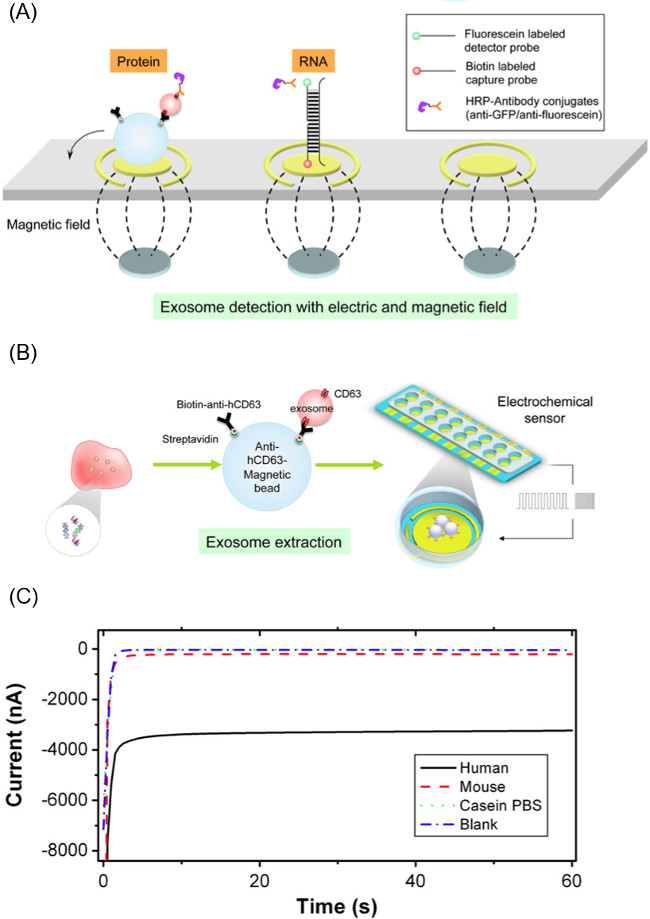
EFIRM法の図2のコンポーネント。(A)抗ヒトCD63被覆した磁性微粒子を使用して、生体液からエキソソームを抽出した後、粒子-エキソソーム複雑に適用される周期的な方形波を用いたエキソソーム貨物をアンロードする方法。解放エキソソームからRNA / DNA /タンパク質標的を検出するために使用される電極バイオセンサーの(B)のスキーム。 (C)より大きい電流の大きさをtに対応EFIRM法、電流測定からの読み出しの代表例生体分子のより高いレベルoをこの図は、Wei らからである。14 この図の拡大版をご覧になるにはこちらをクリックしてください。
結果
TEMを用いてビーズのエキソソームキャプチャの検証
抗ヒトCD63磁気ビーズを使用して、唾液からのエキソソームの単離は、透過型電子顕微鏡(TEM)画像を用いて抽出プロトコールに従って検証した。 TEMはすぐに、( 図3A、および3B参照 )は、隣接するエキソソームの既知のプロファイルと一致して70〜100 nmの顆粒とした磁気ビーズを...
ディスカッション
結果が示すように、抗ヒトCD63被覆した磁性ナノ粒子は、具体的には70〜100ナノメートルの範囲のサイズを有する小さな粒子を捕捉することができる。この捕獲粒子は、エキソソームの以前に観察されたプロファイルと一致している。さらに、粒子の捕捉以下の低電圧CSWの使用は、ビーズ表面から削除し、貨物放出のための伝統的な溶解緩衝液ベースの方法と類似のDNAの分解プロフィールを引?...
開示事項
デビッド·ウォンはRNAmeTRIX社、分子診断会社の共同創設者である。 PeriRx LLCはRNAmeTRIXから分子診断に関連する知的財産のサブライセンス。デビッド·ウォンはPeriRxにコンサルタントです。
謝辞
この作品は、(FW)のグラントUL1TR000124を通じて、トランスレーショナル科学、国立衛生研究所を進めるための研究資源のための国立センター、国立センターによってサポートされていました。フェリックス&ミルドレッド·イップ寄附教授職と(DTWWへ)バーンズファミリー基金、(MT)の賞数T90DE022734下の国立衛生研究所の歯科·頭蓋顔面研究所研究所。内容はもっぱら著者の責任であり、必ずしも国立衛生研究所の公式見解を示すものではありません。
資料
| Name | Company | Catalog Number | Comments |
| Helios 16-Channel Reader System with Chip Interface | Genefluidics, USA | RS-1000-16 | |
| 16x Sensor Chip, Bare Gold, pack of 5 chips | Genefluidics, USA | SC1000-16X-B | |
| Biotinylated anti-human CD63 Antibody | Ancell, USA | 215-030 | |
| Dynabeads MyOne Streptavidin T1 | Invitrogen, USA | 65601 | |
| Neodynium Magnetics (1/10" dia. x 1/32" thick) | K&J Magnetics, USA | DH101 | |
| Ultrapure Distilled Water | Life Technologies, USA | 10977-023 | |
| Mettler Toldeo 3 M KCl Solution | Fisher Scientific, USA | 1911512 | |
| Pyrrole | Sigma-Aldrich, USA | W338605-100g | |
| Anti-Fluorescein-POD, Fab fragments | Roche, Germany | 11426346910 | |
| 3,3′,5,5′-tetramethylbenzidine substrate (TMB/H2O2, low activity) | Neogen, Usa | 330175 | |
| Phosphate Buffered Saline Solution | Life Technologies, USA | 10010023 | |
| Casein/PBS | Fisher Scientific, USA | 37532 |
参考文献
- Rabinowits, G., Gerçel-Taylor, C., Day, J. M., Taylor, D. D., Kloecker, G. H. Exosomal MicroRNA: A Diagnostic Marker for Lung Cancer. Clinical Lung Cancer. 10 (1), 42-46 (2009).
- Thakur, B. K., et al. Double-stranded DNA in exosomes: a novel biomarker in cancer detection. Cell Research. 24 (6), 766-769 (2014).
- Lau, C. S., Wong, D. T. W. Breast Cancer Exosome-like Microvesicles and Salivary Gland Cells Interplay Alters Salivary Gland Cell-Derived Exosome-like Microvesicles In. Vitro. PLoS ONE. 7 (3), e33037 (2012).
- Bala, S., et al. Circulating microRNAs in exosomes indicate hepatocyte injury and inflammation in alcoholic, drug-induced, and inflammatory liver diseases. Hepatolog. 56 (5), 1946-1957 (2012).
- Dear, J. W., Street, J. M., Bailey, M. A. Urinary exosomes: A reservoir for biomarker discovery and potential mediators of intrarenal signalling. Proteomics. 13 (10-11), 1572-1580 (2013).
- Lässer, C., et al. Human saliva, plasma and breast milk exosomes contain RNA: uptake by macrophages. Journal of Translational Medicine. 9 (1), 9 (2011).
- Palanisamy, V., et al. Nanostructural and Transcriptomic Analyses of Human Saliva Derived Exosomes. PLoS ONE. 5 (1), e8577 (2010).
- Camussi, G., et al. Exosomes/microvesicles as a mechanism of cell-to-cell communication. Kidney International. 78 (9), 838-848 (2010).
- Lau, C., et al. Role of pancreatic cancer-derived exosomes in salivary biomarker development. The Journal of Biological Chemistry. 288 (37), 26888-26897 (2013).
- Théry, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and Characterization of Exosomes from Cell Culture Supernatants and Biological Fluids. Current Protocols in Cell Biology. 3 (22), (2001).
- Park, N. J., Li, Y., Yu, T., Brinkman, B. M. N., Wong, D. T. Characterization of RNA in Saliva. Clinical Chemistry. 52 (6), 988-994 (2006).
- Wei, F., et al. Bio/Abiotic Interface Constructed from Nanoscale DNA Dendrimer and Conducting Polymer for Ultrasensitive Biomolecular Diagnosis. Small. 5 (15), 1784-1790 (2009).
- Wei, F., et al. Electrochemical Sensor for Multiplex Biomarkers Detection. Clinical Cancer Research. 15 (13), 4446-4452 (2009).
- Wei, F., Yang, J., Wong, D. T. W. Detection of exosomal biomarker by electric field-induced release and measurement (EFIRM). Biosensors and Bioelectronics. 44, 115-121 (2013).
Erratum
Formal Correction: Errata: Detection of Exosomal Biomarker by Electric Field-induced Release and Measurement (EFIRM)
Posted by JoVE Editors on 1/01/1970. Citeable Link.
An erratum was issued for Detection of Exosomal Biomarker by Electric Field-induced Release and Measurement (EFIRM). The disclosures were updated.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved