Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Elektrik Alan-kaynaklı Release ve Ölçme (EFIRM) tarafından Exosomal Biomarker Algılama
Bu Makalede
Erratum Notice
Özet
Exosomes are microvesicular structures found within biofluids that potentially carry important disease discriminatory biomarkers. Here, a novel method is used to specifically extract exosomes and rapidly test the exosomal cargo for both RNA/protein targets following the disruption of exosomes using non-uniform electric cyclic square waves.
Özet
Eksozomlar arası iletişimde bir aracı rolü mikroveziküler yapılardır. Onlar hastalık ayrımcı biyomarkerlar taşımak olmadığını belirlemek için eksozom iç kargo incelemek için ilgi olduğunu. Exosomal analizinin yapılması için, ayıklanması ve iç içeriği zarar vermeden hedef Biofluids gelen eksozomlar analiz etmek için bir yöntem geliştirilmesi gerekmektedir.
Elektrik alan ile indüklenen salma ve ölçüm (EFIRM) özel olarak, Biofluids gelen eksozomlar açılan kendi yük boşaltma ve iç RNA / protein içeriği test etmek için bir yöntemdir. Bir anti-insan CD63 özgü antikor manyetik mikropartikül kullanarak, eksozomlar ilk Biofluids çökeltilir. Aşağıdaki çıkarma, düşük voltajlı elektrik siklik kare dalgalar (CSW) veziküler membran bozabilir ve kargo boşaltma neden uygulanır. eksozom içeriği nereye için bir elektrot yüzeyi üzerinde hareketsiz DNA primerleri veya antikorlar hibridize edilirMoleküler içeriğin ntification.
EFIRM yöntemi liziz tamponu olmayan analizi için eksozom ekstre ve boşaltılması için avantajlıdır. Bu yöntem, eksozom hem RNA ve protein biyomarker hedeflerin belirli bir algılama gerçekleştirme yeteneğine sahiptir. Boyut-tabanlı teknikler aksine EFIRM özellikle yüzey belirteçleri dayalı eksozomlar ayıklar.
Transmisyon elektron mikroskopisi (TEM) ile tahlil eksozom yakalama ve analiz için bir yöntem işlevselliğini gösterir. EFIRM yöntem, insan akciğer kanseri H640 hücreleri enjekte 9 farelerin analizi tuzlu kontrolleri alan 11 fareden karşı eksozom profili test etmek için (eksozom işaretleyici insan CD63, GFP ifade eden transfekte edilmiş bir hücre hattı) exosomal uygulandı. Exosomal biyobelirteçlerinin Artmış düzeyleri (referans gen GAPDH ve protein yüzey işaretleyici insan CD63-GFP) H640 hem serum ve tükürük örneklerinde fareler enjekte bulunamadı. Ayrıca Saliva ve serum numuneleri doğrusallık (R, = 0.79) sahip olduğu gösterilmiştir. Bu sonuçlar uzak hastalıkların tespiti için tükürük eksozom biyobelirteçlerinin canlılığı düşündürür.
Giriş
Exosome araştırma RNA 1, DNA 2, ve protein 3 kargo taşıyan lipit microvesicles inceleyen bir araştırma ortaya çıkan bir alandır. Eksozom biyoloji Önceki araştırmalar, kan 4, idrar 5, anne sütü 6 ve tükürük 7 gibi Biofluids içinde eksozom belirlenmesine yol açmıştır. Çalışmalar uzaktan gövdenin 8 farklı sistemler arasında iletişimi meditating, eksozomlar farklı hücresel yolların bir rol oynadığını göstermiştir. Rolü eksozomlar hücrelerarası iletişimi oynamak için, onlar hastalık durumları ile ilişkili biyomolekülün hedefleri (protein, RNA ve DNA) paket olabileceği düşünülebilir. In vitro 3 ve hayvan modeli 9 çalışmalar bu hipotezi doğrular görünmektedir. Biyomarkır keşif için exosomal içerik araştıran, bu Biofluids seçici eksozom izolasyonu için bir metodoloji geliştirmek için gerekli olan, uyarılan expulsieksozom gelen kargo ve eksozom biyomoleküllerin miktarının on. Bu çalışmanın kapsamında, eksozomlar bir yapı yaklaşık 70-100 nm arasında bir çapa sahip olan ve yüzey işaretleyici CD63 sahip olarak tarif edilecektir.
Araştırmacılar genellikle ilk Ultrasantrifügasyon 10 ile eksozomlar arındırmak ve daha sonra lizis tamponu kitleri kullanımı yoluyla exosomal içeriğini işlemek. Liziz tamponu yöntemlerin kullanımı dakika saat arasında değişen bir bekleme süresi gerektirir. Bu süreç, potansiyel eksozom kargo zarar ve bozulmasını örnek yol açabilir. Örnek olarak, çevreleyen hücre dışı ortama liziz tamponu üzerinden serbest tükürük eksozom RNA exosomal RNA sonrası liziz ölçümü stabilizasyon tepkin 11 eklenmeden özellikle zor bir görev tampon hale 1 dakika altında bir yarı ömre sahip bulunmaktadır. lizis ve istikrar için çeşitli reaktifler ekleyerek bileşik etkisi komplike ajanları tanıtmak ve analı müdahale edebilirexosomal içeriğinin sis. Alternatif bir yaklaşım, hızlı bir şekilde exosomal içeriği boşaltma ve güvenli bir şekilde tanımlanması için yük korunması için yararlı olabilir.
Bu çalışmada, exosomal içeriğin salınımı için bir tek biçimli olmayan elektrik alanının kullanımını önermektedir. Elektrikli alanları polarize ve hücre zarlarını oluşturan lipid çift bozma yeteneği taşımak için bilinmektedir. Bizim deneysel çalışmalar eksozomlann microvesicle yapısının bozulması ve taşınan kargo serbest bırakılması için düzgün olmayan siklik kare dalgalar (CSW) kullanımını araştırıyor. Bu yöntem en biyomoleküllerin kesintiye olmayacak anlamına birkaç yüz milivolt aralığında gerilimleri kullanır. Bir siklik kare dalga kullanımı çevreleyen akışkan ortama tükürük eksozom mRNA içeriği serbest harekete geçirmek için mümkün olduğunu göstermektedir. Exosomal içeriğin Bu sürüm, sorunsuz bir şekilde biyomarker ekspresyon seviyelerini ölçmek için kullanılabilecek bir elektrot sistemi ile entegre 12,13.. Önerilen bu yöntem, eksozom içeriğinin hızlı, hassas ve parçalama tamponu ücretsiz analiz sağlar.

EFIRM İş Akışı 1. Genel Bakış Şekil.. EFIRM yöntemi geniş arındırıcı ve analiz eksozom için gerekli olan üç ana evreye ayrılır.
Bu SSG göre exosomal içeriği serbest bırakılması ve analiz yöntemi eksozom izolasyonu için CD63 spesifik manyetik mikro ile bağlantılı olarak kullanılır. Bu CD63-afinite taneleri tükürük örnekleri (ve diğer Biofluids) için eksozom seçici izolasyonu için izin verir. İnkübasyon ve manyetize boncuklar kullanarak eksozom çıkarılması ardından, boncuk Şekil 1. Içerik salınımını ve deney analizi bölümünü tabanlı CSW için elektrokimyasal sensör sistemi göç işin bir bakış verir edilirEFIRM yöntemi akar.
Protokol
1. Manyetik Boncuk-tabanlı Exosome Ekstraksiyon
- Boncuklar yeniden askıya almak için bir mikrosantrifüj tüpü içinde, fosfat tamponlu tuzlu su (PBS), tampon 495 ul içinde Streptavidin-kaplı manyetik mikro 5 ul iyi karıştırılmış solüsyonu pipetle. Manyetik bir raf kullanarak üç kez yıkanır ve 500 ul PBS ile yeniden süspanse boncuklar. raf örnek mikrosantrifüj tüpleri tutabilecek bir konut ünitesi tarafında mıknatıs bir dizidir.
- Her yıkamadan için, ilk tüpler 1 dakika rafa oturup, ve daha sonra dikkatlice boncuk bozmadan süpernatant tampon kaldırmak için bir pipet kullanın izin.
- Tarafında mıknatıslar olmadan düzenli bir rafa tüpleri yerleştirin. Tüplerin içine PBS 500 ul ekleyin ve birlikte çözüm ve boncuk karıştırmak için pipet kullanın. Sonra tekrar solüsyon gelen boncuk ayırmak için manyetik rafa geri tüpleri koymak.
- PBS a mıknatıslanma ve tabanda yoluyla tampon bu kaldırma gerçekleştirinüç kez toplam. Bu manyetik parçacıkların bir ilk yıkama yapar.
- Manyetik rafın olmayan manyetize edilmiş bölümü üzerine yerleştirilen bir tüp ile, PBS tamponu 490 ul içine boncuk yeniden süspanse edin. Pipet boncuk karışımı içine 1.0 mg / ml stok konsantrasyonunda biyotinile fare anti-insan CD63 antikoru 5 ul. Çözelti içinde, boncuk ve antikor karışımı pipet kullanın.
- Örnek karıştırıcı üzerine boncuk ve biyotinile antikor karışımı ile mikrosantrifüj tüpleri yerleştirin. 90 ° 5 saniye eğerek ve 1 saniye 5 ° titreşimli de karşılıklı dönüş için örnek rotator için rotator parametrelerini ayarlayın. Oda sıcaklığında 30 dakika için bu parametrelerin numune boncuk karışımı tüpleri döndürün.
- Konjugasyon sonra bağlanmamış antikor çıkarın.
- Oda sıcaklığında dönme, 30 dakika sonra, 5 dakika boyunca geri manyetik rafa tüpleri.
- Bir mikropipet kullanılarak sıvı faz kaldırarak boncuk üç yıkar gerçekleştirin ve 500 μ ile yıkayın; PBS l. Üçlü yıkamadan sonra, raf manyetize kısmına 490 kazein-PBS ul ve yerine boncuk tekrar süspansiyon.
- Antikor kaplı boncuklar kullanılarak exosome çıkarma.
- Hedeflenen örnek kimliği ile her tüp etiketleyin. Mikrosantrifüj tüpe serum veya tükürük 10 ul örnek Pipet. Birkaç kez pipet kullanılarak örneğini ve manyetik boncuk karışımı pipet kullanın.
- Döndürücü üzerine numune ve anti-insan CD63 antikoru boncuk tüpleri ve oda sıcaklığında 2 saat boyunca döner. Aşama 1.2 'de tarif edildiği gibi aynı döndürücü parametreleri kullanın.
- Döner örnek 2 saat sonra, çözelti ayrı tanelerine mıknatıslanma mikropipet ile sıvı faz ayrılması ve Tris-HCI tampon maddesinin 500 ul boncuk resuspending üçlü yıkama yapar. Elde edilen boncuklar artık eksozom bağlı ve elektrik alan serbest bırakılması ve ölçüm için hazırız.
2. Elektrik Alan Bağlı Çıkış birnd Exosomal İçerik Ölçümü
- GADPH Astar ile Elektrot İlk ön kaplamaya tabi tutulması
- Bir plastik de bireysel elektrotların çapraz bulaşmayı önlemek için bir elektrot dizisi uygulayın. Bu deney için, çıplak altından yapılmış bir çalışma, sayaç ve referans elektrot oluşan dizideki her birim elektrot ile 16 sensör elektrot dizisi kullanın.
- Ultra saf damıtılmış su ile bir tüp içine hazır reaktifleri pipetleyerek, 100 nM DNA probu, 0.3 M KCI ve 10 mM pirol bir stok karışım hazırlayın. Vorteks ile iyice karıştırın.
NOT: Bu çalışma için seçilen DNA probu eksozom içinde mevcut olduğu bilinmektedir GAPDH referans genine karşılık gelir. kullanılan prob dizisi '-Biyotin-AGGTCCACCACTGACACGTTG-3 5'. Tüm elektrotlar üzerinde bu karışımı kullanın. - Pipet her altın elektrod yüzeyi üzerine monomer DNA probu karışımı 60 ul. Çalışma, c yeterli kapsama olmasını sağlamak için elektrotları inceleyinSıvı karışım ile Sayaç ve referans elektrotlar.
- Electropolymerize monomer prob karışımı elektrot yüzeyine döngüsel bir kare dalga (CSW) elektrik alanı profili uygulayarak elektrot yüzeyinde bir iletken polimer katmanı oluşturmak için. Bu elektrik alanı 9 saniye +350 mV uygulayarak ve hemen 1 saniye için 950 mV geçiş oluşur. Uygulanan bir elektrik alanı, 100 saniye, toplam 10 çevrim için elektroda bu siklik kare dalga profil uygulanır.
- Elektrotun yüzeyinden sıvının çıkması için sensör yüzeyine damıtılmış su ve azot gazı ile kuru ile 3 kez yıkayın. Bu sıvı düzgün elektrot kaldırılır emin olun.
- Exosome Kargo Boşaltma
- Yük 5 boncuk eksozom kompleks karışımı 495 ul bir detektör probu 1 mcM ul ve karıştırmak için bir pipet kullanın.
Not: detektör probu 3 'ucunda bir floresein molekülüne konjuge edilmiş bir DNA primer sekansıdır. Dedektör probBu çalışma için kullanılan e dizisi eksozom içinde bulunan, GAPDH mRNA karşılık gelir. floresein konjuge detektör probu sekansıdır: 5'-GCAGTGGGGACACGGAAGGCC-Floresein-3 '. - Pipet altında bir mıknatıs dizi ile bir altın elektrot yüzeyine prob ve boncuk eksozom kompleks karışımı 60 ul. Bu mıknatıs dizisi sensörünün çalışma elektrotlara karşılık hizalanmış onaltı 2.54 mm çaplı mıknatıslar oluşur. Şekil 2A mıknatıslar ve boncuk eksozom çözümün yerleşimini gösterir.
- Örnek elektrot yüzeyinde yüklendikten sonra, -300 mV 9 saniye ve 200 mV (200 sn toplam) 1 saniye ile CSW elektrik alanın 20 döngüleri uygulayın. serbest exosomal yük elektrodun sathı üzerinde primerler hibridize olur. Exosome yüzey belirteçleri soruşturma konusu ise,. Deney bu bölümünü atlamak 2B bu süreci göstermektedir Şekil.
- Yıkama-off üçlü damıtılmış su ile elektrot yüzeyini durulayarak elektrot yüzeyinde ilişkisiz analitler. Azot gazı ile elektrot kurutun.
- Yük 5 boncuk eksozom kompleks karışımı 495 ul bir detektör probu 1 mcM ul ve karıştırmak için bir pipet kullanın.
- Raportör Antikor ve saati
- (: 1000 seyreltme, 1 içinde HRP) kazein / PBS içinde seyreltilmiş yaban turpu peroksidazına konjüge edilmiş 150 ünite / ml anti-floresin antikor 60 ul ekle.
- Prob sandviç karmaşık bir anti-floresein HRP bir elektrik alan tahrik konjugasyon kullanın. 1 saniye ve elektrot yüzeyine 5 çevrim için 1 saniye için 500 mV -200 mV uygulanır. Şekil 2A, bir protein ve nükleik asit sisteminde hem de yakalama ve dedektör sistemi kompleksleri gösterir.
- Distile su ve azot gazı ile kuru kullanılarak üçlü yıkama sensör yüzeyi.
- Bağlanmamış fazla bir anti-floresin antikorun yıkama ayrılmasının ardından, 3,3 ', 5,5'-tetrametilbenzidin (TMB), alt-tabakanın 60 ul ekle. Bir çok kanallı pipet kullanarak her bir sensör yüzeyine bu alt tabakayı yükleyin.
- . 16 kanal eş zamanlı olarak ölçüm kapasitesine sahip bir elektrokimyasal potansiyostat kullanılarak 60 sn için -200 mV'de elektrot akımının ölçülmesi ile akım amperometrik olarak okunmasını yapın 2C okuma sırasında akım profilinin bir örneği Şekil.
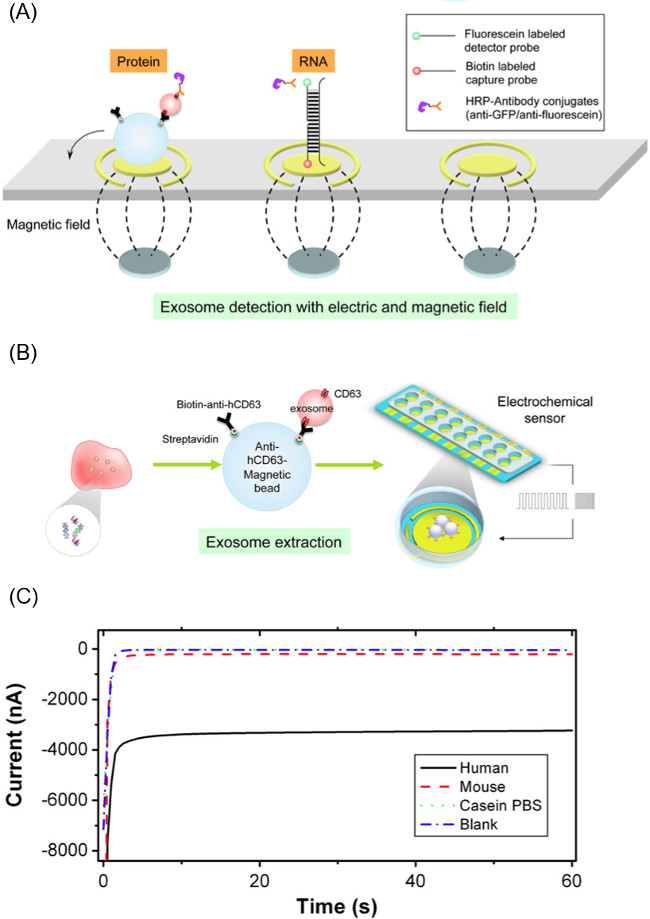
EFIRM Yöntem Şekil 2. Bileşenleri. (A), anti-insan CD63 kaplı manyetik mikropartiküller kullanarak biyo-sıvı gelen eksozomlar ayıklanması ve daha sonra parçacık-eksozom kompleksi uygulanan halkalı kare dalgaları kullanarak eksozom kargo boşaltma yöntemi. Serbest eksozom RNA / DNA / protein hedefleri tespit etmek için kullanılan elektrot biyosensör (B) Şema. Daha büyük akım büyüklüğü t karşılık (C) EFIRM metodolojisi, gelen amperometik okuma Temsilcisi örneğiBir biyomolekülün yüksek seviyelerde o. Bu rakam Wei ve ark değil. 14 Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Sonuçlar
TEM kullanarak Boncuk Exosome Yakalama Doğrulama
Anti-insan CD63 manyetik boncukları kullanılarak tükürük eksozomlann izole transmisyon elektron mikroskobu (TEM) görüntüleri kullanarak ekstraksiyon protokolü takip edilerek doğrulanmıştır. TEM eksozom bilinen profili ile uyumlu hemen bitişik (Şekil 3A, bkz ve 3B), 70-100 nm granüller, manyetik boncuklar gösterir. Resim 70-100 nm taneler daha önceden bunların konjüge anti-...
Tartışmalar
Sonuçlar gösterdiği gibi, anti-insan CD63 kaplı manyetik nanopartikülleri, özellikle 70-100 nm arasında değişen bir boyuta sahiptir, küçük parçacıkları yakalamak mümkündür. Çekilecek parçacık eksozom daha önce gözlenen profili ile tutarlıdır. Bundan başka, parçacıklar yakalanmasından sonra düşük voltajlı CSW kullanım boncuğun yüzeyine kaldırmak ve kargo serbest bırakılması için geleneksel bir liziz tamponu göre yöntem ile benzer DNA parçalanma profilleri neden olduğu da göst...
Açıklamalar
David Wong RNAmeTRIX Inc., moleküler tanı şirketin kurucularından. PeriRx LLC RNAmeTRIX moleküler tanı ile ilgili fikri mülkiyet alt lisansı. David Wong PeriRx bir danışmandır.
Teşekkürler
Bu çalışma Ulusal Araştırma Kaynakları Merkezi ve (FW) Hibe UL1TR000124 aracılığıyla Translational Sciences, Ulusal Sağlık Enstitüleri, Advancing Ulusal Merkezi tarafından desteklenen; Felix & Mildred Yip donatılmış Profesörlük ve (DTWW için) Barnes Aile Fonu, (MT) Ödül Numarası T90DE022734 altında Ulusal Sağlık Enstitüleri Diş & Kranyofasiyal Research Ulusal Enstitüsü. içerik sadece yazarların sorumluluğundadır ve mutlaka Ulusal Sağlık Enstitüleri resmi görüşlerini temsil etmemektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Helios 16-Channel Reader System with Chip Interface | Genefluidics, USA | RS-1000-16 | |
| 16x Sensor Chip, Bare Gold, pack of 5 chips | Genefluidics, USA | SC1000-16X-B | |
| Biotinylated anti-human CD63 Antibody | Ancell, USA | 215-030 | |
| Dynabeads MyOne Streptavidin T1 | Invitrogen, USA | 65601 | |
| Neodynium Magnetics (1/10" dia. x 1/32" thick) | K&J Magnetics, USA | DH101 | |
| Ultrapure Distilled Water | Life Technologies, USA | 10977-023 | |
| Mettler Toldeo 3 M KCl Solution | Fisher Scientific, USA | 1911512 | |
| Pyrrole | Sigma-Aldrich, USA | W338605-100g | |
| Anti-Fluorescein-POD, Fab fragments | Roche, Germany | 11426346910 | |
| 3,3′,5,5′-tetramethylbenzidine substrate (TMB/H2O2, low activity) | Neogen, Usa | 330175 | |
| Phosphate Buffered Saline Solution | Life Technologies, USA | 10010023 | |
| Casein/PBS | Fisher Scientific, USA | 37532 |
Referanslar
- Rabinowits, G., Gerçel-Taylor, C., Day, J. M., Taylor, D. D., Kloecker, G. H. Exosomal MicroRNA: A Diagnostic Marker for Lung Cancer. Clinical Lung Cancer. 10 (1), 42-46 (2009).
- Thakur, B. K., et al. Double-stranded DNA in exosomes: a novel biomarker in cancer detection. Cell Research. 24 (6), 766-769 (2014).
- Lau, C. S., Wong, D. T. W. Breast Cancer Exosome-like Microvesicles and Salivary Gland Cells Interplay Alters Salivary Gland Cell-Derived Exosome-like Microvesicles In. Vitro. PLoS ONE. 7 (3), e33037 (2012).
- Bala, S., et al. Circulating microRNAs in exosomes indicate hepatocyte injury and inflammation in alcoholic, drug-induced, and inflammatory liver diseases. Hepatolog. 56 (5), 1946-1957 (2012).
- Dear, J. W., Street, J. M., Bailey, M. A. Urinary exosomes: A reservoir for biomarker discovery and potential mediators of intrarenal signalling. Proteomics. 13 (10-11), 1572-1580 (2013).
- Lässer, C., et al. Human saliva, plasma and breast milk exosomes contain RNA: uptake by macrophages. Journal of Translational Medicine. 9 (1), 9 (2011).
- Palanisamy, V., et al. Nanostructural and Transcriptomic Analyses of Human Saliva Derived Exosomes. PLoS ONE. 5 (1), e8577 (2010).
- Camussi, G., et al. Exosomes/microvesicles as a mechanism of cell-to-cell communication. Kidney International. 78 (9), 838-848 (2010).
- Lau, C., et al. Role of pancreatic cancer-derived exosomes in salivary biomarker development. The Journal of Biological Chemistry. 288 (37), 26888-26897 (2013).
- Théry, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and Characterization of Exosomes from Cell Culture Supernatants and Biological Fluids. Current Protocols in Cell Biology. 3 (22), (2001).
- Park, N. J., Li, Y., Yu, T., Brinkman, B. M. N., Wong, D. T. Characterization of RNA in Saliva. Clinical Chemistry. 52 (6), 988-994 (2006).
- Wei, F., et al. Bio/Abiotic Interface Constructed from Nanoscale DNA Dendrimer and Conducting Polymer for Ultrasensitive Biomolecular Diagnosis. Small. 5 (15), 1784-1790 (2009).
- Wei, F., et al. Electrochemical Sensor for Multiplex Biomarkers Detection. Clinical Cancer Research. 15 (13), 4446-4452 (2009).
- Wei, F., Yang, J., Wong, D. T. W. Detection of exosomal biomarker by electric field-induced release and measurement (EFIRM). Biosensors and Bioelectronics. 44, 115-121 (2013).
Erratum
Formal Correction: Errata: Detection of Exosomal Biomarker by Electric Field-induced Release and Measurement (EFIRM)
Posted by JoVE Editors on 1/01/1970. Citeable Link.
An erratum was issued for Detection of Exosomal Biomarker by Electric Field-induced Release and Measurement (EFIRM). The disclosures were updated.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır