Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Обнаружение Exosomal Biomarker электрическим полем индуцированного выбросов и измерений (EFIRM)
В этой статье
Erratum Notice
Резюме
Exosomes are microvesicular structures found within biofluids that potentially carry important disease discriminatory biomarkers. Here, a novel method is used to specifically extract exosomes and rapidly test the exosomal cargo for both RNA/protein targets following the disruption of exosomes using non-uniform electric cyclic square waves.
Аннотация
Экзосомы являются мелкопузырчатые структуры, которые играют роль посредника в межклеточной коммуникации. Она представляет интерес для изучения внутреннего груз экзосом, чтобы определить, если они имеют заболевания дискриминационных биомаркеров. Для проведения анализа exosomal, необходимо разработать метод для извлечения и анализа экзосомы из целевых biofluids без повреждения внутреннего содержания.
Электрическое поле, индуцированный выброс и измерение (EFIRM) является метод специально для извлечения экзосомы от biofluids, разгрузка свой груз, и проверка их внутреннее содержание РНК / белок. Использование анти-CD63 человека специфическое антитело магнитного микрочастицы, экзосомы сначала осаждают из biofluids. После экстракции низковольтные электрические циклические прямоугольные волны (РКС) применяются для разрушения везикулярного мембрану и вызывать выгрузки груза. Содержание экзосома гибридизуют с праймерами ДНК или антител, иммобилизованных на поверхности электрода для кваntification молекулярной содержанию.
Метод EFIRM выгодно для извлечения экзосом и разгрузки грузов для анализа без буфера для лизиса. Этот метод может выполнять конкретную обнаружение обеих РНК и белка биомаркеров целей в экзосома. EFIRM извлекает экзосомы специально на основе их поверхностных маркеров, в отличие от методов размера на основе.
Просвечивающей электронной микроскопии (ПЭМ) и анализа свидетельствуют о функциональности метода для захвата и анализа экзосома. Метод EFIRM был применен к exosomal анализ 9 мышей, которым вводили человеческие рака легких H640 клеток (в клеточную линию, чтобы выразить экзосома маркер человек CD63-GFP) для того, чтобы проверить их экзосома профиль против 11 у мышей, получавших управления физиологического раствора. Повышенные уровни exosomal биомаркеров (ссылка ген GAPDH и белка поверхностным маркером человек CD63-GFP) были найдены для H640 вводили мышам в сыворотке и слюны. Кроме того, Салива и образцы сыворотки были продемонстрированы, чтобы иметь линейность (R = 0,79). Эти результаты наводят на размышления для жизнеспособности слюнных экзосом биомаркеров для обнаружения дистальных заболеваний.
Введение
Экзосома исследования развивающаяся область исследования, которая исследует липидов микровезикулы, которые несут РНК 1, ДНК 2, и белок 3 грузов. Предыдущие исследования экзосома биологии привели к идентификации экзосом в biofluids, таких как кровь 4, мочи 5, грудное молоко 6, слюны и 7. Исследования показали, что экзосомы играют важную роль в различных клеточных путей, удаленно медитации данными между различными системами тела 8. Из-за роли экзосомы играть в межклеточной коммуникации, он предположил, что они могут упаковать биомолекулы целей (белок, РНК и ДНК) коррелирует с болезненными состояниями. В пробирке 3 и животная модель 9 исследования по всей видимости, подтверждают эту гипотезу. При исследовании exosomal контент для поиска биомаркеров, необходимо разработать методологию для селективного выделения экзосома от biofluids, вызванной expulsiна груза из экзосом и количественного экзосом биомолекул. В той степени, в этой работе, экзосомы будут определены как структуру, имеющую диаметр приблизительно 70-100 нм и обладающий поверхностным маркером CD63.
Исследователи, как правило, первый очистки экзосомы ультрацентрифугированием 10, а затем обработать exosomal содержание за счет использования буфера для лизиса комплектов. Использование методов лизис буфера требуется время инкубации, начиная от нескольких минут до нескольких часов. Этот процесс может нанести вред экзосома груз и привести к образцу деградации. Например, слюнные экзосом РНК выпущен с помощью лизирующего буфера в окружающую среду внеклеточного обладает периодом полураспада менее 1 мин, что делает измерение exosomal РНК после буфера для лизиса особенно трудной задачей без добавления реагентов стабилизации 11. Усугубляется эффект от добавления различных реагентов для проведения лизиса и стабилизации может ввести агентов, которые усложняют и вмешиваться в анализ содержания exosomal. Альтернативный подход может быть полезен для быстрого разгрузки содержание exosomal и безопасно сохранении груз для характеризации.
В этой работе, мы предлагаем использование в неоднородном электрическом поле для высвобождения exosomal содержанию. Электрические-поля, как известно, несут способность к поляризации и нарушать липидный бислой, который образует клеточные мембраны. Наша экспериментальная работа исследует использование неоднородных циклических квадратных волн (РКС) за нарушение структуры microvesicle экзосом и освобождение осуществляется груз. Этот метод использует напряжение в диапазоне нескольких сотен милливольт, это означает, что большинство биомолекул не будет нарушена. Показано, что использование циклического-меандра может приводить высвобождение слюнных экзосома содержания мРНК в окружающей текучей среды. Этот выпуск содержимого exosomal интегрируется с системой электродов, которые могут быть использованы для количественной оценки уровней экспрессии биомаркера 12,13. Этот предложенный метод позволяет быстро, чувствительной, и лизис буфера свободного анализа содержания экзосома.

Рисунок 1. Обзор EFIRM Workflow.. Метод EFIRM в целом подразделяется на три основных этапа, которые необходимы для очистки и анализа экзосом.
Это метод, основанный релиз и контент-анализ exosomal РКС используется в сочетании с CD63-удельная магнитная микросфер для изоляции экзосома. Эти CD63-сродства бусины позволяют для селективного выделения экзосом из слюнных образцов (и других biofluids). После инкубации и добычи экзосом с использованием намагниченных бусы, бисер, переносятся в электрохимической системе сенсора для РКС на основе релиз контента и анализа часть эксперимента. Рисунок 1 дает общее представление о работетечь метода EFIRM.
протокол
1. Магнитная бисера на основе экзосома Добыча
- Пипетки хорошо смешанный раствор 5 мкл покрытых стрептавидином магнитных микрочастиц в 495 мкл фосфатно-солевым буфером (PBS) буфере в микроцентрифужных трубки для ресуспендирования гранул. Промыть и ресуспендируют гранул с 500 мкл PBS три раза, используя магнитную стойку. Стойка массив магнитов на стороне корпуса блока, который может содержать образец микроцентрифужных пробирок.
- Для каждой стирки, прежде всего позвольте трубы сидеть на стойке в течение 1 мин, а затем использовать пипетки осторожно удалите буфер супернатант, не нарушая бусы.
- Место труб на регулярной стойку без магнитов на стороне. Добавить 500 мкл PBS в трубы, и с помощью пипетки, чтобы перемешать раствор и шарики вместе. Затем поместите пробирки обратно на магнитной стойке, чтобы снова разделить шарики из раствора.
- Выполните эту удаление буфера через намагниченности и суспензии в PBS авсего три раза. Это выполняет начальную мыть магнитных частиц.
- Ресуспендируют бусины в 490 мкл PBS буфера, с трубкой, размещенной на не-намагниченного участка магнитной стойке. Пипеткой 5 мкл биотинилированного мышиного CD63 антитела против человеческого в 1,0 мг / мл концентрации акций в смеси шариков. Используйте пипетку, чтобы смешать шарики и антитела в растворе.
- Поместите микроцентрифужных пробирок с бортом и биотинилированной смеси антител на выборочной ротатора. Установите параметры ротатор для образца ротатора для взаимного вращения при 90 ° наклона 5 сек и вибрирует на 5 ° С в течение 1 сек. Поворот образца, шарик смеси трубы при этих параметрах в течение 30 мин при комнатной температуре.
- Удалить несвязанного антитела после сопряжения.
- После 30 мин вращения при комнатной температуре, поместить пробирки обратно в магнитной стойке в течение 5 мин.
- Выполнение трех промывок шариков путем удалени жидкой фазы с помощью микропипетки и промывают 500 μ; Л PBS. После троекратной промывки, ресуспендируют бусины в 490 мкл казеина-PBS и место на ненамагниченном части стойки.
- Добыча экзосома с использованием шариков покрытых антителами.
- На каждом трубку с целевой выборки ID. Пипетки 10 мкл образца сыворотки или слюны в микроцентрифужных трубки. Используйте пипетку, чтобы смешать образец и магнитных шариков с помощью пипетки несколько раз.
- Поместите трубки с пробой и анти-CD63 человека шариков антител на ротатор и вращать в течение 2 ч при комнатной температуре. Используйте те же параметры, ротатор, как описано в стадии 1,2.
- После 2 ч образца вращающегося, выполнить тройной промывки путем намагничивания в отдельных шариков из раствора, удаление жидкой фазы с микропипетки и ресуспендирования бусины в 500 мкл буфера Tris-HCl. Полученные гранулы теперь связан с экзосом и готовы к электрической выпуска поля и измерения.
2. электрическое поле, создаваемое выходай Измерение Exosomal Материалы
- Начальная намывки электрода с GADPH Primer
- Нанесите пластик хорошо, чтобы массив электродов, чтобы предотвратить перекрестное загрязнение отдельных электродов. Для этого эксперимента, использовать матрицу электродов 16-сенсор с каждой элементарной электрода в массив, состоящий из рабочей, счетчик, и электродом сравнения из голой золота.
- Подготовка исходного смесь 100 нМ ДНК-зонда, 0,3 М KCl и 10 мм пиррола с помощью пипетки на акции реагенты в пробирку с особо чистой дистиллированной воды. Тщательно перемешать встряхиванием.
Примечание: Для данного исследования, ДНК-зонд выбран соответствует исходной GAPDH гене, который, как известно, существуют в экзосом. Последовательность зонда используется: 5'-биотин-AGGTCCACCACTGACACGTTG-3 '. Используйте эту смесь на всех электродах. - Пипеткой 60 мкл зонда смеси мономеров ДНК на поверхности каждого золотого электрода. Проверьте электроды, чтобы обеспечить, что есть адекватный охват рабочей, сounter, и электроды сравнения по жидкой смеси.
- Electropolymerize мономера-зонд смесь для создания проводящего слоя полимера на поверхности электрода путем применения циклического меандр (РКС) профиль электрического поля к поверхности электрода. Это электрическое поле состоит из применения 350 мВ в течение 9 сек и сразу же переход на 950 мВ в течение 1 секунды. Примените этот циклический профиль прямоугольный с электродом для 10 циклов, в общей сложности 100 сек приложенного электрического поля.
- Промыть поверхности датчика 3 раза дистиллированной водой и сухим газообразным азотом, чтобы удалить жидкость с поверхности электрода. Убедитесь, что жидкость полностью удалены от электрода.
- Экзосома выгрузки груза
- Добавить 5 мкл 1 мкМ детектора зонда в 495 мкл бисером экзосом сложной смеси и использовать пипетки перемешать.
Примечание: Детектор датчика представляет собой последовательность праймера ДНК, конъюгированный с флуоресцеином молекулы на 3'-конце. Детектор Probе последовательность, используемая в данном исследовании соответствует GAPDH мРНК нашли в экзосом. Последовательность флуоресцеина конъюгированного зонда детектора: 5'-GCAGTGGGGACACGGAAGGCC-флуоресцеина-3 '. - Пипетка 60 мкл зонда и шарик-экзосом сложной смеси на поверхности золотого электрода с массива магнита снизу. Этот массив магнита состоит из шестнадцати 2,54 мм диаметр магнитов выровнены, чтобы соответствовать рабочим электродам датчика. 2А иллюстрирует размещение магнитов и шарик-экзосом раствора.
- После того, как образец загружен на поверхности электрода, применять 20 циклов электрического поля РКС с 9 сек при -300 мВ и 1 сек при 200 мВ (всего 200 сек). Exosomal груз, который будет выпущен гибридизации с использованием праймеров на поверхности электрода. Если поверхностных маркеров экзосом являются предметом расследования, пропустите эту часть эксперимента. Рисунок 2B иллюстрирует этот процесс.
- Wash-офф несвязанные анализируемые на поверхности электрода тройной промывки поверхности электрода дистиллированной водой. Сушат электрод с газообразным азотом.
- Добавить 5 мкл 1 мкМ детектора зонда в 495 мкл бисером экзосом сложной смеси и использовать пипетки перемешать.
- Репортер антител и считывание
- Добавить 60 мкл 150 единиц / мл, анти-флуоресцеин антитела, конъюгированного с пероксидазой хрена (HRP в соотношении 1: 1000 разведение) разводили в PBS / казеин.
- Используйте электрического поля, приводимый сопряжение к комплексу антифлуоресцеин HRP для сэндвич зонда. Применение -200 мВ в течение 1 сек и 500 мВ в течение 1 сек в течение 5 циклов до поверхности электрода. 2А показывает захват и детектор зонда комплексы как для белка и нуклеиновой кислоты системы.
- Тройной поверхность датчика стирки с использованием дистиллированной воды и сухого газообразного азота.
- После смыва несвязанного избыточного антифлуоресцентного антитела, добавить 60 мкл 3,3 ', 5,5'-тетраметилбензидин (ТМВ) подложки. Загрузите этот субстрат на каждой поверхности датчика с помощью многоканального пипетки.
- Выполнение амперометрического считывание тока путем измерения тока электрода при -200 мВ в течение 60 секунд с помощью электрохимического потенциостате способный одновременного измерения 16 каналов. Фиг.2с показан пример текущего профиля при считывании.
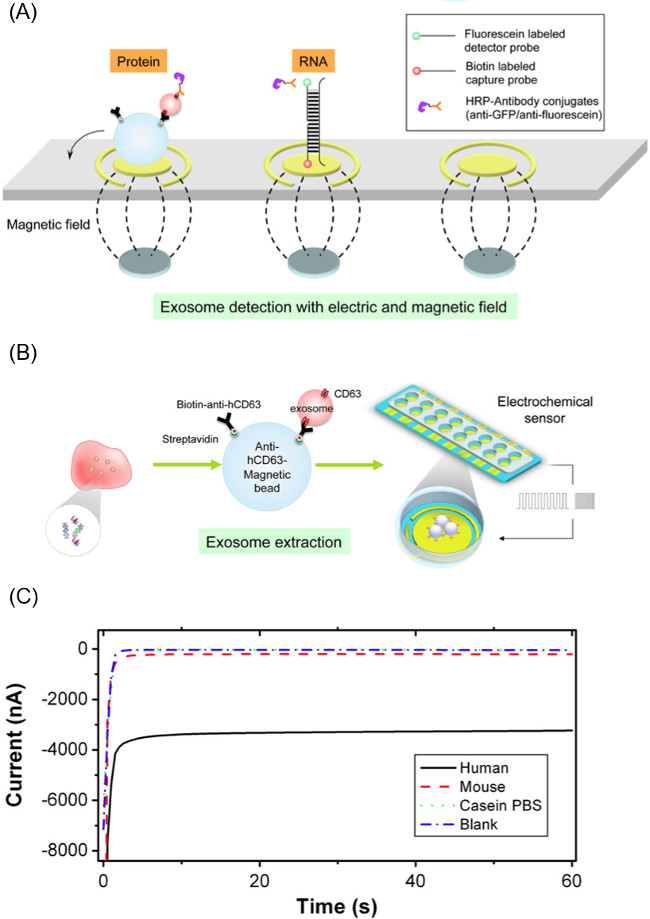
Рисунок 2. Компоненты EFIRM метод. (A) Способ извлечения экзосомы из биожидкости с использованием анти-человеческий CD63 покрытием магнитных микрочастиц, а затем выгрузки экзосома груз с помощью циклических квадратные волны примененного к комплексному частиц-экзосом. (В) Схема электрода биосенсора используется для обнаружения РНК / ДНК / белковых мишеней из выпущенного экзосома. (С) репрезентативный пример амперометрического считывания с методикой EFIRM, где величина тока больше, соответствует тO высоких уровней биомолекулы. Эта цифра составляет от Вэй и др. 14 Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
Результаты
Проверка экзосома Capture из бисера с помощью ПЭМ
Выделение экзосом из слюны с использованием анти-CD63 человека магнитных шариков было подтверждено в соответствии с протоколом экстракции с помощью просвечивающей электронной микроскопии (ТЕМ) изображения. ТЕМ пок?...
Обсуждение
Как показывают результаты, анти-человеческий CD63 покрытием магнитные наночастицы способны специфически захватывать мелкие частицы, которые имеют размер в пределах от 70-100 нм. Это захвачен частиц в соответствии с ранее наблюдаемым профилем экзосом. Кроме того, использование Комиссии по...
Раскрытие информации
Дэвид Вонг соучредитель RNAmeTRIX Inc., молекулярной диагностики компании. PeriRx ООО сублицензии интеллектуальную собственность, относящихся к молекулярной диагностики с RNAmeTRIX. Дэвид Вонг консультант PeriRx.
Благодарности
Эта работа была поддержана Национальным Центром научных ресурсов и Национальным центром для продвижения трансляционных наук, Национальные институты здравоохранения, через гранты UL1TR000124 (до FW); Феликс и Милдред Ип Обладая профессура и фонда семьи Барнс (для DTWW), Национального института стоматологических и черепно-лицевых исследований Национального института здравоохранения в рамках премии номер T90DE022734 (МТ). Содержание исключительно ответственности авторов и не обязательно отражает официальную точку зрения Национального института здоровья.
Материалы
| Name | Company | Catalog Number | Comments |
| Helios 16-Channel Reader System with Chip Interface | Genefluidics, USA | RS-1000-16 | |
| 16x Sensor Chip, Bare Gold, pack of 5 chips | Genefluidics, USA | SC1000-16X-B | |
| Biotinylated anti-human CD63 Antibody | Ancell, USA | 215-030 | |
| Dynabeads MyOne Streptavidin T1 | Invitrogen, USA | 65601 | |
| Neodynium Magnetics (1/10" dia. x 1/32" thick) | K&J Magnetics, USA | DH101 | |
| Ultrapure Distilled Water | Life Technologies, USA | 10977-023 | |
| Mettler Toldeo 3 M KCl Solution | Fisher Scientific, USA | 1911512 | |
| Pyrrole | Sigma-Aldrich, USA | W338605-100g | |
| Anti-Fluorescein-POD, Fab fragments | Roche, Germany | 11426346910 | |
| 3,3′,5,5′-tetramethylbenzidine substrate (TMB/H2O2, low activity) | Neogen, Usa | 330175 | |
| Phosphate Buffered Saline Solution | Life Technologies, USA | 10010023 | |
| Casein/PBS | Fisher Scientific, USA | 37532 |
Ссылки
- Rabinowits, G., Gerçel-Taylor, C., Day, J. M., Taylor, D. D., Kloecker, G. H. Exosomal MicroRNA: A Diagnostic Marker for Lung Cancer. Clinical Lung Cancer. 10 (1), 42-46 (2009).
- Thakur, B. K., et al. Double-stranded DNA in exosomes: a novel biomarker in cancer detection. Cell Research. 24 (6), 766-769 (2014).
- Lau, C. S., Wong, D. T. W. Breast Cancer Exosome-like Microvesicles and Salivary Gland Cells Interplay Alters Salivary Gland Cell-Derived Exosome-like Microvesicles In. Vitro. PLoS ONE. 7 (3), e33037 (2012).
- Bala, S., et al. Circulating microRNAs in exosomes indicate hepatocyte injury and inflammation in alcoholic, drug-induced, and inflammatory liver diseases. Hepatolog. 56 (5), 1946-1957 (2012).
- Dear, J. W., Street, J. M., Bailey, M. A. Urinary exosomes: A reservoir for biomarker discovery and potential mediators of intrarenal signalling. Proteomics. 13 (10-11), 1572-1580 (2013).
- Lässer, C., et al. Human saliva, plasma and breast milk exosomes contain RNA: uptake by macrophages. Journal of Translational Medicine. 9 (1), 9 (2011).
- Palanisamy, V., et al. Nanostructural and Transcriptomic Analyses of Human Saliva Derived Exosomes. PLoS ONE. 5 (1), e8577 (2010).
- Camussi, G., et al. Exosomes/microvesicles as a mechanism of cell-to-cell communication. Kidney International. 78 (9), 838-848 (2010).
- Lau, C., et al. Role of pancreatic cancer-derived exosomes in salivary biomarker development. The Journal of Biological Chemistry. 288 (37), 26888-26897 (2013).
- Théry, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and Characterization of Exosomes from Cell Culture Supernatants and Biological Fluids. Current Protocols in Cell Biology. 3 (22), (2001).
- Park, N. J., Li, Y., Yu, T., Brinkman, B. M. N., Wong, D. T. Characterization of RNA in Saliva. Clinical Chemistry. 52 (6), 988-994 (2006).
- Wei, F., et al. Bio/Abiotic Interface Constructed from Nanoscale DNA Dendrimer and Conducting Polymer for Ultrasensitive Biomolecular Diagnosis. Small. 5 (15), 1784-1790 (2009).
- Wei, F., et al. Electrochemical Sensor for Multiplex Biomarkers Detection. Clinical Cancer Research. 15 (13), 4446-4452 (2009).
- Wei, F., Yang, J., Wong, D. T. W. Detection of exosomal biomarker by electric field-induced release and measurement (EFIRM). Biosensors and Bioelectronics. 44, 115-121 (2013).
Erratum
Formal Correction: Errata: Detection of Exosomal Biomarker by Electric Field-induced Release and Measurement (EFIRM)
Posted by JoVE Editors on 1/01/1970. Citeable Link.
An erratum was issued for Detection of Exosomal Biomarker by Electric Field-induced Release and Measurement (EFIRM). The disclosures were updated.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены