Method Article
免疫低下アダルトゼブラフィッシュへの正常および悪性筋細胞移植
要約
Here, we present a protocol for cell transplantation of zebrafish skeletal muscle and embryonal rhabdomyosarcoma (ERMS) into adult immune compromised rag2E450fs homozygous mutant zebrafish. This protocol allows for the efficient analysis of regeneration and malignant transformation of muscle cells.
要約
ゼブラフィッシュは、開発、再生、および癌を評価するための強力なツールとなっている。より最近では、同種細胞移植プロトコールは、照射、同系および免疫無防備成体ゼブラフィッシュへの正常および悪性細胞の許可移植を開発されてきた。最適化された細胞移植プロトコールと相まって、これらのモデルは、幹細胞機能、再生次損傷、および癌の迅速な評価を可能にする。ここでは、免疫低下大人のRAG2 E450fsホモ接合変異体ゼブラフィッシュにゼブラフィッシュの成人骨格筋および胎児性横紋筋肉腫(ERMS)、胚の筋肉と特徴を共有する小児肉腫、の細胞移植のための方法を提示する。重要なことに、これらの動物は、T細胞を欠き、非血縁ドナー動物から組織の広範囲の生着を促進する、B細胞の機能が低下している。当社の最適化されたプロトコルは、その蛍光標識された筋細胞のpreparを表示RAG2ホモ接合変異魚の背側の筋肉組織に注入されたときにαアクチン-RFPトランスジェニックゼブラフィッシュから管理ポイント確実に生着する。また、蛍光は分化状態に基づいて、細胞に限定される蛍光ジェニックERMSの生着を示す。具体的には、ERMSはAB-菌株Myf5の-GFPで作成された、大人の免疫低下魚の腹膜に注入mylpfa-mCherryをダブルトランスジェニック動物および腫瘍。これらのプロトコルの有用性は、成体ゼブラフィッシュの背側筋肉または腹膜内に注入することができ、正常および悪性のドナー細胞の広範囲の生着にも及ぶ。
概要
ゼブラフィッシュ彼らが切断フィンを再生成することができるので、再生の研究のための優れたモデルであるだけでなく、損傷した脳、網膜、脊髄、心臓、骨格筋および他の組織1。細胞移植による様々な組織からの幹細胞および前駆細胞の同定は、ごく最近2を探求してきたが、成体ゼブラフィッシュにおける細胞および再生研究ステムは、主に、傷害に応答して、再生の特性に焦点を当てている。 10 -ゼブラフィッシュは、ヒトの病気3を模倣するトランスジェニック癌モデルの生成を通じて癌の研究のためにますます使用されるようになっている。
癌の設定では、細胞移植のアプローチは、となっている広く採用され、自己複製11は、機能的異質12,13、血管新生14、増殖を含めた重要な癌プロセスの動的な評価を可能にする、治療応答15、および浸潤16,17。しかし、移植された細胞は、しばしば攻撃し、移植片18を殺す免疫防御をホストによるレシピエント魚から拒否されます。いくつかの方法は、移植細胞の拒絶反応を克服するために使用されてきた。例えば、レシピエント動物の免疫系は、一過性移植前18,19に低線量γ線照射によりアブレーションすることができる。ただし、受信者の免疫系は、20日までに、照射後を回復し、ドナー細胞18を殺す。代替的に、デキサメタゾン処理が長い免疫抑制コンディショニングを提供し、最大30日間14のヒト腫瘍の広い範囲の生着を促進し、TおよびB細胞の機能を抑制するために使用されている。これらの実験は、一定の薬物の投与を必要とし、固形腫瘍の研究に限定されている。 22、ドナーとrecipi -長期生着アッセイは、遺伝的に同一の同系のライン20を使用していたENT細胞が一致した免疫がある。しかし、これらのモデルは、対象のトランスジェニック系統が完全に同系のラインを生産する以上4世代のために同系のバックグラウンドに交配される必要があります。レシピエント魚に免疫拒絶の問題を回避するために、私たちのグループは最近、TおよびB細胞の機能が低下している組織23の広い範囲の生着を可能にしている免疫低下RAG2 E450fsホモ接合変異(ZFINアレル指定RAG2のFB101)ラインを開発しました。類似の免疫低下マウスモデルは、マウスおよびヒトの組織24の細胞移植のために広く使用されてきた。
ここでは、骨格筋および胎児性横紋筋肉腫(ERMS)、新たに記載しRAG2ホモ接合変異体ゼブラフィッシュに、骨格筋での機能を共有する小児肉腫の移植のための方法を提示する。免疫低下大人のゼブラフィッシュの可用性直接可視化し、正常および悪性組織内の幹細胞の自己再生を評価するために、大規模な細胞移植研究を実行するための能力を拡張する。この方法では、αアクチン-RFP 25トランスジェニックゼブラフィッシュの大人からの蛍光標識された筋細胞調製物は、確実にRAG2に生着 背部の筋肉組織への注射後のホモ接合変異体ゼブラフィッシュ。また、私たちは生着し、プライマリMyf5のの -GFPの拡大を証明する。RAG2 E450fsホモ接合変異体ゼブラフィッシュに腹腔内注射を以下のmylpfa- mCherryをトランスジェニックERMS。これらのプロトコルの有用性を示す例を超えて、容易に追加のゼブラフィッシュ再生組織および癌にも適用することができる。
プロトコル
全ての動物手順は、プロトコル#2011N000127の下で、研究動物管理上のマサチューセッツ総合病院小委員会によって承認された。
アダルトRAG2 E450fsホモ接合変異体ゼブラフィッシュへのセクション1.骨格筋細胞移植
アダルトゼブラフィッシュドナー骨格筋細胞の作製
- 蛍光的に筋肉をラベルしているトランスジェニック大人のゼブラフィッシュを入手します。この実験では、30α アクチン-RFPドナー魚25は、レシピエント魚あたり1×10 6個の細胞を移植するために利用された。
- 10分間または全く蓋の動きが明らかにされなくなるまで/ mlのトリカインメタン(MS222)1.6 mgの犠牲ドナーゼブラフィッシュ。
- 吸収性ペーパータオル上ドナー魚を置き、きれいなカミソリの刃を使用して、背部の筋肉を切除。カットは、 図1(a)に述べたように、組織のコレクションを(最大化するために45°の角度で肛門付近でなされるべきである)。きれいな10センチメートルペトリ皿に解剖した組織を置きます。
- 切開した組織に500μlの懸濁緩衝液(予め冷却0.9Xリン酸緩衝生理食塩水、5%ウシ胎児血清(FBS)を補充した(PBS))を加える。 10ドナーゼブラフィッシュまで、このボリューム内に一緒に配置することができる。
- 細胞は均一な懸濁液になるまで> 20倍かみそりの刃で組織をミンチ。全体背部の筋肉組織は、皮膚、骨、フィンなどの均質化される。懸濁バッファーの2ミリリットルを追加します。を5mlピペットを用いて、細胞を解離するために、細胞懸濁液を≥20回粉砕する。
- 氷上に置いた50mlコニカルチューブに40μmのメッシュストレーナーを通して細胞懸濁液を濾過する。
- 5ミリリットル(10ドナー魚が分離株ごとに使用することができます)の最終容量に、同じストレーナーと円錐管を通じて残りの組織を収集し、フィルタリングするために懸濁緩衝液のさらに2.5 mlのペトリ皿を洗ってください。
注:皮膚、骨やフィンを濾過以下除外されます。 - 該当する場合は、同じコニカルチューブに類似した懸濁液を兼ね備えています。
- トリパンブルー色素と血球計数器を用いて生存細胞の総数をカウントします。
- (オプション、ステップ2)必要に応じて、フローサイトメトリーのために500μlのを予約。
- 4℃で10分間、1,000×gで遠心細胞懸濁液、。
- 3.33×10 5細胞/μL(0.9X PBS + 5%FBS)で上清を再懸濁細胞を捨てる。合計では、3μlを受信者ごとに1×10 6細胞(ステップ3)の合計のためのレシピエント魚あたりに注入されます。
注:細胞懸濁液の3未満のμlをレシピエント魚に移植しなければなりません。細胞数は、受信者ごとに5×10 4個の細胞だけ低く制限されている場合は移植の成功した( 表1)につながる可能性がある。
ドナー骨格筋細胞の準備2.フローサイトメトリー分析(オプション)
- 私を概説したように、野生型 、非トランスジェニック魚から筋肉を分離nは1.1ステップ。このサンプルは、陰性対照として機能し、フローサイトメトリーゲートを設定するのに有用である。
- 適切な実行可能性染料を追加します。例えば、筋肉の準備の500μlに株式のDAPI溶液(500 ng /μLで)の5μlを添加する。分析に少し前にボルテックス。 5×10 3〜1×10 4のイベントを取得する。トランスジェニック魚から単離された筋細胞の分析に続いてゲートを配置する最初の野生型の対照試料を分析する。
注:フローサイトメトリー分析は、通常、切開し、細胞が60%以上の生存率( 図2)を保持し 、その間に筋肉組織の切開、後1時間以内に行われる。細胞は常に氷上で維持されるべきである。全細胞の生存率は、トリパンブルー色素および血球計を用いて、移植前に再評価することができる。
アダルトRAG2ホモ接合変異体ゼブラフィッシュへの骨格筋細胞の3筋肉内移植
- 10μを清掃してください;で描画し、70%エタノール(5回)、続いて10%の漂白剤溶液(5回)、放出、その後懸濁バッファー(0.9X PBS + 5%FBS、10回)、続いによってリットル26S Gマイクロシリンジ。
- 遅い蓋の動きまで、システムの水に魚を含むペトリ皿にトリカインメタン(MS222、4 mg / mlのストック溶液)の単一滴を加えることにより(コントロールなど)2-4ヶ月のホモ接合RAG2変異体魚や野生型レシピエント魚を麻酔そして魚はまだです。
注:トリカイン麻酔の投与量は、受信者のゼブラフィッシュの年齢とサイズに依存します。 - 左サイドを上に向けて、湿ったペーパータオルやスポンジに麻酔をかけ、受信者のゼブラフィッシュを置きます。
- latero-背部筋肉組織に注射針を挿入します( 図1Aを参照)。注射は45°の角度で行われていることを確認します。受信者ごとに1×10 6個の細胞の合計魚あたり(ステップ1.12で調製)細胞懸濁液の3μLを注入。
- 慎重に回復するプラスチック製のスプーンを使用してクリーンタンクに注入ゼブラフィッシュを転送する。
- 明視野および落射蛍光顕微鏡下で麻酔をかけた魚を撮影して、移植後30日間、10、20で生着率の受信者ゼブラフィッシュを評価する。
アダルトホモ接合RAG2変異ゼブラフィッシュへの第2節胎児性横紋筋肉腫(ERMS)移植
ゼブラフィッシュ胚の4。DNAマイクロインジェクション
- 6時間またはO / N、37℃で、XhoIで10μgのDNAを消化し てRAG2-kRASG12Dプラスミド7を直線化。
- 標準的なフェノールDNAを精製:クロロホルム抽出し、エタノールで沈殿させる。脱イオン水20μl中に再懸濁し(あるいは、市販のDNA断片の精製カラムを使用することができる)。
- 1%アガロースゲル上で未消化および消化されたDNAを実行し、DNA bの濃度を決定するyの分光計読取。 1%アガロースゲル上で5、および1:10の希釈およびDNAラダーと比較して定量化する:1、1:あるいは、1でサンプルを実行する。
- 0.1 M KClおよび0.5XトリスEDTAで消化されたRAG2-kRASG12D DNAの15 ng /μLでの最終濃度で注入ミックスを調製する。注入量の2 NLに注入された最終DNA量は30頁になります。
注:最大3つの異なるDNA構築物を効率的に胚あたりのDNAの60、PGの最大共注入することができる。これらの導入遺伝子は、ゲノムに組み込まになり、開発腫瘍26内共発現。 - 興味のあるゼブラフィッシュ株( 図1B)に27を説明するように、基本的に1細胞期胚に線形化されたRAG2-kRASG12Dを注入。注射は細胞内ではなく、より高い効率のために卵黄で行ってください。この実験では、二重トランスジェニックAB-株では、Myf5の-GFP、mylpfa-mCherryを使用した。標準の飼育pを用いてゼブラフィッシュを上げるrotocols 28。
注:インジェクションの生存は頻繁に使用されるゼブラフィッシュひずみに依存している。平均して、注入した胚の30%はERMSを開発します。 300〜600胚は十分なGFP陽性とmCherryを陽性原発腫瘍を移植し、分析のために生成されることを保証するために、実験毎に注入されるべきである。
ゼブラフィッシュ幼虫におけるプライマリERMS 5.スクリーニング
- 10〜30日には、外部から見える主要ERMSの出現のための注射後から注入されたゼブラフィッシュを守ってください。
- 30日間の注射後に、蓋の動きが遅いと、魚がまだまで魚システムの水を含むペトリ皿にトリカインメタン(MS222 4 mg / mlのストック溶液)の単一の液滴を添加することにより、受信者のゼブラフィッシュを麻酔。
注:トリカイン麻酔の投与量は、受信者のゼブラフィッシュの年齢とサイズに依存します。原発腫瘍を持つゼブラフィッシュトリカインの低用量を必要とする。 - 主要ERMS-ベアリングを選択落射蛍光顕微鏡を用いて、陽性とmylpfa-mCherryを陽性Myf5の-GFPである魚。
6. ERMS腫瘍の準備
- 10分間または全く蓋の動きが明らかにされなくなるまで1.6 mg / mlのトリカインメタン(MS222)で選択された一次ERMS·ベアリング·ゼブラフィッシュを生け贄に捧げる。
- 個別に各担癌ゼブラフィッシュを処理します。きれいなペトリ皿に魚を置き、カミソリの刃と細かい鉗子( 図1Bに示すように)を使用して、腫瘍の周りに解剖する。きれいなペトリ皿に解剖し、腫瘍組織を転送します。
- 5%ウシ胎児血清(FBS)を補充した予備冷却0.9Xリン酸緩衝生理食塩水(PBS)の100μlのを追加。 > 20回クリーンなかみそりの刃でミンチ組織の細胞は均一な懸濁液になるまで。
- ピペットチップフィルター1000μlのを用いて細胞を解離するには、上下に数回、同じ緩衝液900μlの(0.9X PBS + 5%FBS)、ピペットを追加します。 40&を通じてフィルター#956;対応する50ミリリットルコニカルチューブにMメッシュストレーナー。氷の上に保管してください。
- バッファの追加の2〜4ミリリットルでペトリ皿を洗って、そして同じメッシュストレーナーを通って、対応するコニカルチューブに渡す。
- 4℃で10分間1000×gで、少なくとも遠心分離機。
- バッファー100μlの上清と再懸濁を捨てる。
- トリパンブルー色素と血球計数器を用いて生存細胞の総数をカウントします。
- 同じ緩衝液で所望の濃度に細胞を希釈する(0.9X PBS + 5%FBS)。細胞は、レシピエントあたり2.5×10 4細胞の合計で、受信者のゼブラフィッシュあたり5μLを移植するために/μlの5×10 3個の細胞に希釈してください。
- フローサイトメトリー分析は、サンプル内の蛍光細胞の相対比率を量子化するステップ6.5からの懸濁液の少量を行うことができる。
注:(ステップ3.5におけるフィルタリング以下)脇に100μlの細胞懸濁液を設定し、400μlの希釈するフローサイトメトリー分析のための0.9X PBS + 5%FBSの懸濁バッファーの。適切なゲーティングを確保するために、大人の野生型、Myf5の-GFPとmylpfa-mCherryを魚から分離され、単一のトランスジェニック腫瘍組織や筋肉を使用して追加の分析を行う。第1のステップ2で説明したように、基本的にフローサイトメトリーを実行します。
アダルトRAG2ホモ接合変異体ゼブラフィッシュへのERMSの7.移植
- に描画し、70%エタノール(5回)、続いて10%の漂白剤溶液(5回)、放出によって10μlの26S Gマイクロシリンジを清掃し、その後、懸濁緩衝液、続いて(0.9X PBS + 5%FBS、10倍)。
- 蓋の動きが遅く、魚がまだあるまで、システムの水に魚を含むペトリ皿にトリカインメタン(MS222 4 mg / mlのストック溶液)の単一の液滴を添加することにより、受信者ホモ接合RAG2変異魚を麻酔。
- 湿ったペーパータオルまたはSPOに麻酔をかけ、受信者のゼブラフィッシュを配置腹側を上にして、NGE。
- 腹腔(受信者ごとに2.5×10 4細胞)に細胞懸濁液の5μLを注入。
注:ステップ4.1で説明したように注射針が異なる腫瘍の注射の間にクリーニングする必要があります。 5〜10μlを効率的にレシピエント魚のサイズに応じて、腹腔内に移植することができる。腫瘍移植は、レシピエント魚あたり1×10 4〜5×10 5個のソートされていない細胞( 表1)を注入することによって達成することができる。 - 慎重にプラスチックのスプーンできれいなタンクに受信者のゼブラフィッシュを置く。
- 明視野および落射蛍光顕微鏡下で麻酔をかけた魚を撮影して、移植後30日間、10、20で生着率の受信者ゼブラフィッシュを評価する。
- 分化状態( 図3H)、標準的な組織学的ANALYを評価するために、蛍光活性化細胞選別(FACS)を含む下流のアプリケーションに移植された魚を活用sisの( 図3F)、撮像治療応答15、および/ または希釈分析11を制限するなどの連続移植アプローチ。
結果
免疫低下ホモ接合RAG2変異体ゼブラフィッシュにαアクチン-RFPトランスジェニックドナーからの骨格筋細胞を調製し、移植のための手順 (プロトコル·セクション1、 図1Aおよび図2)が実証されている。骨格筋組織は、αアクチン-RFPジェニックドナーから調製し、フローサイトメトリー分析( 図2B)は、以下のDAPI排除によって評価されるように得られた単一細胞懸濁液は、84.3%の生存細胞を含有していた。 RFP陽性細胞は、この単一の細胞懸濁液( 図2C)の35.3%を占めた。 (魚ごとに注入された1×10 6細胞、 表1、図2D-I)多核繊維への単一細胞の分化によって評価されるようRAG2ホモ接合変異体レシピエント魚の背側骨格筋への細胞の移植は、一貫性のある強力な生着につながった。 ワイルドにタイプ受信者 魚は30日間の実験(N = 13)を介して筋線維を生着しなかった。移植後10日目までに、14 RAG2ホモ接合変異体ゼブラフィッシュのうち9は、注射部位(64.3%、 図2E、F)の近くにRFP陽性の筋線維を含んでいた。重要なことは、移植されたRFP陽性筋(データは示されていない)115日後の生着のために追跡し、堅牢で永続的な筋肉の生着を示されている動物のサブセットと、30日後に移植( 図2G-I)を持続した。これらの結果は、同じプロトコル( 表1)を用いて我々のグループ23によって以前に報告されたものと同様である。
我々はまた、RAG2ホモ接合変異体レシピエント魚(プロトコルセクション2、 図1Bおよび図3)の腹腔にERMS腫瘍細胞の生成、準備と移植のための方法を提示している。 ERMS doublで生成された電子トランスジェニックMyf5の-GFP、腫瘍内の不均一性及び移植11以下の腫瘍細胞集団の機能解析の可視化を可能にすることが示されているmylpfa-mCherryを魚 。彼らは人生の10〜30日の間ERMSを開発し、腫瘍細胞の数は、下流の適用のために制限されている場合、魚が小さいので、各亜集団のさらなる分子的特徴付けが困難である。一つの解決策は、成人レシピエントゼブラフィッシュにERMSを移植することにより腫瘍細胞の数を拡大することである。現在までに、同様の実験を、CG1ひずみ同系の魚を使用して完了し、Myf5の-GFPトランスジェニックた同系株を開発するための戻し交配の4世代を超えて必要と; mylpfa-mCherryを 。これらの問題を回避するために、我々は、AB-ひずみゼブラフィッシュから主要ERMSを生着するための免疫低下RAG2ホモ接合変異体受信者のゼブラフィッシュの有用性を実証した。すべてのプライマリERMSは、RAに移植G2 腫瘍( 表1)の拡張を容易にホモ接合変異体動物。 0〜7の野生型の兄弟が病気23を生着しながら、24〜27のRAG2ホモ接合変異体ゼブラフィッシュは、ERMSを移植したところ、同様の結果が最近報告された。移植されたERMSの代表的な例は、 図3Eで30日後に、移植に示されている。移植されたERMSは、原発腫瘍( 図3B及び3F)で見られるのと同様胎児性横紋筋肉腫の組織学的特徴を共有する。 FACS分析は、それがMyf5の-GFPおよび/ またはmylpfa-mCherryを発現する細胞および分化した細胞を増殖させる含ま機能的に異なる腫瘍をERMSを確認した。腹腔内注入処置後の生存率は95%を超えていた。受信者のゼブラフィッシュは、一般的に30日間移植後の時点の後に腫瘍負荷から屈する。
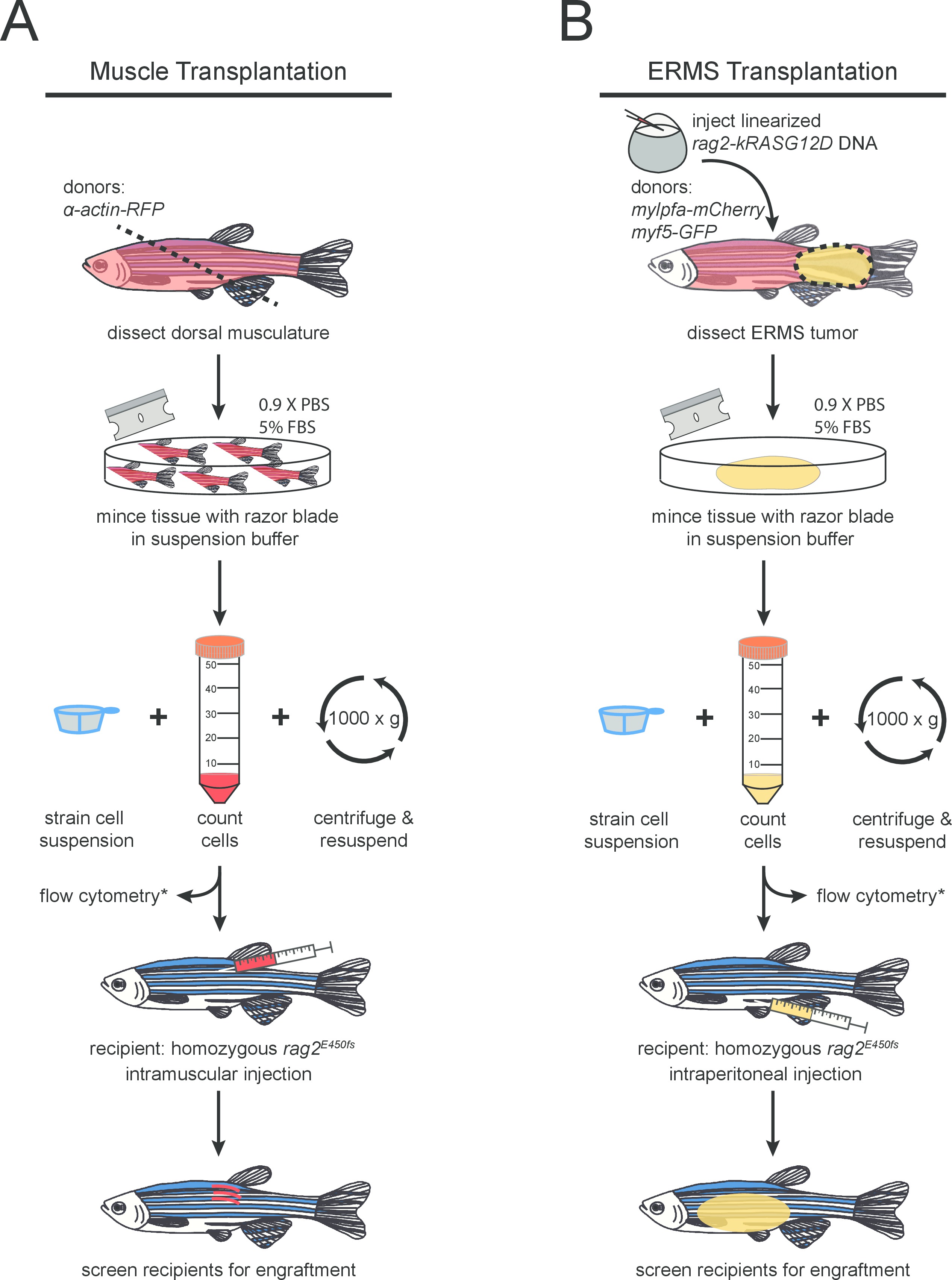
(A)正常および(B)RAG2ホモ接合変異体に悪性の骨格筋細胞の移植のために、図1のプロトコルの概略図 ゼブラフィッシュ。オプションのステップは、(*)が付いています。

RAG2ホモ接合変異体ゼブラフィッシュに図2.骨格筋生着。(A)α アクチン-RFPトランスジェニックドナーゼブラフィッシュ。 (B)単離された筋細胞懸濁液の細胞生存率DAPI色素排除によって評価し、フローサイトメトリー。 野生型対照と比較して、(C)αアクチン-RFP供与体(赤)から筋肉細胞懸濁液内に見出さRFP陽性細胞の割合、(灰色)。 (DE)は 30日、移植後に明視野と野生型動物の蛍光像(D)またはRAG2ホモ接合変異魚(E)を吸収合併。時間の経過(F)生着率。グレーは、非生着魚を示している赤生着動物の数を表す。各時点で分析された動物の数が示されている。時間(矢印)上の分化した筋線維の保持を示す(GI)10(G)に示すパネルEで囲み領域の高倍率画像20(H)および30(I)日後に移植。スケールバーは、2ミリメートルに等しい。 この図の拡大版をご覧になるにはこちらをクリックしてください。

Myf5の-GFPの図3.移植、RAG2ホモ接合変異体にmylpfa-mCherryを ERMS ゼブラフィッシュ AB-歪みMyf5の-GFPで生ずる(AD)RAG2-kRASG12D誘発される主要ERMS。人生の30日目でmylpfa-mCherryをゼブラフィッシュ。 (EH)RAG2ホモ接合変異体ゼブラフィッシュERMSを移植し、移植後30日目に分析した。 (A、E)は、明視野および一次移植ERMSの蛍光像を吸収合併。腫瘍領域は、概説されており、矢印はEで注射部位を示す。 (B、F)、ヘマトキシリンおよび癌に関連した増加した細胞性の領域を示す主要(B)のエオシン染色パラフィン切片および生着ERMS(F)。 (C、G)DAPI色素排除によって評価し、フローサイトメトリーなどの細胞生存率。 (D、H)蛍光腫瘍細胞の亜集団は、フローサイトメトリーによって評価した。スケールバーは、2mm(A、E)と50ミクロン(B、F)に等しくなる。 この図の拡大版をご覧になるにはこちらをクリックしてください。
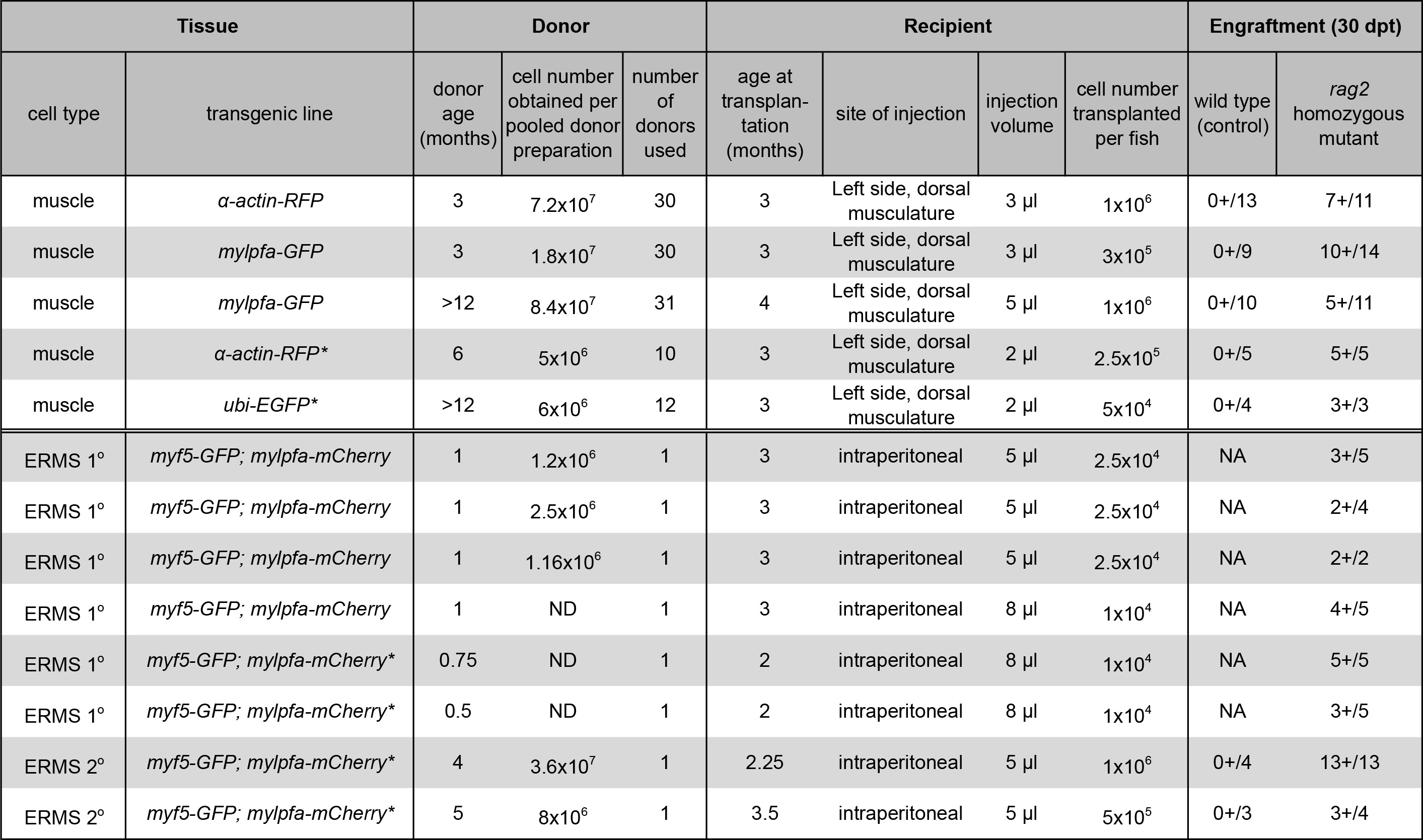
表筋肉およびERMS細胞移植1.生着を生じる。(*)は、以前に同じ技術23を使用してデータを報告して示している。データは、 自然法の許可を得て転載されている。 この表の拡大版を表示するには、こちらをクリックしてください。
ディスカッション
大人の背側骨格筋の効率的かつ堅牢な生着がRAG2ホモ接合変異魚の背側筋組織への細胞の注入に続いて、非常に単純な細胞調製法を用いて達成された。一般的には、筋肉内注射手順は、いくつかの関連した死亡は、直ちに実験に応じて10%〜35%の範囲の、移植手順を、以下に、非常に堅牢であった。さらなる最適化は、おそらく細胞を移植することを容易にするであろう顕微鏡およびマイクロマニピュレーターを用いて静止注入装置の注入および開発のためのより小さなゲージの針の使用を中心に説明する。我々のアプローチは、ドナー動物からのソートされていない筋細胞を使用し、わずか約30%の筋前駆細胞を含んでいた。おそらくレシピエント魚に増加生着につながる濃縮細胞懸濁液を提供する幹細胞及びFACS分離を標識ジェニックレポーター株の使用。骨格筋cは以前に29を説明するようのエルはまた、移植前に濃縮し、培養することができた。驚くべきことに、我々の結果はまた、10日には、筋肉の生着と再生を評価するための堅牢で高速な実験プラットフォームとして、このモデルを確立し、移植を投稿する前に、ニッチの確立とドナー筋肉組織の分化の段階が起こることを示している。さらに、これらの実験は全く心臓毒またはバリウムと塩化筋肉の損傷前は30,31の生着する前に二日を必要とされているマウス、年に完成したものと対比。これは、移植手順の間に生成針傷害は、レシピエント動物32,33内の再生環境の産生を刺激することによって、生着を増強する可能性がある。また、初期の骨格筋の発達に影響を与える遺伝的変異の評価を可能にする手法を容易に若いゼブラフィッシュから骨格筋組織の移植に適合されることを想定ししかし幼虫の段階で致死性につながる。
我々はまた、非エアコン、RAG2ホモ接合変異体魚に腹腔内注射によってゼブラフィッシュERMSの生着のための詳細なプロトコルを提供してきた。このアプローチは、同系トランスジェニック系統内の腫瘍を発生させるため必要とせずに二重トランスジェニック原発腫瘍の拡大のために有用であった。我々の最近の研究は、細胞移植のアプローチは、単一の腫瘍は、動物の数千に拡大および増殖、自己再生および新生血管15に対する効果について評価することができるin vivoでの ERMSの薬剤感受性を評価するための新規な実験モデルを提供することが示されている。さらに、我々が正常T細胞急性リンパ芽球性白血病、黒色腫、およびERMS 23を含むRAG2ホモ接合変異体魚に腫瘍の広い範囲を移植されている。未来に向かってみると、これらの行は癌の重要な機能特性を評価するのに有用であろう思い描く腫瘍内の不均一性、浸潤、転移、血管新生、および治療 抵抗性を評価することを含む、インビボ。また、光学的に透明なキャスパー株ゼブラフィッシュ34 RAG2ホモ接合変異魚の発生可能性が高い癌のこれらの特徴の多くを直接イメージングを容易にする。
合計では、我々はゼブラフィッシュを損なわ大人RAG2ホモ接合変異体の免疫にログイン蛍光標識正常および悪性骨格筋の正常な生着のための詳細なプロトコルを提供する。
開示事項
The authors have no competing financial interests.
謝辞
この作品は、財団(DML)、米国癌協会(DML)、MGHハワードグッドマンフェローシップ(DML)、および米国国立衛生研究所の助成金をスタンドアレックスのレモネードでサポートされていR24OD016761と1R01CA154923(DML)。 CNYフローサイトメトリーコアおよびフロー画像解析、共有計装助成金番号1S10RR023440-01A1。 IMTは、科学技術のためのポルトガル語財団( - FCTFundaçãoパラCiênciaEテクノロジア)からフェローシップによって資金を供給されている。 QTは、中国の奨学金評議会によって運営されている。私たちは彼女の有益なコメントやアドバイスをアンジェラVolorioに感謝。
資料
| Name | Company | Catalog Number | Comments |
| Tris-EDTA buffer solution 1x | Sigma-Aldrich | 93283-100ML | Microinjection. Injection mix. |
| Potassium Chloride | Fisher Science Education | S77375-1 | Microinjection. Injection mix. |
| XhoI Restriction Enzyme | New England Biolabs | R0146S | Microinjection. Plasmid linearization. |
| QIAquick PCR Purification Kit | Qiagen | 28104 (50) or 28106 (250) | Microinjection. For purification of linearized plasmid up to 10 kb. |
| Phenol/Chloroform/Isoamyl Alcohol | Fisher Scientific | BP1753I-100 | Microinjection. For purification of linearized plasmid. |
| UltraPure Agarose, 500 g | Invitrogen | 16500-500 | Microinjection. Linearized plasmid quantification. |
| Nanodrop 2000 Spectrophotometer | Thermo Scientific | http://www.nanodrop.com/Productnd2000overview.aspx | Microinjection. Linearized plasmid quantification. |
| DAPI (4',6-diamidino-2-phenylindole, dihydrochloride) | Life Technologies | D1306 | flow cytometry/FACS |
| 5 ml polystyrene round bottom tube | BD Falcon | 352058 | flow cytometry collection tube |
| BD FACSAria II | BD Biosciences | Special Order Research Products (SORP) program | FACS |
| 5 ml polypropylene round bottom tube | BD Falcon | 352063 | FACS collection tube |
| BD LSR II | BD Biosciences | Special Order Research Products (SORP) program | flow cytometry |
| Phosphate Buffered Saline, pH 7.4 (1x) | Life Technologies | 10010-023 | transplantation |
| Fetal Bovine Serum | Omega Scientific | FB-01 | transplantation |
| Tricaine methanesulphonate (MS-222) | Western Chemical Inc. | http://www.wchemical.com/tricaine-s-ms-222.html | Transplantation. Anesthetic. Caution: Irritant. Irritating to eyes, respiratory system, and skin. |
| VWR Absorbent Bench Underpads | VWR | 56616-018 | Transplantation. Regular paper towels or sponge can be used as an alternative. |
| Singe Edge Industrial Razor Blades | VWR | 55411-050 | transplantation |
| Petri Dish, Polystryrene Disposable Sterile | VWR | 25384-302 | transplantation |
| Cell Strainer, 40 µm Nylon | Falcon-Corning Incorporated | 352340 | transplantation |
| 50 ml Centrifuge Tube | Corning Incorporated | 430828 | transplantation |
| Trypan Blue Stain (0.4%) | Life Technologies | 15250-061 | transplantation |
| Hemacytometer Set | Hausser Scientific | 1483 | transplantation |
| Hamilton syringe, fixed needle, volume 10 µl, needle size 26s ga (bevel tip) | Hamilton | 80366 | transplantation |
| Austin's A-1 Bleach, Commercial | James Austin Company | Transplantation. Any commercial solution can be used. | |
| Ethanol 190 Proof | Decon Labs, Inc. | DSP-MD.43 | Microinjection (linearized plasmid purification) and transplantation. Any commercial solution can be used. |
| High Speed Microcentrifuge, 300D Digital Microcentrifuge | Denville Scientific Inc. | C0265-24 | transplantation |
| Sorvall Legend XFR Centrifuge | Thermo Scientific | 75004539 | Transplantation. Catalog number for 120 V, 60 Hz (US). |
| 5 ml serological pipets | BD Falcon | 357529 | transplantation |
| Corning Stripettor Plus Pipetting Controller | Corning Incorporated | 4090 | Transplantation. Any automatic pipetting controller can be used. |
| Powder free examination gloves | All steps. Any commercial brand can be used. | ||
| Filter pipet tips and micropipettes | All steps. Any commercial brand can be used. | ||
| Dumont forceps #5 | Fine Science Tools | 11205-20 | transplantation |
| Fluorescent Stereomicroscope | Olympus | MVX10 | Scoring. Any appropriate fluorescent stereomicroscope can be used. |
| Olympus DP72 microscope digital camera | Olympus | DP72 | Scoring. Multiple adequate cameras for the selected imaging system can be used. |
参考文献
- Gemberling, M., Bailey, T. J., Hyde, D. R., Poss, K. D. The zebrafish as a model for complex tissue regeneration. Trends in genetics TIG. 29 (11), (2013).
- Boatman, S., Barrett, F., Satishchandran, S., Jing, L., Shestopalov, I., Zon, L. I. Assaying hematopoiesis using zebrafish. Blood cells, molecule., & diseases. 51 (4), 271-276 (2013).
- Langenau, D. M., Traver, D., et al. Myc-induced T cell leukemia in transgenic zebrafish. Science. 299 (5608), 887-890 (2003).
- Yang, H. W., Kutok, J. L., et al. Targeted Expression of Human MYCN Selectively Causes Pancreatic Neuroendocrine Tumors in Transgenic Zebrafish Targeted Expression of Human MYCN Selectively Causes Pancreatic Neuroendocrine Tumors in Transgenic Zebrafish. Cancer Research. , 7256-7262 (2004).
- Patton, E. E., Widlund, H. R., et al. BRAF mutations are sufficient to promote nevi formation and cooperate with p53 in the genesis of melanoma. Current Biology. 15 (3), 249-254 (2005).
- Sabaawy, H. E., Azuma, M., Embree, L. J., Tsai, H. -. J., Starost, M. F., Hickstein, D. D. TEL-AML1 transgenic zebrafish model of precursor B cell acute lymphoblastic leukemia. Proceedings of the National Academy of Sciences of the United States of America. 103 (41), 15166-15171 (2006).
- Langenau, D. M., Keefe, M. D., et al. . Effects of RAS on the genesis of embryonal rhabdomyosarcoma. Gene. 21 (11), 1382-1395 (2007).
- Le, X., Langenau, D. M., Keefe, M. D., Kutok, J. L., Neuberg, D. S., Zon, L. I. Heat shock-inducible Cre/Lox approaches to induce diverse types of tumors and hyperplasia in transgenic zebrafish. Proceedings of the National Academy of Sciences of the United States of America. 104 (22), 9410-9415 (2007).
- Park, S. W., Davison, J. M., Rhee, J., Hruban, R. H., Maitra, A., Leach, S. D. Oncogenic KRAS induces progenitor cell expansion and malignant transformation in zebrafish exocrine pancreas. Gastroenterology. 134 (7), 2080-2090 (2008).
- Zhuravleva, J., Paggetti, J., et al. MOZ/TIF2-induced acute myeloid leukaemia in transgenic fish. British journal of haematology. 143 (3), 378-382 (2008).
- Ignatius, M. S., Chen, E. Y., et al. In vivo imaging of tumor-propagating cells, regional tumor heterogeneity, and dynamic cell movements in embryonal rhabdomyosarcoma. Suppl Data. Cancer cell. 21 (5), 680-693 (2012).
- Blackburn, J. S., Liu, S., et al. Clonal Evolution Enhances Leukemia-Propagating Cell Frequency. Cancer cell. 25 (3), 366-378 (2014).
- Blackburn, J. S., Langenau, D. M. Zebrafish as a model to assess cancer heterogeneity, progression and relapse. Disease model. 7 (7), 755-762 (2014).
- Zhao, C., Wang, X., et al. A novel xenograft model in zebrafish for high-resolution investigating dynamics of neovascularization in tumors. PloS one. 6 (7), e21768 (2011).
- Chen, E. Y., DeRan, M. T., et al. Glycogen synthase kinase 3 inhibitors induce the canonical WNT/β-catenin pathway to suppress growth and self-renewal in embryonal rhabdomyosarcoma. Proceedings of the National Academy of Sciences of the United States of America. 111 (14), 5349-5354 (2014).
- Yang, X. -. J., Cui, W., et al. A novel zebrafish xenotransplantation model for study of glioma stem cell invasion. PloS one. 8 (4), e61801 (2013).
- Chapman, A., Fernandez del Ama, L., Ferguson, J., Kamarashev, J., Wellbrock, C., Hurlstone, A. Heterogeneous Tumor Subpopulations Cooperate to Drive Invasion. Cell Reports. 8 (8), 1-8 (2014).
- Smith, A. C. H., Raimondi, A. R., et al. High-throughput cell transplantation establishes that tumor-initiating cells are abundant in zebrafish T-cell acute lymphoblastic leukemia. Blood. 115 (16), 3296-3303 (2010).
- Iyengar, S., Houvras, Y., Ceol, C. J. Screening for melanoma modifiers using a zebrafish autochthonous tumor model. Journal of visualized experiments JoVE. (69), e50086 (2012).
- Mizgireuv, I., Revskoy, S. Y. Transplantable tumor lines generated in clonal zebrafish. Cancer research. 66 (6), 3120-3125 (2006).
- Streisinger, G., Walker, C., Dower, N., Knauber, D., Singer, F. Production of clones of homozygous diploid zebra fish (Brachydanio rerio). Nature. 291, 293-296 (1981).
- Blackburn, J. S., Liu, S., Langenau, D. M. Quantifying the frequency of tumor-propagating cells using limiting dilution cell transplantation in syngeneic zebrafish. Journal of visualized experiments JoVE. (53), e2790 (2011).
- Tang, Q., Abdelfattah, N. S., et al. Optimized cell transplantation using adult rag2 mutant zebrafish. Nature methods. 11, 821-824 (2014).
- Zhou, Q., Facciponte, J., Jin, M., Shen, Q., Lin, Q. Humanized NOD-SCID IL2rg–/– mice as a preclinical model for cancer research and its potential use for individualized cancer therapies. Cancer letters. 344 (1), 13-19 (2014).
- Higashijima, S., Okamoto, H., Ueno, N., Hotta, Y., Eguchi, G. High-frequency generation of transgenic zebrafish which reliably express GFP in whole muscles or the whole body by using promoters of zebrafish origin. Developmental biology. 192 (2), 289-299 (1997).
- Langenau, D. M., Keefe, M. D. D. D., et al. Co-injection strategies to modify radiation sensitivity and tumor initiation in transgenic Zebrafish. Oncogene. 27 (30), 4242-4248 (2008).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. J Vis Exp. (25), 1-5 (2009).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Alexander, M. S., Kawahara, G., et al. Isolation and transcriptome analysis of adult zebrafish cells enriched for skeletal muscle progenitors). Muscl, & nerve. 43 (5), 741-750 (2011).
- Motohashi, N., Asakura, Y., Asakura, A. Isolation, culture, and transplantation of muscle satellite cells. Journal of visualized experiments JoVE. (86), 1-7 (2014).
- Gerli, M. F. M., Maffioletti, S. M., Millet, Q., Tedesco, F. S. Transplantation of induced pluripotent stem cell-derived mesoangioblast-like myogenic progenitors in mouse models of muscle regeneration. J Vis Exp. (83), e50532 (2014).
- Siegel, A. L., Gurevich, D. B., Currie, P. D. A myogenic precursor cell that could contribute to regeneration in zebrafish and its similarity to the satellite cell. The FEBS journal. 280 (17), 4074-4088 (2013).
- Rowlerson, a., Radaelli, G., Mascarello, F., Veggetti, Regeneration of skeletal muscle in two teleost fish: Sparus aurata and Brachydanio rerio. Cell Tissue Res. 289 (2), 311-322 (1997).
- White, R. M., Sessa, A., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell stem cell. 2 (2), 183-189 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved