Method Article
Normais e malignas Transplante de Células Muscle em imunológico comprometido Adulto Zebrafish
Neste Artigo
Resumo
Here, we present a protocol for cell transplantation of zebrafish skeletal muscle and embryonal rhabdomyosarcoma (ERMS) into adult immune compromised rag2E450fs homozygous mutant zebrafish. This protocol allows for the efficient analysis of regeneration and malignant transformation of muscle cells.
Resumo
Zebrafish tornaram-se uma ferramenta poderosa para a avaliação do desenvolvimento, regeneração e câncer. Mais recentemente, protocolos de transplante de aloenxerto de células têm sido desenvolvidas que permitem o enxerto de células normais e malignas em irradiadas, singeneicos, e peixe-zebra adulto imune comprometido. Estes modelos, quando juntamente com protocolos de transplante de células otimizados permitir a rápida avaliação da função das células-tronco, a regeneração após lesão, e câncer. Aqui, apresentamos um método de transplante de células de adulto zebrafish músculo esquelético e rabdomiossarcoma embrionário (ERMS), um sarcoma pediátrica que compartilha características com o músculo embrionária, em imunológico comprometido adulto RAG2 E450fs peixe-zebra mutante homozigoto. É importante notar que estes animais carecem de células T e reduziram a função das células B, facilitar o enxerto de uma vasta gama de tecidos de animais dadores não relacionados. Os nossos protocolos optimizados mostram que marcado por fluorescência de células de músculo preparções de peixes-zebra transgénicos α-actina-RFP enxertar robustamente quando implantado na musculatura dorsal de RAG2 peixes mutantes homozigotos. Nós também demonstramos enxerto de ERMS fluorescentes-transgênica onde fluorescência está confinada às células com base no estado de diferenciação. Especificamente, foram criados em ERMS AB-estirpe myf5-GFP; mylpfa-mCherry animais transgénicos duplos e tumores injectados no peritoneu de peixe adulto imunológico comprometido. A utilidade destes protocolos se estende para o enxerto de uma grande variedade de células normais e malignas doadoras podem ser implantados na musculatura dorsal do peixe-zebra ou peritoneu de adulto.
Introdução
Peixe-zebra são um modelo excelente para estudos de regeneração, porque eles podem regenerar aletas amputados, bem como um cérebro danificado, retina, espinal medula, coração, músculo esquelético e de outros tecidos 1. Células-tronco e estudos regenerativos no peixe-zebra adulto em grande parte voltada para a caracterização da regeneração em resposta à lesão, enquanto a identificação de células-tronco e progenitoras de vários tecidos por transplante de células só recentemente foi explorado 2. Zebrafish também se tornaram cada vez mais utilizado para o estudo do câncer através da geração de modelos de cancro transgênicos que imitam doenças humanas 3-10.
No cenário de câncer, as abordagens de transplante de células tornaram-se amplamente adotada e permitir a avaliação dinâmica de processos importantes de câncer, incluindo a auto-renovação 11, a heterogeneidade funcional 12,13, neovascularização 14, proliferação,respostas de terapia 15 e invasão 16,17. No entanto, células enxertadas são muitas vezes rejeitadas a partir de peixes destinatário deverá acolher defesas imunitárias que atacam e matam o enxerto 18. Vários métodos têm sido utilizados para superar a rejeição das células enxertadas. Por exemplo, os animais receptores do sistema imune pode ser transitoriamente ablação por uma dose baixa de irradiação gama antes do transplante 18,19. No entanto, o sistema imune receptor irá recuperar por 20 dias pós-irradiação e matar células de dador 18. Alternativamente, o tratamento com dexametasona tem sido utilizada para suprimir a função de células T e B, fornecendo supressiva condicionado se encontra imune e facilitar o enxerto de uma vasta gama de tumores humanos para até 30 dias 14. Estas experiências requer dosagem de droga constante e são limitados para o estudo de tumores sólidos. Ensaios de enxerto a longo prazo usaram linhas sing�icos geneticamente idênticos 20-22, em que o doador e recipient células são imunes correspondido. No entanto, estes modelos requerem linhagens transgênicas de interesse a ser atravessado para o fundo singeneico por mais de quatro gerações para produzir linhas totalmente sing�icos. Para obviar a problemas de rejeição imunitária no receptor de peixe, o nosso grupo desenvolveu recentemente uma comprometida RAG2 E450fs mutante linha homozigótica (ZFIN designação alelo RAG2 fb101), que reduziram a função das células T e B e que permitam o enxerto de uma vasta gama de tecidos 23 imunológico. Similar imunocomprometidos modelos de rato foram utilizados extensivamente para o transplante de células de rato e de 24 tecidos humanos.
Aqui, apresentamos métodos para o transplante de músculo esquelético e rabdomiossarcoma embrionário (ERMS), um sarcoma pediátrica que compartilha características com o músculo esquelético, no RAG2 recentemente descrito homozigoto peixe-zebra mutante. A disponibilidade de um peixe-zebra adulto comprometido imuneexpande nossa capacidade de realizar estudos de transplante de células em grande escala para visualizar diretamente e avaliar com células-tronco auto-renovação dentro dos tecidos normais e malignas. Com este método, marcado por fluorescência a partir de preparações de células de músculo adulto α-actina-RFP 25 peixes-zebra transgénicos robustamente enxertar em RAG2 peixe-zebra mutante homozigótica após a injecção na musculatura dorsal. Além disso, demonstramos o enxerto e expansão da -GFP myf5 primário; mylpfa- ERMS transgênicos mCherry após a injeção intraperitoneal em RAG2 E450fs peixe-zebra mutante homozigoto. A utilidade destes protocolos ultrapassa os exemplos mostrados e pode ser facilmente aplicado a tecidos regenerados adicionais de peixe-zebra e cancros.
Protocolo
Todos os procedimentos com animais foram aprovados pelo Hospital Geral de Massachusetts Subcomissão de Investigação Animal Care, sob o protocolo nº 2011N000127.
Seção 1. Skeletal Muscle Transplante Celular em RAG2 Adulto E450fs Homozygous Mutant Zebrafish
1. Preparação de Zebrafish Adulto Doadores músculo esquelético Cells
- Obter peixe-zebra transgénicos adultos que tenham marcado por fluorescência muscular. Nesta experiência, 30 α -actina-RFP doador de peixe 25, foram utilizadas para transplantar 1 x 10 6 culas por peixe destinatário.
- Sacrifício do peixe-zebra dador em 1,6 mg / ml tricaina metanossulfonato (MS222) durante 10 minutos ou até que não haja movimento opérculo é evidente.
- Coloque o peixe doador em uma toalha de papel absorvente e especial sobre o consumo do músculo dorsal usando uma lâmina de barbear limpo. O corte deve ser feita perto do anus em um ângulo de 45 ° para maximizar a recolha de tecido (como observado na Figura 1A ). Coloque tecido dissecado em um ambiente limpo 10 centímetros placa de Petri.
- Adicionar 500 ul de tampão de suspensão (0,9x pré-arrefecida de tampão fosfato salino (PBS) suplementado com 5% de Soro Fetal Bovino (FBS)) para o tecido dissecado. Até 10 dador de peixe-zebra pode ser colocado em conjunto neste volume.
- Picar o tecido com uma lâmina de barbear> 20 vezes até que as células estão em uma suspensão uniforme. Toda a musculatura dorsal é homogeneizado incluindo pele, ossos e barbatanas. Adicionar 2 ml de tampão de suspensão. Usando uma pipeta de 5 ml, tritura-se a suspensão de células ≥20 vezes para dissociar as células.
- Filtra-se a suspensão de células através de um coador de malha de 40 um para um tubo cónico de 50 ml colocados em gelo.
- Lava-se a placa de Petri com um adicional de 2,5 mL de tampão de suspensão para recolher tecido remanescente e filtra-se através do mesmo filtro e tubo cónico, para um volume final de 5 ml (10 dador de peixe pode ser usado por isolado).
NOTA: pele, os ossos e as aletas serão excluídos seguinte filtração. - Se for o caso, combine suspensões semelhantes para o mesmo tubo cônico.
- Contar o número total de células viáveis usando o corante azul de tripano e um hemocitómetro.
- Reservar 500 ul por citometria de fluxo, se desejado (opcional, passo 2).
- Centrifuga-se a suspensão de células 1000 xg, durante 10 min, a 4 ° C.
- Rejeitar sobrenadante e ressuspender as células em 3,33 x 10 5 células / mL (0,9 vezes PBS + 5% de FBS). No total, 3 ul será injectada por peixe receptor para um total de 1 x 10 6 células por recipiente (passo 3).
NOTA: Menos de 3 ul de suspensão de células deve ser transplantadas para o peixe destinatário. Se o número de células é limitante, tão baixa quanto 5 x 10 4 culas por receptor pode levar a enxerto com sucesso (Tabela 1).
2. Citometria de Fluxo de Análise de Doadores Skeletal Muscle celular Preparação (Opcional)
- Isolar o músculo de um tipo selvagem, peixes não-transgénicos como delineado in passo 1.1. Este exemplo serve como controlo negativo e é útil para definir portões Citometria de Fluxo.
- Adicionar um corante de viabilidade adequada. Por exemplo, adicionam-se 5 ml de solução de estoque de DAPI (500 ng / uL) em 500 uL de preparação de músculo. Vortex ligeiramente antes da análise. Adquirir 5 x outubro 3-1 x 10 4 eventos. Analisar amostras de controlo de tipo selvagem primeiro a colocar portões seguido por análise de células musculares isoladas a partir de peixes transgénicos.
NOTA: A citometria de fluxo de análise é geralmente realizada dentro de 1 hora após a dissecação do tecido muscular, tempo durante o qual as células dissecadas reter mais do que 60% de viabilidade (Figura 2). As células devem ser mantidas em gelo em todos os momentos. Viabilidade celular total pode ser reavaliado antes do transplante utilizando corante azul tripan e um hemocitômetro.
3. intramuscular Transplante de Células musculares esqueléticas em RAG2 Adulto Homozygous Mutant Zebrafish
- Limpe a 10 μ; L 26S G micro-seringa através da elaboração e expulsando solução a 10% de lixívia (5 vezes), seguido de etanol a 70% (5 vezes), e, em seguida, seguido de tampão de suspensão (0.9x PBS + 5% de FBS, 10 vezes).
- Anestesiar peixes 2-4 meses de idade homozigoto RAG2 mutante ou peixe tipo de destinatário selvagem (como controles) pela adição de gotas individuais de metano tricaina (MS222, 4 mg / ml solução estoque) em uma placa de Petri contendo o peixe em água do sistema até que os movimentos lentos opérculo e peixe são ainda.
NOTA: Dose de anestesia tricaina dependerá da idade e tamanho do peixe-zebra destinatário. - Coloque zebrafish destinatário anestesiados em uma toalha de papel úmido ou esponja, com o lado esquerdo virado para cima.
- Insira a agulha da seringa na musculatura látero-dorsal (consulte a Figura 1A). Certifique-se de que as injecções são efectuadas com um ângulo de 45 °. Injectar 3 ul da suspensão de células (preparado no passo 1.12) por peixe para um total de 1 x 10 6 células por recipiente.
- Transferir cuidadosamente zebrafish injetado em um tanque limpo usando uma colher de plástico para se recuperar.
- Avaliar zebrafish destinatário para as taxas de enxertia em 10, 20, 30 dias pós-transplante por imagem peixes anestesiados em campo brilhante e microscopia de epifluorescência.
Seção 2. Embryonal (ERMS) Transplantation em Adulto Homozygous RAG2 Mutant Zebrafish
4. DNA microinjeção de embriões Zebrafish
- Linearizar o plasmídeo RAG2-kRASG12D 7 por digestão de 10 ug de ADN com XhoI, a 37 ° C durante 6 h ou O / N.
- Purificar DNA por fenol padrão: clorofórmio e precipitado com etanol. Ressuspender em 20 ul de água desionizada (alternativamente, as colunas comerciais de purificação de fragmentos de ADN pode ser usado).
- Executar o ADN digerido e digerido num gel de agarose a 1% e determinar a concentração de ADN bleitura espectrômetro y. Alternativamente, as amostras de executar a 1: 1, 1: 5, 1:10 e diluições sobre um gel de agarose a 1% e quantificar comparado a uma escada de ADN.
- Prepara-se uma mistura de injecção a uma concentração final de 15 ng / uL de ADN digerido com RAG2-kRASG12D em KCI 0,1 M e Tris-EDTA 0,5x. A quantidade final de ADN injectado em 2 nl de volume de injecção será de 30 pg.
NOTA: Até três construções de DNA diferentes podem ser co-injetado em um máximo de 60 pg de DNA por embrião de forma eficiente. Estes transgenes se integram no genoma e co-expressas no tumor em desenvolvimento 26. - Injectar linearizado RAG2-kRASG12D em embriões de estádio de uma célula, essencialmente como descrito 27 em peixes-zebra de uma estirpe de interesse (Figura 1B). As injecções devem ser realizados na célula e não na gema para maior eficiência. Neste experimento, a dupla transgênico AB-tensão; myf5-GFP, mylpfa-mCherry foi usado. Levante zebrafish usando o padrão de criação protocols 28.
NOTA: sobrevivência Injection é muitas vezes dependente da cepa zebrafish utilizado. Em média, 30% dos embriões injectados irão desenvolver ERMS. 300-600 embriões devem ser injectada por experiência, a fim de assegurar que os tumores primários suficientes GFP-positiva e mCherry-positivos são gerados para o transplante e análise.
5. Triagem para ERMS primárias em Zebrafish Larvas
- Observe zebrafish injetado de 10 a 30 dias após a injeção para o surgimento de ERMS primárias visíveis externamente.
- Aos 30 dias após a injecção, anestesiar zebrafish destinatário adicionando gotas individuais de metano tricaina (MS222 solução stock 4 mg / ml) em uma placa de Petri contendo sistema de água de peixe até movimentos opérculo lento e peixes ainda estão.
NOTA: Dose de anestesia tricaina irá depender da idade e tamanho do peixe-zebra destinatário. Zebrafish portadores de tumores primários requerem doses mais baixas de tricaina. - Selecione ERMS-bearing primáriopeixes que são myf5-GFP -positivo e mylpfa-mCherry -positivo, utilizando um microscópio de epifluorescência.
6. ERMS Tumor Preparação
- Sacrifício peixe-zebra ERMS-rolamento primário seleccionado em 1,6 mg / ml tricaina metanossulfonato (MS222) durante 10 minutos ou até que não haja movimento opérculo é evidente.
- Processar cada peixe-zebra portadores de tumor separadamente. Coloque o peixe num prato de Petri limpo e dissecar em torno do tumor utilizando uma lâmina de barbear e uma pinça fina (como mostrado na Figura 1B). Transfira o tecido tumoral dissecados para um prato limpo Petri.
- Adicionar 100 ul de 0,9x pré-gelada de tampão de fosfato salino (PBS) suplementado com 5% de Soro Fetal Bovino (FBS). Mince tecido com uma lâmina de barbear limpo> 20 vezes até que as células estão em uma suspensão uniforme.
- Adicionar 900 ul do mesmo tampão (PBS 0,9x + 5% de FBS), pipetar para cima e para baixo várias vezes para dissociar células, utilizando um 1000 ul filtrados ponta da pipeta. Filtrar através de um 40 &# 956; m mesh peneira para o correspondente tubo de 50 ml. Guarde no gelo.
- Lava-se a placa de Petri com um adicional de 2-4 ml de tampão, e passam através do mesmo filtro de malha e para dentro do tubo cónico correspondente.
- Centrifugar a 1.000 xg, durante 10 min, a 4 ° C.
- Descartar o sobrenadante e ressuspender em 100 ul de tampão.
- Contar o número total de células viáveis usando o corante azul de tripano e um hemocitómetro.
- Dilui-se as células à concentração desejada no mesmo tampão (PBS 0,9x + 5% de FBS). As células devem ser diluídas a 5 x 10 3 células / ul de transplante de 5 ul por recipiente em peixes-zebra de um total de 2,5 x 10 4 culas por recipiente.
- A análise de citometria de fluxo também pode ser realizada com uma pequena quantidade da suspensão do passo 6.5 para quantizar as proporções relativas de células fluorescentes na amostra.
NOTA: Separe 100 ml de suspensão de células (após filtragem na etapa 3.5) e diluir com 400 ulde 0,9x PBS + 5% de FBS tampão de suspensão para análise de citometria de fluxo. Para garantir a correcta delimitação, realizar análises adicionais usando tecido tumoral transgênica única ou músculo isolado do tipo selvagem adulto, myf5-GFP e mylpfa-mCherry peixe. Execute Citometria de Fluxo essencialmente como descrito no passo 2 da secção 1.
7. Transplante de ERMS em Adulto RAG2 Homozygous Mutant Zebrafish
- Limpar a 10 ul 26S G micro-seringa através da elaboração e expulsando 10% de solução de lixívia (5 vezes), seguido de etanol a 70% (5 vezes), e, em seguida, seguido de tampão de suspensão (0.9x PBS + 5% de FBS, 10 vezes ).
- Anestesiar destinatário homozigoto peixes mutantes RAG2 adicionando gotas individuais de metano tricaina (MS222 / solução stock 4 mg ml) em uma placa de Petri contendo o peixe em água do sistema até que os movimentos são lentos e opérculo peixes ainda estão.
- Coloque zebrafish destinatário anestesiados em uma toalha de papel molhado ou spoESL, com o lado ventral para cima.
- Injectar 5 ul da suspensão de células para dentro da cavidade peritoneal (2,5 x 10 4 culas por recipiente).
NOTA: A agulha de injecção deve ser limpo entre as injecções de diferentes tumores, tal como descrito na etapa 4.1. 5 a 10 ul pode ser eficientemente transplantado intraperitonealmente, dependendo do tamanho do peixe destinatário. Tumor de enxerto pode ser realizada por injecção de 1 x 04-05 outubro x 10 5 células não separados por peixe destinatário (Tabela 1). - Com cuidado, coloque zebrafish destinatário em um tanque limpo com uma colher de plástico.
- Avaliar zebrafish destinatário para as taxas de enxertia em 10, 20, 30 dias pós-transplante por imagem peixes anestesiados em campo brilhante e microscopia de epifluorescência.
- Utilize peixes enxertada para aplicações a jusante, nomeadamente a triagem de fluorescência de células activadas (FACS) para avaliar o estado de diferenciação (Figura 3H), Analy histológica convencionalsis (Figura 3F), respostas de terapia de imagem 15, e / ou transplante de série se aproxima incluindo análise de diluição limitante 11.
Resultados
Um procedimento para a preparação e transplante de células do músculo esquelético de doadores transgênicos α-actina-RFP em imunológico comprometido homozigoto peixe-zebra mutante RAG2 Foi demonstrado (Protocolo ponto 1, a Figura 1A e Figura 2). O tecido muscular esquelético foi preparado a partir de doadores transgénicos-α-actina RFP e a suspensão de célula única resultante continha 84,3% de células viáveis, tal como avaliado por exclusão com DAPI seguinte análise de citometria de fluxo (Figura 2B). Células RFP-positivos composta de 35,3% desta suspensão de células individuais (Figura 2C). Transplante de células em músculo esquelético dorsal do peixe RAG2 homozigótico mutante receptor conduziu a enxerto consistente e forte, tal como avaliado por diferenciação de células individuais em fibras multinucleadas (1 x 10 6 células injectadas por peixe, Tabela 1, Figura 2D-I). Selvagem tipobeneficiário peixes o enxerto falhou fibras musculares durante a experiência de 30 dias (n = 13). Aos 10 dias após o transplante, 9 em cada 14 RAG2 do peixe-zebra mutante homozigótica continha fibras musculares RFP-positiva próximo do local de injecção (64,3%, Figura 2E, F). Importante, músculo-RFP positivo enxertada persistiu 30 dias pós-transplante (Figura 2G-I), com um subconjunto de animais a ser seguido durante 115 dias após a enxertia e exibindo enxertia músculo robusto e persistente (dados não mostrados). Estes resultados são semelhantes às descritas anteriormente pelo nosso grupo de 23 utilizando o mesmo protocolo (Tabela 1).
Nós também apresentamos um método para a geração, a preparação e a transplantação de células tumorais ERMS na cavidade peritoneal de peixe destinatário RAG2 homozigótico mutante (Protocolo ponto 2, Figura 1B e Figura 3). ERMS foram gerados em DOUBLe transgénico myf5-GFP; mylpfa-mCherry peixe que foram mostrados para permitir a visualização de heterogeneidade intra-tumoral e análise funcional de subpopulações de células de tumor após transplante de 11. No entanto, a melhor caracterização molecular de cada subpopulação é difícil porque os peixes são pequenos quando eles desenvolvem ERMS entre 10 a 30 dias de vida e o número de células tumorais são limitantes para aplicações a jusante. Uma solução consiste em expandir o número de células de tumor por enxertando ERMS em peixes-zebra receptor adulto. Até à data, experiências semelhantes foram concluídos utilizando-CG1 estirpe peixe singeneicos e necessária em excesso de 4 gerações de retrocruzamento para desenvolver linhas singeneicas que eram transgénicos para myf5-GFP; mylpfa-mCherry. Para contornar esses problemas, nós demonstraram a utilidade da imunológico comprometido RAG2 homozigoto zebrafish receptor mutante enxertar ERMS primárias a partir de um peixe-zebra AB-tensão. Todos os ERMS primárias em vós implantada em rag2 animais mutantes homozigóticos, facilitando a expansão do tumor (Tabela 1). Resultados semelhantes foram relatados recentemente, onde 24 dos 27 RAG2 peixe-zebra mutante homozigoto ERMS enxertadas, enquanto 0 de 7 selvagens irmãos tipo engrafted doença 23. Um exemplo representativo de uma ERMS enxertada é mostrado aos 30 dias pós-transplante na Figura 3E. Enxertada ERMS partilham características histológicas de rabdomiossarcoma embrionário, semelhante à encontrada no tumor primário (Figura 3B e 3F). A análise FACS confirmou que continha ERMS funcionalmente distinta células de tumor e células diferenciadas que expressam myf5-GFP e / ou mylpfa-mCherry propagação. As taxas de sobrevivência após o procedimento de injecção intraperitoneal foram em excesso de 95%. Zebrafish Destinatário geralmente sucumbem de carga tumoral após os 30 dias pós-transplante ponto de tempo.
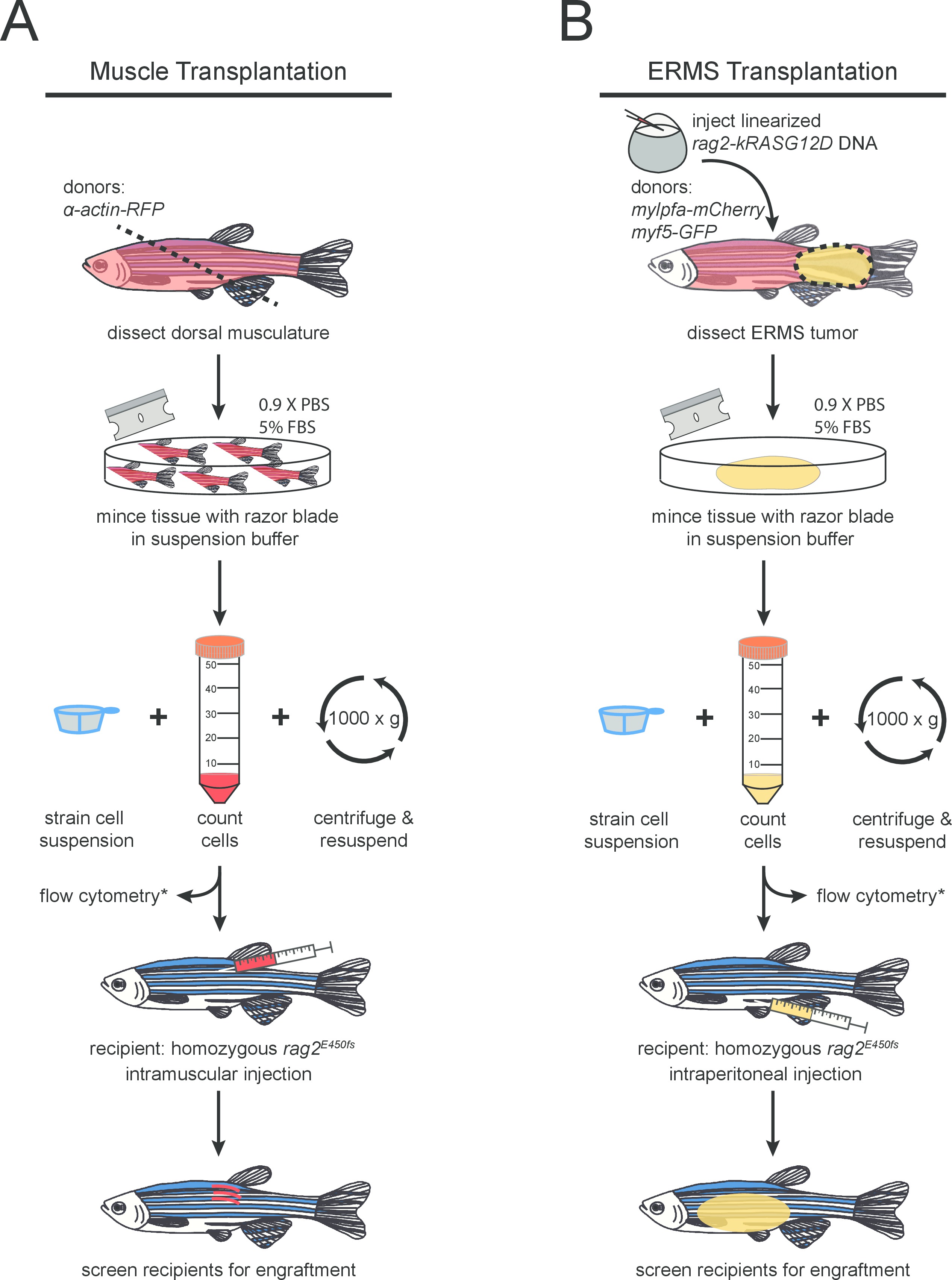
Figura 1. Protocolo esquemática para (A) normal e (B) a transplantação de células do músculo esquelético maligna para RAG2 mutante homozigótica peixe-zebra. etapas opcionais são marcados com (*).

Figura 2. enxerto do músculo esquelético em RAG2 homozigoto peixe-zebra mutante. (A)-α-actina RFP transgênico zebrafish doador. (B) A viabilidade celular de suspensão de células do músculo isolado, tal como avaliado por exclusão de corante de DAPI e citometria de fluxo. (C) Percentagem de células RFP-positivos encontrados dentro da suspensão de células do músculo do doador α-actina-RFP (vermelho), em comparação com um controlo do tipo selvagem(Cinza). (DE) Mesclado campo brilhante e imagens fluorescentes de animais selvagens do tipo (D) ou RAG2 peixe mutante homozigoto (E) aos 30 dias pós-transplante. taxas (F) ao longo do tempo o enxerto. Red indica número de animais enxertados enquanto cinza mostra peixes não enxertada. Número de animais analisados em cada ponto de tempo são indicados. (GI) imagens de ampliação alto da região em caixa em painel E mostradas na 10 (L), 20 (H) e 30 (I) dias pós-transplante, que mostra a retenção de fibras musculares diferenciadas ao longo do tempo (pontas de seta). Barras de escala igual a 2 mm. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 3. Transplantes de myf5-GFP; mylpfa-mCherry ERMS em mutante homozigótica RAG2 . peixe-zebra (AD) RAG2-kRASG12D ERMS primárias induzidas decorrentes AB-deformação myf5-GFP; zebrafish mylpfa-mCherry aos 30 dias de vida. (EH) RAG2 homozigoto peixe-zebra mutante enxertada com ERMS e analisados aos 30 dias pós-transplante. (A, E) de campo claro e imagens fluorescentes de ERMS primárias e transplantados mesclada. Área tumoral é delineado e ponta de seta indica local de injecção em E. (B, F) e hematoxilina-eosina parafina de primário (B) e ERMS enxertadas (F) mostrando as áreas de maior celularidade associada com o câncer. (C,G) A viabilidade celular, tal como avaliado por exclusão de corante de DAPI e citometria de fluxo. (D, H) sub-populações de células tumorais fluorescentes, como avaliado por citometria de fluxo. Barras de escala igual a 2 mm (A, E) e 50 mm (B, F). Por favor, clique aqui para ver uma versão maior desta figura.
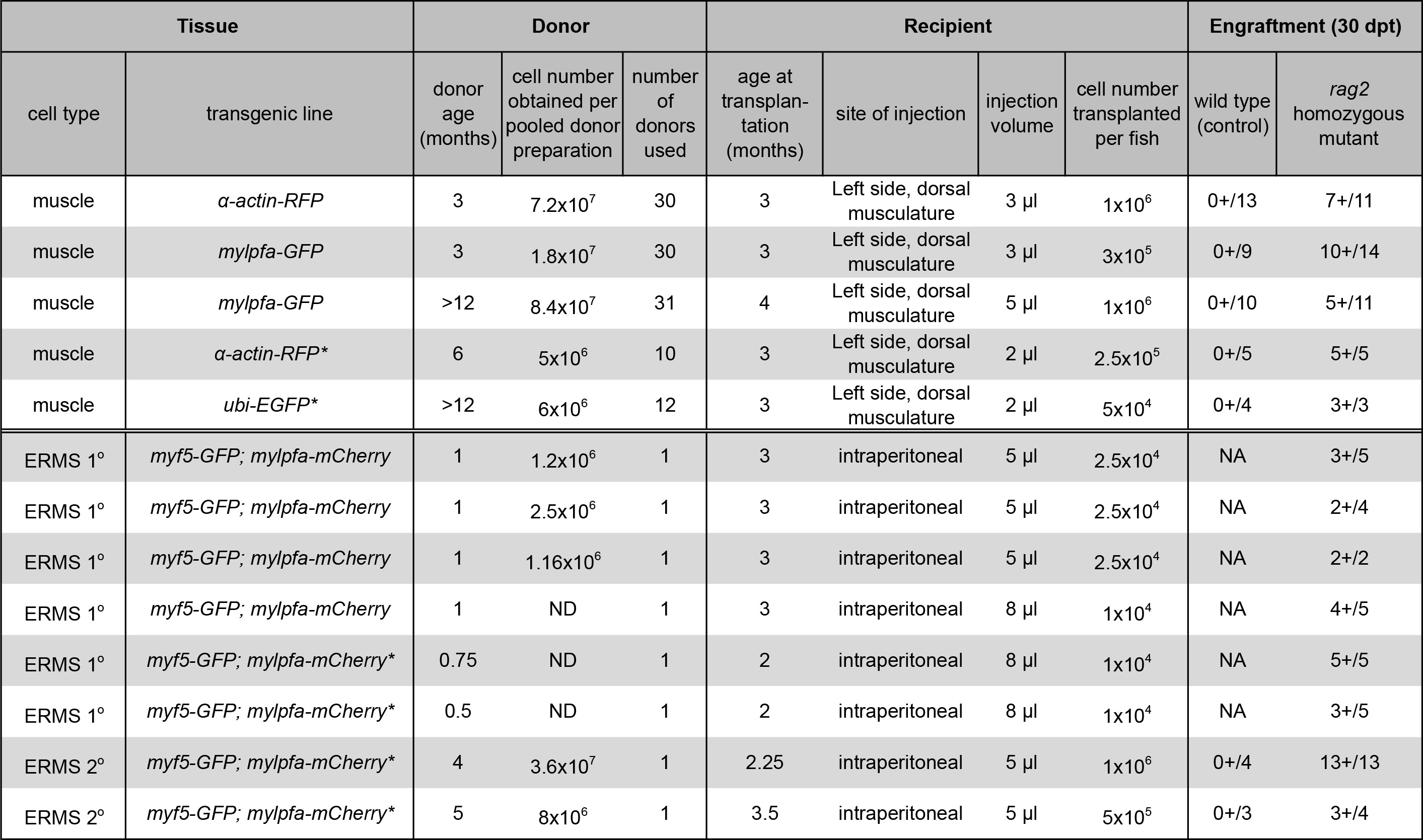
Tabela 1. Resultados de enxerto e transplante de células do músculo ERMS. (*) Indica dados previamente relatados utilizando as mesmas técnicas 23. Os dados são reproduzidos com autorização da Nature Methods. Por favor, clique aqui para ver uma versão maior desta tabela.
Discussão
Enxerto eficiente e robusta de adulto dorsal do músculo esquelético foi atingido com um método de preparação de células muito simples, seguidas por injecção de células na musculatura dorsal do peixe RAG2 mutante homozigótica. Em geral, os procedimentos de injecção por via intramuscular foram muito robusta, com alguma morte associada imediatamente após o procedimento de implante, que varia entre 10% a 35%, dependendo da experiência. Otimização adicionais provavelmente vai centrar-se na utilização de pequenas agulhas de calibre para injeção e desenvolvimento de aparelhos de injeção estacionário usando um microscópio e micromanipulator, o que facilitará a facilidade de implantação de células. Nossa abordagem também usou células musculares, não triados de animais dadores e continha apenas cerca de 30% de células progenitoras muscular. A utilização de linhas transgénicas repórter que rotulam células estaminais e FACS isolamento provavelmente irá fornecer suspensões de células enriquecidas que levam ao aumento enxerto em peixes destinatário. Músculo Esquelético cells também pode ser enriquecido e cultivadas antes do transplante, como anteriormente descrito 29. Notavelmente, os resultados indicam que os passos de estabelecimento de nicho e diferenciação de tecido muscular dador ocorre antes dos 10 dias pós-transplante, a construção deste modelo experimental como uma plataforma robusta e rápida para avaliar o enxerto ea regeneração musculares. Além disso, estas experiências duramente contrastam com os concluída em ratos, onde pré-lesão do músculo com cardiotoxina ou cloreto de bário é necessário dois dias antes enxerto 30,31. É provável que a lesão produzida agulha durante o procedimento de transplante de enxerto potencia, estimulando a produção de um ambiente de regeneração no animal receptor 32,33. Nós também prevêem que o nosso método irá ser facilmente adaptado para o transplante de tecido de músculo esquelético a partir de peixe-zebra mais novo, permitindo uma análise de mutações genéticas que afectam o desenvolvimento precoce do músculo esqueléticomas levar a letalidade nos estágios larvais.
Nós também fornecemos um protocolo detalhado para enxerto de ERMS peixe-zebra por injecção intraperitoneal em RAG2 peixes mutantes não-condicionado, homozigotos. Esta abordagem era útil para a expansão de tumores primários transgénicos duplos sem a necessidade de gerar tumores dentro de uma linha transgénica singeneicos. O nosso trabalho recente demonstrou que as abordagens de transplante de células fornecer novos modelos experimentais para avaliar a sensibilidade ERMS fármaco in vivo, em que um único tumor pode ser expandida em milhares de animais e avaliada pelos seus efeitos sobre o crescimento, a auto-renovação, e neovascularização 15. Por outro lado, temos enxertados com sucesso uma ampla variedade de tumores em peixes mutante homozigótica RAG2 incluindo células T de leucemia linfoblástica aguda, melanoma, e ERMS 23. Olhando para o futuro, nós encaramos essas linhas será útil para avaliar as propriedades funcionais importantes de câncer emvivo incluindo a avaliação heterogeneidade intra-tumoral, invasão, metástase, angiogénese, e resistência à terapia. Além disso, a geração de RAG2 homozigótico mutante peixe na opticamente clara Casper estirpe zebrafish 34 irá provavelmente facilitar imagiologia directa de muitas destas características de cancro.
No total, nós fornecemos protocolos detalhados para o sucesso do enxerto, de músculo esquelético fluorescently marcado normal e maligno em RAG2 para adulto homozigoto mutante zebrafish imune comprometido.
Divulgações
The authors have no competing financial interests.
Agradecimentos
Este trabalho é apoiado por Alex Lemonade Fique Foundation (DML), American Cancer Society (DML), o MGH Howard Goodman Fellowship (DML) e dos Institutos Nacionais de Saúde concede R24OD016761 e 1R01CA154923 (DML). CNY Citometria de Fluxo Core e Análise de Fluxo de imagem, instrumentação compartilhada número de concessão 1S10RR023440-01A1. IMT é financiado por uma bolsa da Fundação Português para a Ciência e Tecnologia (Fundação para a Ciência e Tecnologia - FCT). QT é financiado pelo Conselho de Bolsas de Estudo China. Agradecemos Angela Volorio por seus comentários úteis e conselhos.
Materiais
| Name | Company | Catalog Number | Comments |
| Tris-EDTA buffer solution 1x | Sigma-Aldrich | 93283-100ML | Microinjection. Injection mix. |
| Potassium Chloride | Fisher Science Education | S77375-1 | Microinjection. Injection mix. |
| XhoI Restriction Enzyme | New England Biolabs | R0146S | Microinjection. Plasmid linearization. |
| QIAquick PCR Purification Kit | Qiagen | 28104 (50) or 28106 (250) | Microinjection. For purification of linearized plasmid up to 10 kb. |
| Phenol/Chloroform/Isoamyl Alcohol | Fisher Scientific | BP1753I-100 | Microinjection. For purification of linearized plasmid. |
| UltraPure Agarose, 500 g | Invitrogen | 16500-500 | Microinjection. Linearized plasmid quantification. |
| Nanodrop 2000 Spectrophotometer | Thermo Scientific | http://www.nanodrop.com/Productnd2000overview.aspx | Microinjection. Linearized plasmid quantification. |
| DAPI (4',6-diamidino-2-phenylindole, dihydrochloride) | Life Technologies | D1306 | flow cytometry/FACS |
| 5 ml polystyrene round bottom tube | BD Falcon | 352058 | flow cytometry collection tube |
| BD FACSAria II | BD Biosciences | Special Order Research Products (SORP) program | FACS |
| 5 ml polypropylene round bottom tube | BD Falcon | 352063 | FACS collection tube |
| BD LSR II | BD Biosciences | Special Order Research Products (SORP) program | flow cytometry |
| Phosphate Buffered Saline, pH 7.4 (1x) | Life Technologies | 10010-023 | transplantation |
| Fetal Bovine Serum | Omega Scientific | FB-01 | transplantation |
| Tricaine methanesulphonate (MS-222) | Western Chemical Inc. | http://www.wchemical.com/tricaine-s-ms-222.html | Transplantation. Anesthetic. Caution: Irritant. Irritating to eyes, respiratory system, and skin. |
| VWR Absorbent Bench Underpads | VWR | 56616-018 | Transplantation. Regular paper towels or sponge can be used as an alternative. |
| Singe Edge Industrial Razor Blades | VWR | 55411-050 | transplantation |
| Petri Dish, Polystryrene Disposable Sterile | VWR | 25384-302 | transplantation |
| Cell Strainer, 40 µm Nylon | Falcon-Corning Incorporated | 352340 | transplantation |
| 50 ml Centrifuge Tube | Corning Incorporated | 430828 | transplantation |
| Trypan Blue Stain (0.4%) | Life Technologies | 15250-061 | transplantation |
| Hemacytometer Set | Hausser Scientific | 1483 | transplantation |
| Hamilton syringe, fixed needle, volume 10 µl, needle size 26s ga (bevel tip) | Hamilton | 80366 | transplantation |
| Austin's A-1 Bleach, Commercial | James Austin Company | Transplantation. Any commercial solution can be used. | |
| Ethanol 190 Proof | Decon Labs, Inc. | DSP-MD.43 | Microinjection (linearized plasmid purification) and transplantation. Any commercial solution can be used. |
| High Speed Microcentrifuge, 300D Digital Microcentrifuge | Denville Scientific Inc. | C0265-24 | transplantation |
| Sorvall Legend XFR Centrifuge | Thermo Scientific | 75004539 | Transplantation. Catalog number for 120 V, 60 Hz (US). |
| 5 ml serological pipets | BD Falcon | 357529 | transplantation |
| Corning Stripettor Plus Pipetting Controller | Corning Incorporated | 4090 | Transplantation. Any automatic pipetting controller can be used. |
| Powder free examination gloves | All steps. Any commercial brand can be used. | ||
| Filter pipet tips and micropipettes | All steps. Any commercial brand can be used. | ||
| Dumont forceps #5 | Fine Science Tools | 11205-20 | transplantation |
| Fluorescent Stereomicroscope | Olympus | MVX10 | Scoring. Any appropriate fluorescent stereomicroscope can be used. |
| Olympus DP72 microscope digital camera | Olympus | DP72 | Scoring. Multiple adequate cameras for the selected imaging system can be used. |
Referências
- Gemberling, M., Bailey, T. J., Hyde, D. R., Poss, K. D. The zebrafish as a model for complex tissue regeneration. Trends in genetics TIG. 29 (11), (2013).
- Boatman, S., Barrett, F., Satishchandran, S., Jing, L., Shestopalov, I., Zon, L. I. Assaying hematopoiesis using zebrafish. Blood cells, molecule., & diseases. 51 (4), 271-276 (2013).
- Langenau, D. M., Traver, D., et al. Myc-induced T cell leukemia in transgenic zebrafish. Science. 299 (5608), 887-890 (2003).
- Yang, H. W., Kutok, J. L., et al. Targeted Expression of Human MYCN Selectively Causes Pancreatic Neuroendocrine Tumors in Transgenic Zebrafish Targeted Expression of Human MYCN Selectively Causes Pancreatic Neuroendocrine Tumors in Transgenic Zebrafish. Cancer Research. , 7256-7262 (2004).
- Patton, E. E., Widlund, H. R., et al. BRAF mutations are sufficient to promote nevi formation and cooperate with p53 in the genesis of melanoma. Current Biology. 15 (3), 249-254 (2005).
- Sabaawy, H. E., Azuma, M., Embree, L. J., Tsai, H. -. J., Starost, M. F., Hickstein, D. D. TEL-AML1 transgenic zebrafish model of precursor B cell acute lymphoblastic leukemia. Proceedings of the National Academy of Sciences of the United States of America. 103 (41), 15166-15171 (2006).
- Langenau, D. M., Keefe, M. D., et al. . Effects of RAS on the genesis of embryonal rhabdomyosarcoma. Gene. 21 (11), 1382-1395 (2007).
- Le, X., Langenau, D. M., Keefe, M. D., Kutok, J. L., Neuberg, D. S., Zon, L. I. Heat shock-inducible Cre/Lox approaches to induce diverse types of tumors and hyperplasia in transgenic zebrafish. Proceedings of the National Academy of Sciences of the United States of America. 104 (22), 9410-9415 (2007).
- Park, S. W., Davison, J. M., Rhee, J., Hruban, R. H., Maitra, A., Leach, S. D. Oncogenic KRAS induces progenitor cell expansion and malignant transformation in zebrafish exocrine pancreas. Gastroenterology. 134 (7), 2080-2090 (2008).
- Zhuravleva, J., Paggetti, J., et al. MOZ/TIF2-induced acute myeloid leukaemia in transgenic fish. British journal of haematology. 143 (3), 378-382 (2008).
- Ignatius, M. S., Chen, E. Y., et al. In vivo imaging of tumor-propagating cells, regional tumor heterogeneity, and dynamic cell movements in embryonal rhabdomyosarcoma. Suppl Data. Cancer cell. 21 (5), 680-693 (2012).
- Blackburn, J. S., Liu, S., et al. Clonal Evolution Enhances Leukemia-Propagating Cell Frequency. Cancer cell. 25 (3), 366-378 (2014).
- Blackburn, J. S., Langenau, D. M. Zebrafish as a model to assess cancer heterogeneity, progression and relapse. Disease model. 7 (7), 755-762 (2014).
- Zhao, C., Wang, X., et al. A novel xenograft model in zebrafish for high-resolution investigating dynamics of neovascularization in tumors. PloS one. 6 (7), e21768 (2011).
- Chen, E. Y., DeRan, M. T., et al. Glycogen synthase kinase 3 inhibitors induce the canonical WNT/β-catenin pathway to suppress growth and self-renewal in embryonal rhabdomyosarcoma. Proceedings of the National Academy of Sciences of the United States of America. 111 (14), 5349-5354 (2014).
- Yang, X. -. J., Cui, W., et al. A novel zebrafish xenotransplantation model for study of glioma stem cell invasion. PloS one. 8 (4), e61801 (2013).
- Chapman, A., Fernandez del Ama, L., Ferguson, J., Kamarashev, J., Wellbrock, C., Hurlstone, A. Heterogeneous Tumor Subpopulations Cooperate to Drive Invasion. Cell Reports. 8 (8), 1-8 (2014).
- Smith, A. C. H., Raimondi, A. R., et al. High-throughput cell transplantation establishes that tumor-initiating cells are abundant in zebrafish T-cell acute lymphoblastic leukemia. Blood. 115 (16), 3296-3303 (2010).
- Iyengar, S., Houvras, Y., Ceol, C. J. Screening for melanoma modifiers using a zebrafish autochthonous tumor model. Journal of visualized experiments JoVE. (69), e50086 (2012).
- Mizgireuv, I., Revskoy, S. Y. Transplantable tumor lines generated in clonal zebrafish. Cancer research. 66 (6), 3120-3125 (2006).
- Streisinger, G., Walker, C., Dower, N., Knauber, D., Singer, F. Production of clones of homozygous diploid zebra fish (Brachydanio rerio). Nature. 291, 293-296 (1981).
- Blackburn, J. S., Liu, S., Langenau, D. M. Quantifying the frequency of tumor-propagating cells using limiting dilution cell transplantation in syngeneic zebrafish. Journal of visualized experiments JoVE. (53), e2790 (2011).
- Tang, Q., Abdelfattah, N. S., et al. Optimized cell transplantation using adult rag2 mutant zebrafish. Nature methods. 11, 821-824 (2014).
- Zhou, Q., Facciponte, J., Jin, M., Shen, Q., Lin, Q. Humanized NOD-SCID IL2rg–/– mice as a preclinical model for cancer research and its potential use for individualized cancer therapies. Cancer letters. 344 (1), 13-19 (2014).
- Higashijima, S., Okamoto, H., Ueno, N., Hotta, Y., Eguchi, G. High-frequency generation of transgenic zebrafish which reliably express GFP in whole muscles or the whole body by using promoters of zebrafish origin. Developmental biology. 192 (2), 289-299 (1997).
- Langenau, D. M., Keefe, M. D. D. D., et al. Co-injection strategies to modify radiation sensitivity and tumor initiation in transgenic Zebrafish. Oncogene. 27 (30), 4242-4248 (2008).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. J Vis Exp. (25), 1-5 (2009).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Alexander, M. S., Kawahara, G., et al. Isolation and transcriptome analysis of adult zebrafish cells enriched for skeletal muscle progenitors). Muscl, & nerve. 43 (5), 741-750 (2011).
- Motohashi, N., Asakura, Y., Asakura, A. Isolation, culture, and transplantation of muscle satellite cells. Journal of visualized experiments JoVE. (86), 1-7 (2014).
- Gerli, M. F. M., Maffioletti, S. M., Millet, Q., Tedesco, F. S. Transplantation of induced pluripotent stem cell-derived mesoangioblast-like myogenic progenitors in mouse models of muscle regeneration. J Vis Exp. (83), e50532 (2014).
- Siegel, A. L., Gurevich, D. B., Currie, P. D. A myogenic precursor cell that could contribute to regeneration in zebrafish and its similarity to the satellite cell. The FEBS journal. 280 (17), 4074-4088 (2013).
- Rowlerson, a., Radaelli, G., Mascarello, F., Veggetti, Regeneration of skeletal muscle in two teleost fish: Sparus aurata and Brachydanio rerio. Cell Tissue Res. 289 (2), 311-322 (1997).
- White, R. M., Sessa, A., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell stem cell. 2 (2), 183-189 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados