Method Article
Normali e maligne trapianto muscolare cellulare in immunitario compromesso Zebrafish adulti
In questo articolo
Riepilogo
Here, we present a protocol for cell transplantation of zebrafish skeletal muscle and embryonal rhabdomyosarcoma (ERMS) into adult immune compromised rag2E450fs homozygous mutant zebrafish. This protocol allows for the efficient analysis of regeneration and malignant transformation of muscle cells.
Abstract
Zebrafish sono diventati un potente strumento per la valutazione dello sviluppo, rigenerazione, e il cancro. Più di recente, i protocolli di trapianto di cellule del trapianto sono stati sviluppati che permesso l'attecchimento delle cellule normali e maligne in irradiati, singenici, e immune zebrafish adulto compromesso. Questi modelli quando accoppiati con i protocolli di trapianto di cellule ottimizzati consentono la rapida valutazione della funzione delle cellule staminali, la rigenerazione dopo un trauma, e il cancro. Qui, vi presentiamo un metodo per il trapianto di cellule di zebrafish adulto muscolo scheletrico e rabdomiosarcoma embrionale (ERMS), un sarcoma pediatrico che condivide caratteristiche con il muscolo embrionale, in immunitario compromesso adulto RAG2 E450fs omozigote zebrafish mutante. È importante sottolineare che questi animali mancano di cellule T e hanno ridotto la funzione delle cellule B, favorendo l'attecchimento di una vasta gamma di tessuti da donatori non imparentati. I nostri protocolli ottimizzati mostrano che fluorescente muscolari prepar cellularezioni di α-actina-RFP zebrafish transgenico innestare robusto quando impiantato nella muscolatura dorsale del pesce mutante omozigote RAG2. Dimostriamo anche attecchimento di ERMS fluorescenti transgenici in cui la fluorescenza è limitata alle cellule in base allo stato di differenziazione. In particolare, sono stati creati in ERMS AB-deformazione Myf5-GFP; mylpfa-mCherry doppie animali transgenici e tumori iniettati nel peritoneo di adulti immune pesce compromesso. L'utilità di questi protocolli estende ad attecchimento di una vasta gamma di cellule donatori normali e maligne che può essere impiantato in muscolatura dorsale o peritoneo di zebrafish adulti.
Introduzione
Zebrafish sono un ottimo modello per studi di rigenerazione perché possono rigenerare pinne amputata, così come un cervello danneggiato, retina, midollo spinale, cuore, muscoli scheletrici e altri tessuti 1. Stem Cell e gli studi di rigenerazione in zebrafish adulti hanno in gran parte focalizzata sulla caratterizzazione di rigenerazione in risposta al danno, mentre l'identificazione delle staminali e progenitrici cellule di vari tessuti per il trapianto di cellule solo recentemente è stata esplorata 2. Zebrafish sono diventati sempre più utilizzato per lo studio del cancro attraverso la generazione di modelli di cancro transgenici che mimano la malattia umana 3-10.
Nella cornice di cancro, approcci di trapianto di cellule sono ora ampiamente adottato e permettere la valutazione dinamica dei processi tumorali importanti, tra cui auto-rinnovamento 11, eterogeneità funzionale 12,13, neovascolarizzazione 14, la proliferazione,risposte terapia 15, e l'invasione 16,17. Tuttavia, le cellule trapiantate sono spesso respinti dal destinatario di pesce a causa di ospitare le difese immunitarie che attaccano e uccidono l'innesto 18. Diversi metodi sono stati utilizzati per superare il rigetto delle cellule trapiantate. Ad esempio, gli animali destinatari del sistema immunitario possono essere transitoriamente ablazione da una bassa dose di raggi gamma prima del trapianto 18,19. Tuttavia, il sistema immunitario destinatario recuperare di 20 giorni post-irraggiamento e uccidere le cellule del donatore 18. In alternativa, il trattamento desametasone è stato usato per sopprimere T e la funzione delle cellule B, fornendo più immunitaria soppressiva condizionata e facilitando l'attecchimento di una vasta gamma di tumori umani per 30 giorni 14. Questi esperimenti richiedono dosaggio farmaco costante e sono limitati a studiare dei tumori solidi. Saggi attecchimento a lungo termine hanno usato linee singenici geneticamente identici 20 - 22, dove il donatore e recipicellule ent sono immuni abbinato. Tuttavia, questi modelli richiedono linee transgeniche di interesse da attraversare in secondo piano singenico per più di quattro generazioni a produrre linee completamente singenici. Per ovviare a problemi di rigetto immunitario nel pesce destinatario, il nostro gruppo ha recentemente sviluppato un sistema immunitario compromesso RAG2 E450fs mutante omozigote (ZFIN designazione allele RAG2 FB101) linea che hanno ridotto la funzione delle cellule T e B e che permettono l'attecchimento di una vasta gamma di tessuti 23. Immunocompromessi modelli simili di topo sono stati ampiamente utilizzati per il trapianto di cellule di topo e di tessuti umani 24.
Qui, vi presentiamo i metodi per il trapianto del muscolo scheletrico e rabdomiosarcoma embrionale (ERMS), un sarcoma pediatrico che condivide caratteristiche con il muscolo scheletrico, nel RAG2 appena descritto omozigote zebrafish mutante. La disponibilità di un sistema immunitario compromesso zebrafish adultoespande la nostra capacità di eseguire studi di trapianto di cellule su larga scala di visualizzare direttamente e valutare cellule staminali di auto-rinnovamento all'interno dei tessuti normali e maligni. Con questo metodo, fluorescente preparazioni di cellule muscolari da adulti α-actina-RFP 25 zebrafish transgenico robusta innestare in RAG2 omozigote zebrafish mutante dopo l'iniezione nella muscolatura dorsale. Inoltre, dimostriamo attecchimento e l'espansione di primaria GFP Myf5; mylpfa- mCherry ERMS transgenici dopo l'iniezione intraperitoneale in RAG2 E450fs omozigote zebrafish mutante. L'utilità di questi protocolli va oltre gli esempi mostrati e può essere facilmente applicato ad altri tessuti rigenerativi zebrafish e tumori.
Protocollo
Tutte le procedure di animali sono state approvate dal Massachusetts General Hospital sottocommissione per la ricerca cura degli animali, ai sensi del protocollo # 2011N000127.
Sezione 1. muscolo scheletrico trapianto di cellule in RAG2 adulti E450fs omozigote Mutant Zebrafish
1. Preparazione di Zebrafish adulti donatori cellule del muscolo scheletrico
- Ottenere transgenico zebrafish adulto che hanno fluorescente muscolare. In questo esperimento, 30 α pesce actina-RFP donatore 25 sono stati utilizzati per trapiantare 1 x 10 6 cellule per pesci destinatario.
- Sacrificio zebrafish donatori in 1,6 mg / ml tricaine methanesulfonate (MS222) per 10 minuti o fino a quando nessun movimento opercolo è evidente.
- Mettere pesci donatori su un tovagliolo di carta assorbente e accise muscolo dorsale con una lama di rasoio pulito. Il taglio dovrebbe essere vicino all'ano ad un angolo di 45 ° per massimizzare la raccolta di tessuto (come indicato in figura 1A ). Collocare il tessuto sezionato in un ambiente pulito 10 centimetri piastra di Petri.
- Aggiungere 500 microlitri di buffer di sospensione (0.9x pre-raffreddata Phosphate Buffer Saline (PBS) supplementato con 5% siero fetale bovino (FBS)) per il tessuto sezionato. Fino a 10 zebrafish donatore può essere messo insieme in questo volume.
- Tritare il tessuto con una lametta> 20 volte fino cellule sono in una sospensione uniforme. L'intera muscolatura dorsale viene omogeneizzato tra cui pelle, ossa e pinne. Aggiungere 2 ml di tampone di sospensione. Con una pipetta 5 ml, triturare la sospensione cellulare ≥20 volte a dissociarsi cellule.
- Filtrare la sospensione cellulare attraverso un setaccio maglia 40 micron in una provetta conica da 50 ml posti su ghiaccio.
- Lavare la piastra di Petri con altri 2,5 ml di tampone di sospensione per raccogliere tessuto rimanente e filtrare attraverso lo stesso filtro e tubo conico, per un volume finale di 5 ml (10 pesci donatore può essere utilizzata per isolare).
NOTA: verranno esclusi pelle, ossa e pinne dopo la filtrazione. - Se del caso, combinare sospensioni analoghe nello stesso tubo conico.
- Contare il numero totale di cellule vitali mediante trypan colorante blu e un emocitometro.
- Prenota 500 microlitri per citometria a flusso, se lo si desidera (facoltativo, punto 2).
- Sospensione cellulare Centrifugare a 1.000 xg per 10 min, a 4 ° C.
- Eliminare le cellule surnatante e risospendere a 3,33 x 10 5 cellule / ml (0.9x PBS + 5% FBS). In totale, 3 microlitri sarà iniettato per pesci destinatario per un totale di 1 x 10 6 cellule per destinatario (passo 3).
NOTA: Meno di 3 ml di sospensione cellulare dovrebbero essere trapiantate nel pesce ricevente. Se il numero di cellule è limitante, a partire da 5 x 10 4 cellule per destinatario possono portare a attecchimento di successo (Tabella 1).
2. Citometria a flusso Analisi dei donatori muscolo scheletrico cellulare Preparazione (opzionale)
- Isolare il muscolo da un ceppo selvatico, pesci non transgenici come delineato in punto 1.1. Questo esempio serve come controllo negativo ed è utile per impostare cancelli citometria a flusso.
- Aggiungi un adeguato tintura redditività. Ad esempio, aggiungere 5 ml di soluzione madre DAPI (500 ng / ml) a 500 ml di preparazione muscolare. Vortex leggermente prima dell'analisi. Acquisire 5 x ottobre 03-01 x 10 4 eventi. Analizzare i campioni di controllo di tipo selvaggio prima di inserire porte seguita da analisi di cellule muscolari isolate da pesci transgenici.
NOTA: analisi di citometria di flusso è di solito eseguita entro 1 ora dopo la dissezione tessuto muscolare, durante il quale le cellule sezionato mantengono più del 60% vitalità (Figura 2). Le cellule devono essere tenuti in ghiaccio in ogni momento. Vitalità cellulare totale può essere rivalutato prima del trapianto utilizzando trypan colorante blu e un emocitometro.
3. intramuscolare trapianto di cellule muscolari scheletriche in RAG2 adulti omozigote Mutant Zebrafish
- Pulire a 10 μ; L 26S G micro-siringa disegnando ed espellendo in soluzione al 10% di candeggina (5 volte), seguito da 70% di etanolo (5 volte), e poi seguita da tampone sospensione (0.9x PBS + 5% FBS, 10 volte).
- Anestetizzare 2-4 mesi omozigote RAG2 pesce mutante o selvatici pesce tipo di destinatario (come controlli) con l'aggiunta di singole gocce di tricaine metansolfonato (MS222, 4 mg / ml di soluzione) in una capsula di Petri contenente il pesce in acqua sistema fino movimenti lenti opercoli e pesce sono ancora.
NOTA: Dose di anestesia tricaine dipenderà età e le dimensioni del ricevente zebrafish. - Posizionare anestetizzato zebrafish destinatario su un tovagliolo di carta umido o una spugna, con il lato sinistro rivolto verso l'alto.
- Inserire l'ago della siringa nella muscolatura latero-dorsale (Figura 1A). Assicurarsi che le iniezioni vengono effettuate ad un angolo di 45 °. Iniettare 3 ml di sospensione cellulare (preparato al punto 1.12) per pesce per un totale di 1 x 10 6 cellule per destinatario.
- Trasferire accuratamente zebrafish iniettato in un serbatoio pulito con un cucchiaio di plastica per recuperare.
- Valutare destinatario zebrafish per i tassi di attecchimento a 10, 20, 30 giorni dopo il trapianto ed eseguendo un'immagine pesce anestetizzato in campo chiaro e epifluorescenza.
Sezione 2. embrionale rabdomiosarcoma (ERMS) trapianto in età omozigote RAG2 Mutant Zebrafish
4. DNA microiniezione di embrioni di zebrafish
- Linearizzare il plasmide RAG2-kRASG12D 7 digerendo 10 mg di DNA con XhoI, a 37 ° C per 6 ore o O / N.
- Purificare DNA da fenolo serie: estrazione con cloroformio e precipitato con etanolo. Risospendere in 20 ml di acqua deionizzata (in alternativa, le colonne di purificazione di frammenti di DNA commerciali possono essere utilizzati).
- Eseguire il DNA digerito e digerito su un gel di agarosio 1% e determinare la concentrazione di DNA blettura spettrometro y. In alternativa, eseguire campioni a 1: 1, 1: 5, e 1:10 diluizioni su un gel di agarosio 1% e quantificare rispetto ad una scala DNA.
- Preparare un mix di iniezione ad una concentrazione finale di 15 ng / ml di DNA digerito RAG2-kRASG12D in 0.1 M KCl e 0.5x Tris-EDTA. L'importo finale di DNA iniettato in 2 nl del volume di iniezione sarà 30 pag.
NOTA: Fino a tre diversi costrutti di DNA può essere co-iniettata in un massimo di 60 pg di DNA per dell'embrione in modo efficiente. Questi transgeni integrarsi nel genoma e co-espressi all'interno del tumore in via di sviluppo 26. - Iniettare linearizzato RAG2-kRASG12D in una delle cellule di embrioni stadio essenzialmente come descritto 27 in un ceppo zebrafish di interesse (Figura 1B). Le iniezioni devono essere eseguite nella cella e non nel tuorlo per una maggiore efficienza. In questo esperimento, un doppio transgenico AB-deformazione; Myf5-GFP, mylpfa-mCherry è stato utilizzato. Sollevare zebrafish con allevamento di serie protocols 28.
NOTA: la sopravvivenza di iniezione è spesso dipende dal ceppo zebrafish utilizzato. In media, il 30% degli embrioni iniettati svilupperà ERMS. 300-600 embrioni deve essere iniettato per esperimento per garantire che un numero sufficiente GFP-positive e mCherry-positivi tumori primari vengono generati per il trapianto e l'analisi.
5. Screening per ERMS primarie in Zebrafish Larve
- Osservare zebrafish iniettato da 10 a 30 giorni dopo l'iniezione per la nascita di ERMS primarie visibili esternamente.
- A 30 giorni dopo l'iniezione, anestetizzare destinatario zebrafish con l'aggiunta di singole gocce di tricaine methanesulfonate (MS222 4 mg / ml di soluzione) in una capsula di Petri contenente acqua sistema pesci fino movimenti opercolo lenti e pesci sono ancora.
NOTA: Dose di anestesia tricaine dipenderà dall'età e le dimensioni del ricevente zebrafish. Zebrafish tumore primario richiedono dosi più basse di tricaine. - Selezionare primario ERMS-cuscinettopesci che sono Myf5-GFP -positivo e mylpfa-mCherry -positivo, utilizzando un microscopio a epifluorescenza.
6. ERMS Tumore Preparazione
- Sacrifica selezionato primario zebrafish ERMS-cuscinetto in 1,6 mg / ml tricaine methanesulfonate (MS222) per 10 minuti o fino a quando nessun movimento opercolo è evidente.
- Elaborare ogni zebrafish tumore separatamente. Inserire pesce in un piatto pulito Petri e sezionare attorno al tumore usando una lama di rasoio e pinza sottile (come mostrato nella Figura 1B). Trasferire il tessuto tumorale sezionato in un piatto pulito Petri.
- Aggiungere 100 ml di 0.9x pre-raffreddata Phosphate Buffer Saline (PBS) integrati con il 5% siero fetale bovino (FBS). Tessuto Mince con una lama di rasoio pulito> 20 volte finché cellule sono in una sospensione uniforme.
- Aggiungere 900 ml dello stesso tampone (0.9x PBS + 5% FBS), pipetta su e giù più volte per dissociarsi cellule utilizzando un 1000 ml filtrati punta della pipetta. Filtrare 40 &# 956; m di maglia filtro nel corrispondente tubo conico da 50 ml. Conservare su ghiaccio.
- Lavare la piastra di Petri con un ulteriore 2-4 ml di tampone, e passa attraverso lo stesso filtro a rete e nel tubo conica corrispondente.
- Centrifugare a 1.000 xg per 10 min, a 4 ° C.
- Gettare il surnatante e risospendere in 100 ml di tampone.
- Contare il numero totale di cellule vitali mediante trypan colorante blu e un emocitometro.
- Diluire celle a concentrazione desiderata nello stesso tampone (0.9x PBS + 5% FBS). Le cellule devono essere diluiti a 5 x 10 3 cellule / microlitro per trapianto 5 ml per destinatario zebrafish in un totale di 2,5 x 10 4 cellule per destinatario.
- Analisi Flow Cytometry può essere eseguita anche con una piccola quantità di sospensione dal punto 6.5 quantizzare le relative proporzioni di cellule fluorescenti all'interno del campione.
NOTA: Mettere da parte 100 ml di sospensione cellulare (dopo il filtraggio in fase 3.5) e diluire con 400 microlitridi 0.9x PBS + 5% FBS tampone sospensione per l'analisi in citometria a flusso. Per garantire una corretta gating, effettuare ulteriori analisi utilizzando unico tessuto tumorale transgenico o muscolare isolato dal tipo selvaggio adulti, Myf5-GFP e mylpfa-mCherry pesce. Eseguire Citometria a flusso essenzialmente come descritto al punto 2 della sezione 1.
7. Il trapianto di ERMS in adulti RAG2 omozigote Mutant Zebrafish
- Pulire a 10 microlitri 26S G micro-siringa disegnando ed espellendo in soluzione al 10% di candeggina (5 volte), seguito da 70% di etanolo (5 volte), e poi seguita da tampone sospensione (0.9x PBS + 5% FBS, 10 volte ).
- Anestetizzare destinatario omozigote RAG2 pesce mutante con l'aggiunta di singole gocce di tricaine methanesulfonate (MS222 4 mg / ml di soluzione) in una capsula di Petri contenente il pesce in acqua sistema fino a quando i movimenti sono lenti opercoli e pesci sono ancora.
- Posizionare anestetizzato zebrafish destinatario su un tovagliolo di carta bagnata o spoESN, con il lato ventrale rivolto verso l'alto.
- Iniettare 5 ml di sospensione cellulare nella cavità peritoneale (2,5 x 10 4 cellule per destinatario).
NOTA: L'ago per iniezione deve essere pulito tra iniezioni di tumori diversi, come descritto al punto 4.1. 5 a 10 microlitri possono essere efficacemente trapiantati per via intraperitoneale, secondo destinatario dimensioni dei pesci. Tumor attecchimento può essere eseguita iniettando 1 x 04-5 ottobre x 10 5 cellule non suddivisi per pesci destinatario (Tabella 1). - Posizionare con cura destinatario zebrafish in un serbatoio pulito, con un cucchiaio di plastica.
- Valutare destinatario zebrafish per i tassi di attecchimento a 10, 20, 30 giorni dopo il trapianto ed eseguendo un'immagine pesce anestetizzato in campo chiaro e epifluorescenza.
- Utilizzare pesce innestato per applicazioni a valle, tra cui Fluorescence Activated Cell Sorting (FACS) per valutare lo stato di differenziazione (figura 3H), analy istologica di seriesis (Figura 3F), risposte terapia di imaging 15, e / o il trapianto di serie approcci tra cui la limitazione dell'analisi di diluizione 11.
Risultati
Una procedura per la preparazione e il trapianto di cellule del muscolo scheletrico da α-actina-RFP donatori transgenici in immunitario compromesso omozigote RAG2 zebrafish mutante è stato dimostrato (Sezione protocollo 1, Figura 1A e la figura 2). Tessuto muscolare scheletrico è stato preparato da α-actina-RFP donatori transgenici e la sospensione risultante singola cella conteneva cellule vitali 84,3%, come valutato dal esclusione DAPI seguente citometria a flusso (Figura 2B). Cellule RFP-positivi comprendono il 35,3% di questa sospensione singola cellula (Figura 2C). Il trapianto di cellule nella dorsale muscolo scheletrico di RAG2 omozigote pesce destinatario mutante portato a attecchimento coerente e forte come valutato dalla differenziazione delle cellule singole in fibre multinucleate (1 x 10 6 cellule iniettate per pesci, tabella 1, Figura 2D-I). Selvatica tipodestinatario pesci omesso di innestare fibre muscolari oltre l'esperimento di 30 giorni (n = 13). Di 10 giorni dopo il trapianto, 9 su 14 RAG2 omozigote zebrafish mutante conteneva fibre muscolari RFP-positivo nei pressi del sito di iniezione (64,3%, figura 2E, F). È importante sottolineare che, innestato muscolare RFP-positivo persisteva a 30 giorni post-trapianto (Figura 2G-I), con un sottoinsieme di animali che sono seguiti per 115 giorni dopo l'attecchimento ed esibendo attecchimento muscolare robusto e persistente (dati non riportati). Questi risultati sono simili a quelli riportati in precedenza dal nostro gruppo 23 utilizzando lo stesso protocollo (Tabella 1).
Abbiamo inoltre presentato un metodo per la generazione, la preparazione e il trapianto di cellule tumorali ERMS nella cavità peritoneale di RAG2 omozigote mutante pesci destinatario (Sezione protocollo 2, Figura 1B e Figura 3). ERMS sono stati generati in doublee transgenici Myf5-GFP; mylpfa-mCherry pesci che hanno dimostrato di consentire la visualizzazione di eterogeneità intra-tumorale e l'analisi funzionale delle sottopopolazioni di cellule tumorali dopo il trapianto 11. Tuttavia, un'ulteriore caratterizzazione molecolare di ogni sottopopolazione è difficile perché i pesci sono piccoli, quando si sviluppano ERMS tra 10 a 30 giorni di vita e il numero di cellule tumorali sono limitante per applicazioni a valle. Una soluzione è quella di ampliare il numero di cellule tumorali da innestando ERMS in adulti destinatario zebrafish. Ad oggi, esperimenti simili sono stati completati con CG1-deformazione pesce singenici e richieste in eccesso di 4 generazioni di backcrossing per sviluppare linee singenici che erano transgenici per Myf5-GFP; mylpfa-mCherry. Per aggirare questi problemi, abbiamo dimostrato l'utilità del sistema immunitario compromesso RAG2 omozigote destinatario mutante zebrafish per innestare ERMS primari da un zebrafish AB-ceppo. Tutti ERMS primarie innestate in rag2 animali mutanti omozigoti, facilitando l'espansione del tumore (Tabella 1). Risultati simili sono stati recentemente segnalati in cui 24 dei 27 RAG2 omozigote zebrafish mutante ERMS trapiantate, mentre 0 di 7 fratelli di tipo selvatico innestate malattia 23. Un esempio rappresentativo di un sistema ERMS innestato è mostrato a 30 giorni dopo il trapianto in figura 3E. Innestato ERMS condividono caratteristiche istologiche di rabdomiosarcoma embrionale, simile a quello trovato nel tumore primario (Figura 3B e 3F). Analisi FACS confermato che ERMS conteneva funzionalmente distinta tumore di moltiplicazione delle cellule e le cellule differenziate che esprimono Myf5-GFP e / o mylpfa-mCherry. I tassi di sopravvivenza dopo la procedura di iniezione intraperitoneale erano superiore al 95%. Zebrafish destinatario comunemente soccombere dalla massa tumorale dopo il 30 giorno punto di tempo dopo il trapianto.
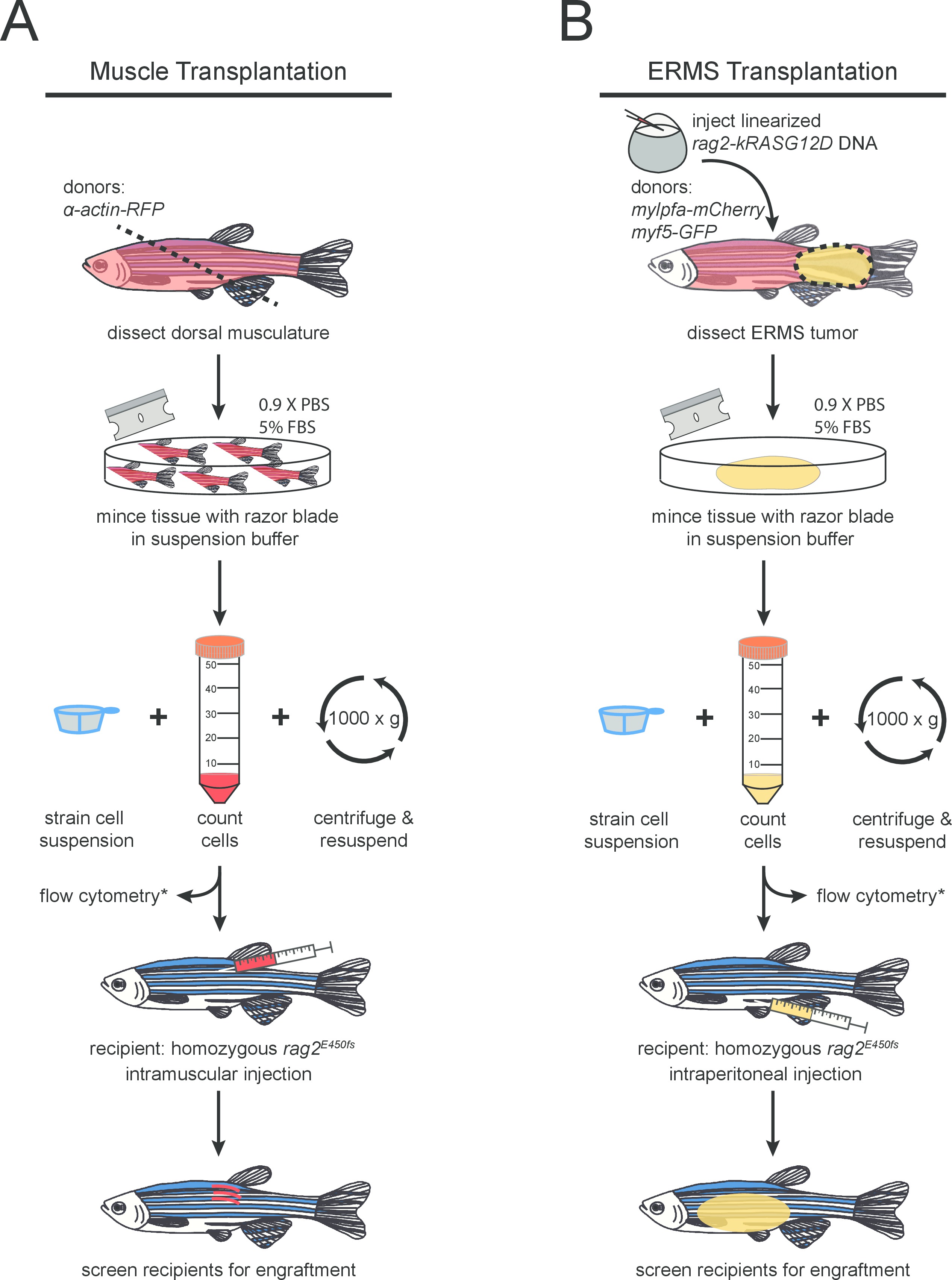
Figura 1. Protocollo schema per (A) normale e (B) maligno trapianto di cellule del muscolo scheletrico in RAG2 mutante omozigote zebrafish. passi opzionali sono contrassegnate con (*).

Figura 2. scheletrico attecchimento muscolare in RAG2 omozigote zebrafish mutante. (A) zebrafish transgenico donatore α-actina-RFP. (B) La vitalità cellulare di isolati sospensione di cellule muscolari, come valutato dal DAPI esclusione del colorante e citometria a flusso. (C) Percentuale di cellule RFP-positive presenti nella sospensione di cellule muscolari dal donatore α-actina-RFP (rosso), rispetto ad un controllo di tipo selvaggio(Grigio). (DE) uniti in campo chiaro e le immagini fluorescenti di animali selvatici tipo (D) o RAG2 omozigote pesce mutante (E) a 30 giorni dopo il trapianto. (F) attecchimento tassi nel tempo. Rosso indica il numero di animali trapiantate mentre grigio mostra pesci non innestato. Numero di animali analizzati in ogni punto sono indicati. (GI) immagini alto ingrandimento della regione in scatola a pannello E mostrato a 10 (G), 20 (H) e 30 (I) giorni post-trapianto, mostrando la conservazione delle fibre muscolari differenziate nel tempo (punte di freccia). Bar scala uguale a 2 mm. Cliccate qui per vedere una versione più grande di questa figura.

Figura 3. Il trapianto di Myf5-GFP; mylpfa-mCherry ERMS in RAG2 mutante omozigote . zebrafish (AD) RAG2-kRASG12D ERMS primarie indotte derivanti AB-deformazione Myf5-GFP; zebrafish mylpfa-mCherry a 30 giorni di vita. (EH) RAG2 omozigote zebrafish mutante innestato con ERMS e analizzato a 30 giorni post-trapianto. (A, E) uniti in campo chiaro e le immagini fluorescenti di ERMS primarie e trapiantati. Zona tumore è delineato e freccia indica sito di iniezione in E. (B, F) Hematoxylin- e sezioni eosina macchiato paraffina di primaria (B) e ERMS trapiantate (F) indichi le zone di maggiore cellularità associati con il cancro. (C,G) La vitalità cellulare come valutato dal DAPI esclusione del colorante e citometria a flusso. (D, H) fluorescenti cellule tumorali sotto-popolazioni, valutata mediante citometria a flusso. Bar scala uguale 2 mm (A, E) e 50 micron (B, F). Cliccate qui per vedere una versione più grande di questa figura.
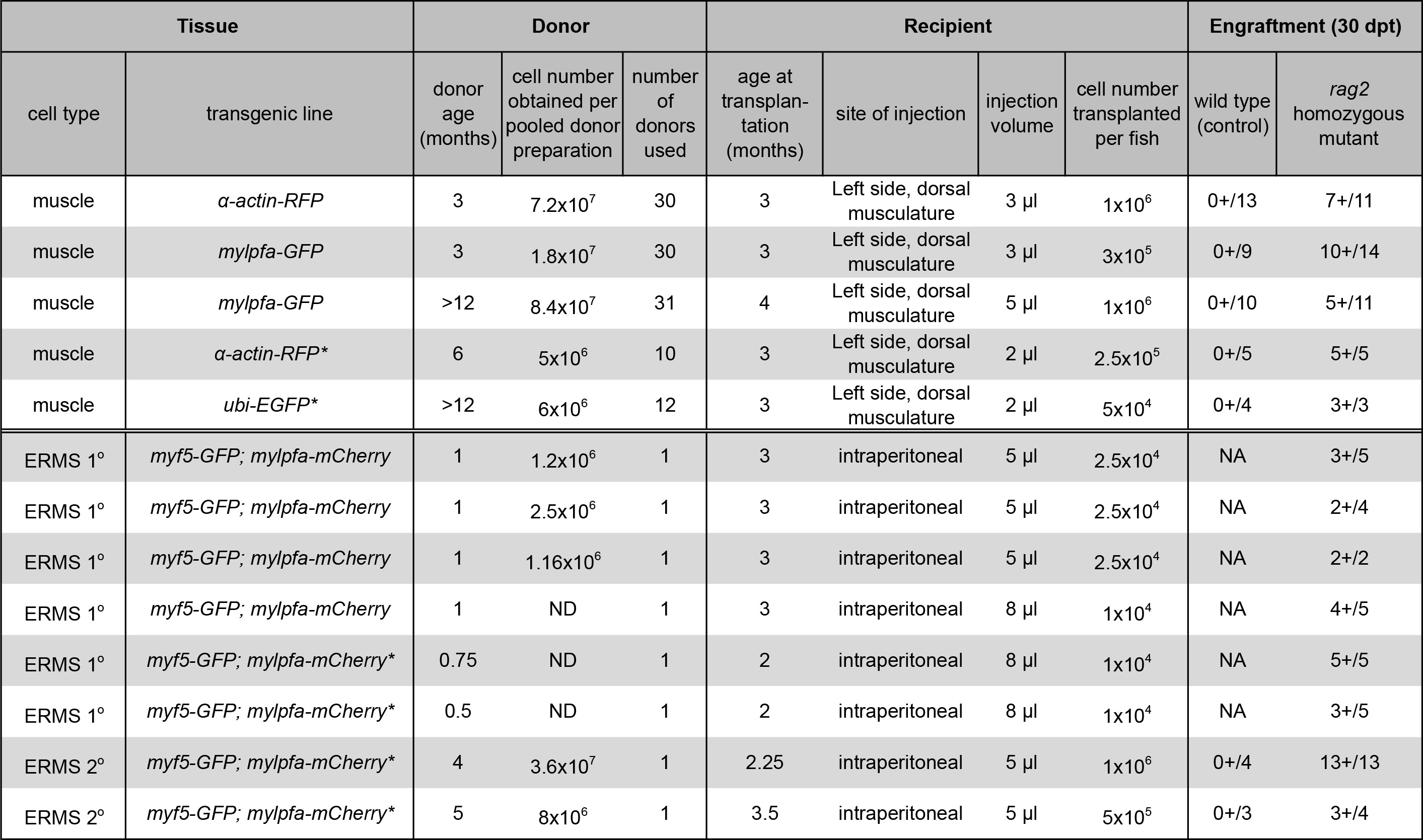
Tabella 1. Risultati attecchimento per il muscolo e il trapianto di cellule ERMS. (*) Indica precedentemente riportati i dati utilizzando le stesse tecniche 23. I dati sono ristampato con il permesso di Nature Methods. Clicca qui per vedere una versione più grande di questa tabella.
Discussione
Attecchimento efficiente e robusto di dorsale adulta muscoli scheletrici è stato raggiunto con un metodo di preparazione cellulare molto semplice, seguito da iniezione di cellule nella muscolatura dorsale del pesce mutante omozigote RAG2. In generale, procedure di iniezione intramuscolare erano molto robusto, con qualche morte associato immediatamente dopo la procedura di impianto, dal 10% al 35% a seconda esperimento. Ottimizzazione aggiuntive probabilmente centrare l'utilizzo di aghi calibro più piccoli per l'iniezione e lo sviluppo di apparati di iniezione stazionario utilizzando un microscopio e micromanipolatore, che faciliteranno la facilità di impiantare cellule. Il nostro approccio utilizzato anche le cellule muscolari non ordinati da donatori e conteneva solo circa il 30% delle cellule progenitrici del muscolo. L'utilizzo di linee transgeniche giornalista che etichettano le cellule staminali e l'isolamento FACS probabilmente fornirà sospensioni cellulari arricchite che portano ad una maggiore attecchimento in pesci destinatario. Skeletal muscolare cells potrebbe anche essere arricchita e coltivate prima del trapianto, come descritto in precedenza 29. Sorprendentemente, i nostri risultati indicano anche che le fasi di creazione di nicchia e di differenziazione del tessuto muscolare del donatore si verificano prima di 10 giorni dopo il trapianto, che stabilisce questo modello come una piattaforma sperimentale robusta e veloce per valutare l'attecchimento muscolare e la rigenerazione. Inoltre, questi esperimenti crudamente in contrasto con quelli maturati nei topi, in cui è necessario pre-infortunio di muscoli con cardiotossina o bario cloruro di due giorni prima attecchimento 30,31. È probabile che il pregiudizio ago prodotta durante la procedura di trapianto potenzia attecchimento stimolando la produzione di un ambiente rigenerativo entro il destinatario animale 32,33. Prevediamo inoltre che il nostro metodo sarà facilmente adattabile al trapianto di tessuto muscolare scheletrico da zebrafish più giovane, consentendo la valutazione delle mutazioni genetiche che influenzano lo sviluppo del muscolo scheletrico precocema portare alla letalità nelle fasi larvali.
Abbiamo anche fornito un protocollo dettagliato per l'attecchimento di ERMS zebrafish mediante iniezione intraperitoneale in non-condizionata, RAG2 omozigote pesce mutante. Questo approccio era utile per l'espansione dei tumori primari doppi transgenici senza la necessità di generare tumori all'interno della linea transgenica singenici. Il nostro lavoro recente ha dimostrato che gli approcci di trapianto di cellule forniscono nuovi modelli sperimentali per valutare la sensibilità ai farmaci ERMS in vivo, in cui un singolo tumore può essere espansa in migliaia di animali e valutati per gli effetti sulla crescita, auto-rinnovamento, e neovascolarizzazione 15. Inoltre, abbiamo innestato con successo una vasta gamma di tumori in RAG2 pesce mutante omozigote comprese cellule T leucemia acuta linfoblastica, il melanoma, e ERMS 23. Guardando verso il futuro, prevediamo queste linee saranno utili per valutare importanti proprietà funzionali di cancro inVivo tra cui la valutazione eterogeneità intra-tumorale, invasione, metastasi, l'angiogenesi, la resistenza e la terapia. Inoltre, la generazione di RAG2 omozigote pesce mutante nel otticamente trasparente Casper ceppo zebrafish 34 sarà probabilmente faciliterà l'imaging diretto di molte di queste caratteristiche di cancro.
In totale, forniamo protocolli dettagliati per l'attecchimento di successo del muscolo scheletrico fluorescenza marcata normale e maligna in a RAG2 adulto omozigote immune mutante zebrafish compromesso.
Divulgazioni
The authors have no competing financial interests.
Riconoscimenti
Questo lavoro è supportato da Lemonade di Alex stand Foundation (DML), American Cancer Society (DML), la MGH Howard Goodman Fellowship (DML), e National Institutes of Health concede R24OD016761 e 1R01CA154923 (DML). CNY Citometria a flusso Core e flusso Immagine Analysis, strumentazione condivisa numero concessione 1S10RR023440-01A1. IMT è finanziato da una borsa di studio dalla Fondazione portoghese per la Scienza e la Tecnologia (Fundação para a Ciência e Tecnologia - FCT). QT è finanziato dal Consiglio Scholarship Cina. Ringraziamo Angela Volorio per i suoi utili commenti e consigli.
Materiali
| Name | Company | Catalog Number | Comments |
| Tris-EDTA buffer solution 1x | Sigma-Aldrich | 93283-100ML | Microinjection. Injection mix. |
| Potassium Chloride | Fisher Science Education | S77375-1 | Microinjection. Injection mix. |
| XhoI Restriction Enzyme | New England Biolabs | R0146S | Microinjection. Plasmid linearization. |
| QIAquick PCR Purification Kit | Qiagen | 28104 (50) or 28106 (250) | Microinjection. For purification of linearized plasmid up to 10 kb. |
| Phenol/Chloroform/Isoamyl Alcohol | Fisher Scientific | BP1753I-100 | Microinjection. For purification of linearized plasmid. |
| UltraPure Agarose, 500 g | Invitrogen | 16500-500 | Microinjection. Linearized plasmid quantification. |
| Nanodrop 2000 Spectrophotometer | Thermo Scientific | http://www.nanodrop.com/Productnd2000overview.aspx | Microinjection. Linearized plasmid quantification. |
| DAPI (4',6-diamidino-2-phenylindole, dihydrochloride) | Life Technologies | D1306 | flow cytometry/FACS |
| 5 ml polystyrene round bottom tube | BD Falcon | 352058 | flow cytometry collection tube |
| BD FACSAria II | BD Biosciences | Special Order Research Products (SORP) program | FACS |
| 5 ml polypropylene round bottom tube | BD Falcon | 352063 | FACS collection tube |
| BD LSR II | BD Biosciences | Special Order Research Products (SORP) program | flow cytometry |
| Phosphate Buffered Saline, pH 7.4 (1x) | Life Technologies | 10010-023 | transplantation |
| Fetal Bovine Serum | Omega Scientific | FB-01 | transplantation |
| Tricaine methanesulphonate (MS-222) | Western Chemical Inc. | http://www.wchemical.com/tricaine-s-ms-222.html | Transplantation. Anesthetic. Caution: Irritant. Irritating to eyes, respiratory system, and skin. |
| VWR Absorbent Bench Underpads | VWR | 56616-018 | Transplantation. Regular paper towels or sponge can be used as an alternative. |
| Singe Edge Industrial Razor Blades | VWR | 55411-050 | transplantation |
| Petri Dish, Polystryrene Disposable Sterile | VWR | 25384-302 | transplantation |
| Cell Strainer, 40 µm Nylon | Falcon-Corning Incorporated | 352340 | transplantation |
| 50 ml Centrifuge Tube | Corning Incorporated | 430828 | transplantation |
| Trypan Blue Stain (0.4%) | Life Technologies | 15250-061 | transplantation |
| Hemacytometer Set | Hausser Scientific | 1483 | transplantation |
| Hamilton syringe, fixed needle, volume 10 µl, needle size 26s ga (bevel tip) | Hamilton | 80366 | transplantation |
| Austin's A-1 Bleach, Commercial | James Austin Company | Transplantation. Any commercial solution can be used. | |
| Ethanol 190 Proof | Decon Labs, Inc. | DSP-MD.43 | Microinjection (linearized plasmid purification) and transplantation. Any commercial solution can be used. |
| High Speed Microcentrifuge, 300D Digital Microcentrifuge | Denville Scientific Inc. | C0265-24 | transplantation |
| Sorvall Legend XFR Centrifuge | Thermo Scientific | 75004539 | Transplantation. Catalog number for 120 V, 60 Hz (US). |
| 5 ml serological pipets | BD Falcon | 357529 | transplantation |
| Corning Stripettor Plus Pipetting Controller | Corning Incorporated | 4090 | Transplantation. Any automatic pipetting controller can be used. |
| Powder free examination gloves | All steps. Any commercial brand can be used. | ||
| Filter pipet tips and micropipettes | All steps. Any commercial brand can be used. | ||
| Dumont forceps #5 | Fine Science Tools | 11205-20 | transplantation |
| Fluorescent Stereomicroscope | Olympus | MVX10 | Scoring. Any appropriate fluorescent stereomicroscope can be used. |
| Olympus DP72 microscope digital camera | Olympus | DP72 | Scoring. Multiple adequate cameras for the selected imaging system can be used. |
Riferimenti
- Gemberling, M., Bailey, T. J., Hyde, D. R., Poss, K. D. The zebrafish as a model for complex tissue regeneration. Trends in genetics TIG. 29 (11), (2013).
- Boatman, S., Barrett, F., Satishchandran, S., Jing, L., Shestopalov, I., Zon, L. I. Assaying hematopoiesis using zebrafish. Blood cells, molecule., & diseases. 51 (4), 271-276 (2013).
- Langenau, D. M., Traver, D., et al. Myc-induced T cell leukemia in transgenic zebrafish. Science. 299 (5608), 887-890 (2003).
- Yang, H. W., Kutok, J. L., et al. Targeted Expression of Human MYCN Selectively Causes Pancreatic Neuroendocrine Tumors in Transgenic Zebrafish Targeted Expression of Human MYCN Selectively Causes Pancreatic Neuroendocrine Tumors in Transgenic Zebrafish. Cancer Research. , 7256-7262 (2004).
- Patton, E. E., Widlund, H. R., et al. BRAF mutations are sufficient to promote nevi formation and cooperate with p53 in the genesis of melanoma. Current Biology. 15 (3), 249-254 (2005).
- Sabaawy, H. E., Azuma, M., Embree, L. J., Tsai, H. -. J., Starost, M. F., Hickstein, D. D. TEL-AML1 transgenic zebrafish model of precursor B cell acute lymphoblastic leukemia. Proceedings of the National Academy of Sciences of the United States of America. 103 (41), 15166-15171 (2006).
- Langenau, D. M., Keefe, M. D., et al. . Effects of RAS on the genesis of embryonal rhabdomyosarcoma. Gene. 21 (11), 1382-1395 (2007).
- Le, X., Langenau, D. M., Keefe, M. D., Kutok, J. L., Neuberg, D. S., Zon, L. I. Heat shock-inducible Cre/Lox approaches to induce diverse types of tumors and hyperplasia in transgenic zebrafish. Proceedings of the National Academy of Sciences of the United States of America. 104 (22), 9410-9415 (2007).
- Park, S. W., Davison, J. M., Rhee, J., Hruban, R. H., Maitra, A., Leach, S. D. Oncogenic KRAS induces progenitor cell expansion and malignant transformation in zebrafish exocrine pancreas. Gastroenterology. 134 (7), 2080-2090 (2008).
- Zhuravleva, J., Paggetti, J., et al. MOZ/TIF2-induced acute myeloid leukaemia in transgenic fish. British journal of haematology. 143 (3), 378-382 (2008).
- Ignatius, M. S., Chen, E. Y., et al. In vivo imaging of tumor-propagating cells, regional tumor heterogeneity, and dynamic cell movements in embryonal rhabdomyosarcoma. Suppl Data. Cancer cell. 21 (5), 680-693 (2012).
- Blackburn, J. S., Liu, S., et al. Clonal Evolution Enhances Leukemia-Propagating Cell Frequency. Cancer cell. 25 (3), 366-378 (2014).
- Blackburn, J. S., Langenau, D. M. Zebrafish as a model to assess cancer heterogeneity, progression and relapse. Disease model. 7 (7), 755-762 (2014).
- Zhao, C., Wang, X., et al. A novel xenograft model in zebrafish for high-resolution investigating dynamics of neovascularization in tumors. PloS one. 6 (7), e21768 (2011).
- Chen, E. Y., DeRan, M. T., et al. Glycogen synthase kinase 3 inhibitors induce the canonical WNT/β-catenin pathway to suppress growth and self-renewal in embryonal rhabdomyosarcoma. Proceedings of the National Academy of Sciences of the United States of America. 111 (14), 5349-5354 (2014).
- Yang, X. -. J., Cui, W., et al. A novel zebrafish xenotransplantation model for study of glioma stem cell invasion. PloS one. 8 (4), e61801 (2013).
- Chapman, A., Fernandez del Ama, L., Ferguson, J., Kamarashev, J., Wellbrock, C., Hurlstone, A. Heterogeneous Tumor Subpopulations Cooperate to Drive Invasion. Cell Reports. 8 (8), 1-8 (2014).
- Smith, A. C. H., Raimondi, A. R., et al. High-throughput cell transplantation establishes that tumor-initiating cells are abundant in zebrafish T-cell acute lymphoblastic leukemia. Blood. 115 (16), 3296-3303 (2010).
- Iyengar, S., Houvras, Y., Ceol, C. J. Screening for melanoma modifiers using a zebrafish autochthonous tumor model. Journal of visualized experiments JoVE. (69), e50086 (2012).
- Mizgireuv, I., Revskoy, S. Y. Transplantable tumor lines generated in clonal zebrafish. Cancer research. 66 (6), 3120-3125 (2006).
- Streisinger, G., Walker, C., Dower, N., Knauber, D., Singer, F. Production of clones of homozygous diploid zebra fish (Brachydanio rerio). Nature. 291, 293-296 (1981).
- Blackburn, J. S., Liu, S., Langenau, D. M. Quantifying the frequency of tumor-propagating cells using limiting dilution cell transplantation in syngeneic zebrafish. Journal of visualized experiments JoVE. (53), e2790 (2011).
- Tang, Q., Abdelfattah, N. S., et al. Optimized cell transplantation using adult rag2 mutant zebrafish. Nature methods. 11, 821-824 (2014).
- Zhou, Q., Facciponte, J., Jin, M., Shen, Q., Lin, Q. Humanized NOD-SCID IL2rg–/– mice as a preclinical model for cancer research and its potential use for individualized cancer therapies. Cancer letters. 344 (1), 13-19 (2014).
- Higashijima, S., Okamoto, H., Ueno, N., Hotta, Y., Eguchi, G. High-frequency generation of transgenic zebrafish which reliably express GFP in whole muscles or the whole body by using promoters of zebrafish origin. Developmental biology. 192 (2), 289-299 (1997).
- Langenau, D. M., Keefe, M. D. D. D., et al. Co-injection strategies to modify radiation sensitivity and tumor initiation in transgenic Zebrafish. Oncogene. 27 (30), 4242-4248 (2008).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. J Vis Exp. (25), 1-5 (2009).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Alexander, M. S., Kawahara, G., et al. Isolation and transcriptome analysis of adult zebrafish cells enriched for skeletal muscle progenitors). Muscl, & nerve. 43 (5), 741-750 (2011).
- Motohashi, N., Asakura, Y., Asakura, A. Isolation, culture, and transplantation of muscle satellite cells. Journal of visualized experiments JoVE. (86), 1-7 (2014).
- Gerli, M. F. M., Maffioletti, S. M., Millet, Q., Tedesco, F. S. Transplantation of induced pluripotent stem cell-derived mesoangioblast-like myogenic progenitors in mouse models of muscle regeneration. J Vis Exp. (83), e50532 (2014).
- Siegel, A. L., Gurevich, D. B., Currie, P. D. A myogenic precursor cell that could contribute to regeneration in zebrafish and its similarity to the satellite cell. The FEBS journal. 280 (17), 4074-4088 (2013).
- Rowlerson, a., Radaelli, G., Mascarello, F., Veggetti, Regeneration of skeletal muscle in two teleost fish: Sparus aurata and Brachydanio rerio. Cell Tissue Res. 289 (2), 311-322 (1997).
- White, R. M., Sessa, A., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell stem cell. 2 (2), 183-189 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon